
Preview text:
lOMoAR cPSD| 58728417 Chương 1
NGUYÊN LÝ I NHIỆT ĐỘNG HỌC
1.1. Nguyên lý I nhiệt động học
1.1.1. Nhiệt và công
Nhiệt và công là hai hình thức truyền năng lượng
của hệ. Công ký hiệu là A và nhiệt ký hiệu là Q. Quy ước dấu Công A Nhiệt Q Hệ sinh > 0 < 0 Hệ nhận < 0 > 0
1.1.2. Nguyên lý I nhiệt động học
Biểu thức của nguyên lý I nhiệt động học: U = Q - A
Khi áp dụng cho một quá trình vô cùng nhỏ: dU = Q - A
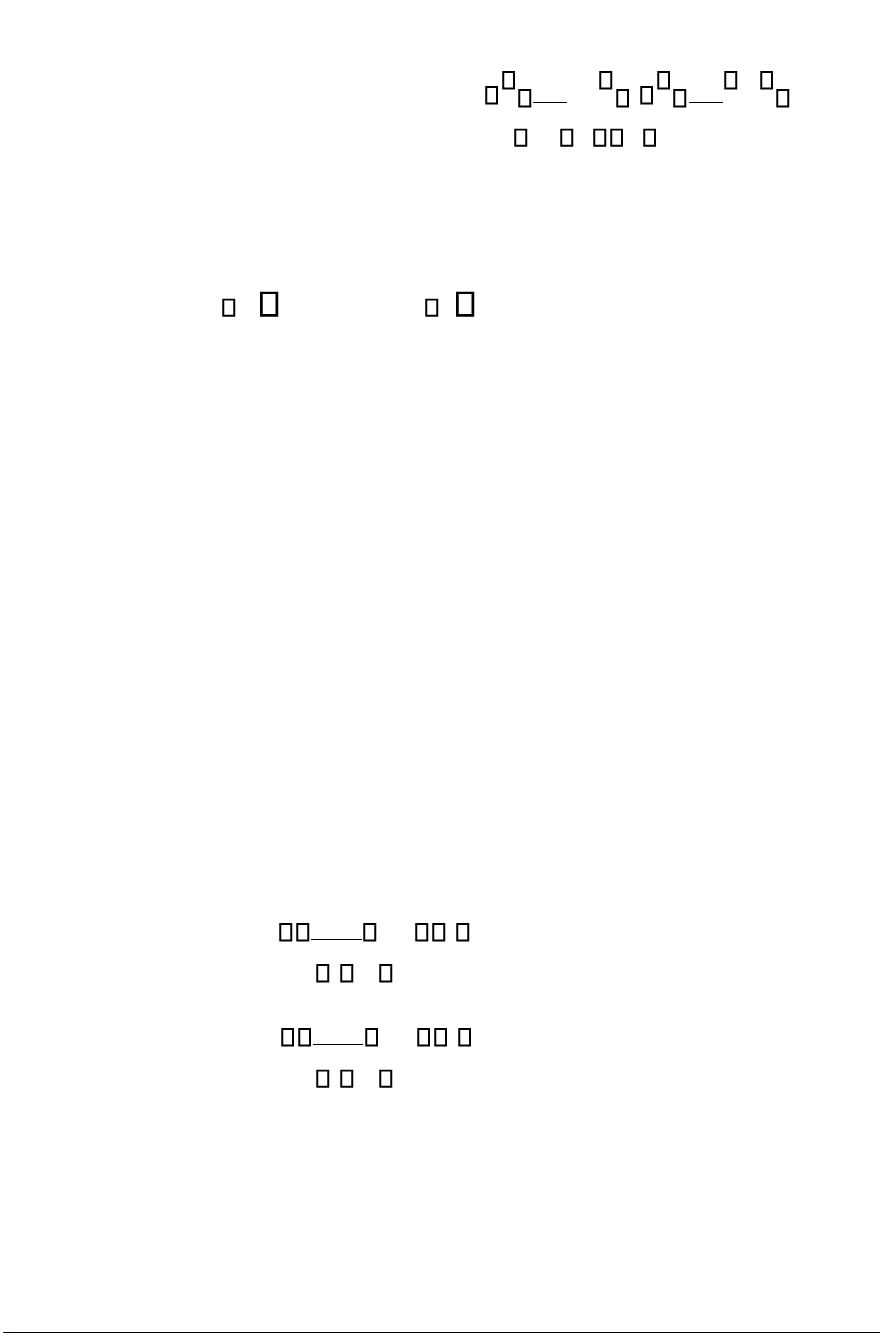
Ở dạng tích phân nguyên lý I có thể được viết: V 2 ΔU Q PdV V 1
1.1.3. Áp dụng nguyên lý I cho một số quá trình. lOMoAR cPSD| 58728417
1.1.3.1. Quá trình đẳng tích: V = const, dV = 0. V 2 Av PdV 0 V 1 Từ đó ta có: QV = ΔU
1.1.3.2. Quá trình đẳng áp: P = const, dP = 0. Ap = P.(V2 - V1) = P. V
Do đó: Qp = ΔU + P V = (U + PV) = H
1.1.3.3. Quá trình đẳng áp của khí lý tưởng
Từ phương trình trạng thái khí lý tưởng: PV = nRT Ta có: Ap = P V = nRΔT ΔUp = Qp – nRΔT
1.1.3.4. Quá trình dãn nở đẳng nhiệt của khí lý tưởng
Biến thiên nội năng khi dãn nở đẳng nhiệt (T = const)
khí lý tưởng là bằng không nên: V2 nRTln P1 QT AT nRTln V1 P2 Trong đó:
P1: áp suất ở trạng thái đầu.
P2: áp suất ở trạng thái cuối. lOMoAR cPSD| 58728417
1.1.3.5. Nhiệt chuyển pha cp Q T Trong đó:
cp: nhiệt chuyển pha (cal hoặc J)
nc = - đđ, hh = - ngtụ Ghi chú:
R là hằng số khí lý tưởng và có các giá trị sau:
R = 1,987 cal/mol.K = 8,314 J/mol.K R = 0,082 lit.atm/mol.K
1 cal = 4,18 J; 1 l.atm = 101,3 J = 24,2 cal
1.2. Định luật Hess
1.2.1. Nội dung định luật
Trong quá trình đẳng áp hoặc đẳng tích, nhiệt phản ứng
chỉ phụ thuộc vào trạng thái đầu và trạng thái cuối mà
không phụ thuộc vào các trạng thái trung gian.
Biểu thức của định luật Hess: QV = ΔU và Qp = ΔH Trong đó:
U: nhiệt phản ứng đẳng tích.
H: nhiệt phản ứng đẳng áp.
Khi quá trình xảy ra ở điều kiện tiêu chuẩn ta có nhiệt
phản ứng tiêu chuẩn: H0298, U0298.
Đối với các quá trình xảy ra khi có mặt các chất khí lOMoAR cPSD| 58728417
(được xem là khí lý tưởng), ta có: ΔH = ΔU + RTΔn
Với n là biến thiên số mol khí của quá trình.
1.2.2. Các hệ quả của định luật Hess -
Nhiệt phản ứng nghịch bằng nhưng trái dấu với nhiệt phản ứng thuận. ΔHnghịch = - ΔHthuận -
Nhiệt phản ứng bằng tổng nhiệt sinh của các chất
tạo thành trừ đi tổng nhiệt sinh của các chất tham gia phản ứng.
ΔH phản ứng = ∑ΔHssp - ∑ ΔHstc -
Nhiệt phản ứng bằng tổng nhiệt cháy của các chất
tham gia phản ứng trừ đi tổng nhiệt cháy của các chất tạo thành.
ΔH phản ứng = ∑ΔHchtc - ∑ ΔHchsp
Ghi chú: Nhiệt tạo thành tiêu chuẩn ( H0298, tt), nhiệt
đốt cháy tiêu chuẩn ( H0298,đc) được cho sẵn trong sổ tay hóa lý. 1.3. Nhiệt dung 1.3.1. Định nghĩa δQ - Nhiệt dung đẳng áp: Cp H dP P T P lOMoAR cPSD| 58728417 δQ -
Nhiệt dung đẳng tích: Cv U dT V T V - Mối liên hệ: Cp - Cv = R -
Nhiệt lượng Q được tính: T2 T2 Q m CdT hoặc Q n CdT T1 T1
1.3.2. Ảnh hưởng của nhiệt độ đến nhiệt dung
Sự phụ thuộc vào nhiệt độ của nhiệt dung được biểu
diễn bằng các công thức thực nghiệm dưới dạng các hàm số: Cp = a0 + a1.T + a2.T2 Hoặc Cp = a0 + a1.T + a-2.T-2
Trong đó: a0, a1, a2, a-2 là các hệ số thực nghiệm có thể
tra giá trị của chúng trong sổ tay hóa lý.
1.2.2. Định luật Kirchhoff
Hiệu ứng nhiệt của phản ứng phụ thuộc vào nhiệt độ
được biểu diễn bởi định luật Kirchhoff: ΔH ΔCp T P Hoặc ΔU ΔCv T V
Sau khi lấy tích phân ta được: T lOMoAR cPSD| 58728417 ΔHT ΔH0 ΔCpdT 0
Nếu lấy tích phân từ T1 đến T2 ta được: T 2 ΔHT 2 ΔHT1 ΔCpdT T 1 1.4. Bài tập mẫu
Ví dụ 1: Tính biến thiên nội năng khi làm bay hơi 10g
nước ở 200C. Chấp nhận hơi nước như khí lý tưởng và
bỏ qua thể tích nước lỏng. Nhiệt hóa hơi của nước ở 200C bằng 2451,824 J/g. Giải
Nhiệt lượng cần cung cấp để làm hóa hơi 10g nước là:
Q = m. = 10. 2451,824 = 24518,24 (J)
Công sinh ra của quá trình hóa hơi là: A = P. V = P(Vh - Vl) = PVh 10 = nRT 8,314 293 1353,33 (J) 18
Biến thiên nội năng là: