














Preview text:
Chương III Kim loại kiềm thổ (Nguyên tố nhóm IIA)
PGS.TS. Phạm Chiến Thắng Bộ môn Hóa Vô cơ Nội dung 1. Nguyên tố 2. Kim loại kiềm thổ 3. Hợp chất ơn giản
4. Một số tính chất bất thường của Be 2
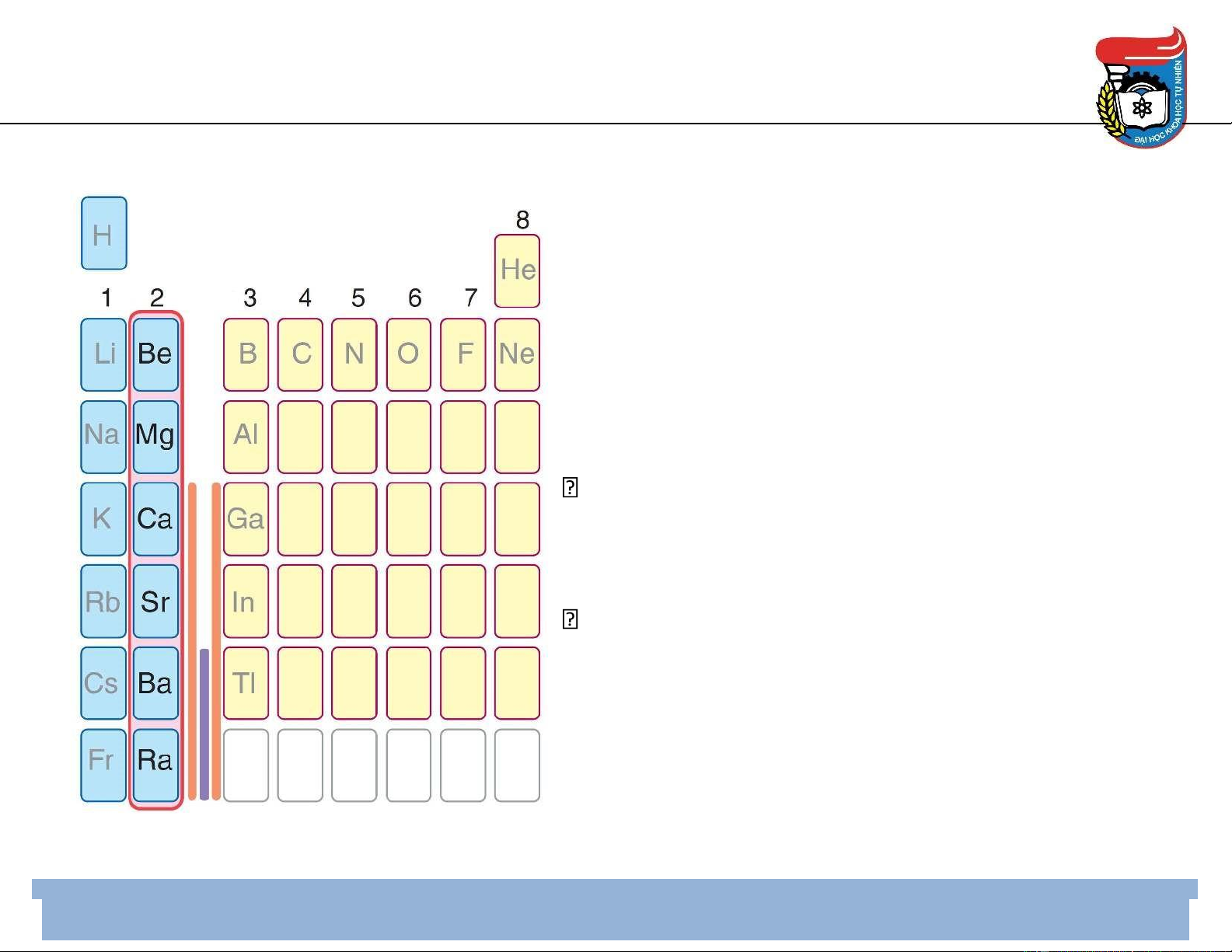
Vị trí trong bảng HTTH Hóa học 3
• Be, Mg, Ca, Sr, Ba, Ra (phóng xạ)
• Cấu hình electron hóa trị: ns2 • Vị trí: nhóm II A
• Khả năng tạo liên kết hóa học:
Cho 2 e: tạo cation M2+ (Mg, Ca, Sr, Ba) → kim
loại hoạt ộng, liên kết ion
Be: liên kết cộng hóa trị • Sô ́ oxi hóa: 0, +2 4 Nội dung 1. Nguyên tố 2. Kim loại kiềm thổ 3. Hợp chất ơn giản
4. Một số tính chất bất thường của Be 5
Kim loại kiềm thổ – Tính chất vật lý
• Tất cả: màu trắng bạc • Ca, Sr, Ba: mềm Be Mg Ca Sr Ba Ra 6
Kim loại kiềm thổ – Tính chất vật lý
Sô ́ hiệu nguyên tử, Z 4 12 20 38 56 88
Cấu hình e ở trạng thái cơ bản [He] 2s2 [Ne] 3s2 [Ar] 4s2 [Kr] 5s2 [Xe] 6s2 [Rn] 7s2
Nhiệt ô ̣ nóng chảy (°C) 1287 650 842 777 727 700 Nhiệt ô ̣ sôi (°C) 2469 1091 1484 1377 1845 1737 Ti ̉ khối 1,86 1,74 1,55 2,6 3,6 5,5
Năng lượng ion hóa thứ nhất, IE1 899,5 737,7 589,8 549,5 502,8 509,3 (kJ/mol) * **
Năng lượng ion hóa thư ́ hai, IE2 1757 1451 1145 1064 965,2 979,0 (kJ/mol)
Năng lượng ion hóa thư ́ ba, IE3 (kJ/mol) 14850 7733 4912 4138 3619 3300
Thế khử tiêu chuẩn 𝐸 / (V) -1,85 -2,37 -2,87 -2,89 -2,90 -2,92
• t°nc, t°s cao hơn kim loại kiềm, biến ổi không ồng ều do sự khác biệt về mạng tinh thể
• Tỉ khối: tăng dần từ Be ến Ba
• Độ cứng: giảm dần từ Be ến Ba 7
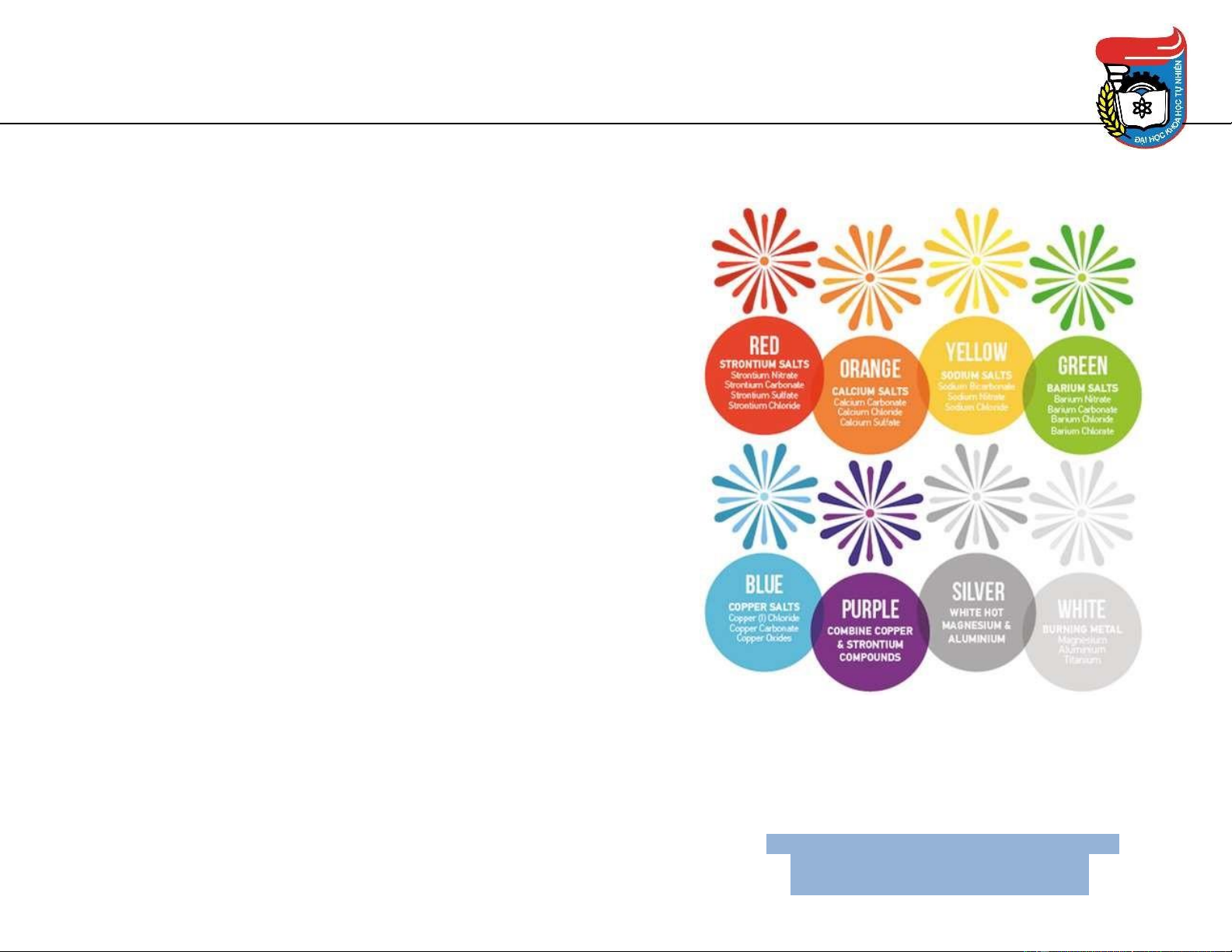
Kim loại kiềm thổ – Tính chất vật lý • Tính khử mạnh
Phương pháp nhuốm màu ngọn lửa Đỏ cam Đỏ son Lục hơi vàng Hóa học của pháo hoa 8
Kim loại kiềm thổ – Tính chất vật lý 9
Kim loại kiềm thổ – Tính chất hóa học
• Hoạt ộng về mặt hóa học (sau kim loại kiềm)
• Chất khử mạnh (tăng từ Be → Ba)
• Ca, Sr & Ba: tương tự nhưng kém hoạt ộng hơn so với Na 10
Kim loại kiềm thổ – Tác dụng với ơn chất
• Tất cả phản ứng với O2, N2, S & halogen
Kim loại kiềm thổ – Tác dụng với ơn chất
• Khác biệt trong phản ứng tạo hi rua & cacbua 11
Kim loại kiềm thổ – Tác dụng với nước
• Be & Mg: trơ ộng học với nước tại nhiệt ộ phòng
(bao phủ bề mặt kim loại)
• Mg: phản ứng với nước nóng hoặc hơi nước 12
• Ca, Sr & Ba: phản ứng với nước tương tự Na
Kim loại kiềm thổ – Tính chất hóa học •
Be tan trong dung dịch kiềm ặc hoặc kiềm nóng chảy Be(r) + 2 NaOH(dd) + 2 H2O(l) Na2[Be(OH)4](dd) + H2(k) 13 Be(r) + NaOH(l) Na2BeO2(l) + H2(k) 14 Trạng thái thiên nhiên
• Mg & Ca: phổ biến trong vỏ trái ất
Mg: nước biển, dolomit CaCO3.MgCO3, magnesit MgCO3 Ca: á vôi CaCO3 15 16 Trạng thái thiên nhiên
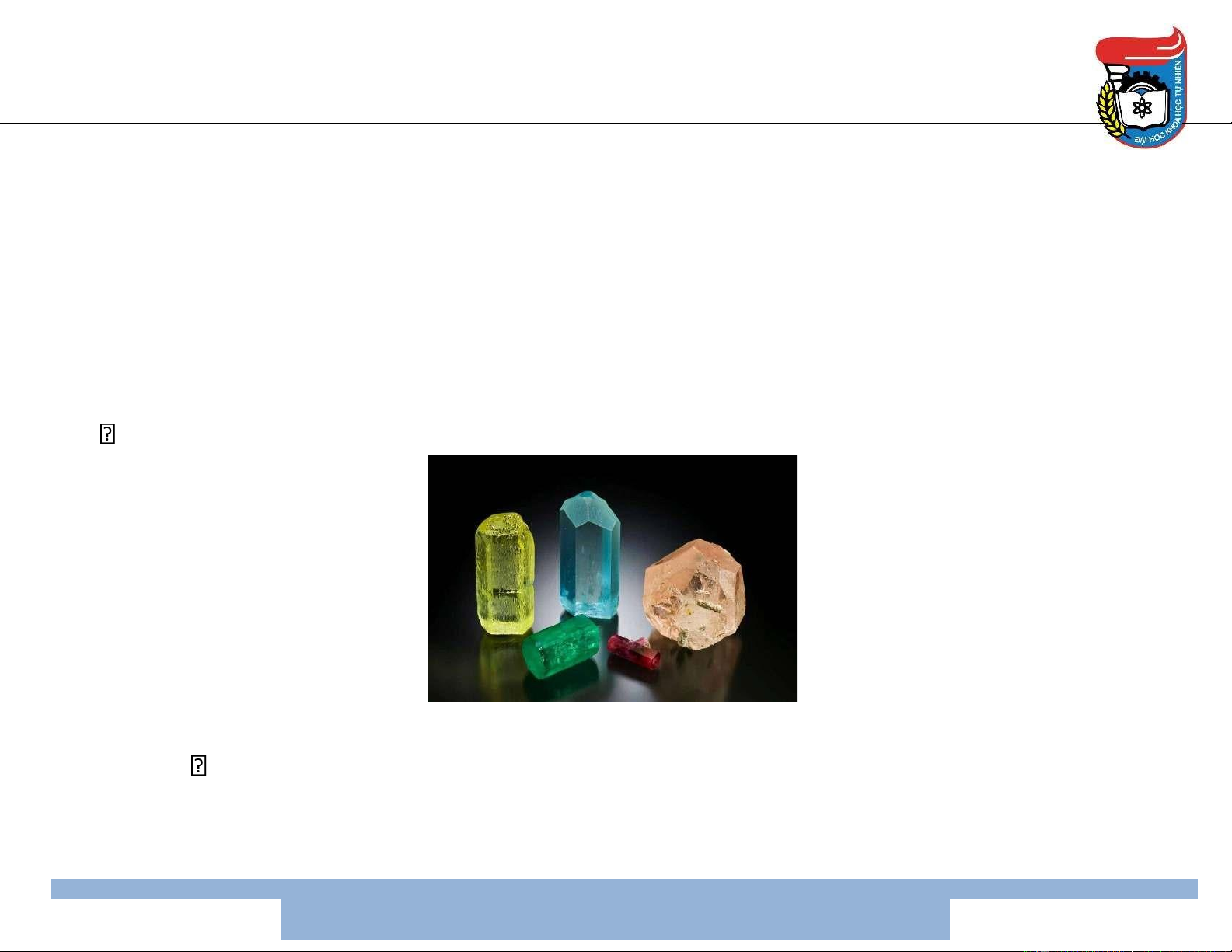
• Be, Sr & Ba: ít phổ biến hơn
Be: quặng á quý, beryl Be3Al2(SiO3)6
Sr & Ba: celestit SrSO4, strontianit SrCO3 & baryt BaSO4 17 Điều chế • Be: khử BeF2 bằng Mg
• Mg : iện phân nóng chảy MgCl2 hoặc khử MgO bằng than cốc
• Ca, Sr & Ba: iện phân nóng chảy MCl2 hoặc khử MO bằng Al 18 Nội dung 1. Nguyên tố 2. Kim loại kiềm thổ 3. Hợp chất ơn giản
4. Một số tính chất bất thường của Be 19 Hi rua
• Tất cả kim loại kiềm thổ (trừ Be): hi rua kiểu ion
• Điều chế: bằng phản ứng trực tiếp với H 2 (áp suất cao)
• CaH2: tác nhân làm khô dung môi
• MgH2: vật liệu tiềm năng cho việc tích trữ H2 Phần trăm khối lượng H lớn (7,67%) 20




