





Preview text:
CHƯƠNG I: ESTE – LIPIT Bài 1: ESTE
I. Khái niệm – phân loại 1. Khái niệm:
- Khi thay nhóm –OH ở nhóm cacboxyl của axit cacboxylic bằng nhóm OR’ thì được este Axit cacboxylic Este
RCOOR’ hoặc R’-OCO-R hoặc R’-OOC-R
Trong đó: R là H hoặc gốc hidrocacbon R’ là gốc hidrocacbon 2. Phân loại:
a. Dựa vào đặc điểm gốc hidrocacbon R, R’
- no (không chứa liên kết π) : este no
- Este đơn chức có 1 nhóm chức –COO–
CTTQ của este no, đơn chức, mạch hở: CmH2m+1COOCpH2p+1 (m 0; p 1)
Hoặc: CnH2nO2 (n = m + p + 1 2)
- Este đa chức có 2 nhóm chức –COO– trở lên (COOCH3)2 : dimetyl oxalat
(CH3COO)2C2H4 : etilenglicol diaxetat
II. Đồng phân – danh pháp 1. Đồng phân C3H6O2 : HCOOCH2CH3 : Etyl fomiat CH3COOCH3 : Metyl axetat C4H8O2 : HCOOCH2CH2CH3 : Propyl fomiat : isopropyl fomiat CH3COOCH2CH3 : Etyl axetat
CH3CH2COOCH3 : Metyl propionat 2. Danh pháp
Tên este = Tên gốc hidrocacbon R’ + tên gốc axit RCOO- III. Lý tính
- Nhiệt độ sôi: este < ancol < axit (cùng số nguyên tử Cacbon)
- Trạng thái: chất lỏng hoặc rắn
- Độ tan: nhẹ hơn nước, rất ít tan trong nước, hòa tan được nhiều chất hữu cơ khác nhau- Mùi: thơm, dễ chịu
Công thức và tên một số este có mùi thơm:
CH3-COO-CH2-CH2-CH(CH3)2 : isoamyl axetat : mùi chuối chín CH3-CH2-CH2-COO-CH2-
CH3 : etyl butirat : mùi dứa
(CH3)2CH-CH2-COO-CH2-CH3 : etyl isovalerat : mùi táo
CH3-COO-CH2-C6H5 : benzyl axetat : mùi hoa nhài
IV. Tính chất hóa học
1. Phản ứng thủy phân a. Trong môi trường axit RCOOR’ + H2O RCOOH + R’OH
Đặc điểm: phản ứng thuận nghịch
b. Trong môi trường bazo (phản ứng xà phòng hóa)
RCOOR’ + NaOH RCOONa + R’OH
Đặc điểm: phản ứng một chiều Lưu ý:
- Nếu ancol kém bền chuyển sang andehit, xeton…
- Este của ancol có n chức thì tác dụng với dd NaOH, KOH theo tỉ lệ mol 1 : n
- Este của phenol (đơn chức) thì tác dụng với dd NaOH, KOH theo tỉ lệ mol 1 : 2 tạo muối và nước
2. Phản ứng của gốc hidrocacbon
a. Các este không no có thể tham gia phản ứng cộng H2 (Ni,to), cộng dd Br2, cộng HX, trùng hợp
CH2=CH-COO-CH3 + H2 CH3CH2COOCH3
CH2=CH-COO-CH3 + Br2 (dd) CH2Br-CHBr-COO-CH3
b. Este của axit fomic tham gia phản ứng tráng gương 1HCOOR’ → 2Ag 3. Phản ứng cháy
- Các este dễ cháy tạo CO2, H2O và phản ứng tỏa nhiệt
- Nếu este no, đơn chức, mạch hở: nCO2 = nH2O CnH2nO2 + O2 nCO2 + nH2O
- Nếu este khác (không no/đa chức) : nCO2 > nH2O V. Điều chế este
- Este của ancol được điều chế bằng phản ứng este hóa giữa axit cacboxylic và ancol RCOOH + R’OH RCOOR’ + H2O
- Este của phenol được điều chế bằng phản ứng giữa dẫn xuất của axit cacboxylic và phenolVd: (CH3CO)2O + C6H5OH → CH3COOC6H5
- Este không no được điều chế bằng phản ứng cộng
Vd: CH3COOH + CHCH → CH3COOCH=CH2 VI. Ứng dụng - Làm dung môi
- Sản xuất polime dùng làm thủy tinh hữu cơ, chất dẻo…
- Một số este của axit phtalic được dùng làm chất hóa dẻo, làm dược phẩm
- Làm hương liệu trong công nghiệp thực phẩm và mĩ phẩm Bài 2: CHẤT BÉO I. Khái niệm lipit
- Lipit là những hợp chất hữu cơ có trong tế bào sống, không hòa tan trong nước nhưng tan trong các dung môi hữu cơ không phân cực
- Lipit bao gồm: chất béo, sáp, steroit, photpholipit… II. Chất béo 1. Cấu tạo
- Chất béo là trieste của glixerol với axit béo, gọi chung là triglixerol hay triaxylglixerol R1-COO-CH2
R no: chất béo rắn (dạng mỡ) R2-COO-CH
R không no: chất béo lỏng (dạng dầu) R3-COO-CH2
Trong đó R1, R2, R3 là các gốc hidrocacbon của axit béo có thể giống hoặc khác nhau CTCT thu gọn: (RCOO)3C3H5
- Axit béo là những axit đơn chức, có mạch cacbon dài, không phân nhánh, số nguyên tử Cacbon chẵn
Công thức và tên một số axit béo thường gặp: Công thức C15H31-COOH C17H35-COOH C17H33-COOH C17H31-COOH
Tên thông thường Axit panmitic Axit stearic Axit oleic Axit linoleic Đặc điểm cấu tạo no no 1C=C 2C=C M 255 + 1 283 + 1 281 + 1 279 + 1
2. Tính chất vật lí
- Chất béo không tan trong nước, nhẹ hơn nước, tan nhiều trong dung môi hữu cơ như benzen, clorofom
- Ở nhiệt độ thường, chất béo tồn tại ở trạng thái lỏng hoặc rắn 3. Tính chất hóa học
a. Phản ứng thủy phân
- Phản ứng thủy phân trong môi trường axit
(COO)3C3H5 + 3H2O 3COOH + C3H5(OH)3
- Phản ứng xà phòng hóa
(COO)3C3H5 + 3NaOH 3COONa + C3H5(OH)3 b. Phản ứng hidro hóa
Chất béo không no (lỏng) + H2 Chất béo no (rắn)
Chất béo không no, có k liên kết C=C + 3COO (3 + k) liên kết π CTPT: CnH2n-4-2kO6 CnH2n-4-2kO6 + kH2 CnH2n-4O6
CnH2n-4-2kO6 + kBr2 → CnH2n-4Br2kO6 c. Sự ôi hóa dầu mỡ
- Dầu mỡ để lâu có mùi khó chịu (hôi, khét) mà ta gọi là hiện tượng dầu mỡ bị ôi
- Nguyên nhân của hiện tượng này là do liên kết đôi C=C ở gốc axit không no của chất béo bị oxi hóa chậm bởi oxi không khí tạo
thành peoxit, chất này bị phân hủy thành các andehit có mùi khó chịu và gây hại cho người ăn 4. Ứng dụng
- Chất béo là thức ăn quan trọng của con người. Nó là nguồn dinh dưỡng quan trọng và cung cấp phần lớn năng lượng cho cơ thể hoạt động
- Trong công nghiệp, một lượng lớn chất béo dùng để điều chế xà phòng và glixerol
CHƯƠNG II: CACBOHIDRAT
Bài 1: MỞ ĐẦU – GLUCOZO I. Mở đầu 1. Khái niệm
- Cacbohidrat (gluxit, saccarit) là những hợp chất hữu cơ tạp chức:
+ có thành phần nguyên tố: C, H, O
+ thường có công thức chung: Cn(H2O)m
+ về cấu tạo, cacbohidrat là những hợp chất polihidroxicacbonyl và dẫn xuất của chúng 2. Phân loại
- Monosaccarit: là nhóm cacbohidrat đơn giản nhất không thể thủy phân được Vd: Glucozo, Fructozo (C6H12O6)
- Disaccarit: là nhóm cacbohidrat mà khi thủy phân sinh ra 2 phân tử monosaccarit Vd: Saccarozo, Mantozo (C12H22O11)
- Polisaccarit: là nhóm cacbohidrat phức tạp mà khi thủy phân đến cùng sinh ra nhiều phân tử monosaccarit
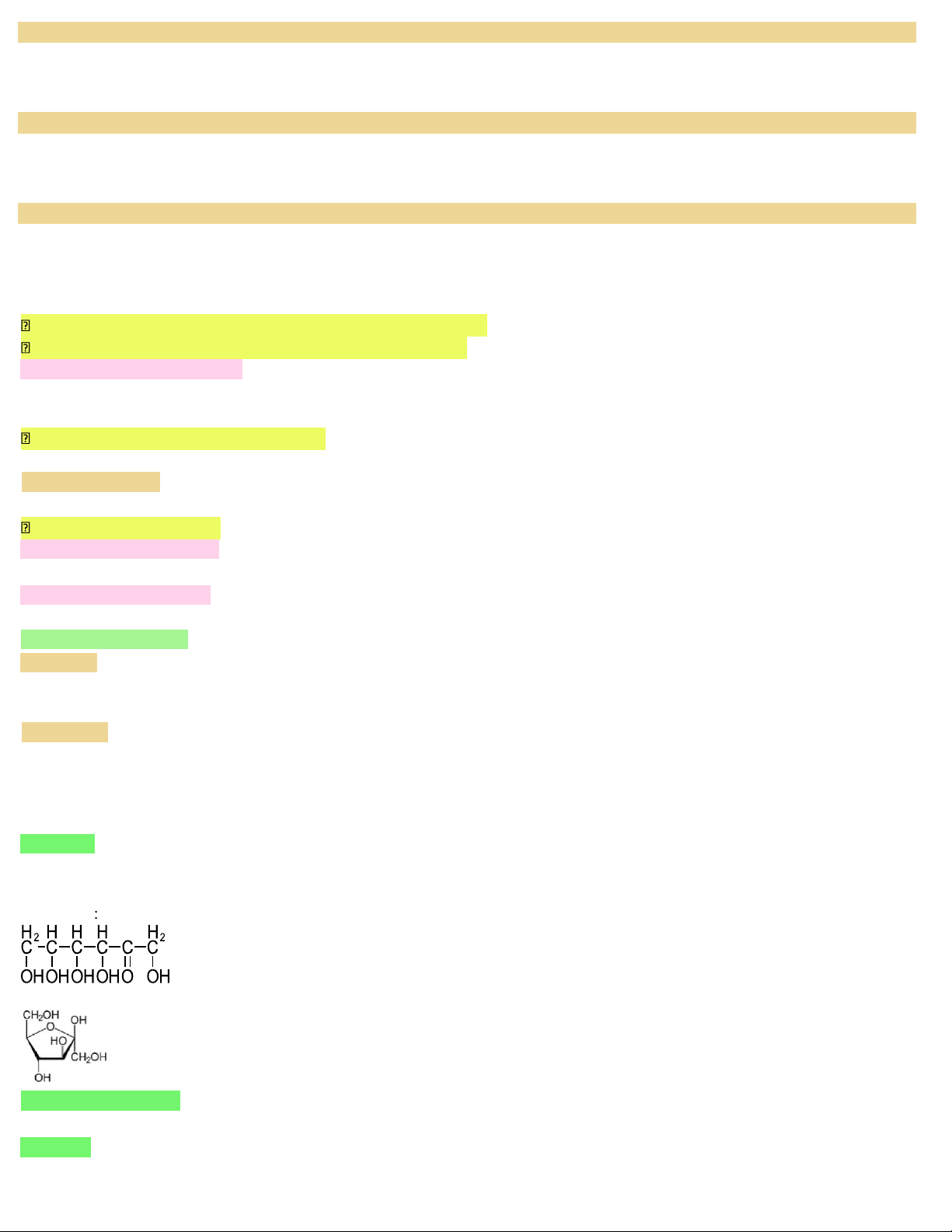
Vd: Tinh bột, Xenlulozo ( (C6H10O5)n ) II. Glucozo 1. Cấu tạo - CTPT: C6H12O6 - CTCT: + mạch hở: Không phân nhánh Có 1 nhóm –CHO Có 5 nhóm –OH
+ mạch vòng: (trạng thái rắn) -glucozo β-glucozo Vòng 6 cạnh (5C + 1O)
Có 5 nhóm –OH (OH ở C1 là OH hemiaxetal)
2. Trạng thái tự nhiên
- Glucozo có trong hầu hết các bộ phận của cây như lá, hoa, rễ… và nhất là trong quả chín. Đặc biệt, glucozo có nhiều trong quả
nho nên còn gọi là đường nho
- Trong mật ong có nhiều glucozo (khoảng 30%)
- Glucozo cũng có trong cơ thể người và động vật
- Trong máu người có một lượng nhỏ glucozo, hầu như không đổi (nồng độ 0,1%) 3. Lý tính
- Chất kết tinh, không màu
- Nhiệt độ nóng chảy 146C (dạng ) và 150C (dạng ) - Dễ tan trong nước
- Có vị ngọt ( < đường mía) 4. Tính chất hóa học
4.1: Tính chất của nhóm –CHO
a. Tác dụng với AgNO3/NH3
- Phản ứng tráng gương - Tạo amoni gluconat - Chất khử: C6H12O6 - Chất oxh: AgNO 3/NH3
HOCH2[CHOH]4CHO + 2AgNO3 + 3NH3 + H2O 2Ag↓ + HOCH2[CHOH]4COONH4 + 2NH4NO3 Amoni gluconat
b. Oxi hóa bằng Cu(OH)2 trong NaOH, t
- Phản ứng tạo Cu2O↓ màu đỏ gạch - Tạo natri gluconat - Chất khử: C6H12O6 - Chất oxh: Cu(OH) 2/NaOH
HOCH2[CHOH]4CHO + 2Cu(OH)2 + NaOH HOCH2[CHOH]4COONa + Cu2O↓ + 3H2O
c. Tác dụng với nước Br2 - Mất màu nước Br2 - Tạo axit gluconic - Chất khử: C6H12O6 - Chất oxh: Br2/H2O
HOCH2[CHOH]4CHO + Br2 + H2O → HOCH2[CHOH]4COOH + HBr d. Tác dụng với H2 - Thu được sobitol
- Chất khử: H2 - Chất oxh: C6H12O6
HOCH2[CHOH]4CHO + H2 HOCH2[CHOH]4CH2OH Sobitol
Trong phản ứng a,b,c glucozo là chất khử hay chất bị oxi hóa
Trong phản ứng d glucozo là chất oxi hóa hay chất bị khử
4.2: Tính chất của ancol đa chức
a. Tác dụng với Cu(OH)2 ở điều kiện thường
- Dung dịch glucozo hòa tan Cu(OH)2 → dd màu xanh lam
Glucozo có nhiều nhóm –OH liền nhau
2C6H12O6 + Cu(OH)2 → (C6H11O6)2Cu + 2H2O b. Phản ứng tạo este
- Glucozo có thể tạo este chứ 5 gốc axetat trong phân tử khi tham gia phản ứng với anhidrit axetic (CH3CO)2O (pridin)
Glucozo có 5 nhóm –OH
4.3: Tính chất của dạng vòng
- Glucozo tác dụng với CH3OH/HCl, nhóm –OH hemiaxetal phản ứng tạo hợp chất glicozit có nhóm –OCH3
4.4: Phản ứng lên men rượu C6H12O6 2C2H5OH + 2CO2
5. Điều chế - Ứng dụng a. Điều chế
- Trong công nghiệp: điều chế từ tinh bột (C6H10O5)n + nH2O nC6H12O6 b. Ứng dụng
- Glucozo được dùng làm thuốc tăng lực
- Glucozo được dùng để tráng gương, tráng ruột phích
- Là sản phẩm trung gian trong sản xuất ancol etylic
III. Fructozo (đồng phân của Glucozo) 1. Cấu tạo - CTPT: C6H12O6 - C TCT: + m ạc : h hở + m ạch vòng : β-fructozo .
2 Trạng thái tự nhiên
- Có nhiều trong quả ngọt, đặc biệt là mật ong (40%) 3. Lý tính
- Chất kết tinh, không màu, dễ tan trong nước, có vị ngọt (> đường mía)
4. Tính chất hóa học
- Có tính chất của ancol đa chức:
+ Hòa tan Cu(OH)2 tạo dd màu xanh lam
- Vì trong môi trường có OH- , Fructozo chuyển thành Glucozo nên: + Fructozo tráng gương
+ Tạo kết tủa đỏ gạch khi tác dụng với Cu(OH)2/NaOH, to
+ Fructozo không tác dụng với nước Br2
Dùng nước Br2 để phân biệt Fructozo và Glucozo
* Tính chất hóa học của Glucozo và Fructozo: Glucozo Fructozo H 2 /Ni, t o + + ( tạo sobitol ) ( tạo sobitol + mannitol ) AgNO 3 /NH 3 + + + + Cu(OH) 2 /OH - , t o Cu(OH) 2 + + Br 2 /H 2 O + - ( CH 3 CO) 2 O + + CH 3 OH/HCl + + H 2 O/H + , t o - -
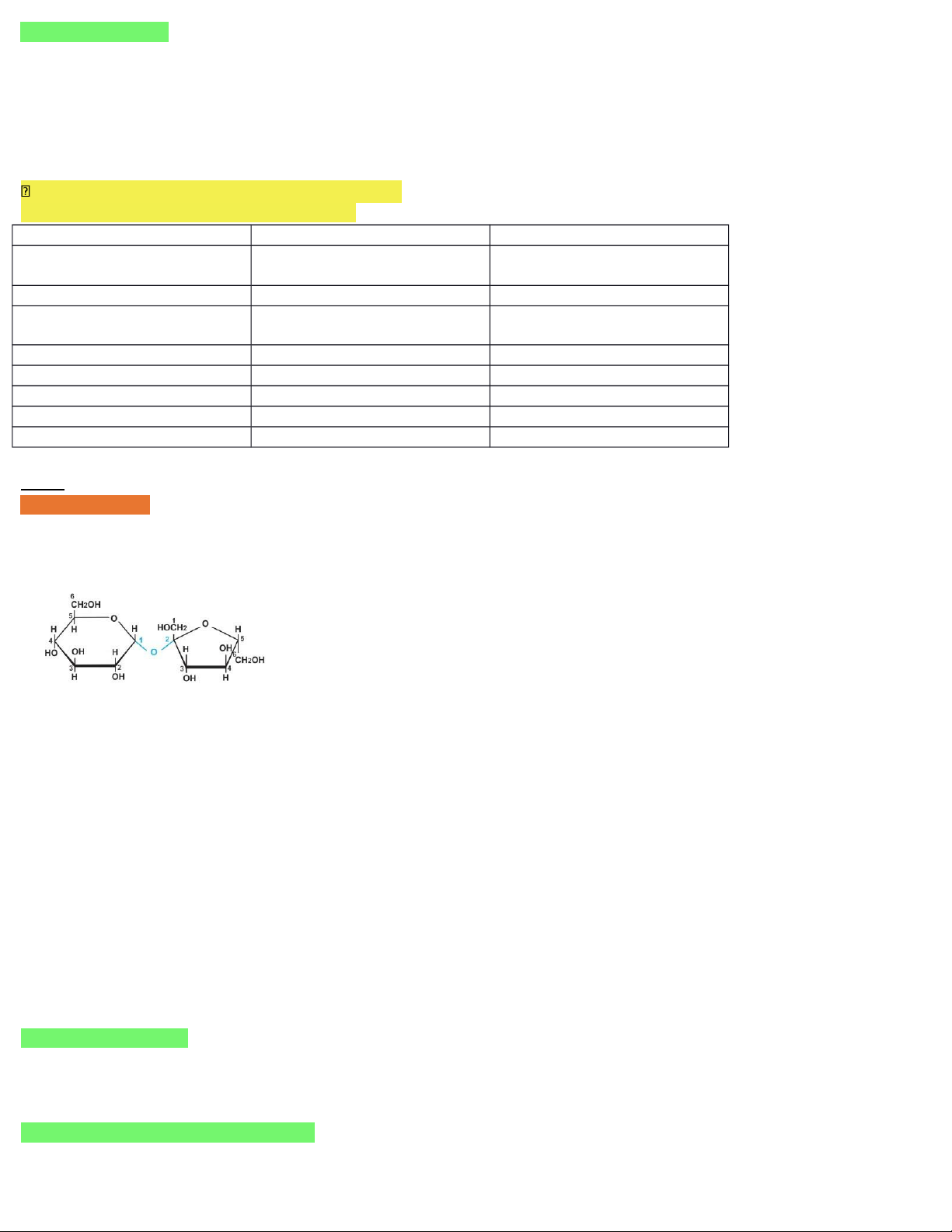
Bài 2: SACCAROZO – MANTOZO A. SACCAROZO I. Cấu tạo - CTPT: C12H22O11 (M = 342) - Cấu trúc: α-glucozo β-fructozo + dạng vòng
+ 1 gốc α-glucozo liên kết với 1 gốc β-fructozo
+ có liên kết C1-O-C2 là liên kết glicozit
II. Trạng thái tự nhiên
- Saccarozo có trong nhiều loại thực vật và là thành phần chủ yếu của:
+ đường mía (từ cây mía)
+ củ cải đường (từ củ cải đường)
+ đường thốt nốt (từ cụm hoa thốt nốt) III. Lý tính
- Chất kết tinh, không màu
- Nhiệt độ nóng chảy 185C - Dễ tan trong nước - Có vị ngọt
IV. Tính chất hóa học
1. Phản ứng thủy phân
C12H22O11 + H2O C6H12O6 + C6H12O6 Glucozo Fructozo + xúc tác: H+/enzim
2. Phản ứng với một số hidroxit kim loại
- Saccarozo tác dụng với đồng (II) hidroxit tạo dd đồng saccarat màu xanh lam
2C12H22O11 + Cu(OH)2 → (C12H21O11)2Cu + 2H2O Đồng saccarat
- Saccarozo tác dụng với canxi hidroxit tạo dd canxi saccarat2C12H22O11 + Ca(OH)2 → (C12H21O11)2Ca + 2H2O
Áp dụng trong quá trình sản xuất và tinh chế đường, dẫn khí CO2 vào dd canxi saccarat sẽ cho kết tủa CaCO3, còn lại dd saccarozo 3. Phản ứng khác
- Vì phân tử saccarozo có cấu trúc mạch vòng và không còn nhóm –OH hemiaxetal nên saccarozo:
+ Không tác dụng với AgNO3/NH3 tạo Ag
+ Không tác dụng với Cu(OH)2/NaOH tạo Cu2O
+ Không tác dụng với Br2/H2O
+ Không tác dụng với H2/Ni, to
+ Không tác dụng với CH3OH/HCl V. Ứng dụng
- Dùng trong công nghệ thực phẩm, để sản xuất bánh, kẹo, nước giải khát
- Dùng trong công nghiệp dược phẩm để pha chế thuốc B. MANTOZO I. Cấu tạo - CTPT: C12H22O11 (M = 342) - Cấu trúc: α-glucozo α-glucozo
+ 2 gốc α-glucozo liên kết với nhau
+ có liên kết α-1,4-glicozit
+ còn nhóm OH hemiaxetal → có thể mở vòng tạo nhóm –CHO
II. Tính chất hóa học
1. Phản ứng thủy phân C12H22O11 + H2O 2C6H12O6 Glucozo
2. Phản ứng với đồng (II) hidroxit
- Mantozo tác dụng với Cu(OH)2 ở điều kiện thường tạo dd màu xanh lam
*Tính chất hóa học của Saccarozo và Mantozo Saccarozo Mantozo H 2 /Ni, t o - + AgNO 3 /NH 3 - + - + Cu(OH) 2 /OH - , t o Cu(OH) 2 + + Br 2 /H 2 O - + ( CH 3 CO) 2 O + + CH 3 OH/HCl - + H 2 O/H + , t o + +
Bài 3: TINH BỘT – XENLULOZO A. TINH BỘT I. Cấu tạo - CTPT: (C6H10O5)n
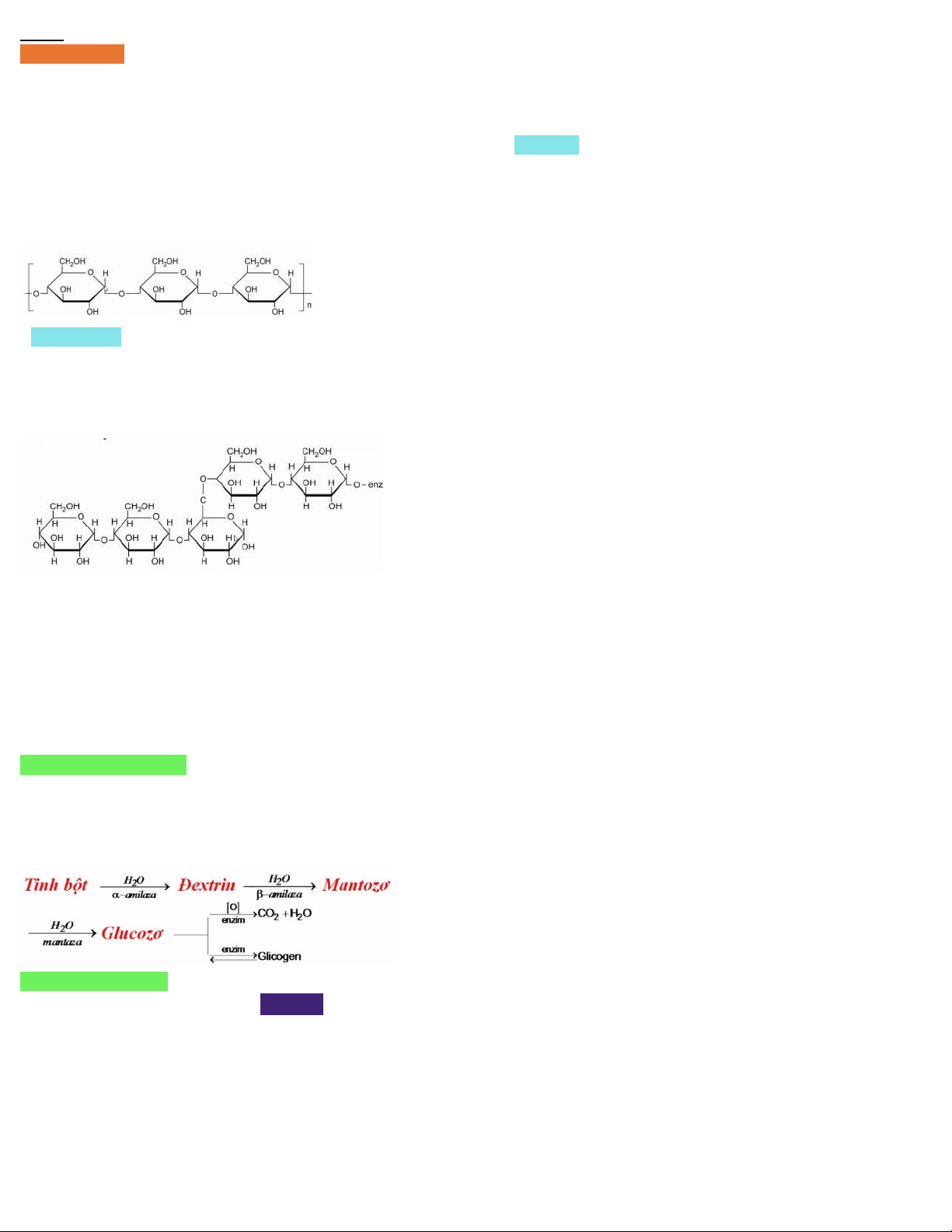
- Tinh bột là hỗn hợp của 2 polisaccarit: amilozo và amilopectin
- Cả 2 đều có CTPT là (C6H10O5)n , trong đó C6H10O5 là gốc α-glucozo - Amilozo:
+ Chiếm từ 20-30% khối lượng tinh bột
+ do các gốc α-glucozo nối với nhau + liên kết α-1,4-glucozit
+ không phân nhánh, không duỗi thẳng mà xoắn lại thành hình lò xo - Amilopectin:
+ chiếm 70-80% khối lượng tinh bột
+ do các gốc α-glucozo nối với nhau
+ liên kết α-1,4-glicozit và α-1,6-glicozit → cấu tạo phân nhánh
II. Trạng thái tự nhiên
- Tinh bột có rất nhiều trong các loại ngũ cốc (gạo, mì, ngô,…), củ (khoai, sắn,…) và quả (táo, chuối…)
- Hàm lượng tinh bột trong gạo khoảng 80%, trong ngô khoảng 70%, trong mì khoảng 65%, trong củ khoai tây tương khoảng 20% III. Lý tính
- Chất rắn vô định hình, màu trắng
- Không tan trong nước nguội. Trong nước nóng từ 65oC trở lên, tinh bột chuyển thành dd keo nhớt, gọi là hồ tinh bột IV.
Tính chất hóa học
1. Phản ứng thủy phân
- Thủy phân hoàn toàn thu được glucozo (C6H10O5)n + nH2O nC6H12O6 - Xúc tác: H+ hoặc enzim
- Trong cơ thể người và động vật, tinh bột bị thủy phân thành glucozo nhờ các enzim
2. Phản ứng màu iot
- Hồ tinh bột + dd I2 → dd có màu xanh tím
- Khi đun nóng thì mất màu xanh, để nguội thì xuất hiện màu xanh trở lại V. Ứng dụng
- Tinh bột trong các loại lương thực là một trong những thức ăn cơ bản của con người B. XENLULOZO I. Cấu tạo - CTPT: (C6H10O5)n
- Xenlulozo có phân tử khối rất lớn
- Do các mắt xích β-glucozo nối với nhau - Liên kết β-1,4-glucozit
- Phân tử Xenlulozo không phân nhánh, không xoắn
- Mỗi mắt xích C6H10O5 có 3 nhóm –OH tự do → CTCT của Xenlulozo: [C6H7O2(OH)3]n
II. Trạng thái tự nhiên
- Xenlulozo là thành phần chính tạo nên lớp màng tế bào thực vật, là bộ khung của cây cối- Xenlulozo có nhiều trong
bông (95-98%), đay, gai, tre, nứa (50-80%), gỗ (40-50%) III. Lý tính
- Chất rắn hình sợi, màu trắng, không mùi, không vị
- Không tan trong nước ngay cả khi đun nóng, không tan trong các dung môi hữu cơ thông thường như ete,
benzen…- Tan trong nước Svayde (dung dịch thu được khi hòa tan Cu(OH)2 trong amoniac)
IV. Tính chất hóa học
1. Phản ứng thủy phân
- Thủy phân hoàn toàn thu được glucozo (C6H10O5)n + nH2O nC6H12O6
- Xúc tác: H+ hoặc enzim xenlulaza
* Trong cơ thể người và động vật, tinh bột bị phân hủy thành glucozo nhờ các enzim amilaza và mantaza
2. Phản ứng với HNO3
[C6H7O2(OH)3]n + 3nHNO3 (đ) [C6H7O2(ONO2)3]n + 3nH2O Xenlulozo trinitrat
Xenlulozo trinitrat: làm thuốc súng không khói
3. Phản ứng với (CH3CO)2O
[C6H7O2(OH)3]n + 3n(CH3CO)2O [C6H7O2(OCOCH3)3]n + 3nCH3COOH Xenlulozo axetat
Xelulozo axetat: sản xuất phim ảnh, tơ axetat V. Ứng dụng
- Dùng làm vật liệu xây dựng, đồ dùng gia đình…
- Sản xuất tơ nhân tạo (tơ axetat, tơ visco, tơ đồng – amoniac) - Sản xuất giấy
- Sản xuất xenlulozo trinitrat dùng làm thuốc súng - Sản xuất etanol
* Tính chất hóa học của tinh bột và xenlulozo Tinh bột Xenlulozo I 2 + - ( CH 3 CO) 2 O + + HNO 3 đ/H 2 SO 4 + + H 2 O/H + ,t o + +




