











Preview text:
70 câu trắc nghiệm (chủ yếu vào đại cương, thuốc virus và các tác dụng phụ) + 10 câu nối ý I. Đại cương
Bài 1. Thuốc và quá trình khám phá thuốc mới
1. Thuốc và quá trình khám phá
− Định nghĩa: Thuốc là chất hoặc hỗn hợp các chất dùng cho người nhằm phòng bệnh, chữa
bệnh, chẩn đoán hoặc điều chỉnh chức năng sinh lý cho cơ thể, bao gồm thuốc thành phẩm,
nguyên liệu làm thuốc, vaccine và sinh phẩm y tế
− Quá trình nghiên cứu và phát triển thuốc hiện đại
2. Ứng dụng một số kĩ thuật hiện đại − Tổng hợp tổ hợp
− Sàng lọc hiệu năng cao
− Máy tính hỗ trợ thiết kế
Bài 2. Đích tác dụng của thuốc
1. Enzyme: Chất xúc tác cho nhiều phản ứng hóa học (thuận nghịch) trong TB
Đinh Hoàng Giang – K4 Dược h c – SMP ọ − VNU 1
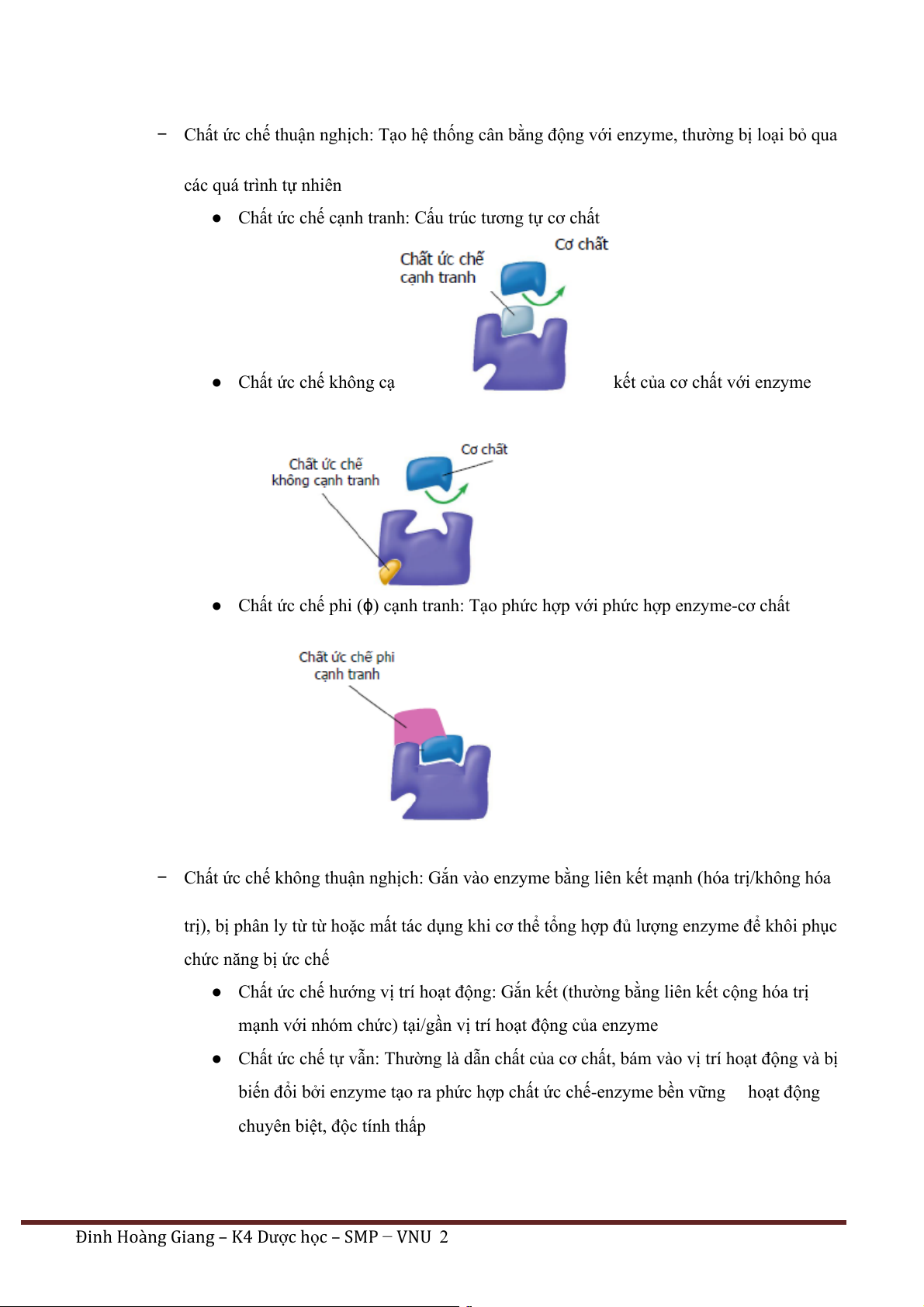
− Chất ức chế thuận nghịch: Tạo hệ thống cân bằng động với enzyme, thường bị loại bỏ qua các quá trình tự nhiên
● Chất ức chế cạnh tranh: Cấu trúc tương tự cơ chất
● Chất ức chế không cạ
kết của cơ chất với enzyme
● Chất ức chế phi (ϕ) cạnh tranh: Tạo phức hợp với phức hợp enzyme-cơ chất
− Chất ức chế không thuận nghịch: Gắn vào enzyme bằng liên kết mạnh (hóa trị/không hóa
trị), bị phân ly từ từ hoặc mất tác dụng khi cơ thể tổng hợp đủ lượng enzyme để khôi phục chức năng bị ức chế
● Chất ức chế hướng vị trí hoạt động: Gắn kết (thường bằng liên kết cộng hóa trị
mạnh với nhóm chức) tại/gần vị trí hoạt động của enzyme
● Chất ức chế tự vẫn: Thường là dẫn chất của cơ chất, bám vào vị trí hoạt động và bị
biến đổi bởi enzyme tạo ra phức hợp chất ức chế-enzyme bền vững hoạt động
chuyên biệt, độc tính thấp
Đinh Hoàng Giang – K4 Dược h c – SMP ọ − VNU 2
− Chất ức chế trạng thái chuyển tiếp: Chất bền vững có cấu trúc tương tự cơ chất trong trạng
thái chuyển tiếp, bám thuận nghịch/không thuận nghịch vào vị trí hoạt động
2. Receptor: Protein tiếp nhận tín hiệu hóa học (ligand) từ bên ngoài, hoạt hóa/ức chế chuỗi phản
ứng sinh hóa liên kết chuyên biệt với nó
− Chất chủ vận: Hoạt hóa receptor, đặc trưng bới EC50 ● Chất siêu chủ vận
● Chất chủ vận toàn phần
● Chất chủ vận từng phần (tác dụng của hầu hết các thuốc)
− Chất đối vận: Ngăn chặn hoạt động của chất chủ vận, đặc trưng bởi IC50
− Chất chủ vận ngược: Gây tác động ngược lại với chất chủ vận
3. Acid nucleic: Đại phân tử thiết yếu cho mọi dạng sống, cấu tạo từ đường 5 carbon + nhóm
phosphat + base nitơ purine (A, G) hoặc pyrimidine (T, U, C)
− Chất ức chế quá trình tổng hợp acid nucleic: Ngăn chặn sự tổng hợp DNA
● Chất chống chuyển hóa: Thay thế chất nội sinh tạo sản phẩm không có vai trò,
hoặc ức chế enzyme tham gia vào con đường chuyển hóa
Kháng folate (cofactor trong tổng hợp A, G, T) Kháng purine Kháng pyrimidine
Đinh Hoàng Giang – K4 Dược h c – SMP ọ − VNU 3
● Chất ức chế enzyme: Ức chế enzyme trực tiếp chịu trách nhiệm tổng hợp acid nucleic
− Chất tác động trên phân tử acid nucleic: Ức chế sao chép, nhân đôi, gây chết TB
● Tác nhân chèn mạch: Thường có vòng hoặc dị vòng ngưng tụ phẳng, chèn vào giữa
các base của DNA (liên kết hydro, Van der Waals, tĩnh điện), làm bung từng phần chuỗi xoắn DNA
● Tác nhân alkyl hóa: Hình thành liên kết chéo nội mạch làm vặn chuỗi, hoặc liên
mạch để khóa chúng lại với nhau
● Tác nhân cắt mạch: Bẻ acid nucleic thành từng mảnh không thể nối lại bằng DNA ligase
4. Màng và thành TB: Lớp vật chất bao quanh giúp bảo vệ, điều hòa, nâng đỡ TB
− Chất ức chế khả năng duy trì sự toàn vẹn của màng TB-màng lipid kép bán thấm gồm
nhiều loại lipid và protein
− Chất ức chế quá trình tổng hợp thành TB-nằm bao ngoài màng một số loại TB (ở VK là peptidoglycan)-hoàn chỉnh
− Chất tạo kênh hoặc phá hủy một phần màng/thành TB
Bài 3. Liên quan cấu trúc – tác dụng
1. Mục đích của việc nghiên cứu liên hệ giữa cấu trúc và tác dụng của thuốc
− Khái quát các tác động sinh học của việc thay đổi cấu trúc cụ thể
− Phát triển loại thuốc mới tăng cường hoạt tính hoặc có hoạt tính mới và giảm tác dụng phụ so với thuốc hiện hành
2. Tác động khi thay đổi hình dạng và kích thước chất lead
− Số lượng nhóm methylene trong chuỗi và vòng
● Khi tăng ở chuỗi có thể tạo dạng hạt micelle làm giảm hoạt tính thuốc
● Khi thay đổi ở vòng có thể thay đổi hoạt tính thuốc
− Nồng độ bão hòa (no)
Đinh Hoàng Giang – K4 Dược h c – SMP ọ − VNU 4
● Thêm liên kết đôi làm tăng độ “cứng” của cấu trúc và có thể tạo ra đồng phân E và Z
● Khử liên kết đôi làm cấu trúc linh hoạt hơn − Hệ vòng
● Thêm vòng có thể tạo ra “túi” thân dầu giúp thuốc dễ dàng bám vào đích
● Các hệ vòng lớn có thể phối hợp với nhau tạo ra chất kháng lại sự tấn công từ enzyme
● Bớt đi hệ vòng thường tạo ra chất hoạt động tự nhiên hơn
3. Tác động khi thêm/thay nhóm thế mới
− Thêm nhóm thế vào vị trí trống Nhóm Độ thân Ảnh hưởng thế dầu Tăng hấp thụ
Giảm giải phóng từ màng TB -CH3 Tăng
Có thể thay đổi con đường và khả năng chuyển hóa
Nhóm alkyl dài hơn có tác động tương tự Tăng hấp thu -F và
Tích tụ lại trong mô lipid Tăng -Cl
Thường dùng nhóm -CF3 thay cho -Cl vì chúng có kích thước tương đương
Tạo trung tâm LK hydro, có thể ảnh hưởng khả năng gắn thuốc vào đích -OH Giảm
Có thể tăng tỉ lệ loại bỏ thuốc thông qua con đường chuyển hóa và/hoặc thải trừ mới Tạo muối -NR3 Giảm
Tạo trung tâm LK hydro, có thể ảnh hưởng khả năng gắn thuốc vào đích
Tránh các amine thơm vì chúng thường độc và/hoặc gây ung thư Tạo muối -COOH
Tăng tỉ lệ loại bỏ thuốc và Giảm
Gắn nhóm -COOH vào phân tử nhỏ có thể thay đổi hoạt tính -SO3H
Gắn nhóm -SO3H thường không thay đổi hoạt tính
Đinh Hoàng Giang – K4 Dược h c – SMP ọ − VNU 5
− Thay nhóm thế mới vào vị trí cũ: Thường tạo ra chất có cùng hoạt tính với lead
● Nhóm đẳng cấu điện tử (isostere): Phân tử/ion có cùng số nguyên tử và/hoặc số
electron lớp vỏ và/hoặc lớp vỏ electron tương tự nhau
● Nhóm đẳng cấu điện tử sinh học: Hợp chất chứa isostere có hoạt tính sinh học
4. Định lượng liên quan cấu trúc – tác dụng: QSAR
− Phương trình Hansch cho nhóm thế
● log (1/C) = k1*π + k2*σ + k3*ES + k4
● C: nồng độ chất tối thiểu gây ra đáp ứng sinh học
● π: hằng số thân dầu
● σ: hằng số Hammett cho hiệu ứng điện tử
● ES: hằng số Taft cho tác động của cấu trúc lập thể
− Biểu đồ Craig: Thể hiện sự kết hợp giá trị của 2 thông số của phương trình Hansch
VD: Để tác dụng cao, nhóm thế cần có giá trị π>0 và σ<0 chọn những nhóm thuộc góc phần tư duới phải
− Cây quyết định Topliss: Định hướng nghiên cứu chất tương đồng có tác dụng tốt nhất
● Với nhóm thế trực tiếp vào vòng thơm
● Với thay đổi trên chuỗi no là nhánh của vòng thơm
Bài 4. Chuyển hóa thuốc và thiết kế thuốc
1. Quá trình chuyển hóa thuốc
Đinh Hoàng Giang – K4 Dược h c – SMP ọ − VNU 6
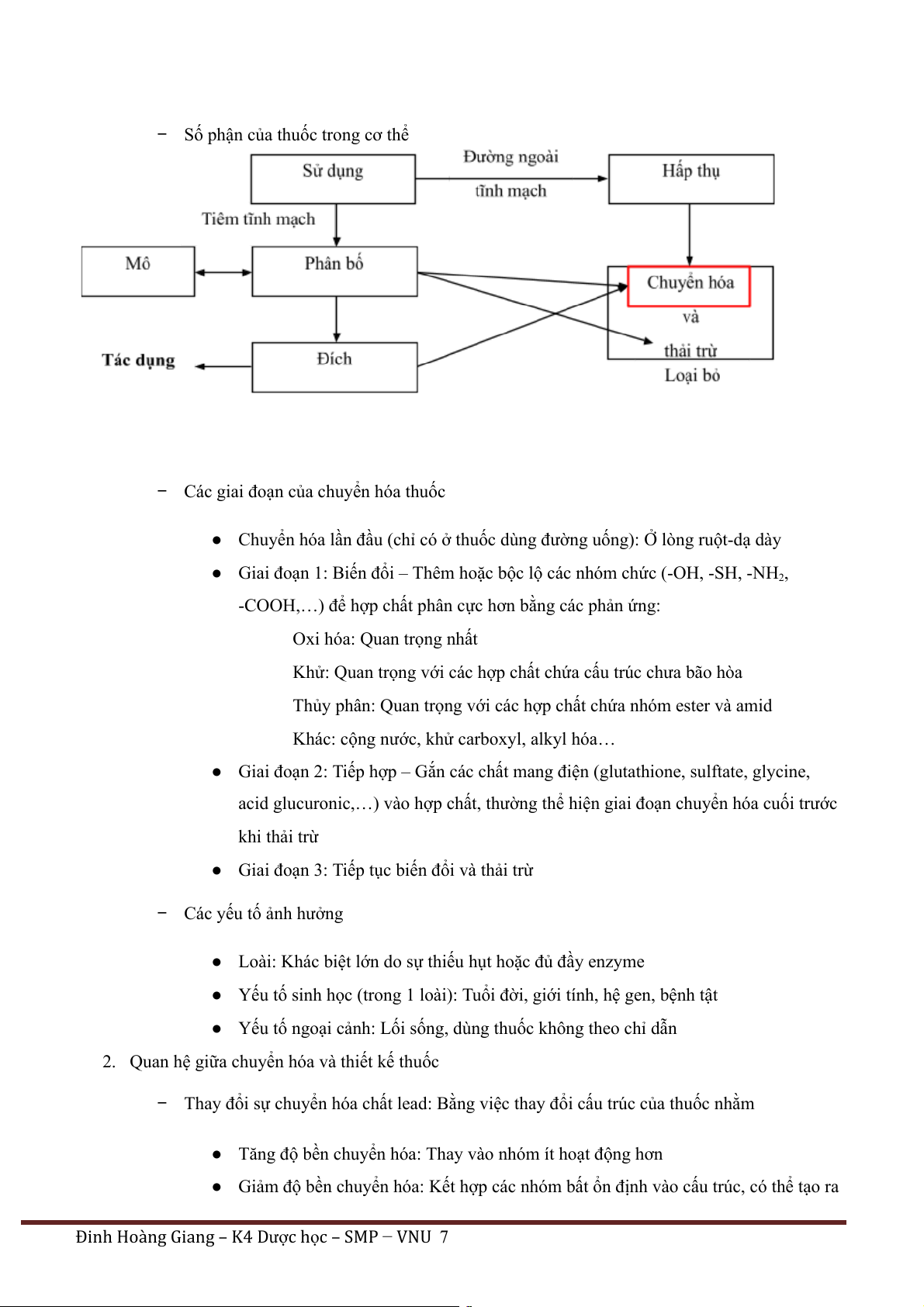
− Số phận của thuốc trong cơ thể
− Các giai đoạn của chuyển hóa thuốc
● Chuyển hóa lần đầu (chỉ có ở thuốc dùng đường uống): Ở lòng ruột-dạ dày
● Giai đoạn 1: Biến đổi – Thêm hoặc bộc lộ các nhóm chức (-OH, -SH, -NH2,
-COOH,…) để hợp chất phân cực hơn bằng các phản ứng: Oxi hóa: Quan trọng nhất
Khử: Quan trọng với các hợp chất chứa cấu trúc chưa bão hòa
Thủy phân: Quan trọng với các hợp chất chứa nhóm ester và amid
Khác: cộng nước, khử carboxyl, alkyl hóa…
● Giai đoạn 2: Tiếp hợp – Gắn các chất mang điện (glutathione, sulftate, glycine,
acid glucuronic,…) vào hợp chất, thường thể hiện giai đoạn chuyển hóa cuối trước khi thải trừ
● Giai đoạn 3: Tiếp tục biến đổi và thải trừ
− Các yếu tố ảnh hưởng
● Loài: Khác biệt lớn do sự thiếu hụt hoặc đủ đầy enzyme
● Yếu tố sinh học (trong 1 loài): Tuổi đời, giới tính, hệ gen, bệnh tật
● Yếu tố ngoại cảnh: Lối sống, dùng thuốc không theo chỉ dẫn
2. Quan hệ giữa chuyển hóa và thiết kế thuốc
− Thay đổi sự chuyển hóa chất lead: Bằng việc thay đổi cấu trúc của thuốc nhằm
● Tăng độ bền chuyển hóa: Thay vào nhóm ít hoạt động hơn
● Giảm độ bền chuyển hóa: Kết hợp các nhóm bất ổn định vào cấu trúc, có thể tạo ra
Đinh Hoàng Giang – K4 Dược h c – SMP ọ − VNU 7
Tiền thuốc (prodrug): Hợp chất chỉ có tác dụng khi đã được chuyển hóa
Thuốc mềm (soft drug): Hợp chất có tác dụng được chuyển hóa liên tục
thành dạng không độc, bán thải ngắn − Tiền thuốc (prodrug) ● Phân loại
Chất tiền sinh học: Giải phóng phần có hoạt tính trong cấu trúc sau chuyển hóa
Chất vận chuyển: Chất có hoạt tính được gắn với chất mang thông qua một
cầu nối (nhóm chức dễ bị chuyển hóa) ● Mục đích
Tăng khả năng hấp thụ và vận chuyển qua màng
Tăng sức chịu đựng từ bệnh nhân Giải phóng chậm
Tác dụng hướng đích (đặc biệt là khả năng qua hàng rào máu não và tìm kiếm khối u)
Tác dụng phụ tối thiểu II. Thuốc kháng sinh Bài 1. Đại cương
1. Định nghĩa: Kháng sinh là các chất có nguồn gốc VSV, tổng hợp, bán tổng hợp có tác dụng tiêu
diệt hoặc ức chế sự sinh trưởng của VSV và điều trị nhiễm trùng ở liều nhỏ 2. Phân loại
− Theo nguồn gốc: tự nhiên, bán tổng hợp, tổng hợp. Chỉ số trị liệu (TI): tỉ số giữa MTC và
MEC; chỉ số càng lớn thuốc càng ít độc
− Theo tác dụng: diệt khuẩn (đặc trưng bởi MBC) và kìm khuẩn (đặc trưng bởi MIC)
− Theo phổ tác dụng: phổ rộng (độc với vật chủ cao) và phổ hẹp (độc với vật chủ thấp)
− Theo cơ chế: ức chế tổng hợp thành TB, ức chế chức năng màng TB, ức chế tổng hợp
protein, chống chuyển hóa, ức chế tổng hợp acid nucleic
Đinh Hoàng Giang – K4 Dược h c – SMP ọ − VNU 8
− Theo loại VSV đích: thuốc kháng khuẩn (TB nhân sơ), thuốc kháng nấm (TB nhân chuẩn),
thuốc kháng virus (TB chủ) (độc tính tăng dần)
− Theo cấu trúc hóa học: các họ kháng sinh 3. Đề kháng
− VSV không bị tiêu diệt hoặc ức chế, do tự nhiên hoặc mắc phải − Cơ chế:
● Sản xuất enzyme phá hủy phân tử thuốc
● Thay đổi khả năng thấm của màng TB với thuốc
● Thay đổi cấu trúc điểm gắn thuốc
● Thay đổi đường biến dưỡng làm mất tác dụng của thuốc
● Thay đổi phân tử đích 4. Sử dụng
− Phải đúng, đủ liều, không bỏ liều − Dùng dự phòng
− Phối hợp 2 kháng sinh diệt/kìm khuẩn khác cơ chế, không phối hợp 2 loại với nhau Bài 2. Họ beta-lactam 1. Tính chất chung
− Cấu trúc: Nguyên tử N gắn vào β-carbon so với nhóm carbonyl
Đinh Hoàng Giang – K4 Dược h c – SMP ọ − VNU 9
− SAR: Hoạt tính phụ thuộc vào
● Vòng beta-lactam nguyên vẹn
● Nhóm chức có tính acid trên nguyên tử N1 hoặc C2
● Mạch nhánh trên vòng beta-lactam ● Dị vòng ngưng tụ ● C bất đối
− Cơ chế tác dụng: Kháng sinh diệt khuẩn, ngăn chặn sự phát triển và nhân đôi của TB VK
● Ức chế giai đoạn transpeptidation cuối cùng trong quá trình tổng hợp
peptidoglycan của thành TB VK
● Được xúc tác bởi enzyme PBP bám không thuận nghịch với β-lactam
● Làm tích tụ tiền chất peptidoglycan, hoạt hóa thủy phân peptidoglycan − Đề kháng
● Tự nhiên: beta-lactam phải vượt qua thành TB, khó đi qua màng giàu lipid (Gram
(-)), bị chặn lại ở lỗ vận chuyển do nội độc tố
● Enzyme: VK tổng hợp beta-lactamase. Để khắc phục, β-lactam được dùng chung
với chất ức chế β-lactamase (hoạt tính kháng sinh yếu, tác dụng đối vận không
thuận nghịch với β-lactamase) ● Biến đổi PBP 2. Phân loại
− Nhóm penicillin (vòng β-lactam ngưng tụ với vòng 5 cạnh có S): Tính acid, ly trích từ
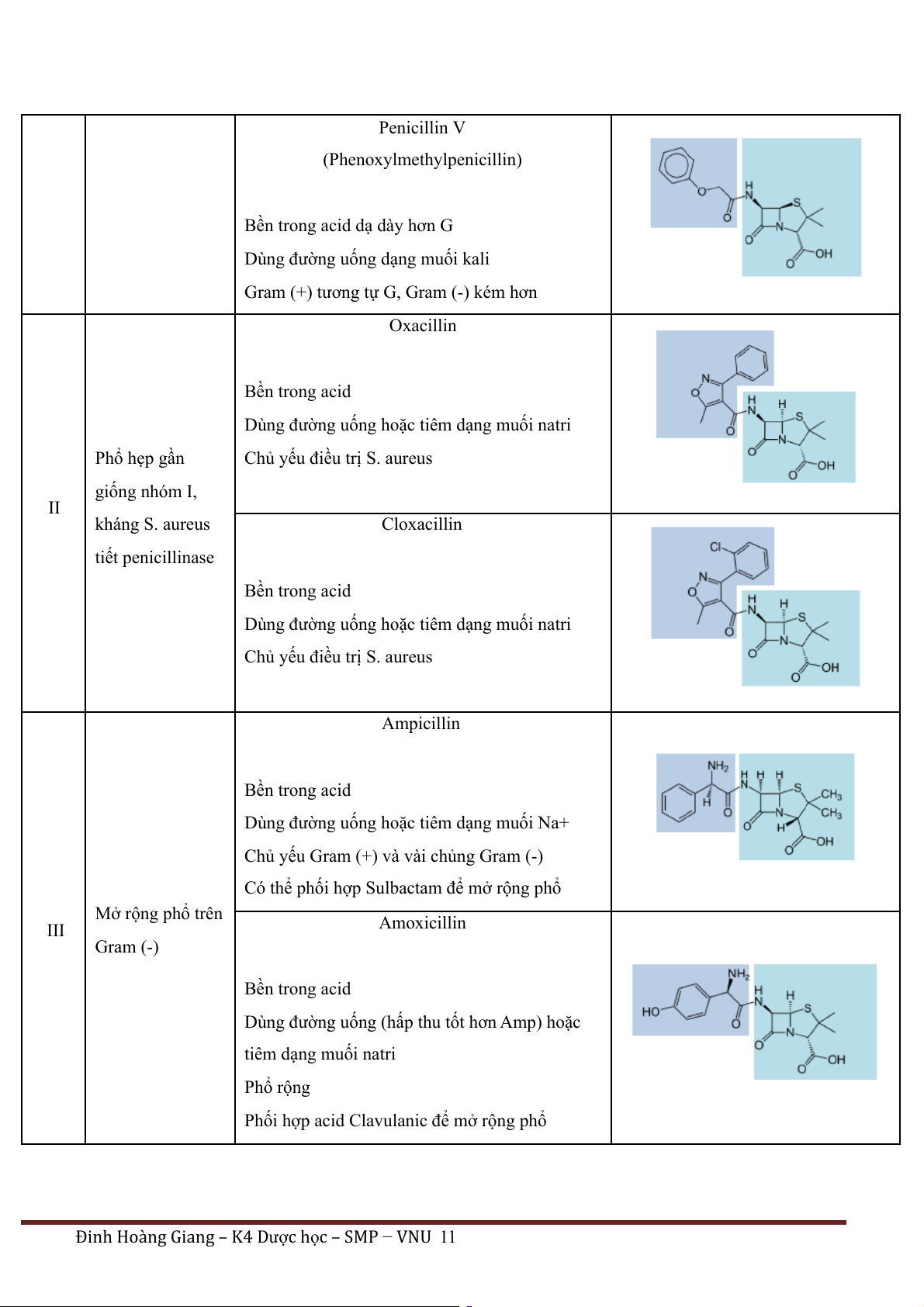
penicillum và bán tổng hợp từ 6-APA Nhóm Phổ kháng khuẩn Chất điển hình Cấu trúc Penicillin G (Benzylpenicillin) Phổ hẹp, chủ yếu I
Không bền trong acid dạ dày trên Gram (+)
Dùng đường tiêm dạng muối kali
Chủ yếu Gram (+), một số Gram (-)
Đinh Hoàng Giang – K4 Dược h c – SMP ọ − VNU 10 Penicillin V (Phenoxylmethylpenicillin)
Bền trong acid dạ dày hơn G
Dùng đường uống dạng muối kali
Gram (+) tương tự G, Gram (-) kém hơn Oxacillin Bền trong acid
Dùng đường uống hoặc tiêm dạng muối natri Phổ hẹp gần
Chủ yếu điều trị S. aureus giống nhóm I, II kháng S. aureus Cloxacillin tiết penicillinase Bền trong acid
Dùng đường uống hoặc tiêm dạng muối natri
Chủ yếu điều trị S. aureus Ampicillin Bền trong acid
Dùng đường uống hoặc tiêm dạng muối Na+
Chủ yếu Gram (+) và vài chủng Gram (-)
Có thể phối hợp Sulbactam để mở rộng phổ Mở rộng phổ trên III Amoxicillin Gram (-) Bền trong acid
Dùng đường uống (hấp thu tốt hơn Amp) hoặc tiêm dạng muối natri Phổ rộng
Phối hợp acid Clavulanic để mở rộng phổ
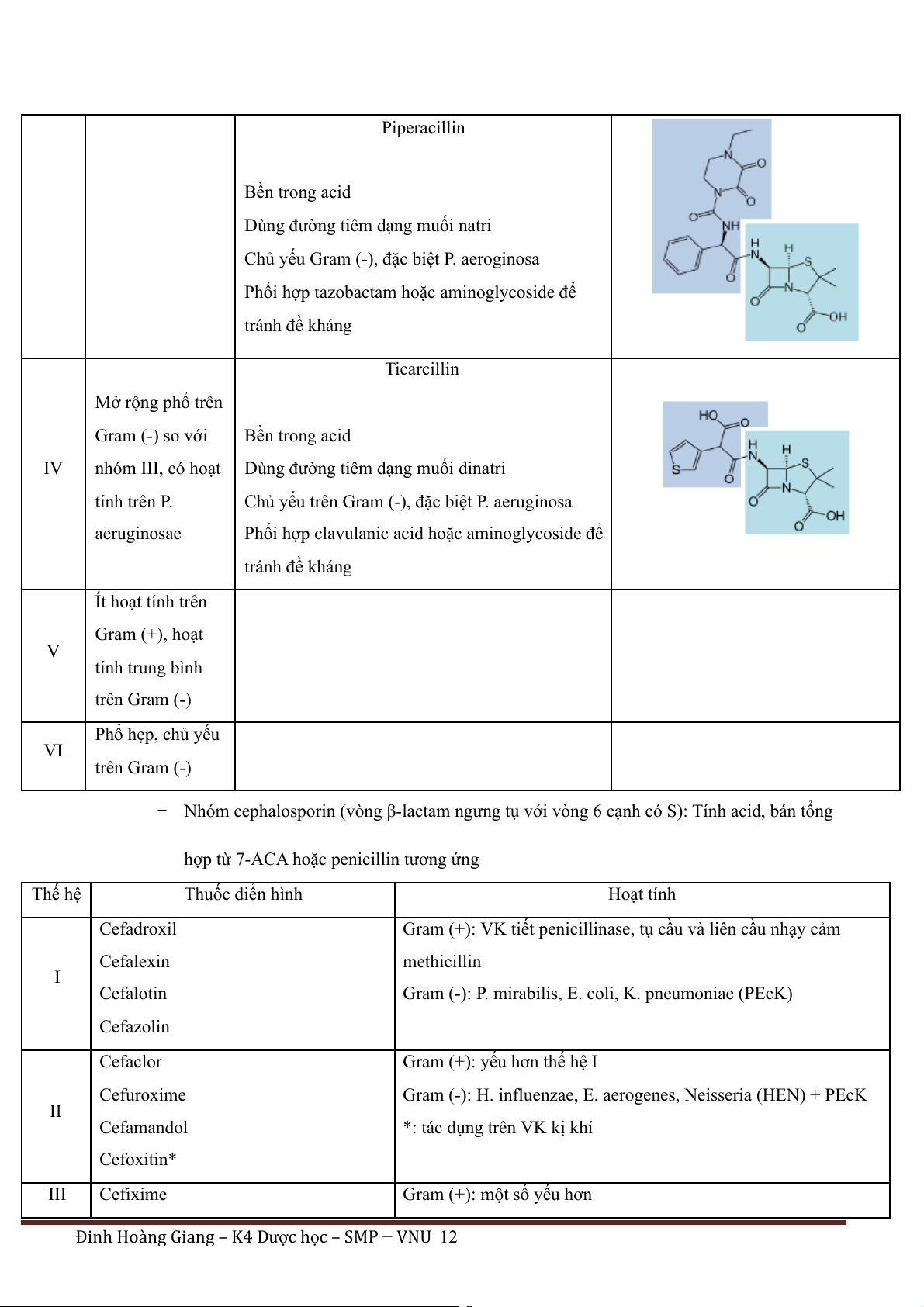
Đinh Hoàng Giang – K4 Dược h c – SMP ọ − VNU 11 Piperacillin Bền trong acid
Dùng đường tiêm dạng muối natri
Chủ yếu Gram (-), đặc biệt P. aeroginosa
Phối hợp tazobactam hoặc aminoglycoside để tránh đề kháng Ticarcillin Mở rộng phổ trên Gram (-) so với Bền trong acid IV nhóm III, có hoạt
Dùng đường tiêm dạng muối dinatri tính trên P.
Chủ yếu trên Gram (-), đặc biệt P. aeruginosa aeruginosae
Phối hợp clavulanic acid hoặc aminoglycoside để tránh đề kháng Ít hoạt tính trên Gram (+), hoạt V tính trung bình trên Gram (-) Phổ hẹp, chủ yếu VI trên Gram (-)
− Nhóm cephalosporin (vòng β-lactam ngưng tụ với vòng 6 cạnh có S): Tính acid, bán tổng
hợp từ 7-ACA hoặc penicillin tương ứng Thế hệ Thuốc điển hình Hoạt tính Cefadroxil
Gram (+): VK tiết penicillinase, tụ cầu và liên cầu nhạy cảm Cefalexin methicillin I Cefalotin
Gram (-): P. mirabilis, E. coli, K. pneumoniae (PEcK) Cefazolin Cefaclor
Gram (+): yếu hơn thế hệ I Cefuroxime
Gram (-): H. influenzae, E. aerogenes, Neisseria (HEN) + PEcK II Cefamandol
*: tác dụng trên VK kị khí Cefoxitin* III Cefixime
Gram (+): một số yếu hơn
Đinh Hoàng Giang – K4 Dược h c – SMP ọ − VNU 12 Cefotaxime Gram (-): tăng tác dụng Ceftriaxone *: kháng Pseudomonas Cefoperazone* Ceftazidime* Cefepime
Gram (+): mở rộng phổ, tương đương thế hệ I IV Cefquinome
Gram (-): kháng beta-lactamase hơn thế hệ III, có thể qua hàng rào máu dịch não-tủy
Ceftobiprole: kháng Pseudomonas V Ceftaroline
− Nhóm carbapenem (vòng β-lactam ngưng tụ với vòng 5 cạnh không có S): Phổ rộng, hiệu
lực cao trên cả 2 nhóm VK Gram, kháng hầu hết β-lactamase
Không bền hóa học, thu được bằng cách lên Bền hơn Thienamycin, phổ cực rộng trên
men Streptomyces, từ đó phát triển các
VK hiếu khí, kỵ khí, Gram (+) và (-), đặc carbapenem khác
biệt kháng Pseudomonas aeruginosa và Enterococcus species
− Nhóm monobactam (vòng β-lactam không ngưng tụ): Chỉ tác dụng trên VK Gram (-); chỉ
có aztreonam được thương mại hóa Bài 3. Họ aminosid 1. Tính chất chung
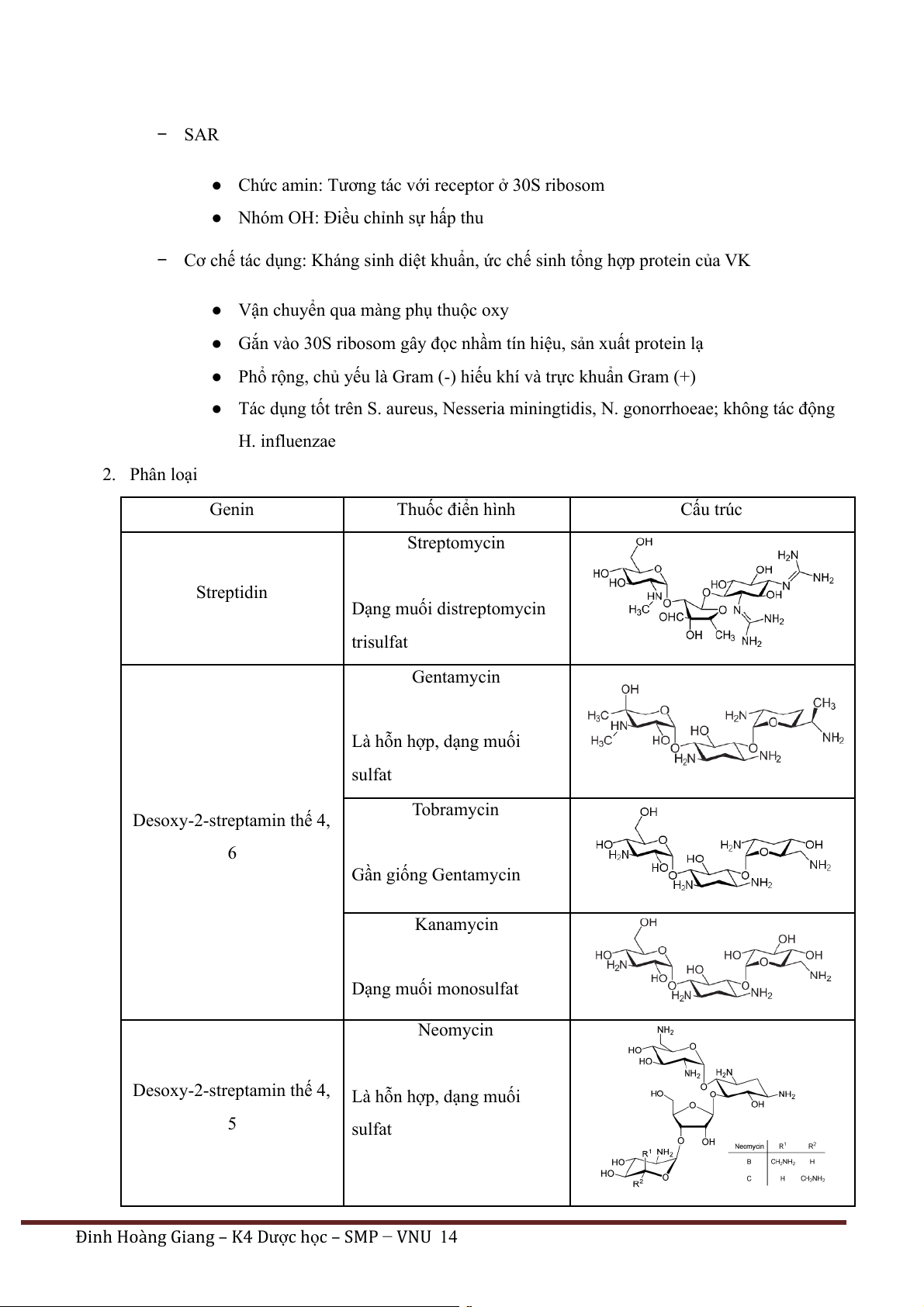
− Cấu trúc: Heterosid = Genin + Ose
● Genin: aminocyclitol (cycloalkan có ít nhất 3 nhóm OH gắn vòng + nhóm amino)
● Ose: đường có ít nhất 1 ose amin (glucosamin, ribose, streptose…)
● Tính base rất phân cực (khó thấm màng, bài tiết nhanh), kháng penicillinase
● Nguồn gốc thiên nhiên (streptomyces và micromonospora) và bán tổng hợp
Đinh Hoàng Giang – K4 Dược h c – SMP ọ − VNU 13 − SAR
● Chức amin: Tương tác với receptor ở 30S ribosom
● Nhóm OH: Điều chỉnh sự hấp thu
− Cơ chế tác dụng: Kháng sinh diệt khuẩn, ức chế sinh tổng hợp protein của VK
● Vận chuyển qua màng phụ thuộc oxy
● Gắn vào 30S ribosom gây đọc nhầm tín hiệu, sản xuất protein lạ
● Phổ rộng, chủ yếu là Gram (-) hiếu khí và trực khuẩn Gram (+)
● Tác dụng tốt trên S. aureus, Nesseria miningtidis, N. gonorrhoeae; không tác động H. influenzae 2. Phân loại Genin Thuốc điển hình Cấu trúc Streptomycin Streptidin Dạng muối distreptomycin trisulfat Gentamycin Là hỗn hợp, dạng muối sulfat Tobramycin Desoxy-2-streptamin thế 4, 6 Gần giống Gentamycin Kanamycin Dạng muối monosulfat Neomycin Desoxy-2-streptamin thế 4, Là hỗn hợp, dạng muối 5 sulfat
Đinh Hoàng Giang – K4 Dược h c – SMP ọ − VNU 14 Spectinomycin Streptamin Dạng muối hydroclorid
Bài 4. Họ macrolid và kháng sinh tương đồng 1. Tính chất chung
− Cấu trúc: Heterosid = Aglycon + Ose
● Aglycon: lacton 14-16 nguyên tử, gắn OH
● Ose: 2-3 phân tử đường, ít nhất 1 ose amin ● Tính base thân dầu
● Nguồn gốc thiên nhiên (streptomyces) và bán tổng hợp − SAR
● Tính thân dầu: Tăng hoạt lực
● Gắn kết ribosom: Nhóm thế 10, ester, các gốc đường, nhóm amino của đường
● Mở vòng lacton: Bất hoạt
− Cơ chế tác dụng: Kháng sinh kìm khuẩn ở liều trị liệu, diệt khuẩn ở liều cao, ức chế tổng hợp protein ở VK
● Thấm qua màng Gram (+) cao hơn Gram (-)
● Gắn vào receptor 50S ribosom (trừ động vật có vú), ngăn cản giải mã di truyền
● Phổ khá hẹp, chủ yếu trên cầu khuẩn, trực khuẩn Gram (+), một số cầu khuẩn, trực
khuẩn Gram (-), VK yếm khí − Đề kháng
● Tự nhiên: Trực khuẩn Gram (-) ngăn thuốc thấm qua porin
● Thu nhận (qua plasmid): Cầu khuẩn Gram (+) giảm tính thấm qua thành hoặc thay
đổi thụ thể; VK đường ruột tiết enzyme thủy phân thuốc
● Chéo: Giữa các kháng sinh cùng nhóm, nhất là macrolid cổ điển 2. Phân loại Vòng Thuốc điển hình Cấu trúc lacton
Đinh Hoàng Giang – K4 Dược h c – SMP ọ − VNU 15 Erythromycin Là hỗn hợp
Dạng base, muối, ester, muối ester
Độc tính thấp, có thể dùng cho phụ nữ mang thai (trừ dạng estolat) Roxithromycin
Bền hơn erythromycin trong acid, mạnh hơn trên một số mầm Gram (-) 14 Clarithromycin
Bền hơn erythromycin trong acid, mạnh hơn trên
tụ cầu, liên cầu và chủng đề kháng
Chất chuyển hóa qua gan có hoạt tính mạnh gấp đôi
Chỉ định loét dạ dày do H. pylori Dirithromycin Flurithromycin Azithromycin 15
Bền hơn erythromycin trong acid, phổ mở rộng sang Gram (-) Spiramycin Là hỗn hợp 16
Độc tính thấp, chỉ định nhiễm toxoplasma ở phụ nữ mang thai 3. Họ streptogramin
Đinh Hoàng Giang – K4 Dược h c – SMP ọ − VNU 16 − Cấu trúc
− Phổ kháng khuẩn tương tự macrolid, ít đề kháng, đồng vận với aminosid, rifampicin Bài 5. Họ cyclin 1. Tính chất chung
− Cấu trúc: Octahydronaphtacen
● Tính base; tính acid nhẹ
● Nguồn gốc thiên nhiên (streptomyces) và bán tổng hợp − SAR ● Thân dầu
● Nhóm alkyl cồng kềnh, dễ tạo phức với cation đa hóa trị giảm hấp thu qua màng ruột
− Cơ chế tác dụng: Kháng sinh kìm khuẩn (trừ minocyclin), ức chế tổng hợp protein
● Dạng muối HCl hấp thu nhanh qua tiêu hóa
Đinh Hoàng Giang – K4 Dược h c – SMP ọ − VNU 17
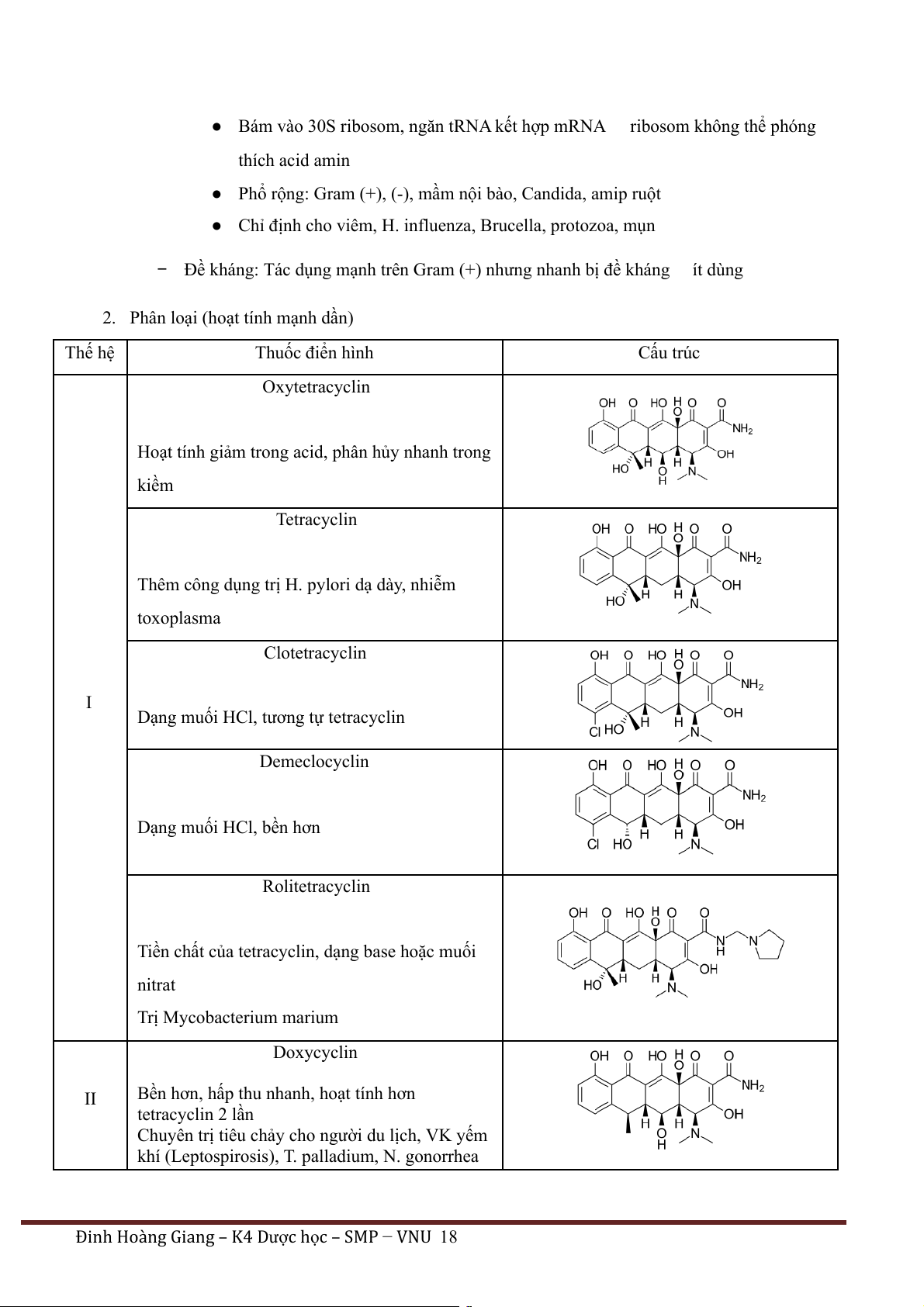
● Bám vào 30S ribosom, ngăn tRNA kết hợp mRNA ribosom không thể phóng thích acid amin
● Phổ rộng: Gram (+), (-), mầm nội bào, Candida, amip ruột
● Chỉ định cho viêm, H. influenza, Brucella, protozoa, mụn
− Đề kháng: Tác dụng mạnh trên Gram (+) nhưng nhanh bị đề kháng ít dùng
2. Phân loại (hoạt tính mạnh dần) Thế hệ Thuốc điển hình Cấu trúc Oxytetracyclin
Hoạt tính giảm trong acid, phân hủy nhanh trong kiềm Tetracyclin
Thêm công dụng trị H. pylori dạ dày, nhiễm toxoplasma Clotetracyclin I
Dạng muối HCl, tương tự tetracyclin Demeclocyclin Dạng muối HCl, bền hơn Rolitetracyclin
Tiền chất của tetracyclin, dạng base hoặc muối nitrat Trị Mycobacterium marium Doxycyclin II
Bền hơn, hấp thu nhanh, hoạt tính hơn tetracyclin 2 lần
Chuyên trị tiêu chảy cho người du lịch, VK yếm
khí (Leptospirosis), T. palladium, N. gonorrhea
Đinh Hoàng Giang – K4 Dược h c – SMP ọ − VNU 18 Minocyclin
Bền hơn, hấp thu tốt, dạng muối HCl, hoạt tính hơn 2-4 lần
Đặc biệt trị Streptococcus viridans, M. marium Bài 6. Họ lincosamid 1. Tính chất chung
− Cấu trúc: Amid = Acid hygric + Ose amin chứa S
− Cơ chế tác dụng: Kháng sinh kìm khuẩn, ức chế giai đoạn đầu tổng hợp protein
● Phân phối tốt vào các mô, không vào dịch não tủy
● Tác động lên 50S ribosom (giống macrolid) làm peptidyl-tRNA phân ly sớm khỏi ribosom
● Hoạt tính trên trực khuẩn Gram (-), cầu khuẩn Gram (+), một số VK yếm khí, KST sốt rét 2. Phân loại Lincomycin (7R) –CHOHCH3 Clindamycin (7S) –CHClCH3 Clindamycin phosphat -O-PO3H2 Clindamycin palmitat -OCO(CH2)14CH3 Bài 7. Họ phenicol 1. Tính chất chung − SAR
● Cần sự toàn vẹn cấu trúc
Đinh Hoàng Giang – K4 Dược h c – SMP ọ − VNU 19
● Nhóm thế âm điện ở p- làm tăng hoạt tính
− Cơ chế tác dụng: Kháng sinh kìm khuẩn, ức chế sinh tổng hợp protein ở VK
● Gắn vào 50S ribosom, ngăn tRNA giải mã
● Phổ rộng: một số Gram (+), Gram (-), VK kị khí − Đề kháng: Rất nhanh
● Trung gian plasmid: VK tiết acetyl transferase làm acetyl hóa thuốc không kết hợp được với ribosom
● Chéo: Giữa cloramphenicol và thiamphenicol 2. Phân loại
Nguồn gốc tự nhiên (streptomyces), nay tổng
Hoạt tính yếu hơn, khó thâm qua màng VK hơn
hợp hoàn toàn; dạng alcohol I hoặc ester
Độc tính trên tiêu hóa, máu; gây hội chứng
Ít độc hơn do không có nhóm nitro
xám, tai biến loại Herxheimer
Chỉ định dùng khi hết sức cần thiết; nhiễm
Chỉ định nhiễm trùng tiêu hóa, hô hấp, gan mật
trùng nặng mà các kháng sinh an toàn hơn
do mầm đề kháng kháng sinh khác không hiệu quả
Bài 8. Họ phosphonic: Fosfomycin 1. Tính chất chung
Đinh Hoàng Giang – K4 Dược h c – SMP ọ − VNU 20