















Preview text:
lOMoAR cPSD| 45148588
500 CÂU TRẮC NGHIỆM HÓA VÔ CƠ – Y DƯỢC Câu 1:
Nguyên tố (A) có electron cuối cùng xác định bởi 4 số lượng tử: n = 3 , l = 2 , m = -2 ,
ms = - ½. Vậy nguyên tố A là:
Cho ZCu= 29 ; ZZn= 30 ; ZFe= 26 ; ZAg= 47 . A. Cu B. Zn C. Ag D. Fe
Câu 2: Xét các nguyên tố thuộc phân nhóm chính, trong bảng hệ thống tuần hoàn, tính chất
kim loại và tính khử của chúng biến đổi như sau: (chọn câu đúng)
A. Trong một phân nhóm chính đi từ trên xuống dưới, tính kim loại tăng dần.
B. Trong một phân nhóm chính đi từ trên xuống dưới, tính kim loại giảm dần.
C. Trong một chu kỳ đi từ trái sang phải tính kim loại tăng dần.
D. Trong một chu kỳ đi từ trái sang phải tính khử tăng dần. Câu 3:
CH2=CH-COOH có pKa= 4,26. Vậy pH của 100ml dung dịch CH2=CH-COOH 0,12M là: A. 2,32 B. 2,59 C. 3,24 D. 2,56 Câu 4:
Nguyên tố (B) có electron cuối cùng xác định bởi 4 số lượng tử: n = 4 , l =1 , m = 0 ,
ms = - ½. Vậy Vậy nguyên tố B là: Cho ZCl= 17 ; ZBr= 35 ; ZO= 8 ; ZS= 16 . A. Cl B. Br C. Oxi D. S
Câu 5: Cấu hình electron của S (Z = 16).1s2 2s2 2p6 3s2 3p4. Cho biết
hàm sóng xác định electron cuối cùng đặc trưng cho nguyên tử S là; A. B. C. D.
Câu 6: Cấu hình electron của Mg (Z = 12).1s2 2s2 2p6 3s2. Cho biết
hàm sóng xác định electron cuối cùng đặc trưng cho nguyên tử Mg là; A. B. C. D. Câu 7:
Cho biết cấu hình electron của nguyên tố Ca (Z = 20).
A. 1s2 2s2 2p6 3s2 3p6 4s2
B. 1s2 2s2 2p6 3s2 3p6 3d2
C. 1s2 2s2 2p6 3s2 3p6 3d1 4s1
D. 1s2 2s2 2p6 3s2 3p4 3d4 Câu 8:
Cho biết cấu hình electron của nguyên tố Fe (Z = 26).
A. 1s2 2s2 2p6 3s2 3p6 4s2 3d6
B. 1s2 2s2 2p6 3s2 3p6 3d6 4s2 lOMoAR cPSD| 45148588
C. 1s2 2s2 2p6 3s2 3p6 3d1 4s1
D. 1s2 2s2 2p6 3s2 3p4 3d4 Câu 9:
Cho biết cấu hình electron của ion Fe2+ (Z = 26).
A. 1s2 2s2 2p6 3s2 3p6 4s2 3d4
B. 1s2 2s2 2p6 3s2 3p6 3d6
C. 1s2 2s2 2p6 3s2 3p6 3d4 4s2
D. 1s2 2s2 2p6 3s2 3p4 3d8
Câu 10: Cấu hình electron của Cl (Z = 17).1s2 2s2 2p6 3s2 3p5. Cho biết vị trí (chu kỳ và phân
nhóm) trong bảng hệ thống tuần hoàn.
A. Chu kỳ 3, phân nhóm VA.
B. Chu kỳ 3, phân nhóm IIA.
C. Chu kỳ 3, phân nhóm VIIA.
D. Chu kỳ 2, phân nhóm VIIA.
Câu 11: Cấu hình electron của Cr (Z = 24).1s2 2s2 2p6 3s2 3p63d5 4s1. Cho biết vị trí (chu kỳ và
phân nhóm) trong bảng hệ thống tuần hoàn.
A. Chu kỳ 4, phân nhóm IA.
B. Chu kỳ 4, phân nhóm VA.
C. Chu kỳ 4, phân nhóm VIB.
D. Chu kỳ 4, phân nhóm IVA.
Câu 12: Hãy cho biết trong phân tử CH4 có bao nhiêu liên
kết hóa học được hình thành: A. 4 Liên kết B. 4 Liên kết C. 4 Liên kết D. 4 Liên kết
Câu 13: Hãy cho biết trong phân tử CH3-CH3 có bao nhiêu liên kết hóa học được hình thành: A. 1 Liên kết và 6
liên kết B. 1 Liên kết và 6 liên kết C. 1 Liên kết và 6
liên kết D. Cả 3 câu trên đề sai. Câu 14:
NH3 có pKb = 4,74. Vậy pH của dung dịch NH3 0,12M là: A. 11,24 B. 11,71 C. 11,17 D. 8,29
Câu 15: Hoà tan 4,6 gam một chất (A) không điện ly (MA= 92) vào 100 gam nước tạo thành dung
dịch (X). Tính nhiệt độ sôi của dung dịch (X). Biết hằng số nghiệm sôi của nước là 0,52. A. 100,5oC B. 100,26oC C. 100,6oC D. 101,26oC
Câu 16: Xét phản ứng (A) là phản ứng đơn giản có hệ số nhiệt độ = 2. Vậy khi nhiệt độ tăng
lên 40oC thì tốc độ phản ứng thay đổi: A. tăng lên 8 lần.
B. tăng lên 16 lần.
C. Giảm xuống 8 lần. D. Giảm xuống 8 lần. Câu 17:
Xét phân tử NH3. Hãy cho biết trạng thái lai hoá của N trong phân tử NH3. A. sp. B. sp2. C. sp3. D. sp3d2.
Câu 18: Xét phản ứng: Cho phản ứng : CaCO 3( r ) CaO(r) + CO2(k)
Cho biết: Biến thiên thiên entalpi của phản ứng: = 42,5 Kcal/mol.
Biến thiên thiên entropi của phản ứng: = 38,4 Cal/moloK.
Hãy xác định nhiệt đô tại đó bắt đầu xảy ra phản ứng:
A. 500oC B. 1000,4oC C. 1106,77oK D. 1106,77oC 2 lOMoAR cPSD| 45148588
Câu 19: Xét phản ứng: (NH2)2CO (dd) + H2O (l) CO2 (dd) + 2 NH3 (dd) Biết:
kcal/mol: -76,3 -68,3 -98,7 -19,3 Hiệu ứng
nhiệt của phản ứng ở điều kiện chuẩn là:
A. – 7,3Kcal/mol B. 7,3 Kcal/mol C. 7,3 Kcal. D. 37 Kcal/mol Câu 20:
Hãy cho biết thứ nguyên (đơn vị) của hằng số tốc độ của phản ứng một chiều bậc một: A. (thời gian)-1
B. mol. lít-1.(thời gian)-1
C. lít2.mol-2.(thời gian)-1
D. lit.mol-1(thời gian)-1 Câu 21:
Hãy cho biết thứ nguyên (đơn vị) của hằng số tốc độ của phản ứng một chiều bậc hai: A. (thời gian)-1
B. mol. lít-1.(thời gian)-1
C. lít2.mol-2.(thời gian)-1 lit.mol-1(thời gian)- 1 D.
Câu 22: Khối lượng mol của phân tử hemoglobin là 70000g/mol. Nếu hòa tan 40 gam hemoglobin
vào nước thành 1 lít dung dịch ở 4oC thì áp suất thẩm thấu của dung dịch tạo thành là: Cho R= 0,082 at.lít/oK.
A. 0,026 at B. 0,013 at C. 0,15 at D. 0,2 at Câu 23:
Phương trình động học xác định hằng số tốc độ của một phản ứng một chiều
là: ln[A] = -kt + ln[Ao] hoặc ln (a-x) = -kt + ln a Hoặc hoặc Với [A]o= a
là n ng đô chất A ở thời đi ऀ m ban đầu.̣
[A] = a –x là n ng đô chất A ở thời đi ऀ m t đang xét.̣
Hãy cho biết bâc của phản ứng một chiều ở trên là:̣ A. Bâc 1̣ B. Bâc 2 ̣ C. Bâc 3 ̣ D. Bâc 0̣ Câu 24:
C6H5NH2 có pKb = 9,42. Vậy pH của 100ml dung dịch C6H5NH2 0,01M là: A. 8,00 B. 5,71 C. 9 D. 8,29
Câu 25: Môt phản ứng có hằng số nhiệ t độ ̣ =2. H漃ऀ i khi tăng nhiêt độ lên 40̣ o thì tốc độ của
phản ứng đó tăng lên bao nhiêu lần. A. 4 lần B. 8 lần C. 16 lần D. 32 lần Câu 26:
CH3COOH có pKa= 4,74. Vậy pH của dung dịch CH3COOH 0,15M là: A. 2,3 B. 2,78 C. 3,24 D. 5,56 lOMoAR cPSD| 45148588
Câu 27: Phải lấy bao nhiêu gam glucozơ hòa tan trong 100 gam nước đ ऀ hạ nhiêt độ đông ̣ đăc
của dung dịch thu được xuống 0,93̣ oC. Biết kđ của nước bằng 1,86. A. 12 gam
B. 14 gam C. 9 gam D. 18 gam
Câu 28: Hoà tan 4,6 gam một chất (A) không điện ly (MA= 92) vào 100 gam nước tạo thành dung
dịch (X). Tính nhiệt độ sôi của dung dịch (X). Biết hằng số nghiệm sôi của nước là 0,52. A. 100,5oC B. 100,26oC C. 100,6oC D. 101,26oC Câu 29:
Tích số tan của CaCO3 ở 25oC 4,8.10-9. Vậy độ tan của CaCO3 ở 25oC là:
A. 6,892.10-5mol/lít. B. 6,289.10-5 mol/lít.
C. 6,928.10-5 mol/lít.
D. 8,926.10-5 mol/lít. Câu 30:
NH3 có pKb = 4,74. Vậy pH của dung dịch g m NH3 0,12M và NH4Cl 0,1M
là: A. 8,253 B. 9,34 C. 9,29 D.10,26 Câu31
Nguyên tử hydro ở trạng thái kích thích có bán kính nguyên tử bằng 2,12 Å. H漃ऀ i diện tử của
nguyên tử Hydro bị kích thích đang chuy ऀ n động trên quĩ đạo nào. A. K B. L C. M D. N Câu 32
Ở trạng thái cơ bản của nguyên tử hydro người ta tính được vận tốc của electron vào khoảng 108
cm/s. Trong một giây electron chuy ऀ n động được bao nhiêu vòng xung quanh nhân.
A. 3,002916432x1015 vòng B. 3,002916432x1012 vòng
C. 3,002916432x1010 vòng D. 3,002916432 vòng Câu 33
Khi giải phương trình sóng Schrodinger người ta thu được các hàm sóng Ψ . Mỗi hàm sóng Ψ
thu được như vậy ứng với mấy vân đạo nguyên tử ?
A/ một B/ ba C/ năm D/ bảy. Câu 34
Đối với các nguyên tố thuộc phân nhóm chính, trong bảng hệ thống tuần hoàn, tính chất của chúng biến đổi:
A. Từ trên xuống dưới trong một phân nhóm, tính kim loại tăng dần.
B. Từ trên xuống dưới trong một phân nhóm tính kim loại giảm dần.
C. Từ trái sang phải tính kim loại tăng dần.
D. Từ trái sang phải tính khử tăng dần. Câu 35
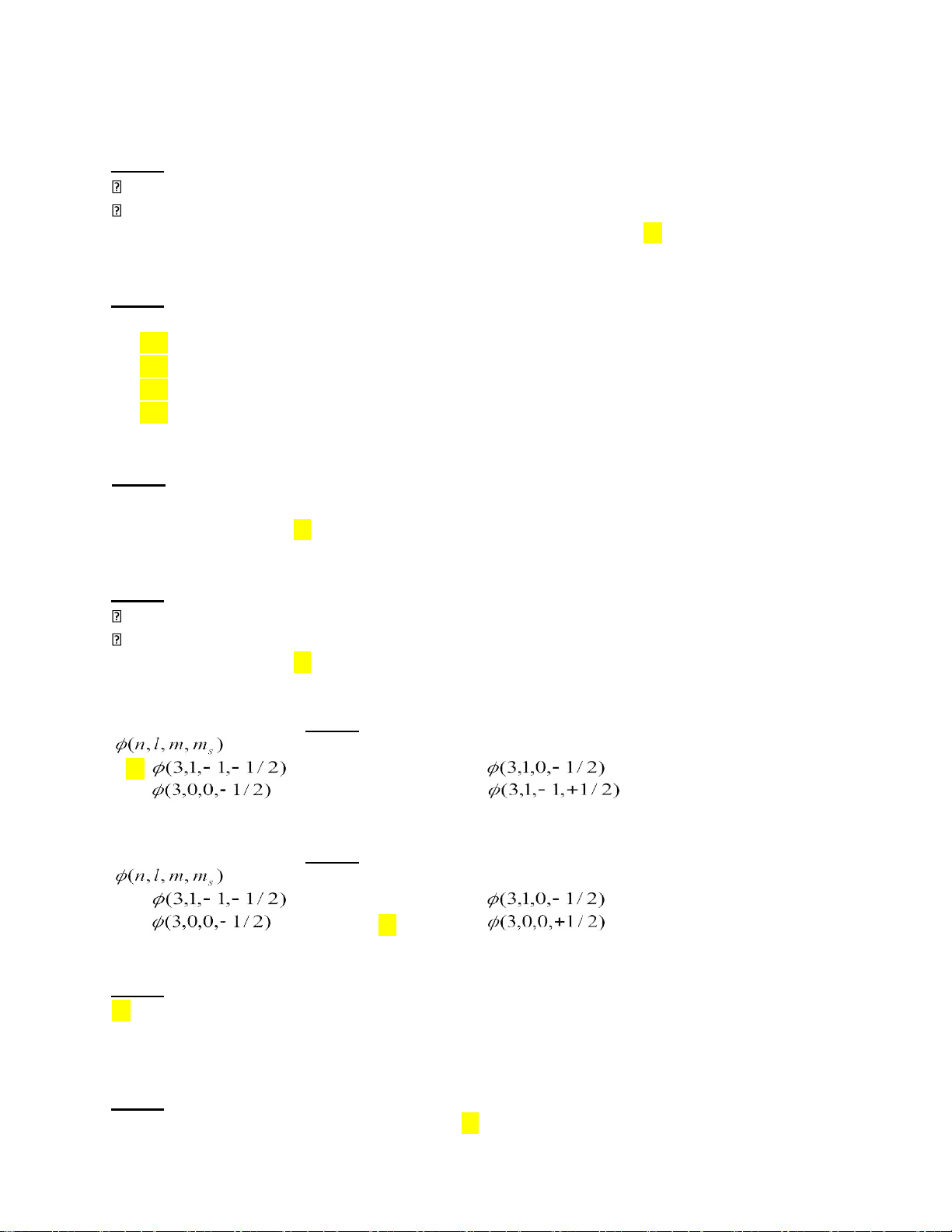
Có một bộ bốn số lượng tử thích hợp cho nguyên tử A như sau:
A . n=3 ,l= 0,m=1 , ms = + 1/2 B. n=3 ,l= 0,m= 0 , ms = + 1/2
C. n=3,l= 3 , m=1 , ms =+1/2 D. n=3,l= 0, m=2 , ms = + 1/2 Câu 36
Khi tạo thành phân tử NH3 nguyên tử N có kiều lai hóa: 4 lOMoAR cPSD| 45148588
A . sp B. sp2 C . sp3 D. sp3d2 Câu 37
Khi tạo thành phân tử HNO3 nguyên tử N có kiều lai hóa:
A . sp B. sp2 C . sp3 D. sp3d2 Câu 38
Cấu tạo và điện tích của ion cyanua có th ऀ mô tả như sau: (+) (-) (-) (+) (-) (-)
A. C≡N A. C≡N B. C≡N D. C≡N Câu 39 Cho phản ứng : CaCO3(r) CaO(r) + CO2(k) Cho biết: CaCO3(r) CaO(r) CO2(k) -288,5 -151,9 -94,1 Nhiệt tạo thành ( ) Kcal/mol 22,2 9,5 51,1 Entropi ( ) Cal/moloK
Nhiệt độ cần thiết đ ऀ phản ứng này bắt đầu xảy ra là:
A. 5000C B. 1000,40C C. 836,40C D. 1109,40C Câu 40 Cho phản ứng:
2CO (k) + 4H2 (k) H2O(l) + C2H5OH(l) Cho biết: H2 CO C2H5OH H2O -26,4 -66,4 -68,3 Nhiệt tạo thành ( ) Kcal/mol 31,2 9,5 38,4 16,7 Entropi ( ) Cal/moloK
Nhiệt độ cần thiết đ ऀ phản ứng này bắt đầu xảy ra là:
A. 100oC B. 923,34 oC C. 650,34 oC D. 450,34 oC Câu 41 Cho phản ứng:
(NH2)2CO (dd) + H2O (l) CO2 (dd) + 2NH3 (dd) Biết:
kcal/mol: -76,3 -68,3 -98,7 -19,3
Hiệu ứng nhiệt của phản ứng ở điều kiện chuẩn là:
A. – 7,3Kcal/mol B. 7,3 Kcal/mol C. 73 Kcal/mol D. 37 Kcal/mol Câu 42
Hằng số tốc độ của phản ứng bậc hai có đơn vị:
A. (thời gian)-1 B. mol. lít-1.(thời gian)-1 ; C. lít2.mol-2.(thời gian)-1; D. lit.mol-1(thời gian)-1 Câu 43 lOMoAR cPSD| 45148588
Cho Fe =56 , O=16 . Đương lượng gam của Fe2O3 là:
A. 160/3 gam B. 80/3 gam C. 40/3 gam D. 60/3 gam Câu 44
Trong một phản ứng: Fe2+ Fe3+
Cho biết Fe= 56 , O= 16. Đương lượng gam của FeO là:
A. 72 gam B. 36 gam C. 24 gam D. 12 gam Câu 45
Khối lượng mol của phân tử hemoglobin là 70000g/mol. Nếu hòa tan 40 gam hemoglobin vào
nước thành 1 lít dung dịch ở 4oC thì áp suất thẩm thấu của dung dịch tạo thành là: A. 0,026 at
B. 0,013 at C. 0,15 at D. 0,2 at Câu 46
Cho ZC = 6 ; ZO= 8. Đô bộ i liên kết giữa hai nguyên tử C và O trong phân tử CO là:̣ A. 1 ; B. 2 C. 3 D. 4 Câu 47
Cho các chất: CO2 ; H2O ; CCl4 ; SO2 . Các chất có phân tử phân cực: A. CO2 ; H2O B. CO2 ; CCl4 C. H2O ; CCl4 D. H2O ; SO2 Câu 48
Cho EC=C = 142,5 Kcal/mol ; EC-C = 78,0 Kcal/mol ; EC-H = 99,0 Kcal/mol EH-H= 104,2 Kcal/mol
Phản ứng CH2=CH2 + H2 CH3-CH3 có hiêu ứng nhiệ t:̣
A. 293 Kcal B. -293 Kcal C. 2,93 Kcal D. -2,93 kcal Câu 49
Có môt chất A tham gia phản ứng, phương trình độ ng học được mô tả:̣ ln[A] = -kt + ln[A0]
Với [A]: là n ng đô chất A ở thời đi ऀ m t và [Ạ0] là n ng đô chất A ban đầu.̣
Bâc của phản ứng mà A tham gia là:̣ A. Bâc 1̣ B. Bâc 2 C. Bậ c 3 D. Bậ c 0̣ Câu 50
Có môt chất A tham gia phản ứng, phương trình độ ng học được mô tả:̣ [A] = -kt + [A0]
Với [A]: là n ng đô chất A ở thời đi ऀ m t và [Ạ 0] là n ng đô chất A ban
đầu.̣ Bâc của phản ứng mà A tham gia là:̣ A. Bâc 1 B. Bậ c 2 C. Bậ c 3 ̣ D. Bâc 0̣ Câu 51
Có môt chất A tham gia phản ứng, phương trình độ ng học được mô tả:̣ 6 lOMoAR cPSD| 45148588
Với [A]: là n ng đô chất A ở thời đi ऀ m t và [Ạ 0] là n ng đô chất A ban
đầu.̣ Bâc của phản ứng mà A tham gia là:̣ A. Bâc 1 ̣ B. Bâc 2̣ C. Bâc 3 D. Bậ c 0̣ Câu 52
Có môt chất A tham gia phản ứng, phương trình động học được mô tả:̣
Với [A]: là n ng đô chất A ở thời đi ऀ m t và [Ạ 0] là n ng đô chất A ban đầu.̣
Bâc của phản ứng mà A tham gia là:̣
A. Bâc 1 B. Bậc 2 ̣ C. Bâc 3̣ D. Bâc 0̣ Câu 53
Hằng số tốc độ của phản ứng bậc môt có đơn vị:̣
A. (thời gian)-1 B. mol. lít-1 (thời gian)-1 ; C. lít2.mol-2.(thời gian)-1; D. lit.mol-1(thời gian)-1 Câu 54
Hằng số tốc độ của phản ứng bậc ba có đơn vị:
A. (thời gian)-1 B. mol. lít-1 .(thời gian)-1 ; C. lít2.mol-2.(thời gian)-1; D. lit.mol-1(thời gian)-1 Câu 55
Hằng số tốc độ của phản ứng bậc không có đơn vị:
A. (thời gian)-1 B. mol. lít-1 (thời gian)-1 ; C. lít2.mol-2.(thời gian)-1; D. lit.mol-1(thời gian)-1 Câu 56
Môt phản ứng có hằng số nhiệ t độ
̣ =3. H漃ऀ i khi tăng nhiêt độ lên 40̣ o thì tốc đô của
phản ứng đó ̣ tăng lên bao nhiêu lần.
A. 3 lần B. 12 lần C. 18 lần D. 81 lần
Câu 57 Ở 410oC hằng số cân bằng của phản ứng: H2 + I2 ⇄ 2HI KC = 48
H漃ऀ i khi trôn 1 mol Ḥ 2 với 1 mol I2 trong môt bình có dung tích 1 lít thì n ng độ của Ḥ 2 tại
thời đi ऀ m cân bằng là bao nhiêu?
A. 0,776 mol/lít B. 0,224 mol/lít C. 0,5 mol/lít D. 1,552 mol/lit Câu 58
Môt phản ứng có hệ số nhiệ t bằng 2. Ở 0̣ 0C phản ứng kết thúc sau 1024 ngày. H漃ऀ i ở 30oC
phản ứng kết thúc sau bao lâu?
A.1000 ngày B. 100 ngày C. 128 ngày 126 ngày Câu 59
Phải lấy bao nhiêu gam glucozơ hòa tan trong 150 gam nước đ ऀ hạ nhiêt độ đông đặ c của
dung ̣ dịch thu được xuống 0,75oC. Biết kđ của nước bằng 1,86
A. 5 gam B. 10 gam C. 15 gam D. 10,89 gam
Câu 60: C6H5NH2 có pKb = 9,42. Trong môt cốc chứa 100ml dung dịch C̣ 6H5NH2 0,01M. pH của dung dịch đó là. lOMoAR cPSD| 45148588 A. 8,00 B. 8,5 C. 9 D. 8,29 Câu 61
Tính n ng độ OH- trong một lít dung dịch NH3 0,1M. Biết hằng số điện ly của NH3 Kb=1,8.10-5. A)) 1,34.10- 3(mol/lít B) 4,24.10-3(mol/lít) C) 1,34.10-2(mol/lít) D) 4,24.10-4(mol/lít) Câu 62
Trong các dung dịch sau đây: Na2CO3 , NaCl , K2SO4 , CH3COONa , C6H5ONa, NH4Cl,
C6H5ONH3Cl, AlCl3. Dung dịch nào có pH>7 A) NaCl , K2SO4 B) NH4Cl , C6H5ONH3Cl, AlCl3 C) K2SO4, CH3COONa, AlCl3 D) Na2CO3 , CH3COONa, C6H5ONa Câu 63
Tính độ tan (mol/lit) ở 25oC của CaSO4 trong nước . Cho biết tich số tan của CaSO4 ở 25oC là 9,1. 10-6. A) 2,12.10-3 (mol/lít) B) 3,6016. 10-3(mol/lít) C) 3,66 . 10-3 (mol/lít) D) 3,0166.10-3(mol/lít)
Câu 1. Sản phẩm chính của phản ứng
R3N + NaNO2 + HCl → a/. R-OH b/. R- NH-N=O c/. [R3NH] +NO2d/. R-NH + 3 Cl-
Câu 2). Nhận xét nào đối với Glycin(NH2-CH2-COOH) là SAI
a/. Glycin tự nhiên có cấu hình D ?
b/. Glycin tự nhiên có cấu hình L
c/. Glycin là acid amin trung tính
d/. Glycin có hai đ ng phân
Câu 3). Danh pháp của hợp chất H-CO-N(CH3)2
a/. Formamid b/. N,N-dimethylformamid
c/. Dimethylformamid d/. N,N- dimethylaminoformamid 8 lOMoAR cPSD| 45148588
Câu 4). Liên kết C=C do sự xen phủ của các orbital
a/. s xen phủ với s b/. s xen phủ với p c/. p
xen phủ với p theo kiểu bên d/. p xen phủ với p theo ki ऀ u trục
Câu 5). Số đ ng phân lập th ऀ của 2,3-
dihydroxybutandioic là a/. 1 b/. 2 c/. 3 D L va meso d/. 4
Câu 6). Ti ऀ u phân nào sau đây là bền nhất a/. CH • • 3 b/. R-CH2 c/. (R)2CH•
d/. (R)3C• voi goc tu do B3>B2>B1
Câu 7). Sản phẩm của phản ứng CH4 + O2 (thiếu) t0 → ? a/. CO2 + H2
b/. CO + H2O c/. C + H2O (t,pt,Cu: HCHO + nuoc ; t,Ni:
cacbonic + hidro) d/. CO + H2
Câu 8). Sản phẩm chính của phản ứng:
CH3-CH=CH2 + HBr/Peroxid → ? a/. CH3-CHBr-CH
3 day la phan ung AE voi HX cong uu tien voi cabarcation ben
hoac giai thich theo hieu ung lien hop b/.
CH3-CH2-CH2Br ? c/. CH3-CHBr-
CH3 và CH3-CH2-CH2Br d/. Tất cả đều đúng
Câu 9). Hai chất được gọi là « đối hình » có quan hệ là a/. Vật và ảnh
qua gương phẳng b/. Vật và ảnh qua gương phẳng không
trùng khích that's right c/. Vật và ảnh qua gương phẳng trùng
khích d/. Là đ ng phân nhưng không phải vật và ảnh
Câu 10). Số loại liên kết trong công thức theo ki ऀ u phối
cảnh a/. 1 b/. 2 c/. 3 it's true d/. 4
Câu 11). Hiệu ứng cộng hưởng(liên hợp) là a/. sự phân cực của nối
bi ऀ u diễn bỡi các công thức cộng hưởng
b/. Sự lan truyền e trong phân tử khi có sự di chuyển của điện tử hoặc p it's true
c/. Hiệu ứng làm cho năng lượng phân tử thấp
d/. Tổ hợp tuyến tính các công thức cộng hưởng
Câu 12). Trường hợp nào KHÔNG phải là siêu liên hợp
a/. R-CH2-CH=CH2, R-CH2-CH=O b/. C6H5-
CH2-R, R-CH2-COOR’ c/. R-CH2-CO-NH2, R- CH + 2-CH2
d/. CH2=CH-CH=CH2, H-CO- N(CH3)2 lOMoAR cPSD| 45148588
Câu 13). Cơ chế phản ứng cộng H2O vào Alken, xúc tác acid là a/. 1/. H+
vào nối , 2/.OH- vào C+ b/. 1/. H+ vào nối , 2/. HOH vào C+ và
Tách H+ trả lại môi trường c/. 1/. HOH vào nối C=C , 2/. H+ vào
Cd/. 1/. H+ vào nối , 2/.OH- vào C•
Câu 14). Sản phẩm chính của phản ứng
CH3-CH=CH2 + Cl2 (1:1) as →? a/. CH3-CHCl-CH2Cl b/. Cl-CH2-CH=CH2 c/. Cl-CH2-CHCl-CH2Cl d/. Cl-CH2-CH2-CH2-Cl
Câu 15). Phản ứng của Toluen và Cl2 (Fe xúc tác) theo cơ chế nào? a/. Thế thân e b/. Thế thân hạch c/. Thế gốc tự do d/. Cộng gốc tự do
Câu 16). Sản phẩm chính của phản ứng CH3CH2COOH + Cl2/P, h → ? a/. CH3CH2COCl b/. CH3CHClCOOH c/. CH2ClCH2COOH d/. CH3CH2CO- O-COCH2CH3
Câu 17). Sắp xếp tính acid của acid monocloro benzoic
a/. para > meta > orto b/. para > orto > meta c/.
Orto > meta > para d/. Meta > orto > para
Câu 18). Hợp chất nào dễ bị mất CO2 nhất
a/. CH3COOH b/. C6H5-COOH c/. CH3COCH2COOH d/. CH3CH2COOH
Câu 19). Sản phẩm cuối cùng của phản ứng
CH3COOC2H5 + CH3MgBr(dư) r i H3O+→
a/. acid acetic b/. dimethylceton c/. 1,1- Dimethylethanol ? d/. Ethylmethylceton
Câu 20). Điều kiện của phản ứng C6H5-CH=CH2 + H2 → C6H11-CH2CH3
a/. H2/Ni b/. H2/Ni, t0 c/. H2/Ni, t0 cao, P cao d/. Tất cả đều đúng
Câu 21). Sản phẩm chính của phản ứng
CH3CH=CHCH3 + H2SO4 đặc/nguội → ?
a/. CH3CH2-CHOH-CH3 b/. CH3CH2-
CH(SO3H)-CH3 c/. CH3CH2-O-CH2CH3 d/. CH3C≡CCH3 10 lOMoAR cPSD| 45148588
Câu 22). Tính chất của Phenol. Nhận định nào là đúng
a/. Dễ phản ứng thế thân điện tử hơn benzene
b/. Khó phản ứng thế thân điện tử hơn
benzene c/. Nhóm OH dễ bị đứt kh漃ऀ i vòng
C6H5d/. Phản ứng ester hóa mạnh hơn alcol
Câu 23). Sản Phẩm chính của phản ứng
C6H5-O-Na + CH3Br → ? a/. C6H5-O-
CH3 b/. C6H5-Br + CH3O-Br c/. C6H5- CH3 d/. CH3-C6H4-OH
Câu 24). Sắp xếp theo khả năng phản ứng vào nối C=O
HCHO(A), CH3COCH3(B), C6H5CHO (C) a/. A
> B > C b/. A > C > B c/. B > A > C d/. C > B > A
Câu 25). Sản phẩm phản ứng: R-MgX + CH3COCH3r i H3O+ → ? a/. alcol bậc 1 b/. acol bậc 2 c/. Alcol bậc 3 d/. Acid carboxylic
Câu 26). Phản ứng chủ yếu của dẫn xuất halogen là
a/. Thế thân e b/. Thế thân hạch c/. Thế gốc
tự do d/. Cộng thân hạch
Câu 27). C2H5OH có KHÔNG khả năng phản ứng với chất nào sau đây a/. PCl5 b/. SOCl2 c/. HCl/ZnCl2 d/. Cl2/as
Câu 28). So sánh khả năng phản ứng ester hóa
CH3OH (A), CH3CH(OH)CH3 (B) và (CH3)2C(OH)CH3(C)
a/. C > B > A b/. B > C > A c/. A > B > C d/. C > A > B
Câu 29). Phản ứng nào điều chế được ceton ?
a/. RCH2OH + CrO3/Pyridin.HCl b/.
RCH2OH + CrO3/H2SO4.aceton c/.
RCHCl2 + NaOH d/. R-C≡CH + H2O/HgSO4.H+
Câu 30). Sản phẩm chính của phản ứng
CH3CH=O + PCl5 → ? a/. CH3COOH
b/. CH3CH2OH c/. CH3CHCl2 d/. CH3CH2Cl lOMoAR cPSD| 45148588
Câu 31). Glucose dạng vòng cho phản ứng tạo liên kết Glycose-phosphat của nhóm OH trên C số nào? a/. C1 b/. C2 c/. C4 d/. C6
Câu 32). Dạng vòng của Fructose còn gọi là hợp chất nào? a/. Semiacetal b/. Semicetal c/. Semiacetal nội d/. Semicetal nội
Câu 33). Sản phẩm chính cuối cùng của phản ứng
2CH3CH=O + 1/.–OH 2/.t◦ → ? a/.
CH3CH(OH)CH2CH=O b/. CH3CH=CHCH=O
c/. CH3COOH d/. CH3CO-O-COCH3
Câu 34). Phân loại amin có tên gọi: 4-amino-1,3-dimethylbenzen
a/. amin bậc 1 b/. amin béo bậc 1 c/. amin thơm bậc 1 d/. monoamin bậc 1
Câu 35). Sắp xếp tính base của ba chất: n-hexylamin(A), pyperidin(B), pyridin(C)
a/. A > B > C b/. B > A > C c/. C > B > A d/. B > C > A
Câu 36). Sản phẩm của phản ứng CH3CH2CONH2 + H3O+ → a/. CH3CH2COOH + NH3 b/. CH + 3CH2COOH + NH4 c/. CH3CH2COO- + NH3 d/. CH + 3CH2COO-NH4
Câu 37). Nhận xét nào đối với Glycin(NH2-CH2-COOH) là SAI
a/. Glycin tự nhiên có cấu hình D ? b/. Glycin tự nhiên có cấu hình L
c/. Glycin là acid amin trung tính
d/. Glycin có hai đ ng phân
Câu 38). Trong nhóm chức –COOH có sự liên hợp gì? a/. - - b/. - - p cô lập ? c/. - - p trống d/. - - gốc tự do
Câu 39). Sắp xếp theo độ linh động của H
CH3CHO(A), OHCCH2CHO(B), CH3CH=CH2(C)
a/. A > B > C b/. A > C > B c/. B > A > C d/. C > B > A 12 lOMoAR cPSD| 45148588
Câu 40). Sản phẩm chính của phản ứng CH3CH=O + H2N-NH-CO-NH2 → ?
a/. CH3CH=N-NH-CO-NH2 b/. H2N-NH-CO-N=CHCH3 c/. CH3CH(OH)HN-NH-CO-NH2 d/. H2N-NH-CO- NHCH(OH)CH3
Chương 4. HIỆU ỨNG NHIỆT CỦA _ CÁC QUÁ TRÌNH HÓA HỌC
4.1 Nhiệt phản ứng a) Nội năng U b) Nhiệt độ T 4.3
Chọn phương án đúng:
Xét hệ phản ứng NO(k) + 1/2O2(k) NO2(k) H0298 = -7,4 kcal. Phản ứng được thực hiện trong
bình kín có th ऀ tích không đổi, sau phản ứng được đưa về nhiệt độ ban đầu. Hệ như thế là:
a) Hệ kín & đ ng th ऀ c) Hệ kín & dị th ऀ b) Hệ cô lập
d) Hệ cô lập và đ ng th ऀ lOMoAR cPSD| 45148588 4.4
Chọn phương án sai:
Hệ cô lập là hệ không có trao đổi chất, không trao đổi năng lượng
dưới dạng nhiệt và công với môi trường. n phương án sai. Các đại
lượng dưới đây đều là hàm trạng thái: a) Thế đẳng áp , nội năng, công. b)
entanpi, entropi, nhiệt dung đẳng áp. c)
nhiệt độ, áp suất, thế đẳng tích, thế đẳng áp d)
Thế đẳng áp, entanpi, entropi, nội năng, nhiệt dung đẳng tích. 4.2
Chọn trường hợp đúng.
Đại lượng nào sau đây là hàm trạng thái có thuộc tính cường độ: lOMoAR cPSD| 45148588 14 c) Th ऀ tích V a) Công chống áp suất ng b)
Hệ kín là hệ không trao đổi chất và công, song có th ऀ trao đổi nhiệt với môi trường. c)
Hệ đoạn nhiệt là hệ không trao đổi chất và nhiệt, song có th ऀ trao đổi công với môi trường. d)
Hệ hở là hệ không bị ràng buộc bởi hạn chế nào, có th ऀ trao đổi chất và năng lượng với môi trường.
4.5 Chọn phát bi ऀ u sai:
1) Khí quy ऀ n là một hệ đ ng th ऀ và đ ng nhất.
2) Dung dịch NaCl 0,1M là hệ đ ng th ऀ và đ ng nhất.
3) Benzen và nước là hệ dị th ऀ .
4) Quá trình nung vôi: CaCO3(r) CaO(r) + CO2(k) thực hiện trong lò hở là hệ cô lập.
5) Thực hiện phản ứng trung hòa:
HCl(dd) + NaOH(dd) NaCl(dd) + H2O(l) trong nhiệt lượng kế (bình kín, cách nhiệt) là hệ kín a) 1,5 b) 2,4 c) 1,4,5 d) 4 4.6
Chọn phương án đúng:
Sự biến thiên nội năng U khi một hệ thống đi từ trạng thái thứ nhất (I) sang trạng thái thứ hai (II)
bằng những đường đi khác nhau có tính chất sau: a)
Không thay đổi và bằng Q - A theo nguyên lí bảo toàn năng lượng. b)
Không th ऀ tính được do không th ऀ xác định giá trị tuyệt đối nội năng của hệ. c)
Thay đổi do nhiệt Q và công A thay đổi theo đường đi. d)
Không th ऀ tính được do mỗi đường đi có Q và A khác nhau.
4.2 Phương trình nhiệt hóa học
4.7 Chọn phát bi ऀ u chính xác và đầy đủ của định luật Hess
a) Hiệu ứng nhiệt của quá trình hóa học chỉ phụ thuộc vào bản chất và trạng thái của các chất đầu
và sản phẩm chứ không phụ thuộc vào đường đi của quá trình.
b) Hiệu ứng nhiệt đẳng áp hay đẳng tích của quá trình hóa học chỉ phụ thuộc vào bản chất của các
chất đầu và sản phẩm chứ không phụ thuộc vào đường đi của quá trình.
c) Hiệu ứng nhiệt đẳng áp hay đẳng tích của quá trình hóa học chỉ phụ thuộc vào bản chất và trạng
thái của các chất đầu và sản phẩm chứ không phụ thuộc vào đường đi của quá trình.
d) Hiệu ứng nhiệt đẳng áp của quá trình hóa học chỉ phụ thuộc vào bản chất và trạng thái của các
chất đầu và sản phẩm chứ không phụ thuộc vào đường đi của quá trình. 4.8
Chọn phương án đúng:
của một quá trình hóa học khi hệ chuy ऀ n từ trạng thái thứ nhất (I) sang trạng thái thứ hai (II)
bằng những cách khác nhau có đặc đi ऀ m: a)
Có th ऀ cho ta biết mức độ diễn ra của quá trình b)
Có th ऀ cho ta biết chiều tự diễn biến của quá trình ở nhiệt độ cao. c)
Không đổi theo cách tiến hành quá trình. d)
Có th ऀ cho ta biết độ hỗn loạn của quá trình 4.9 Chọn phương án đúng:
H0298 của một phản ứng hoá học
a) Tùy thuộc vào nhiệt độ lúc diễn ra phản ứng.
b) Tùy thuộc vào đường đi từ chất đầu đến sản phẩm.
c) Không phụ thuộc vào bản chất và trạng thái của các chất đầu và sản phẩm phản ứng. lOMoAR cPSD| 45148588
d) Tùy thuộc vào cách viết các hệ số tỉ lượng của phương trình phản ứng.
4.10 Chọn phương án đúng:
Trong điều kiện đẳng tích, phản ứng phát nhiệt là phản ứng có: a) U < 0 c) H < 0 b) Công A < 0 d) U > 0 4.11
Chọn phương án đúng:
Cho phản ứng : N2 (k) + O2 (k) = 2NO (k) có H0298 = +180,8 kJ.
Ở điều kiện tiêu chuẩn ở 25oC , khi thu được 1 mol khí NO từ phản ứng trên thì: a)
Lượng nhiệt t漃ऀ a ra là 180,8 kJ. c)
Lượng nhiệt t漃ऀ a ra là 90,4 kJ. b)
Lượng nhiệt thu vào là 180,8 kJ. d)
Lượng nhiệt thu vào là 90,4 kJ.
4.12 Chọn phương án đúng:
Hệ thống hấp thu một nhiệt lượng bằng 300 kJ. Nội năng của hệ tăng thêm 250 kJ. Vậy trong biến
đổi trên công của hệ thống có giá trị: a) -50 kJ, hệ nhận công c) 50 kJ, hệ sinh công b) -50 kJ, hệ sinh công d) 50 kJ, hệ nhận công
4.13 Chọn phương án đúng:
Trong một chu trình, công hệ nhận là 2 kcal. Tính nhiệt mà hệ trao đổi : a) +4 kcal b) -2 kcal c) +2 kcal d) 0
4.14 Chọn phương án đúng:
Một hệ có nội năng giảm (∆U < 0), khi đi từ trạng thái 1 sang trạng thái 2 trong điều kiện đẳng áp.
Biết rằng trong quá trình biến đổi này hệ t漃ऀ a nhiệt ( < 0), vậy hệ :
a) Sinh ra công c)
Không dự đoán được dấu của công b) Nhận công
d) Không trao đổi công
4.15 Chọn phương án đúng:
Trong điều kiện đẳng áp, ở một nhiệt độ xác định, phản ứng :
A(r) + 2B(k) = C(k) + 2D(k) phát nhiệt. Vậy: a)
U < H c) Chưa đủ dữ liệu đ ऀ so sánh b) U = H d) U > H
4.16 Chọn phương án đúng:
Tính sự chênh lệch giữa hiệu ứng nhiệt phản ứng đẳng áp và đẳng tích của phản ứng sau đây ở 25oC:
C2H5OH (ℓ) + 3O2 (k) = 2CO2(k) + 3H2O (ℓ) (R = 8,314 J/mol.K) a) 2478J b) 4539J c) 2270J d) 1085J
4.17 Chọn câu đúng:
1) Công thức tính công dãn nở A = nRT đúng cho mọi hệ khí.
2) Trong trường hợp tổng quát, khi cung cấp cho hệ đẳng tích một lượng nhiệt Q thì toàn bộ
lượng nhiệt Q sẽ làm tăng nội năng của hệ
3) Biến thiên entanpi của phản ứng hóa học chính là hiệu ứng nhiệt của phản ứng đó trong điều kiện đẳng áp.
a) Không có câu đúng c) Tất cả cùng đúng
b) 2 & 3 d) 3
4.18 Chọn phương án đúng:
Một phản ứng có H = +200 kJ. Dựa trên thông tin này có th ऀ kết luận phản ứng tại điều kiện đang xét: 1) thu nhiệt. 2) xảy ra nhanh.
3) không tự xảy ra được. a) 1 b) 2,3 c) 1,2,3 d) 1,3 16 lOMoAR cPSD| 45148588
4.19 Chọn phương án đúng:
Hiệu ứng nhiệt tạo thành tiêu chuẩn của CO2 là biến thiên entanpi của phản ứng: a)
Cgraphit + O2 (k) = CO2 (k) ở 25oC, áp suất riêng của O2 và CO2 đều bằng 1 atm b)
Ckim cương + O2 (k) = CO2 (k) ở 0oC, áp suất riêng của O2 và CO2 đều bằng 1 atm c)
Cgraphit + O2 (k) = CO2 (k) ở 0oC, áp suất chung bằng 1atm d)
Cgraphit + O2 (k) = CO2 (k) ở 25oC, áp suất chung bằng 1atm 4.20 Chọn trường hợp đúng.
Ở điều kiện tiêu chuẩn, 250C phản ứng: H2(k) + ½ O2(k) = H2O(ℓ)
Phát ra một lượng nhiệt 241,84 kJ. Từ đây suy ra:
1) Nhiệt đốt cháy tiêu chuẩn ở 250C của khí hydro là -241,84kJ/mol
2) Nhiệt tạo thành tiêu chuẩn ở 250C của hơi nước là -241,84kJ/mol
3) Hiệu ứng nhiệt của phản ứng trên ở 250C là -241,84kJ
4) Năng lượng liên kết H – O là 120,92 kJ/mol a) 1, 2, 3,4 b) 1, 3, 4 c) 1, 3 d) 2, 4
4.21 Chọn trường hợp đúng.
Biết rằng nhiệt tạo thành tiêu chuẩn của B2O3 (r), H2O (ℓ) ,CH4 (k) và C2H2 (k) lần lượt bằng:
1273,5 ; -285,8; -74,7 ; +2,28 (kJ/mol). Trong 4 chất này, chất dễ bị phân hủy thành đơn chất nhất là: a) H2O b) C2H2 c) CH4 d) B2O3
4.22 Chọn trường hợp đúng.
Trong các hiệu ứng nhiệt ( H) của các phản ứng cho dưới đây, giá trị nào là hiệu ứng nhiệt đốt cháy?
1) C(gr) + ½O2(k) = CO(k) H0298 = -110,55 kJ
2) H2(k) + ½O2(k) = H2O(k) H0298 = -237,84kJ
3) C(gr) + O2(k) = CO2(k) H0298 = -393,50kJ a) 3 b) 1,3 c) 1,2 d) 2,3
4.23 Chọn câu sai. a)
Nhiệt tạo thành của các hợp chất hữu cơ trong cùng một dãy đ ng đẳng có trị số tuyệt đối
tăng khi khối lượng phân tử của hợp chất tăng lên. b)
Nhiệt thăng hoa của một chất thường lớn hơn nhiều so với nhiệt nóng chảy của chất đó c)
Nhiệt đốt cháy của các hợp chất hữu cơ trong cùng một dãy đ ng đẳng có trị số tuyệt đối
giảm khi khối lượng phân tử của hợp chất tăng lên. d)
Nhiệt hòa tan của một chất không những phụ thuộc vào bản chất của dung môi và chất tan
mà còn phụ thuộc vào lượng dung môi.
4.24 Chọn đáp án không chính xác. Ở một nhiệt độ xác định:
1) Nhiệt tạo thành tiêu chuẩn của đơn chất luôn bằng 0.
2) Nhiệt cháy tiêu chuẩn của một chất là một đại lượng không đổi.
3) Nhiệt hòa tan tiêu chuẩn của một chất là một đại lượng không đổi.
4) Nhiệt chuy ऀ n pha tiêu chuẩn của một chất là một đại lượng không đổi. a) 1, 3 & 4 b) 1, 2 & 4 c) 1 & 3 d) 2, 3 & 4
4.25 Chọn phương án đúng:
Hiệu ứng nhiệt của một phản ứng ở điều kiện đẳng áp bằng:
1) Tổng nhiệt tạo thành sản phẩm trừ tổng nhiệt tạo thành các chất đầu.
2) Tổng nhiệt đốt cháy các chất đầu trừ tổng nhiệt đốt cháy các sản phẩm.
3) Tổng năng lượng liên kết trong các chất đầu trừ tổng năng lượng liên kết trong các sản phẩm. a) 1 b) 2 c) 3 d) 1, 2, 3 lOMoAR cPSD| 45148588
4.26 Chọn trường hợp đúng.
Cho nhiệt tạo thành tiêu chuẩn ở 250C của các chất NH3, NO, H2O lần lượt bằng: -46,3; +90,4 và - 241,8 kJ/mol.
Hãy tính hiệu ứng nhiệt của phản ứng: 2NH3(k) + 5/2O2(k) 2NO(k) + 3H2O(k) a) +452 kJ b) +406,8 kJ c) –406,8 kJ d) –452 kJ
4.27 Chọn giá trị đúng.
Khi đốt cháy than chì bằng oxy người ta thu được 33g khí cacbonic và có 70,9 kcal thoát ra ở điều
kiện tiêu chuẩn, vậy nhiệt tạo thành tiêu chuẩn của khí cacbonic có giá trị (kcal/mol). a) -94,5 b) -70,9 c) 94,5 d) 68,6
4.28 Chọn giá trị đúng.
Xác định nhiệt đốt cháy tiêu chuẩn ở 250C của khí metan theo phản ứng:
CH4(k) + 2O2 (k) = CO2 (k) + 2H2O(ℓ)
Nếu biết hiệu ứng nhiệt tạo thành tiêu chuẩn của các chất CH4 (k), CO2 (k) và H2O (ℓ) lần lượt bằng:
-74,85; -393,51; -285,84 ( kJ/mol) a) –890,34 kJ/mol c) 890,34 kJ/mol b) –604,5 kJ/mol d) 604,5 kJ/mol
4.29 Chọn phương án đúng:
Tính H0298 của phản ứng sau:
H2C = CH – OH ⇄ H3C – CH = O
Cho biết năng lượng liên kết (kJ/mol) ơ 250C, 1atm: EC = C = 612 kJ/mol EC – C = 348 kJ/mol EC – O = 351 kJ/mol EC = O = 715 kJ/mol EO – H = 463kJ/mol EC – H = 412 kJ/mol a) +98k b) + c) – J 49kJ 49kJ. d) –
4.30 Chọn phương án đúng: 98kJ
Tính năng lượng mạng lưới tinh th ऀ của Na2O(r) ở 250C. Cho biết
Nhiệt tạo thành tiêu chuẩn của Na2O: ( H0298 )tt 415,9kJ /mol
Năng lượng ion hóa thứ nhất của Na: I1 = 492kJ/mol
Nhiệt thăng hoa tiêu chuẩn của Na: ( H0298 )th 107,5kJ /mol
Ái lực electron của oxy: O + 2e O2– FO = 710kJ/mol
Năng lượng liên kết O = O: ( H0298 )pl 498kJ /mol a) 2223 kJ/mol c) 1974 kJ/mol b) 2574 kJ/mol d) 2823 kJ/mol
4.31 Chọn phương án đúng:
Tính hiệu ứng nhiệt 0 của phản ứng: B A, biết hiệu ứng nhiệt của các phản ứng sau: C A 1 D C 2 D B 3 a) 0 = 1 - 2 + 3 c) 0 = 1 + 2 + 3 b) 0 = 3 + 2 - 1 d) 0 = 1 + 2 - 3
4.32 Chọn giá trị đúng.
Tính nhiệt tạo thành tiêu chuẩn của CH3OH l漃ऀ ng, biết rằng: C (r) + O 0 2 (k) = CO2 (k) H1 = -94 kcal/mol 18