





Preview text:
lOMoAR cPSD| 45148588
BÀI TẬP NHIỆT ĐỘNG HÓA HỌC-2
Câu 1. Phản ứng nhị hợp NO2 : 2NO2 (k) N2O4 (k)
Biết H0S (kcal/mol) : 8,091 2,309
S0 (cal.mol–1.K–1) : 57,2 72,2
– Tính biến thiên năng lượng tự do của pư ở 00C và 1000C. Cho biết chiều tự diễn biến tại những nhiệt độ đó.
– Xđ ở nhiệt độ nào thì G = 0 ? Xác định chiều của phản ứng ở nhiệt độ cao hơn và thấp hơn nhiệt độ đó.
Giả thiết H và S của các chất thay đổi theo nhiệt độ không đáng kể. Câu 2: Cho: O2(k) Cl2(k) HCl(k) H2O(k) S 0 298 (J/mol.K) 205,03 222,9 186,7 188,7 H 0 298 (kJ/mol) 0 0 -92,31 -241,83
1. Tính hằng số cân bằng của phản ứng ở 2980K 4HCl(k) + O + 2H 2(k) 2Cl2(k 2O(k)
2. Giả thiết H và S không phụ thuộc vào nhiệt độ, tính hằng số cân bằng của phản ứng ở 6980K.
3. Muốn tăng hiệu suất phản ứng oxi hóa HCl thì nên tiến hành phản ứng ở những điều kiện nào? Caâu 3: Tại 25oC,
tạo thành các chất như sau: (theo kJ.mol-1) H2O(k) CO2(k) CO(k) H2O(l)
-228,374 -394,007 -137,133 -236,964
a. Tính Kp của phản ứng: tại 25oC
b. Tính áp suất hơi nước tại 25oC
c. Hỗn hợp gồm các khí CO, CO2, H2 mà mỗi khí đều có áp suất riêng phần là 1 atm được trộn với nước (lỏng,
dư). Tính áp suất riêng phần mỗi khí có trong hỗn hợp cân bằng tại 25oC, biết quá trình xảy ra khi V = const.
Câu 4: Ở điều kiện chuẩn, entanpi phản ứng và entropi của các chất có giá trị như sau: Số thứ tự Phản ứng H0298(kJ) 1 2NH -1011 3 + 3N2O 4N2 + 3H2O 2 N -317 2O + 3H2 N2H4 + H2O 3 2NH -143 4 3 + ½ O2 N2H4 + -286 H2O H2 + ½ O2 H2O S0298(N2H4) = 240 J/mol. K S0298(H2O) = 66,6 J/mol. K S0298(N2) = 191 J/mol. K S0298(O2) = 205 J/mol. K
a) Tính entanpi tạo thành của
H0298 của N2H4, N2O và NH3, S0298
b) Viết phương trình của phản ứng cháy hiđrazin tạo thành nước và nitơ
c) Tính nhiệt phản ứng cháy đẳng áp ở 298K và tính
G0298 và tính hằng số cân bằng K
d) Nếu hỗn hợp ban đầu gồm 2 mol NH3 và 0,5 mol O2 thì nhiệt pảhn ứng 3 ở thể tích không đổi là bao nhiêu? Câu 5 :
1./ Cho biết sinh nhiệt chuẩn ( ∆Ho ) của ( O3 ) khí = +34Kcal/mol ,
( ∆Ho ) của ( CO2 ) khí = -94,05 Kcal/mol, ( ∆Ho ) của ( NH3 ) khí = -11,04 Kcal/mol
( ∆Ho ) của ( HI ) khí = + 6,2Kcal/mol
a./ Sắp xếp theo thứ tự tính bền tăng dần của các đơn chất hợp chất : O3 , CO2 ,NH3 ,và HI giải thích ?.
b./ Tính năng lượng liên kết E N-N ,biết EH-H = 104Kcal/mol và EN-H = 93 Kcal/mol
2./Cho phản ứng : H2O ( k ) + CO ( k ) H2 ( k ) + CO2 ( k )
Tính Ho298oK và Eo 298oK biết rằng H o 298oK cuả CO2 ( k ); H2O ( k ) , CO ( k ) lần lượt là -94,05 , - 57,79 ; - 26,41 Kcal/ mol
Câu 6: Cho các số liệu nhiệt động của một số phản ứng sau ở 298oK. lOMoAR cPSD| 45148588
2NH3 + 3N2O 4N2 + 3H2O H1= -1011KJ/mol N2O + 3H2 N2H4 + H2O H2= -317KJ/mol 2NH3
+ 0,5O2 N2H4 + H2O H3= -143KJ/mol H2 + 0,5O2 H2O H4= -286KJ/mol Hãy tính
nhiệt tạo thành của N2H4, N2O và NH3.
Câu 7 :Chất lỏng N2H4 có thể dùng làm nhiên liệu đẩy tên lửa
1. Tính nhiệt tạo thành của N2H4 khi biết:
2. Trong nhiên liệu đẩy tên lửa, hidrazin lỏng phản ứng với hidropeoxit lỏng tạo ra nitơ và hơi nước.
Viết pư và tính nhiệt toả ra khi 1m3(đktc) khí N2H4 phản ứng, biết nhiệt tạo thành của H2O2(l) là :-187,8kJ/ mol.
Câu 8 : Butadien – 1,3 ở trạng thái khí trong điều kiện 250C và 100 kPa. 1 0 0 :
a) Tính Nhiệt tạo thành chuẩn của nó ở 25 C khi biết: H ở 298 K theo kJ.mol 0 0
H đốt cháy C4H6 = 2552,73 ; H sinh H2O (l) = 285,83; 0 0
H sinh CO2 (k) = 393,51; H thăng hoa C(r) = 716,7 0 kết:
b) Tính Nhiệt tạo thành chuẩn của nó ở 25 C khi biết các trị số năng lượng liên H – H C – C C = C C – H kJ. mol 1 436 345 615 415
c) So sánh kết quả của 2 phần trên và giải thích.
Câu 9 Một nồi hơi bằng thép có khối lượng 900 kg. Nồi hơi chứa 400 kg nước. Giả sử hiêu suất sử dụng nhiệt
của nồi hơi là 70 %. Cần bao nhiêu calo nhiệt để nâng nhiệt độ của nồi hơi từ 10oC lên 100oC ? Nhiệt dung riêng
của thép là 0,46 kJ/mol, nhiệt dung riêng của nước là 4,184 kJ/mol.
Câu 10 : Độ tan của Mg(OH)2 trong nước ở 180C là 9.10-3 g/ℓ ; còn ở 1000C là 4.10-2 g/ℓ.
a/ Tính tích số tan của Mg(OH)2 ở 2 nhiệt độ trên.
b/ Tính các đại lượng ∆H0, ∆G0 và ∆S0 của phản ứng hòa tan, giả sử ∆H0, ∆S0 không thay đổi theo nhiệt
độ. Biết R = 8,314 J.mol.k-1. Câu 11: 1.
a/ Khi trung hòa 1mol axit mạnh bằng 1 mol bazơ mạnh trong dd loãng , nhiệt tỏa ra H=-57,32kJ .
Entanpi tạo thành nước lỏng là -285,81kJ/mol; Entanpi tạo thành H+=0. Hãy xác định Entanpi tạo thành OH-(aq)
b/ Khi trung hòa 1mol HCN bằng kiềm mạnh , thấy giải phóng ra 12,13kJ nhiệt. Tính H của phản ứng điện li HCN 2.
a/ Với phản ứng tổng hợp NH3, ở 673K có hằng số cân bằng K1= 1,3.10-2 ; ở 773K có hằng số cân bằng
K2= 3,8.10-3. Xác định H trong khỏang nhiệt độ đó. b/ Muốn tăng hiệu suất phản ứng tổng hợp NH3, nên tiến
hành pư ở những điều kiện nào về nhiệt độ, áp suất ?
Câu 12 : Cho phản ứng aA + bB dD + eE Biết
Với C là nồng độ tại thời điểm đang xét. 1) Chứng minh rằng: Với
và K c là hằng số cân bằng của phản ứng. 2) với phản ứng: lOMoAR cPSD| 45148588
Hỏi các hỗn hợp có thành phần sau đây sẽ phản ứng theo chiều nào? HẾT GIẢI 1) Theo đề bài, ta có
Khi hệ đạt tới cân bằng thì trở thành K c nên vào (1) ta có: Lúc đó Vậy thay 2) Ta thấy với phản ứng: Xét tỉ số : <1 nếu : phản ứng xảy >1 ra theo chiều thuận; =1 nếu : phản ứng xảy ra theo chiều nghịch; nếu : phản ứng đạt tới trạng thái cân bằng. Từ a)
phản ứng xảy ra theo chiều thuận Từ b)
phản ứng xảy ra theo chiều nghịch Từ c)
hệ đang ở trạng thái cân bằng GIẢI
1. a/ Phản ứng trung hòa : H+
(aq) + OH-(aq) H2O(l) H = -57,32kJ lOMoAR cPSD| 45148588 ttOH ttH O2 ttH 285,81 0 57,32
228,49kJ mol/ b/ Phản
ứng trung hòa HCN bằng kiềm mạnh :
(1) HCN(dd) + OH- H2O(l) + CN-(aq) H1= -12,13 kJ
(2) H+(aq) + OH-(aq) H2O(l) H2 = -57,32kJ Lấy (1) - (2) HCN
(dd) H+(aq) + CN-(aq) H3 =-12,13-(-57,32)= 45,19kJ 2.a/ Áp dụng phương trình : log K2 0 1 1 K1 2,303R T 2 T1 1 1 log1,3.103,8.10 3 2 2,303. 0 R 673 773 0 4,68.104 J
b/ N2(K) + 3H2(K) 2NH3(K) H < 0 Muốn
tăng hiệu suất tổng hợp NH3 cần phải : - Tăng áp suất của hệ
- Giảm nhiệt độ của hệ GIẢI Trong dung dịch : - Ở 180C hay 291k : - Ở 1000C hay 372k :
b/ Từ ∆G0 = ∆H0 – T. ∆S0 và ∆G0 = - RT ℓnks
vì ∆H0, ∆S0 không thay đổi theo nhiệt độ, nên : lOMoAR cPSD| 45148588
Muốn tính ∆G0 phải tính tích số tan ks ở 298k (250C) Từ Từ Từ ∆G0 = - RTℓnks Từ ∆G0 = - ∆H0 – T. ∆S0
∆S0 = - 38,02 J.mol -1. k -1 ĐÁP SỐ
Nhiệt lượng là 268405,7 kJ GIẢI
a) C4H6 + 5,5 O2 4CO2 + 3H2O
H0 (cháyC4H6) = 4 H0 (sinhCO2) + 3 H0 (sinh H2O) H0 (sinhC4H6)
H0(sinhC4H6) = 4 ( 393,51) + 3( 285,83) ( 2552,73) = 121,2 kJ/mol b) H
0(sinhC4H6) = 4 H0(thăng hoaCrắn) + 3E(H H) 6 E(C H) E(C C) 2E(C=C )
= (4 2866,8) + (3 436) (6 415) (345) (2 615) = 109,8 kJ/mol lOMoAR cPSD| 45148588
c) Năng lượng liên kết theo tính toán không phù hợp với kết quả thực nghiệm (lệch tới 10%), lớn hơn thông
thường do có sự không định vị của mây làm cho phân tử bền vững hơn so với mô hình liên kết cộng hoá trị định vị.
Sự khác nhau giữa 2 nhiệt tạo thành được gọi là năng lượng cộng hưởng của phân tử = 11,4 kJ. mol 1. GIẢI
a/ Phương trình cần tìm: N2 + 2H2 N2H4 -Xếp các phản ứng 4N2 + 3H2O 2NH3 + 3N2O - H1
3N2O + 3.3H2 3.N2H4 + 3H2O 3. H2 2NH3 + 0,5O2 N2H4 + H2O H3 H2O H2+ 0,5O2 - H4 4N2 + 8H2 4N2H4 H H= - H1+3 H3+ H3- H4 = 1011-3.317-143+286 =203KJ. - Nhiệt tạo thành N2H4:
HN2H4 = 203/4 = 50,75KJ.mol-1 b/
N2O + 3H2 N2H4 + H2O H2= -317 H2= HN2H4 + HH2O – HN2O HN2O= HN2H4 + HH2O – H2 = 50,75 – 286 + 317 = 81,75KJ.mol-1 c/ 2HN3 + 0,5O2 N2H4 + H2O H3
H3= HN2H4 + HH2O – 2. HNH3 => HNH3=( HN2H4 + HH2O – H3)/2 HNH3=(50,75-286+143)/2 =- 46,125KJ.mol-1. GIẢI 2. N2H4(k) + H2O2(k) N2(k) + 2H2O(k)
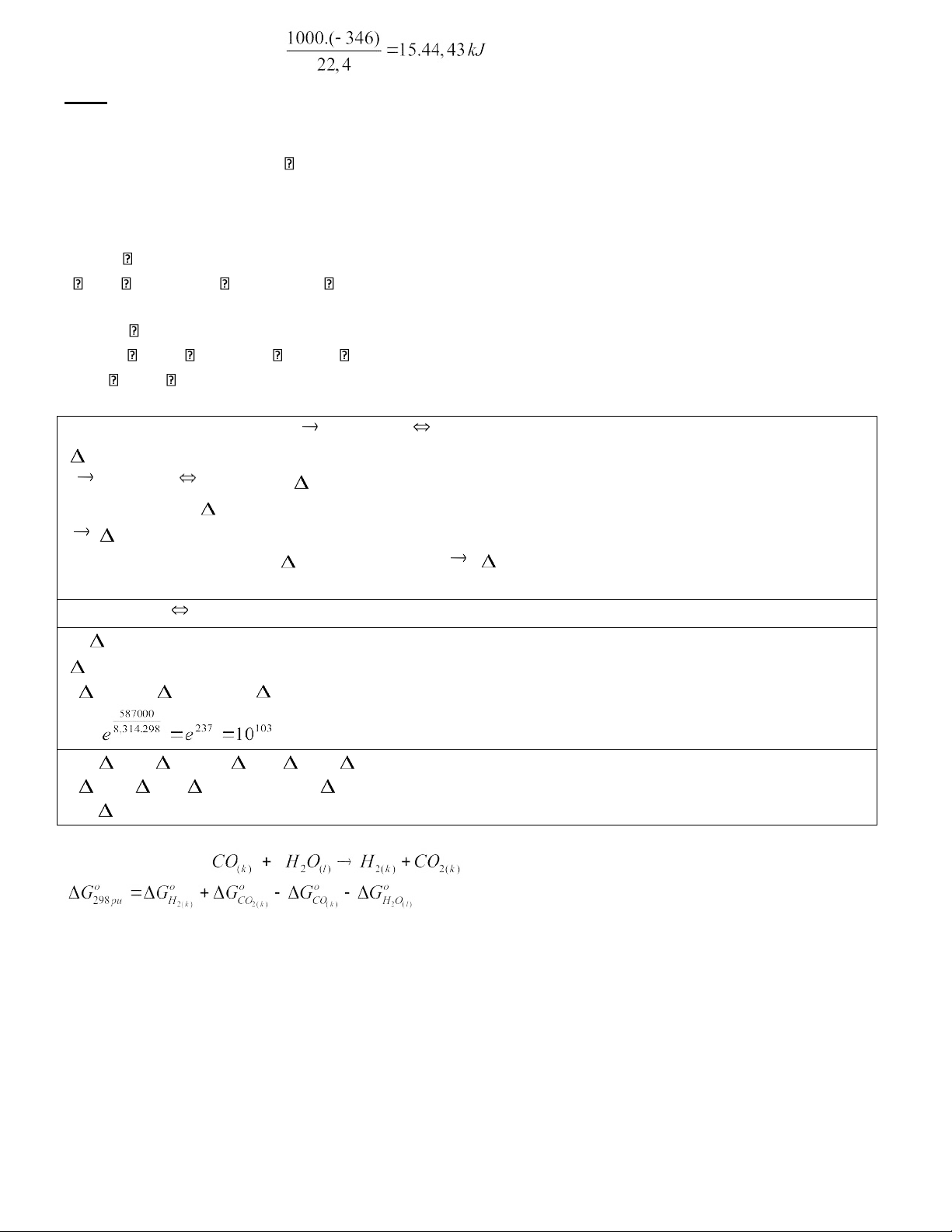
Khi 1 mol khí N2H4 phản ứng toả ra 346 kJ. Vậy nhiệt lượng toả ra khi đốt cháy 1m3 khí N2H4 (đktc)
1 .Nhiệt tạo thành của N 2 H 4 là Ta có: lOMoAR cPSD| 45148588 là: GIẢI
a./ Vì sinh nhiệt càng âm tức năng lượng càng tỏa nhiệt ra nhiều thì hợp chất càng bền . Do đó thứ tự độ bền
tăng dần là : O3 < HI < NH3 < CO2
b./ Xét phản ứng N2 + 3H2 2NH3 thì ∆H Pư = 2.-11,04Kcal
Ta có : E N-N + 3 x E H-H - 2 x E N-H = 2 x -11,04
Suy ra E N-N = - 22,08 – (3 . 104 -6 . 93 ) = 223,92 Kcal/mol 2./ a) Tính Ho 298oK Ho = Ho CO2 - Ho H2O - Ho CO
= -94,05 - ( -57,79 ) - ( - 26,41 ) = -9,85Kcal b) Tính Eo 298oK
Ta có Ho = Eo + RT n với n = 2 - 2 = 0
Vậy Ho = Eo = -9,85Kcal ( 1 đ ) GIẢI
a) Ta có –(1) + 3(2) + (3) – (4) 4N2 + 8H2 4N2H4
H0298 = 1011 + 3.(-317) + ( -143) + 286 = 203kJ N2 + 2H2 N2H4 H0 298 = 50,8kJ / mol * Từ 2 : 0 +
H0298 (N2O) – 50,8 + 286 = 317 H0298 (N2O) = 81,88kJ / mol * Từ 3: 50,8 – 286 -2. H0 298 (NH3) = -143 H0298 (NH3) = -45,6 kJ / mol b) N2H4 + O2 N2 + 2H2O c)
H0298 = -2.286 -50,8 = -623 kJ
S0298 = 191 + 2.66,6 – 205 – 240 = 121 J/K
G0298 = H0298 + T. S0298 = -623 + 298.121 = -587kJ K = d) H = U + p. v = U + nRT U = H -
nRT trong đó n = 1 – 2,5 = - 1,5
U = -143000 + 1,5. 8,314. 298 = -139kJ GIẢI a/
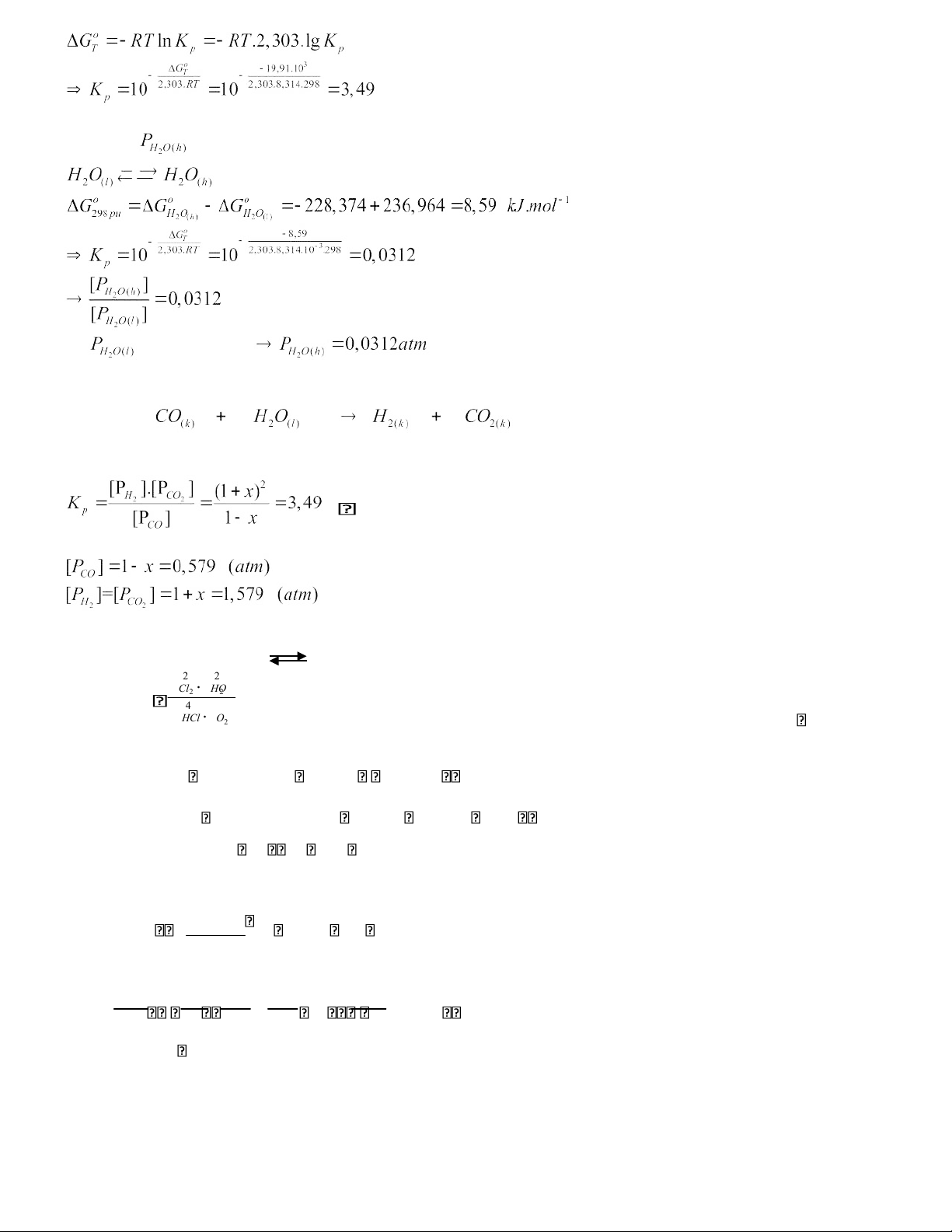
= 0 + (-394,007) + 137,133 + 236,964 = -19,91 kJ.mol-1..
Áp dụng phương trình đẳng nhiệt Van Hoff, ta có: lOMoAR cPSD| 45148588 b/ Để xét
ở 25 o C ta xét cân bằng ở 25 o C. Vì = const = 1atm ( 25 ở o C) theo phản ứng: dư) ( Ban đầu: 1 1 1 (atm)
Cân bằng: 1 – x 1 + x 1 + x x = 0,421
Vậy tại thời điểm cân bằng ở 25 o C: GIẢI 1 . 4HCl + O 2 2 Cl 2 + 2 H 2 O 2 PP . 2 Cl2 2 HO KP 4 PP . HCl 2 O
c/ Vì ở điều kiện T; V = const áp suất
riêng phần tỷ lệ với số mol mỗi khí nên có thể tính áp suất riêng phần Có
H 0 Phản ứng = 2 H(0H O2 ) 4 H(0HCl) 114,42kJ
S0 Phản ứng = 2S(0Cl2) 2S(0H O2 ) (4S(0HCl) S(0O2)) 128,63(J /K)
G0 H0 T S. 0
=-114420 + 298.128,63 = -76088,26(J) Vậy : lg K G P 13,34 KP 1013,34 2,3. .K T 2. lnKK698 RH 698 2981 1 lnKK698298 26,47 298 hay KP(698) = 101,8
3. Dựa vào các số liệu bài toán, suy ra Muốn tăng hiệu suất oxi hóa HCl cần: - Hạ nhiệt độ. - Tăng áp suất - Tăng nồng độ O2 lOMoAR cPSD| 45148588 Giải
Ở điều kiện chuẩn (1 atm và 250C) : H0pư – 2
= = 2309 – 2.8091 = –13873 (cal/mol)……………….. S0pư – 2
= = 72,7 – 2.57,5 = –42,2 (cal.mol–1.K–1) …………………….
Áp dụng : G0T = H0pư – T S0pư để tính G ở các nhiệt độ khác nhau. (Vì H0 và S0 biến thiên không đáng
kể theo nhiệt độ, nên có thể sử dụng để tính G ở các nhiệt độ khác nhau theo công thức nêu ra.) a) Ở 00C, tức 273K :
G0273 = –13873 + 42,2.273 = –2352 (cal/mol) . ……………………………….
G0273 < 0, vậy ở nhiệt độ này phản ứng diễn ra theo chiều thuận……………………… b) Ở 1000C, tức 373K :
G0373 = –13873 + 42,2.373 = +1868 (cal/mol) > 0 …………………………..
Vậy phản ứng lúc này diễn ra theo chiều nghịch. ……………………………………….
c) Khi phản ứng đạt trạng thái cân bằng ở nhiệt độ T nào đó thì G0T = 0.
Khi đó : –13873 + 42,2.T = 0 T =
= 329 (K) hay 560C ………………………………………………..
Ở nhiệt độ t > 560C (hay T > 329K) thì :
G0T = –13873 + 42,2T > 0, phản ứng diễn ra theo chiều nghịch. …………………
Ở nhiệt độ t < 560C (hay T < 329K) thì :
G0T = –13873 + 42,2T < 0, phản ứng diễn ra theo chiều thuận……………………