




Preview text:
lOMoAR cPSD| 59416725 Bài 5: Enzyme
1. Cách gọi tên và phân loại enzyme .................................................................................................. 2
1.1. Gọi tên ..................................................................................................................................... 2
1.2. Phân loại .................................................................................................................................. 2
2. Một số đặc tính của phân tử enzyme ............................................................................................ 5
2.1. Cấu tạo và cấu trúc enzyme .................................................................................................... 5
2.2. Trung tâm hoạt động và tính đặc hiệu cơ chất ....................................................................... 6
2.3. Các dạng cấu trúc của phân tử enzyme .................................................................................. 7
3. Cấu trúc và chức năng của các coenzyme ...................................................................................... 7
4. Cơ chế xúc tác của enzyme ............................................................................................................ 9
4.2. Cơ chế tác dụng của enzyme ................................................................................................... 9
5. Động học enzyme ......................................................................................................................... 10
5.1. Tốc độ phản ứng và đơn vị đo ............................................................................................... 10
5.2. Thuyết Michaelis-Menten......................................................................10 .......................... 10
6. Các yếu tố ảnh hưởng đến hoạt động của enzyme ..................................................................... 12
6.1. Nồng độ cơ chất [S] ............................................................................................................... 13
6.2. Nồng độ enzyme [E] .............................................................................................................. 13
6.3. Nhiệt độ................................................................................................12 ............................ 13
6.4. pH môi trường ....................................................................................................................... 14
6.5. Chất hoạt hóa ........................................................................................................................ 14
6.6. Chất ức chế ............................................................................................................................ 14
4.1. Sự biến thiên năng lượng tự do (ΔG) và năng lượng hoạt hóa (Ea).........8 BÀI 5: ENZYME
Môi trường đặc biệt của các phản ứng sinh hóa trong cơ thể: + dung môi: nước (chiếm + pH trung tính (~7.4) 2/3) + áp suất ôn hòa + nhiệt độ: 37oC
Các phản ứng trong cơ thể phải diễn ra nhanh chóng, mạnh mẽ, được kiểm soát,
điều hòa chặt chẽ phù hợp với nhu cầu cơ thể.
- Cần enzyme: xúc tác sinh học với đầy đủ tính chất của 1 xúc tác: o
+ không bị tiêu hao/ sinh thêm trong quá trình phản ứng o + chỉ làm tăng
vpứ mà không tạo ra phản ứng o
+ không làm thay đổi hằng số cân bằng, chiều của phản ứng - Ngoài
ra, enzyme còn có 1 số tính chất của 1 phân tử sinh học:
+ hầu hết là protein (một số là RNA)
+ hiệu lực xúc tác lớn hơn nhiều lần so với xúc tác vô cơ thông thường lOMoAR cPSD| 59416725
+ có tính đặc hiệu cơ chất (substrate) và phản ứng
+ hoạt động ở môi trường pH và nhiệt độ nhất định (dễ biến tính)
+ kiểm soát và điều hòa chặt chẽ qua kiểm soát hoạt tính enzyme
Enzyme đóng vai trò quan trọng trong các phản ứng trong cơ thể: thoái hóa các phân tử dinh
dưỡng, tích lũy và chuyển dạng năng lượng, xúc tác tạo nên các phân tử phức tạp từ tiền chất của nó.
Giá trị thực tiễn lâm sàng của enzyme:
- Chẩn đoán và điều trị bệnh dựa trên đo hoạt độ enzyme trong huyết tương, hồng cầu, mô
- Nghiên cứu, chẩn đoán và điều trị các bệnh rối loạn di truyền do thiếu hụt, không có
hoặc tăng cường hoạt động enzyme
- Nghiên cứu và ứng dụng điều chế thuốc hoạt động thông qua tương tác với enzyme
- Công cụ thực hành trong CN hóa sinh y học, CN thực phẩm và nông nghiệp
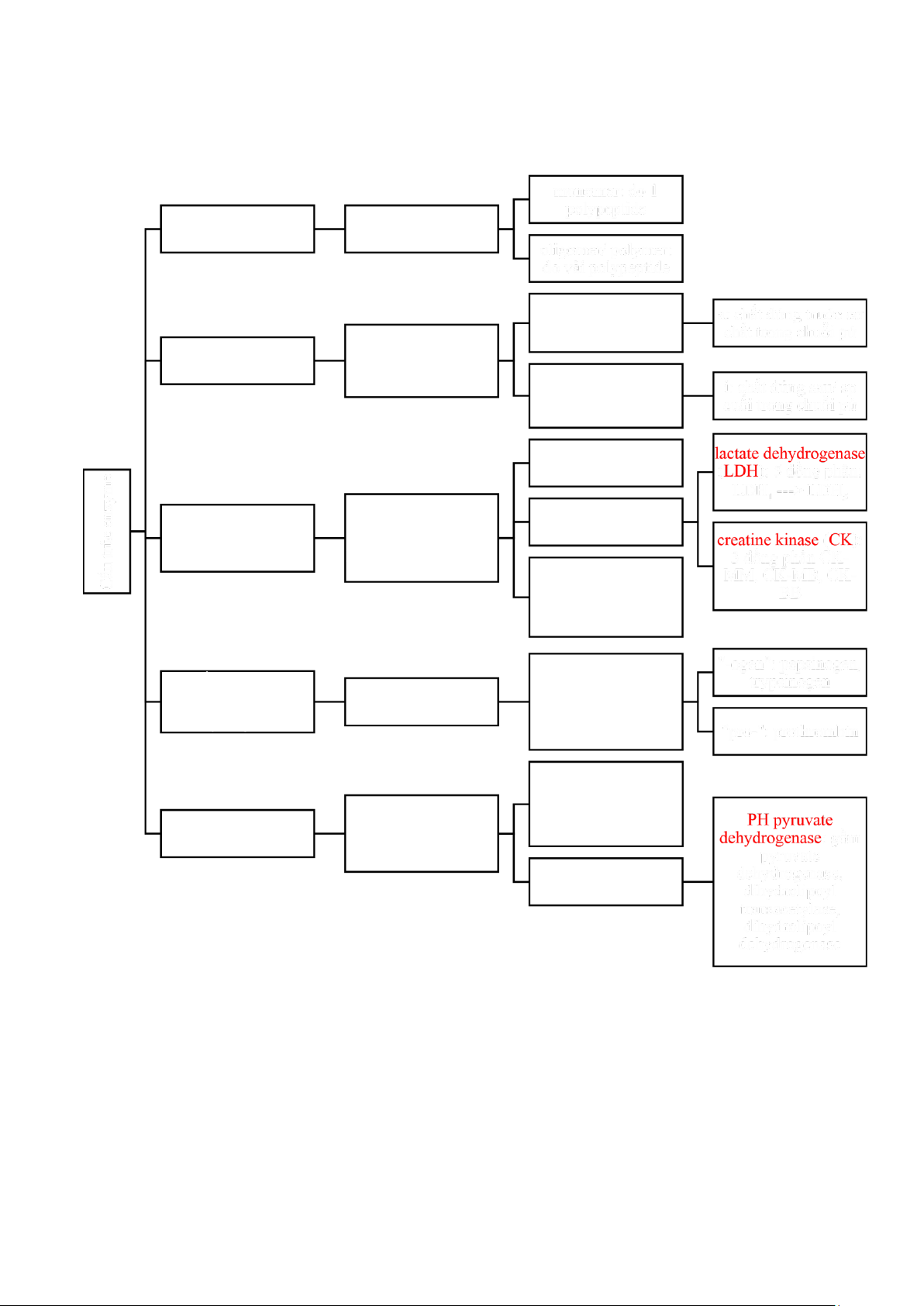
1. Cách gọi tên, bản chất hóa học của enzyme
1. Cách gọi tên và phân loại enzyme 1.1. Gọi tên
+ tên cơ chất + “ase”: urease (phân giải ure), protease (phân giải protein), nucleolase
(phân giải nucleotide), lipase (phân giải lipid), … + tên tác dụng + “ase”: oxidase (pứ
OXH), amino transferase (pứ trao đổi amino acid), decarboxylase (khử CO2), …
+ tên cơ chất + tác dụng + “ase”: lactate dehydrogenase (khử hydro trong lactate),
tyrosin decarboxylase (khử CO2), …
+ tên thường gọi (không theo quy tắc): trypsin, pepsin, chymotrypsin, rubisco, …
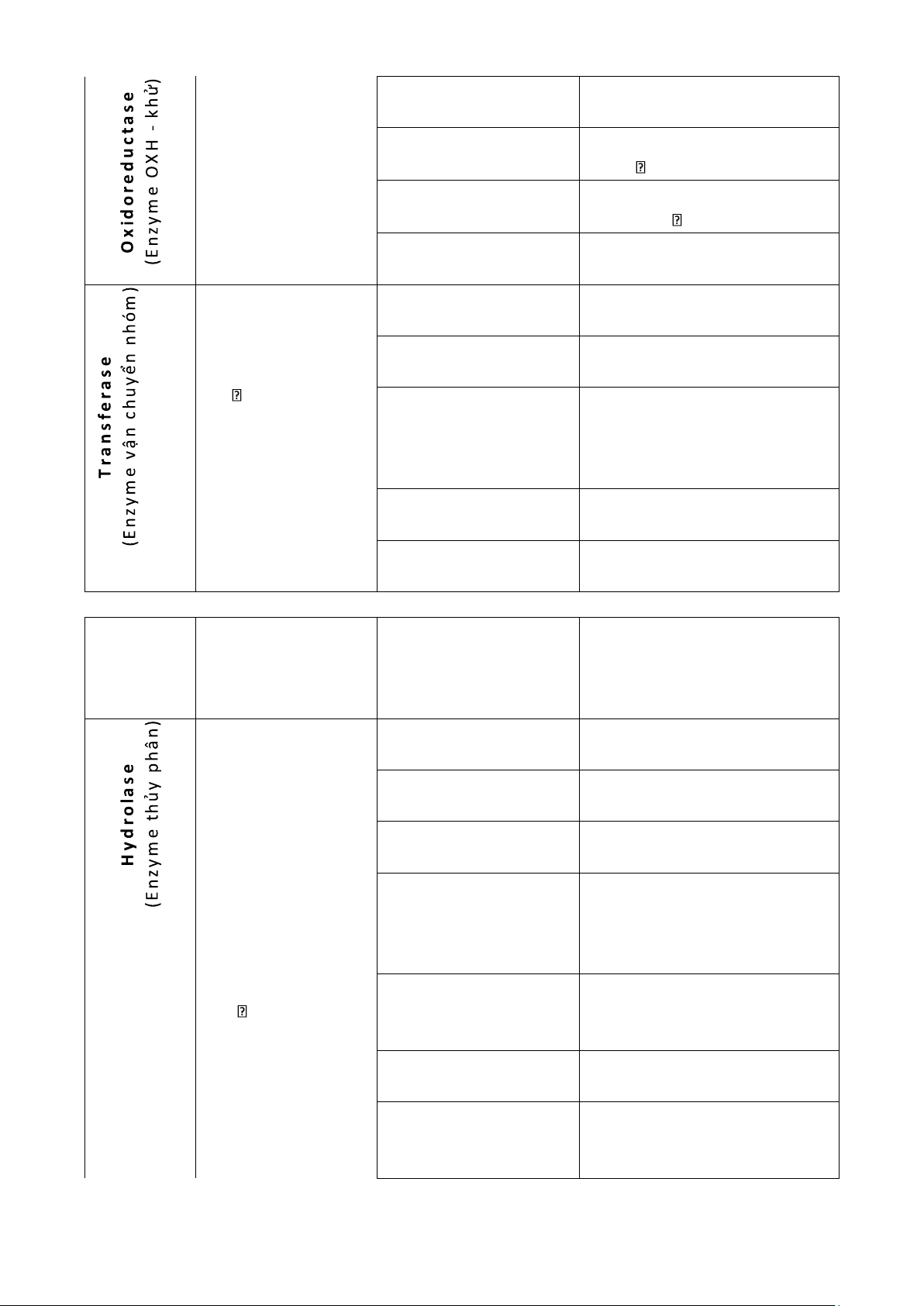
2. Phân loại enzyme theo phân loại quốc tế, phản ứng tổng quát và cho ví dụ mỗi loại 1.2. Phân loại
Chuẩn hóa enzyme, do hiệp hội enzyme quốc tế (Enzyme Commission: EC) thực hiện, dựa trên các yếu tố: (1)Phản ứng chúng (2)Cơ chất tương ứng -
(3)Coenzyme tham gia tham gia - class subclass – sub-subclass
- Enzyme [X: EC a.b.c.d.] nghĩa là: enzyme thuộc loại a, lớp b, nhóm c và số thứ tự trong nhóm d Loại Vai trò Lớp Vai trò
+ Sử dụng các ptu không phải - xúc tác các O phản ứng OXH – khử
2 làm chất nhận điện tử Dehydrogenase + NAD+, FAD, … - có sự trao đổi Hhoặc điện tử (e-): + O A + BH
2 là chất nhận điện tử nhưng 2 B + Oxidase
không tham gia vào thành phần AH2 cơ chất 2 lOMoAR cPSD| 59416725
+ đưa H và điện tử vào cơ chất Reductase + xúc tác phản ứng: Catalase 2H2O2 O2 + 2H2O + xúc tác phản ứng: Peroxidase H2O2 + AH2 A + 2H2O
Oxygenase/ hydroxylase + gắn 1 ngtu O vào cơ chất - xúc tác các phản
+ chuyển nhóm -NH2 từ amino Aminotransferase ứng vận chuyển 1 acid vào keto acid nhóm hóa học (trừ Transketolase &
+ chuyển đvi 2C và 3C vào cơ H) giữa 2 cơ chất: AX transaldolase chất + B A + BX Acyl/methyl/ glucosyl – transferase/
+ chuyển các nhóm tương ứng phosphorylase vào cơ chất + chuyển gốc -PO -3 từ Kinase ATP vào cơ chất Thiolase
+ chuyển nhóm CoA-SH vào cơ chất
+ chuyển các nucleotide từ các nucleotide triphosphate (NTP) Polymerase vào DNA hoặc RNA
+ thủy phân liên kết ester Esterase
+ thủy phân liên kết glycosidic Glucosidase
+ thủy phân liên kết peptide Protease - xúc tác cho phản ứng cắt đứt
+ thủy phân liên kết ester liên kết hóa học = phosphate Phosphatase thủy phân
+ tách gốc -PO -3 khỏi cơ chất - có sự tham gia của H2O: AB +
+ thủy phân liên kết ester H2O AH Phospholipase phosphate trong phospholipid + BOH
+ thủy phân liên kết amide Amidase
+ thủy phân liên kết C-N Deaminase + tách nhóm amino (- NH2) ra khỏi cơ chất lOMoAR cPSD| 59416725 + thủy phân liên kết Nuclease ester phosphate trong DNA/ RNA Decarboxylase + tách CO2 từ cơ chất
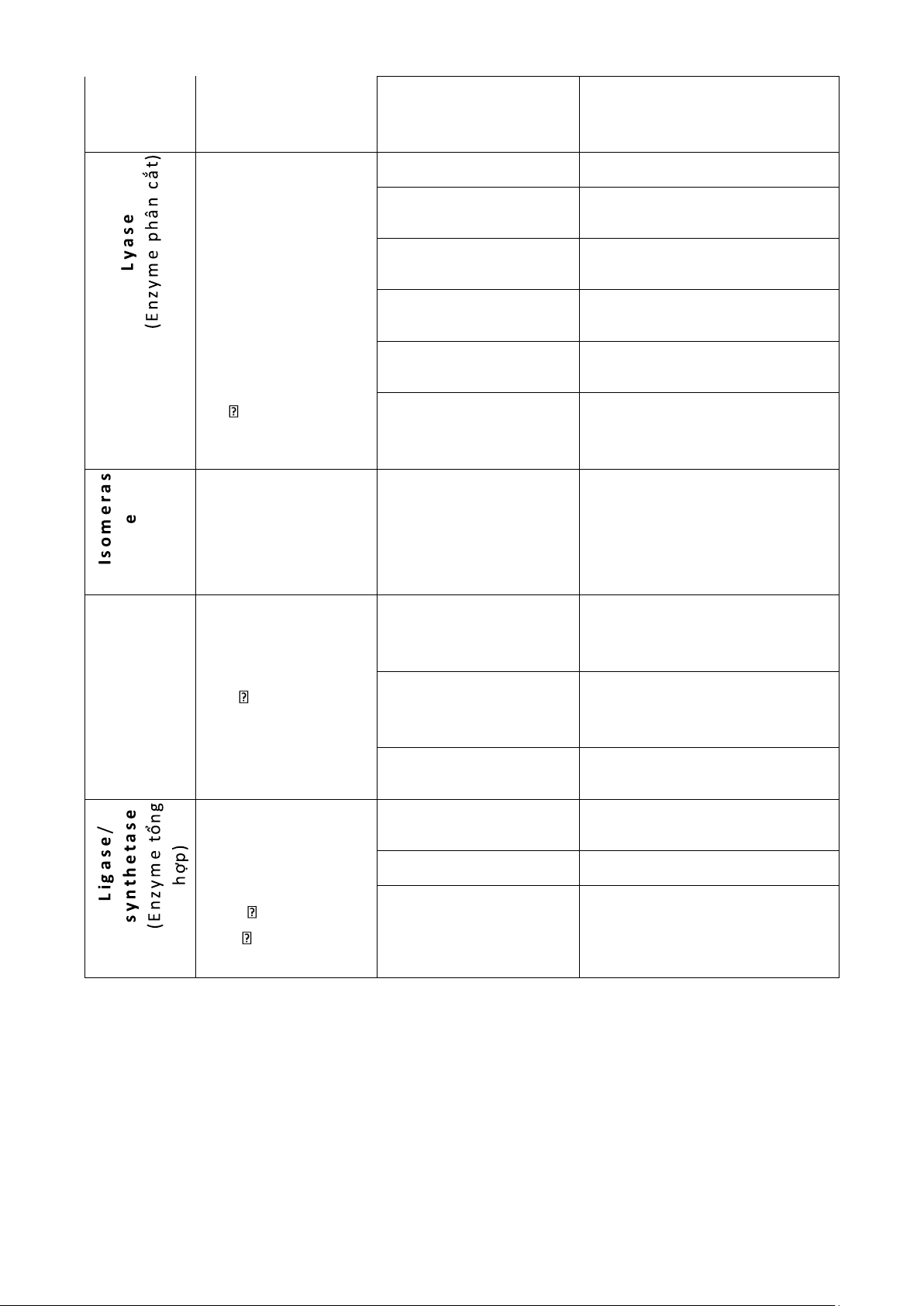
+ tách 1 ptu aldehyde từ cơ chất - các enzyme Aldolase tách nhóm - xúc tác cho
+ tách đôi 1 ptu mà không có Lyase phản ứng chuyển 1 H2O nhóm hóa học khỏi
+ gắn 1 ptu H2O vào cơ chất Hydratase cơ chất - không có sự tham gia của
+ tách 1 ptu H2O khỏi cơ chất Dehydratase H2O: AB A + B
+ gắn 2 ptu mà không có ATP Synthase (không cần năng lượng) - xúc tác cho phản Racemase
+ chuyển dạng đồng phân giữa
ứng biến đổi giữa các dãy D và L đồng phân của chất: (optical isomer)
+ chuyển dạng giữa các ptu có 1 chiral carbon
+ chuyển dạng đồng phân các Epimerase
ptu có nhiều chiral carbons
+ chuyển dạng giữa nhóm ABC ACB Isomerase ketone và aldehyde
+ chuyển nhóm hóa học giữa Mutase các ngtu trong 1 ptu - xúc tác cho phản
+ gắn 2 ptu với nhau có mặt ATP Synthetase ứng gắn 2 ptu thành 1 ptu lớn Carboxylase + gắn CO2 vào cơ chất hơn - có ATP/ GTP: A + B AB
+ gắn 2 đoạn nucleotide với (ATP ADP + P Ligase i) nhau * Lưu ý: 4 lOMoAR cPSD| 59416725
Phân biệt chức năng của các enzyme cùng loại nhưng khác lớp: Transferase Isomerase Synthetase Phosp horylase Ki nase chuyển nhóm chuyển nhóm P tự do vào P từ chất hữu Isomerase Mutase Synthetase Synthase i phân tử i cơ vào phân tử tổng hợp cần tổng hợp chuyển loại có ATP không cần nhóm chức chuyển vị trí ATP nhóm chức
3. Thành phần cấu tạo, cấu trúc, trung tâm hoạt động của enzyme
2. Một số đặc tính của phân tử enzyme
2.1. Cấu tạo và cấu trúc enzyme
* Đơn vị: Dalton (Da/ đvC/ u): đơn vị đo khối lượng nguyên tử 1 Da = 1/12 C12 Da -
Cấu tạo: protein, thường từ 12.000 – hàng triệu Da - Thành phần:
+ Cofactor: là các chất phối hợp với enzyme, bổ sung khả năng phản ứng và khả năng xúc tác cho phân tử enzyme
• Coenzyme: các cofactor hữu cơ, thường là vitamin và dẫn xuất của chúng, có
trong các enzyme OXH – khử hoặc enzyme vận chuyển nhóm
• Ion kim loại: các ion vô cơ, đóng vai trò: tham gia trực tiếp vào phản ứng xúc tác,
hoạt động như 1 chất oxh-khử, tạo phức hợp với cơ chất
• Nhóm phụ (prosthetic group): các cofactor gắn chặt vào phân tử, không thể tách ra
+ Các enzyme có chứa kim loại/ cần kim loại để hoạt động gọi là enzyme kim loại (metalloenzyme) enzyme enzyme enzyme tạp thuần (holoenz yme ) chỉ có am ino không có chất cộng acid coenzyme amino acid tác ( apoenzyme ) ( cofactor ) amylase, protease coenzym e ion kim loại ( Fe 2+ , Cu 2+ ,...) lOMoAR cPSD| 59416725
2.2. Trung tâm hoạt động và tính đặc hiệu cơ chất
- Trung tâm hoạt động (active site): + vùng đặc biệt của enzyme
+ nơi gắn với cơ chất để phản ứng
+ có thể có 1 hoặc vài trong 1 enzyme
+ gồm những nhóm hóa học hoặc liên kết tiếp xúc trực tiếp hoặc không trực tiếp với cơ chất
- Cấu tạo trung tâm hoạt động: bao gồm các amino acid có các nhóm có hoạt tính cao: có
khả năng tạo liên kết hydro/ ion với cơ chất: + serine (Ser): -OH (hydrogen + lysine (Lys): ε-NH + 3 (ionic bond) bond) + histidine (His): imidazole+ + cysteine (Cys): -SH (ionic bond) (disulfide bridge) + tryptophan (Trp): indole+
+ glutamic acid (Glu): γ-COO- (ionic bond) (ionic bond)
- Trung tâm hoạt động dẫn đến tính đặc hiệu cơ chất của enzyme
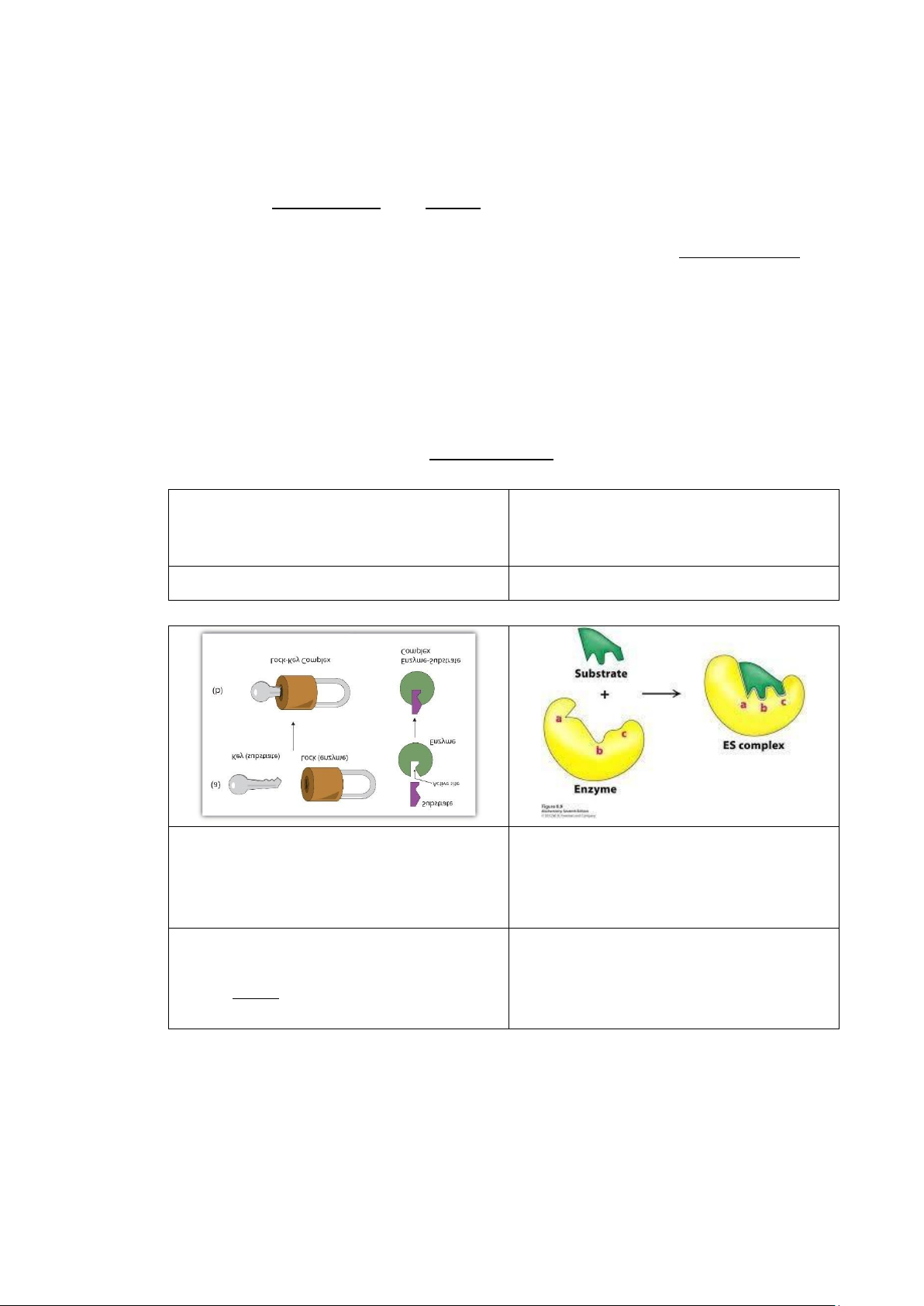
- Có 2 giả thuyết được đưa ra để diễn tả mối quan hệ giữa enzyme và cơ chất:
Thuyết “mô hình cảm ứng không gian”
Thuyết “ổ khóa và chìa khóa” (lock and (induced fit theory) key theory) Emil Fischer Koshland -
active site có tính mềm dẻo và
- active site có cấu trúc chỉ khớp được với linh hoạt cơ chất của nó -
có thể biến đổi cấu trúc không
gian để phù hợp với cơ chất -
giải thích được tính đặc hiệu tuyệt -
giải thích được tính đặc hiệu đối tương đối -
không giải thích được tính đặc hiệu -
được đa số các tác giả hiện nay tương đối chấp nhận 6 lOMoAR cPSD| 59416725
4. Trung tâm dị lập thể enzyme, ý nghĩa trong chuyển hóa chất
5. Isoenzyme, phức hợp đa enzyme, cho ví dụ
2.3. Các dạng cấu trúc của phân tử enzyme
6. Bản chất hóa học các coenzyme, ví dụ một số coenzyme và vai trò của chúng
3. Cấu trúc và chức năng của các coenzyme - Chức năng:
+ tham gia cùng enzyme trong quá trình xúc tác do ái lực giữa enzyme
– coenzyme giống ái lực giữa enzyme – cơ chất
+ gắn đồng hóa trị với enzyme, tạo ra trung tâm hoạt động cho enzyme trong xúc tác pứ
- Coenzyme thường được tổng hợp từ vitamin nhóm B - Phân loại coenzyme: lOMoAR cPSD| 59416725
Hậu quả thiếu hụt Coenzyme Vai trò Vitamin vitamin NAD+ (nicotinamide adenine dinucleotide)
Trao đổi 2 điện tử và 1 Niacin NADP+ Pellagra H+ (vitamin B3) (nicotinamide adenine dinucleotide phosphate) FMN (flavin mononucleotide
Trao đổi 2 điện tử và 2 Riboflavin (vitamin ) Cheilosis H+ ở vòng isoalloxazine B2) FAD (flavin adenine nucleotide) Heme
Trao đổi điện tử nhờ: Fe2+ ⇌ (porphyrin Fe2+) Fe3+ + e Lipoic acid
Khử CO2 khỏi pyruvic acid và α-keto glutaric acid TPP Beriberi Thiamin (thiamine Tách nhóm CO2 (do ứ đọng pyruvic (vitamin B pyrophosphate) 1) acid) Pantothenic acid Coenzyme A (CoA- Vận chuyển nhóm acyl (vitamin B SH) 5) Cao huyết áp S- Vận chuyển nhóm -CH adenosylmethionine 3 (methyl) FH4 Thiếu máu Vận chuyển nhóm 1 Folic acid (tetrahydrofolat Dị tật ống thần carbon (vitamin B e) 9) kinh Phát ban lông mày, Vận chuyển nhóm Biotin (vitamin Biotin đau cơ, mệt carboxyl B7) Trầm cảm, nhầm Pyridoxine (vitamin
Pyridoxal phosphate Vận chuyển -NH2 (amin) lẫn, co giật B6) 5’- Vận chuyển nhóm Cobalamine Thiếu máu (ác methyl tính) deoxyadenosy
Sắp xếp lại nội tuyến (vitamin B Nhiễm toan l cobalamine 12) methylmalonic 8 lOMoAR cPSD| 59416725
7. Cơ chế hoạt động xúc tác phản ứng của enzyme
4. Cơ chế xúc tác của enzyme
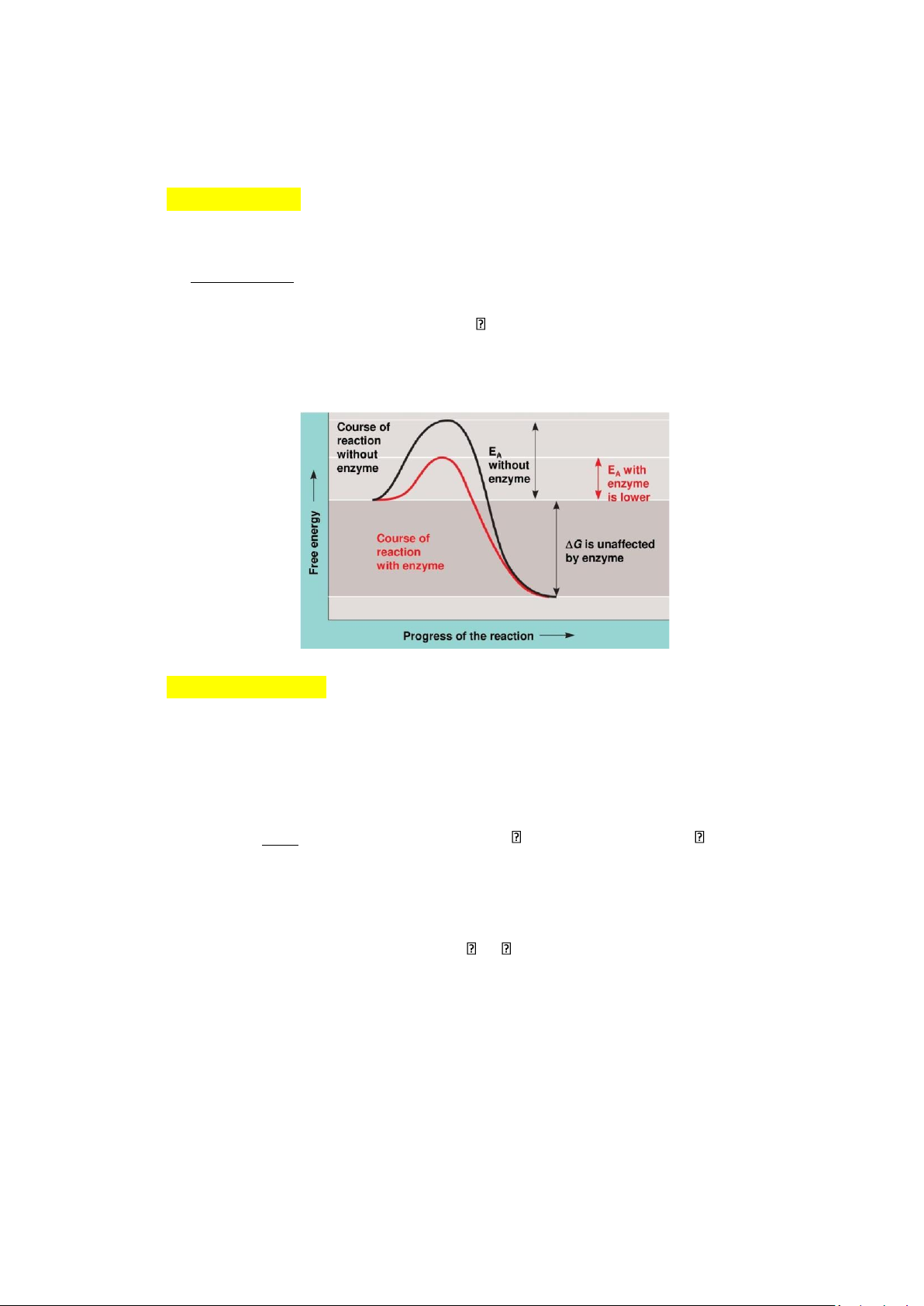
4.1. Sự biến thiên năng lượng tự do (ΔG) và năng lượng hoạt hóa (Ea)
- Năng lượng tự do (G): năng lượng có thể tạo ra công có ích
+ phản ứng xảy ra khi ΔG < 0
- Trong phản ứng hóa học thông thường, ngay cả khi ΔG < 0, phản ứng vẫn chưa thể xảy ra do sức ỳ hóa học:
• entropy (S): phản ứng xảy ra theo chiều giảm sự hỗn loạn của các ptu trong hệ
• môi trường: lớp áo nước gây cản trở mất hoạt tính của cơ chất
• cấu trúc: hình thể không gian cồng kềnh của cơ chất
• chức năng: sự sắp xếp chưa định hướng của các nhóm chức trong ptu enzyme
- Phản ứng xảy ra khi năng lượng tự do ΔG < 0 và năng lượng hoạt hóa
Ea > sức ỳ hóa học
- Năng lượng hoạt hóa (Ea): năng lượng cần thiết để nâng 1 mol cơ chất lên trạng thái
chuyển tiếp (transition state) ở đỉnh hàng rào năng lượng
(tại nhiệt độ nhất định) để phản ứng có thể xảy ra
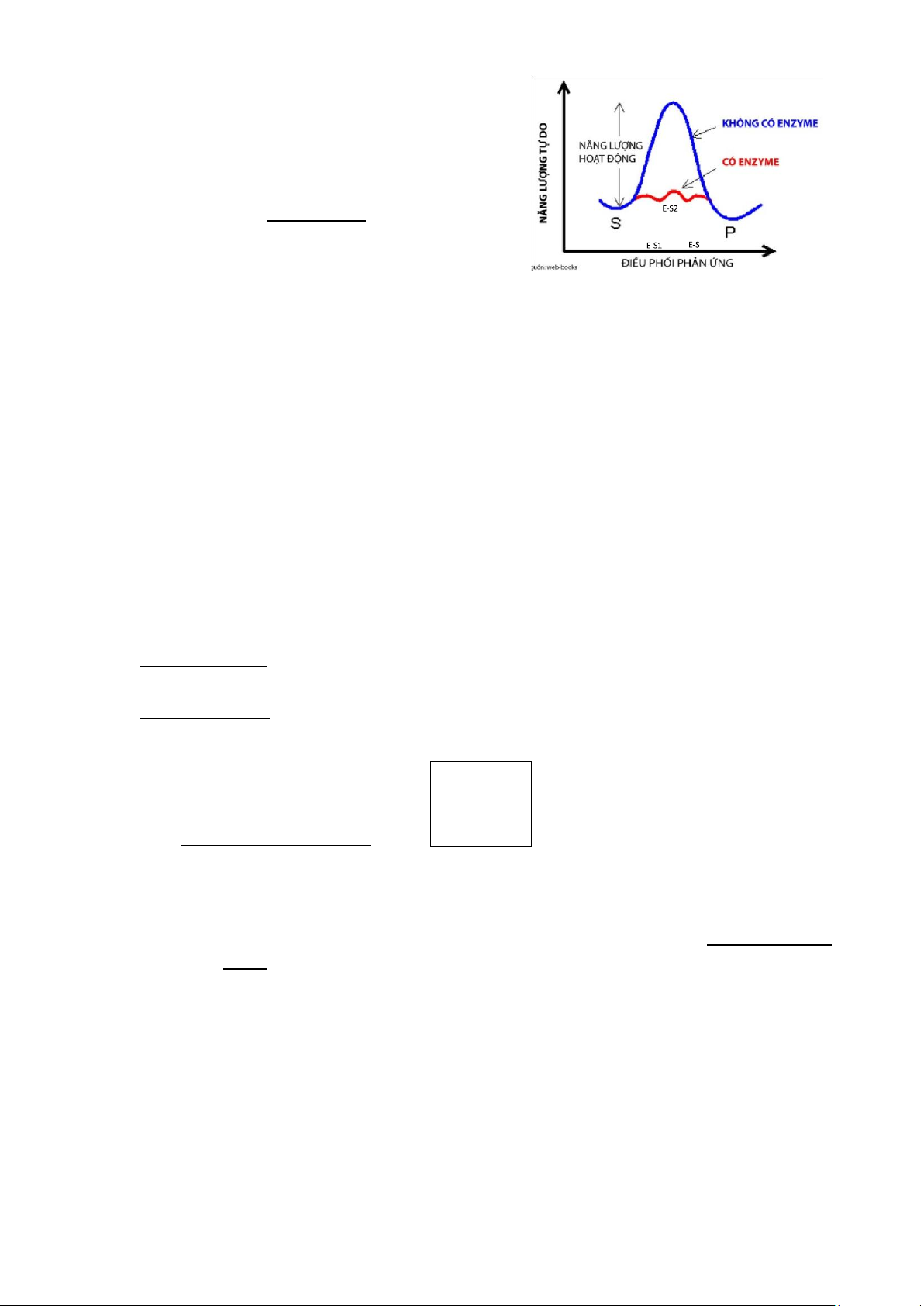
4.2. Cơ chế tác dụng của enzyme
- Enzyme làm giảm Ea của phản ứng để cơ chất trạng thái chuyển tiếp sản phẩm 1 cách dễ dàng hơn
- Enzyme thực hiện điều đó bằng cách tạo ra phức hợp enzyme-cơ chất – trạng thái
chuyển tiếp có mức năng lượng hoạt hóa thấp hơn nhiều so với ban đầu: E + S ES E + P (a) (b)
Với: +) E = enzyme; S = substrate; ES = enzyme-substrate complex; P = product lOMoAR cPSD| 59416725
+) (a) phản ứng liên phân tử (b) phản ứng nội phân tử
- Các cách thức làm tăng Vpứ của enzyme:
+ xúc tác acid-base nói chung: các chất cho và
nhận proton được định vị đúng vị trí
+ xúc tác đồng hóa trị: trạng thái chuyển tiếp không ổn định ES ES
+ xúc tác ion kim loại: cho và nhận e
+ tác động điện: “căng giãn orbital” của Koshland, phá vỡ nhân thơm
- Cơ chế tác dụng của enzyme:
o Các tương tác yếu giữa cơ chất và enzyme tại active site
(hydro, ionic, hydrophobic) giải phóng ΔG o Hình thành phức hợp ES thông qua
trạng thái chuyển tiếp E-
S1* o ΔG tiếp tục hoạt hóa phức hợp ES lên trạng thái chuyển tiếp E-
S2*, E-S3*… o Với Ea thấp, phức hợp dễ dàng được hoạt hóa để tạo ra sphẩm và enzyme tự do
8. Đơn vị quốc tế đo hoạt độ enzyme
5. Động học enzyme
5.1. Tốc độ phản ứng và đơn vị đo
- Hoạt độ enzyme : lượng enzyme làm biến đổi 1 µmol cơ chất thành sản phẩm trong 1
phút ở 25oC và các điều kiện chuẩn khác o + đơn vị: IU (international units)
- Tốc độ phản ứng : lượng cơ chất biến đổi dưới tác dụng của enzyme trong 1 phút ở 25oC
và các điều kiện chuẩn khác ∆ v= ∆
+ tốc độ phản ứng ban đầu (Vinitial):
• Là tốc độ pứ enzyme ở khoảng thời gian đầu của phản ứng
• Khi tốc độ chưa bị ảnh hưởng bởi sự thay đổi của T, pH, [C], …
• Tăng lên 1 cách tuyến tính ban đầu (proportional) sau đó k tăng tuyến tính nữa
• Chỉ tại Vintial, hoạt độ enzyme mới được đo chính xác (~5 phút) + tốc độ phản ứng tối đa (Vmax):
• Khi các phân tử enzyme đều bão hòa cơ chất, tốc độ phản ứng đạt mức tối đa
• Enzyme là nhân tố giới hạn (limiting factor)
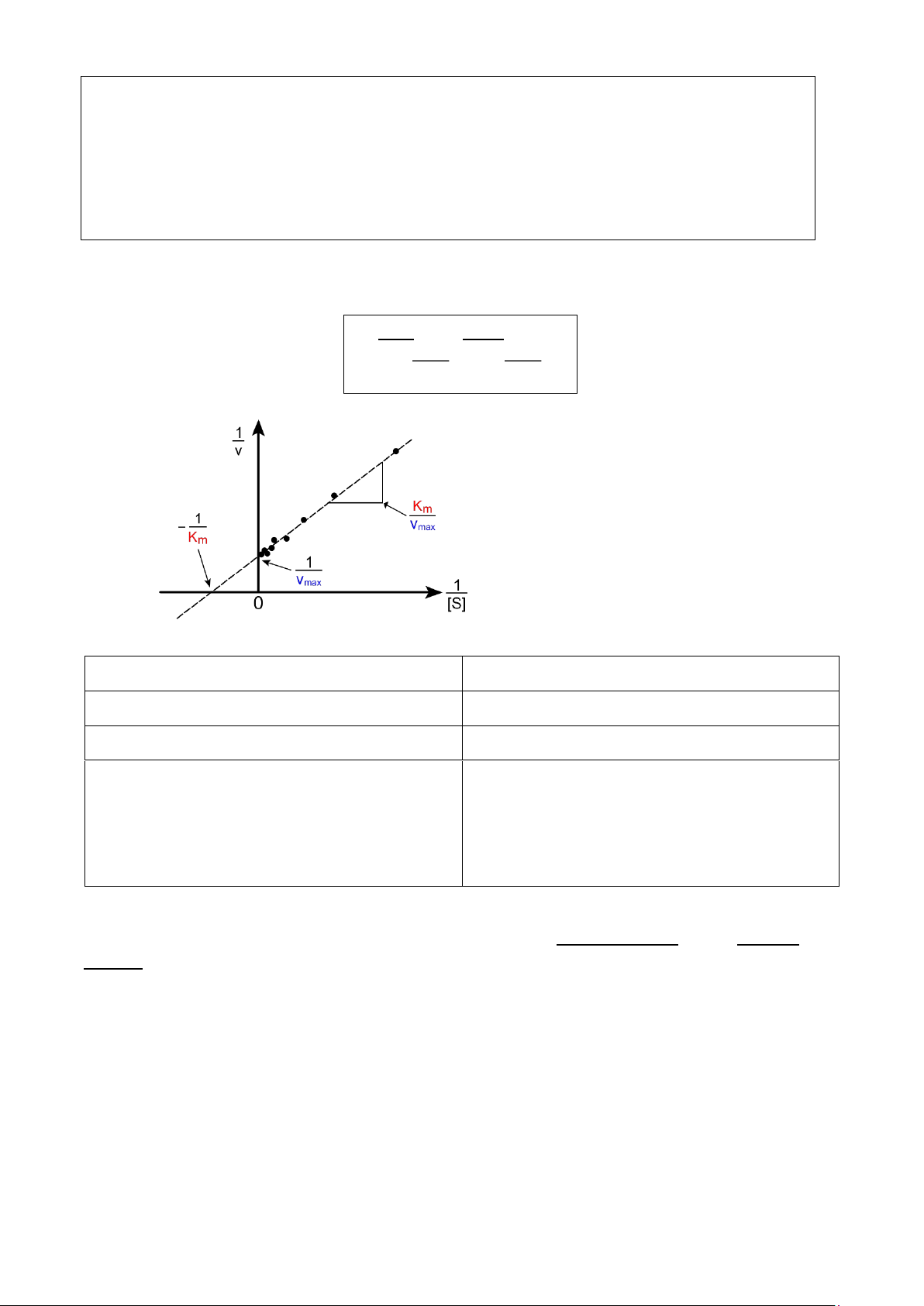
9. Phương trình và đồ thị Michaelis-Menten, ý nghĩa Km
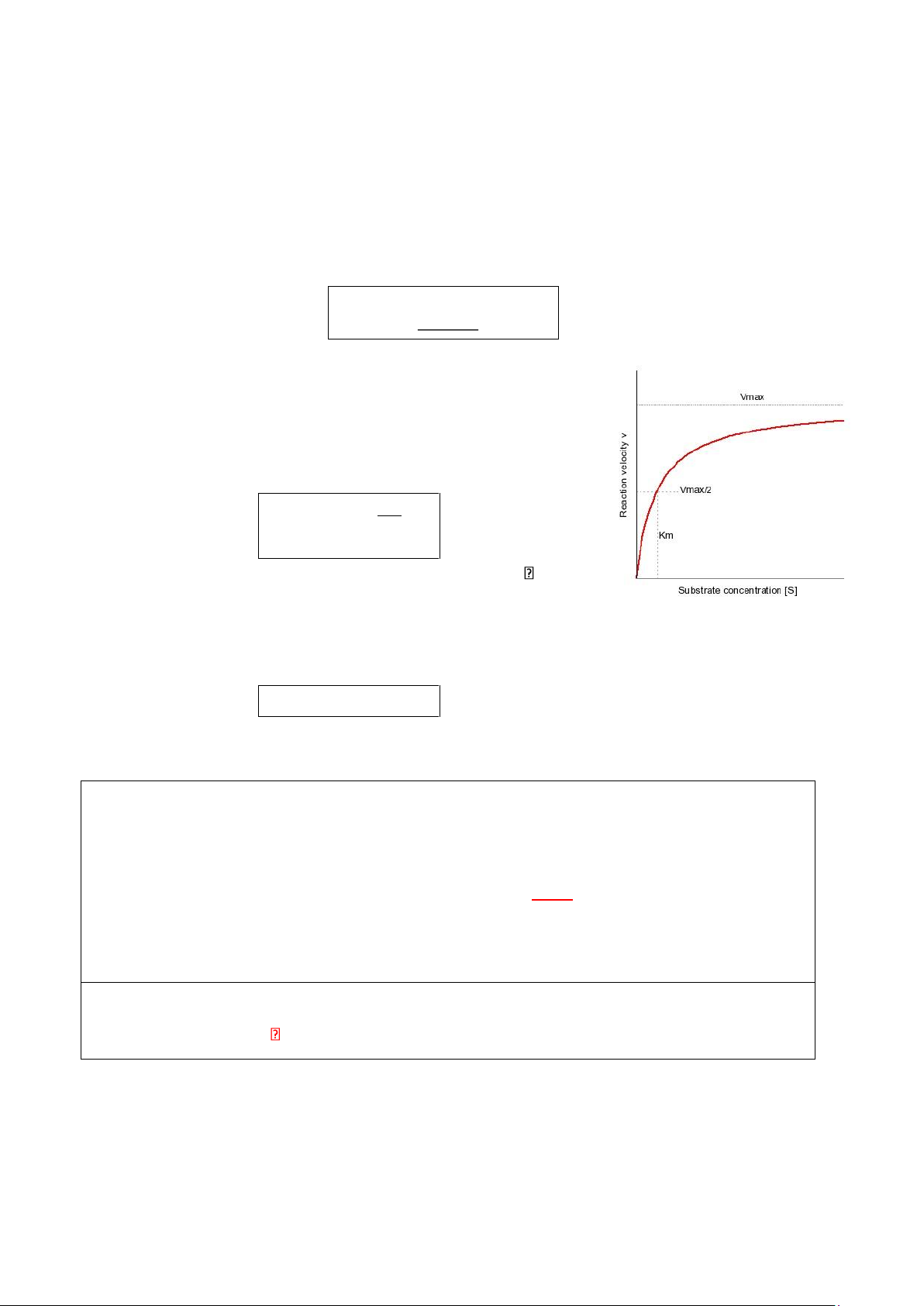
5.2. Thuyết Michaelis-Menten
- Thuyết Michaelis – Menten: vai trò của nồng độ cơ chất [S] trong việc hình thành phức hợp enzyme-cơ chất ES 10 lOMoAR cPSD| 59416725
- Mối quan hệ giữa enzyme, cơ chất và sản phẩm phản ứng được thể hiện bằng phương trình: k1 k2
- E + S <-----> ES -----> E + P k-1
- Từ giả thuyết Michaelis, ta có công thức thể hiện mối quan hệ giữa tốc độ phản ứng và
nồng độ cơ chất như sau: [S] V = (1 Vmax K m+[S] )
Với: V = tốc độ phản ứng/ Vmax = tốc độ tối đa
[S] = nồng độ cơ chất
Km = hằng số Michaelis của enzyme với cơ chất +) [S] << Km
- [S] không đáng kể, vì vậy phương trình (1) trở thành: [S] V (2 = Vmax Km )
- Phản ứng (2) là phản ứng động học bậc 1, và V [S] +) [S] >> Km
Đồ thị Michaelis-Menten -
Km không đáng kể, vì vậy phương trình (1) trở thành: (3 V = Vmax )
- Phản ứng (3) là phản ứng động học bậc 0, và việc tăng V chỉ phụ thuộc vào [E] chứ không phụ thuộc vào [S]
* Ý nghĩa giá trị Km:
+ Km (mmol/l): hằng số tổng hợp của các hằng số tốc độ, và Km = [S]V = ½ Vmax
+ Km là hằng số đặc trưng cho mỗi enzyme => thể hiện ái lực của enzyme với cơ chất -
Km càng nhỏ, ái lực càng lớn (cần [S] nhỏ để V = ½Vmax) -
Km càng lớn, ái lực càng nhỏ (cần [S] lớn để V = ½ Vmax)
+ Để đạt được Vmax, [S] 100 lần Km lOMoAR cPSD| 59416725
* Ý nghĩa giá trị Vmax:
+ Vmax: thể hiện số vòng quay (turnover number) của 1 enzyme
+ K2 (hằng số động học): số vòng quay = số phân tử cơ chất được biến đổi thành sản phẩm
trong 1 đơn vị thời gian, khi enzyme đã được bão hòa đầy đủ với cơ chất
10. Phương trình và đồ thị Lineweaver-Burk, ý nghĩa đồ thị -
Phương trình Lineweaver – Burk: 1 Km 1 1 (4 = . + ) V Vmax [S] Vmax Đồ thị Lineweaver-Burk
- So sánh giữa phương trình và đồ thị Michaelis – Menten và Lineweaver – Burk: Michaelis-Menten Lineweaver-Burk Đồ thị hyperbol Đồ thị tuyến tính Khó xác định Vmax, Km
Có thể xác định Vmax, Km
Áp dụng tốt trên thực nghiệm để xác định:
+ pH – nhiệt độ tối ưu
Chỉ mang tính chuẩn xác trên lý thuyết
+ chất ức chế cạnh tranh/ không cạnh tranh đối với enzyme
6. Các yếu tố ảnh hưởng đến hoạt động của enzyme
Trong thực nghiệm lâm sàng, người ta thường sử dụng hoạt độ enzyme thay vì nồng độ
enzyme để nghiên cứu và chẩn đoán do lượng enzyme trong huyết thanh thường rất ít.
Trong nghiên cứu, tốc độ phản ứng của enzyme thường được đánh giá qua các yếu tố sau: + nồng độ cơ chất [S] + pH môi trường + chất ức chế (inhibitor) + nồng độ enzyme [E] + chất hoạt hóa (activator) + nhiệt độ 12 lOMoAR cPSD| 59416725
6.1. Nồng độ cơ chất [S]
- Khi nồng độ enzyme [E] giữ nguyên, nếu nồng độ cơ chất [S] tăng thì tốc độ phản ứng
tăng cho đến khi enzyme bão hòa
- Thể hiện qua phương trình và đồ thị Michaelis – Menten
6.2. Nồng độ enzyme [E]
- Khi nồng độ cơ chất [S] giữ nguyên, nếu nồng độ enzyme [E] tăng thì tốc độ phản ứng tăng
- Giá trị Km không đổi khi thay đổi nồng độ enzyme [E]
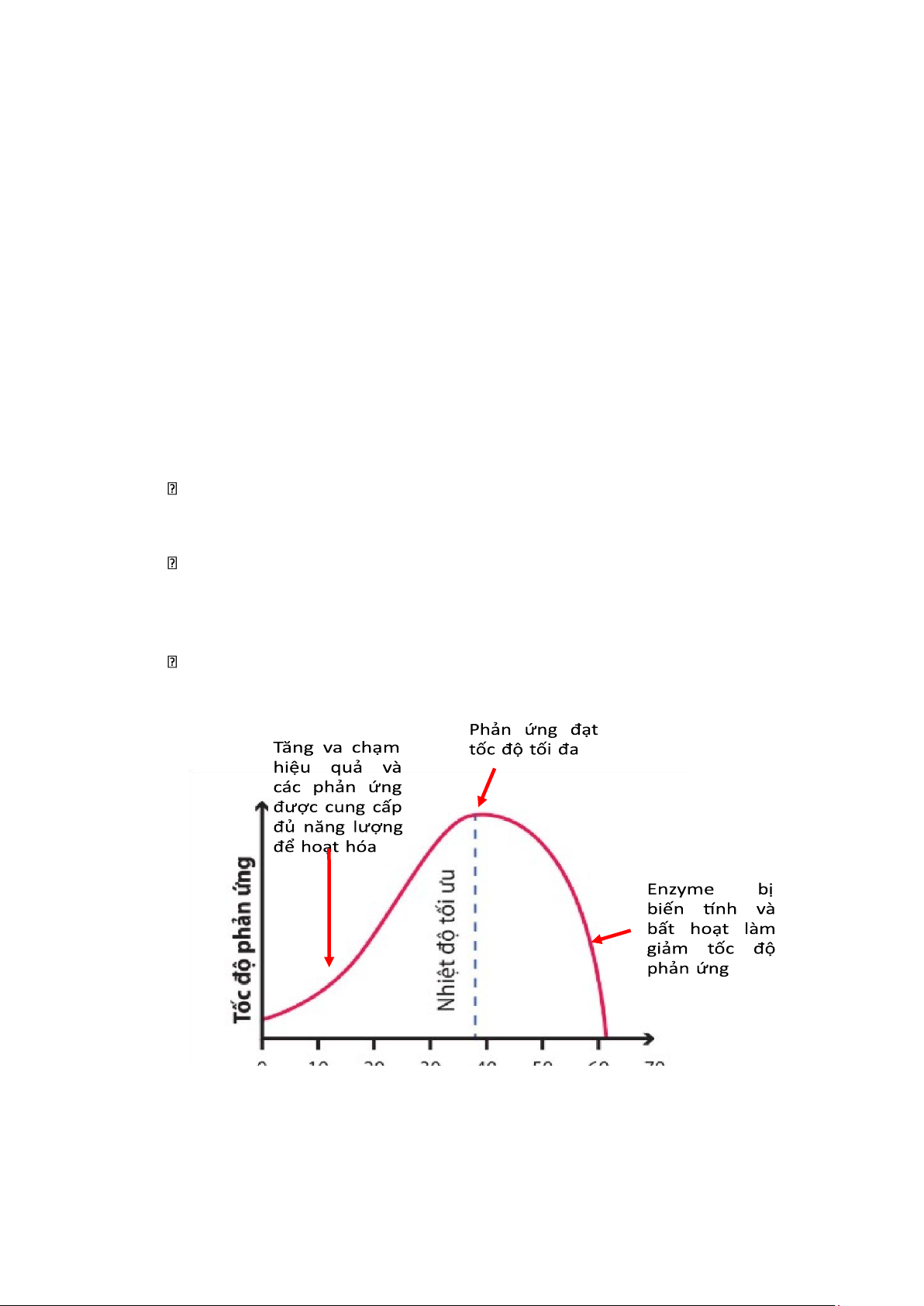
11. Ảnh hưởng của nhiệt độ và pH đến hoạt động của enzyme, ví dụ pH hoạt động tối ưu của 1 số enzyme 6.3. Nhiệt độ
- Khi tăng nhiệt độ dần lên mức nhiệt độ tối ưu của enzyme, tốc độ phản ứng tăng và
thường tăng gấp 2 lần mỗi khi tăng 10oC.
Hệ số nhiệt độ (temperature coefficient) Q10 = 2
- Khi tăng nhiệt độ vượt quá mức nhiệt độ tối ưu, enzyme bắt đầu biến tính và mất dần
khả năng xúc tác của nó
Trong lâm sàng, các mẫu huyết tương được đông lạnh trước khi nghiên cứu
- Một số vi khuẩn sống ở môi trường có điều kiện khắc nghiệt (suối nước nóng, đáy biển
nóng) có chứa enzyme rất bền với nhiệt (75-80oC): Taq DNA polymerase, Tli DNA
polymerase, Pfu DNA polymerase, Tth DNA polymerase, Tma DNA polymerase, …
Được sử dụng cho phản ứng chuỗi polymerase (polymerase chain reaction – PCR) lOMoAR cPSD| 59416725 6.4. pH môi trường
- Thay đổi pH có thể gây biến tính enzyme, do các ion mang điện tích trong dung dịch làm
ảnh hưởng đến trạng thái ion hóa của enzyme
Biến đổi cấu trúc/ thay đổi điện tích trên các gốc amino acid ở active site
- Enzyme trong cơ thể thường hoạt động trong khoảng pH từ 7 – 8, một số enzyme đặc
biệt hoạt động trong môi trường đặc biệt (pepsin (pH 2 – 4), trypsin (pH 8 – 10))
- Trong thí nghiệm, hoạt độ enzyme được kiểm soát ở pH tối ưu bằng các dung dịch đệm
(buffer solution) thích hợp
6.5. Chất hoạt hóa
- Các chất hoạt hóa enzyme có vai trò:
+ tăng tốc độ phản ứng enzyme
+ hoạt hóa enzyme từ trạng thái không hoạt động sang hoạt động
- Các chất hoạt hóa thường là ion (Ca2+, Fe2+, Mg2+, Mn2+, Zn2+, K+, Cl-, Br-) hoặc coenzyme (NAD+, FAD)
- Cơ chế hoạt động của các chất hoạt hóa:
• Tạo vị trí hoạt động (+) để tác động lên nhóm điện tích (-) của cơ chất
• Làm thay đổi cấu trúc không gian của cơ chất
• Làm ổn định cấu trúc bậc 3 và 4 của phân tử enzyme
• Làm enzyme dễ gắn với cơ chất hơn
• Liên kết cơ chất với enzyme hoặc coenzyme Tạo ra sự oxi hóa hoặc sự khử 6.6. Chất ức chế
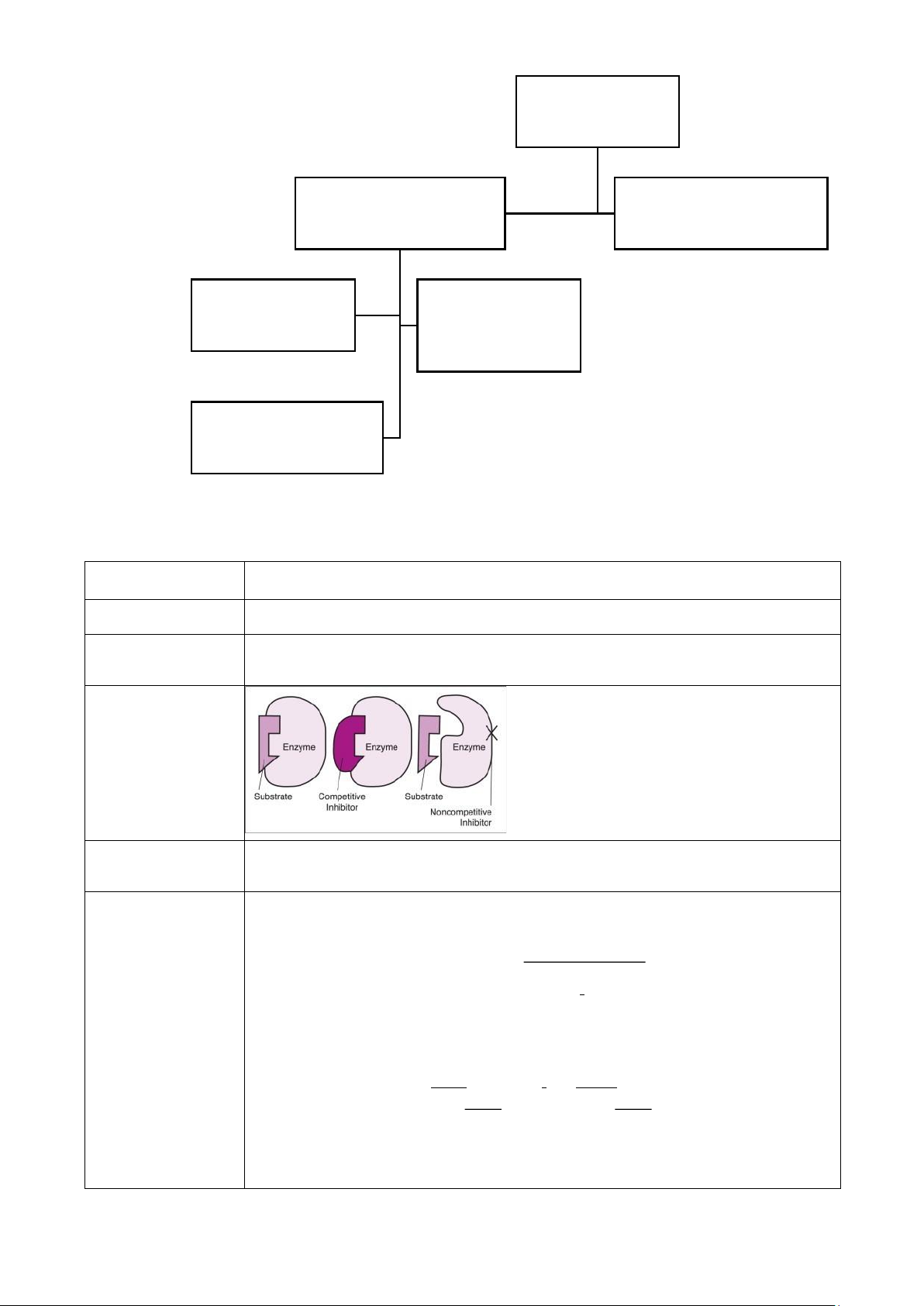
- Các chất ức chế giúp làm giảm hoặc mất hoạt tính của những enzyme nhất định
VD: aspirin (acetylsalicylate) - ức chế enzyme trong tổng hợp prostaglandin
(gây ra đau) - Phân loại: 14 lOMoAR cPSD| 59416725 Chất ức chế ( inhibitor ) Ức chế thuận nghịch Ức chế không thuận nghịch ( reversible inhibition ) ( irreversible inhibition ) Ức chế cạnh tranh Ức chế không ( competitive cạnh tranh inhibitor) ( uncompetitive inhibitor) Ức chế không cạnh tranh hỗn hợp ( mixed inhibitor )
12. Ảnh hưởng của các chất ức chế cạnh tranh đến hoạt động của enzyme, đặc điểm loại ức chế này 6.6.1.
Ức chế thuận nghịch
Ức chế cạnh tranh Chất ức chế
Chất có cấu trúc tương tự như cơ chất của enzyme Vị trí tác động
Trung tâm hoạt động (active site)
+ phức hợp EI hình thành thay vì ES
+ không có sự xúc tác xảy ra Cơ chế Ảnh hưởng
Cơ chất S cạnh tranh ngược lại với chất ức chế I khi tăng [S]
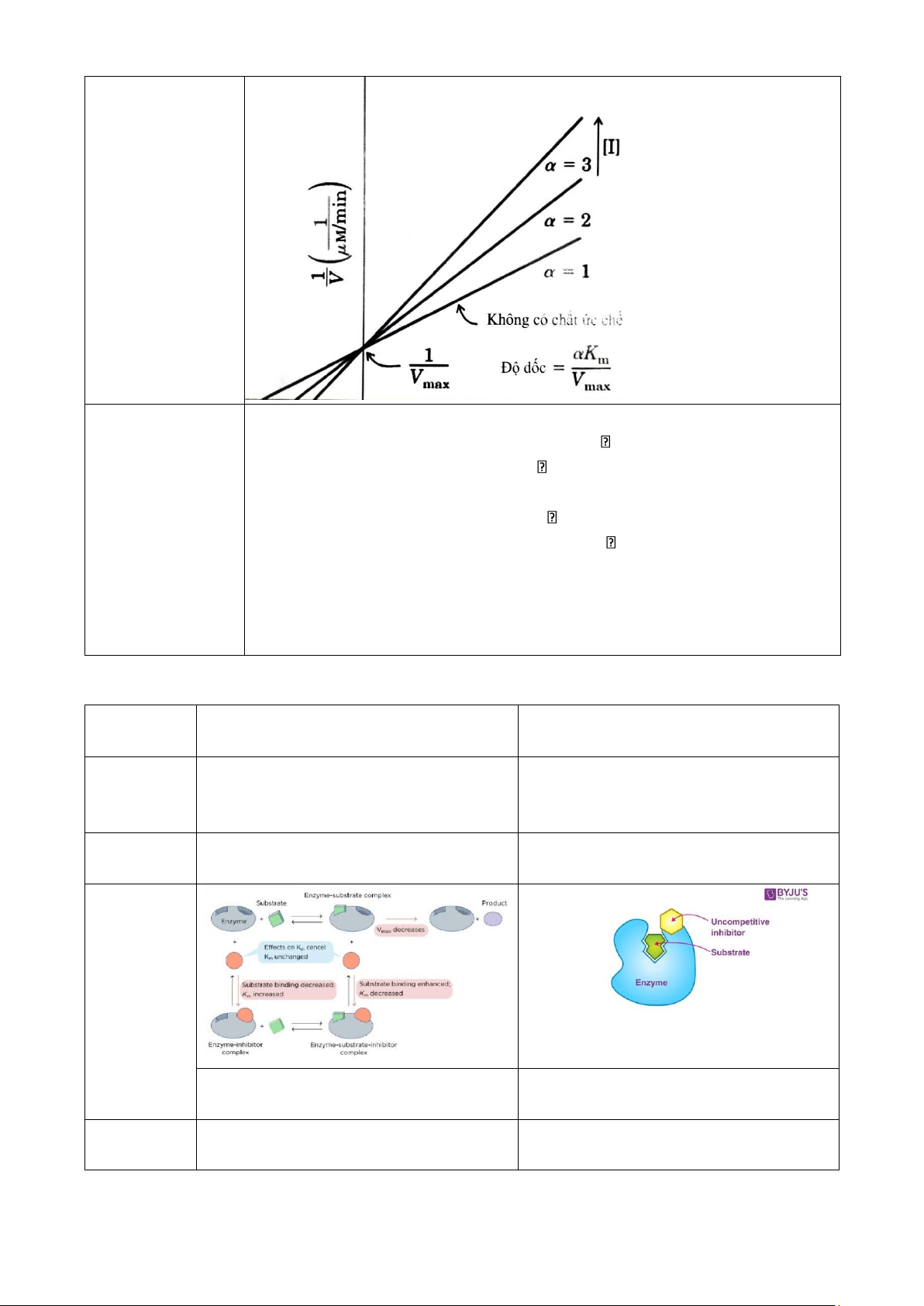
Phương trình & đồ + Michaelis-Menten: thị [S]
V = Vmax Km(1+K[ II])+[S] (5) + Lineweaver-Burk: 1 Km [I] 1 1 = (1+ ) . + (6 V Vmax KI [S] Vmax )
+ Vmax không đổi nhưng Km tăng do [S] tăng 15 lOMoAR cPSD| 59416725
+ điều trị ngộ độc methanol:
• Alcohol dehydrogenase chuyển methanol formaldehyde
• Ethanol cạnh tranh với methanol acetaldehyde => truyền chậm
ethanol trong tĩnh mạch + điều trị bệnh gout:
• Xanthine oxidase chuyển xanthine uric acid (urate tích tụ gây bệnh) Ví dụ lâm sàng
• Thuốc Allopurinol cạnh tranh với xanthine ngăn qtrinh tạo urate
13. Ảnh hưởng của các chất ức chế không cạnh tranh đến hoạt động của enzyme, đặc điểm loại ức chế này
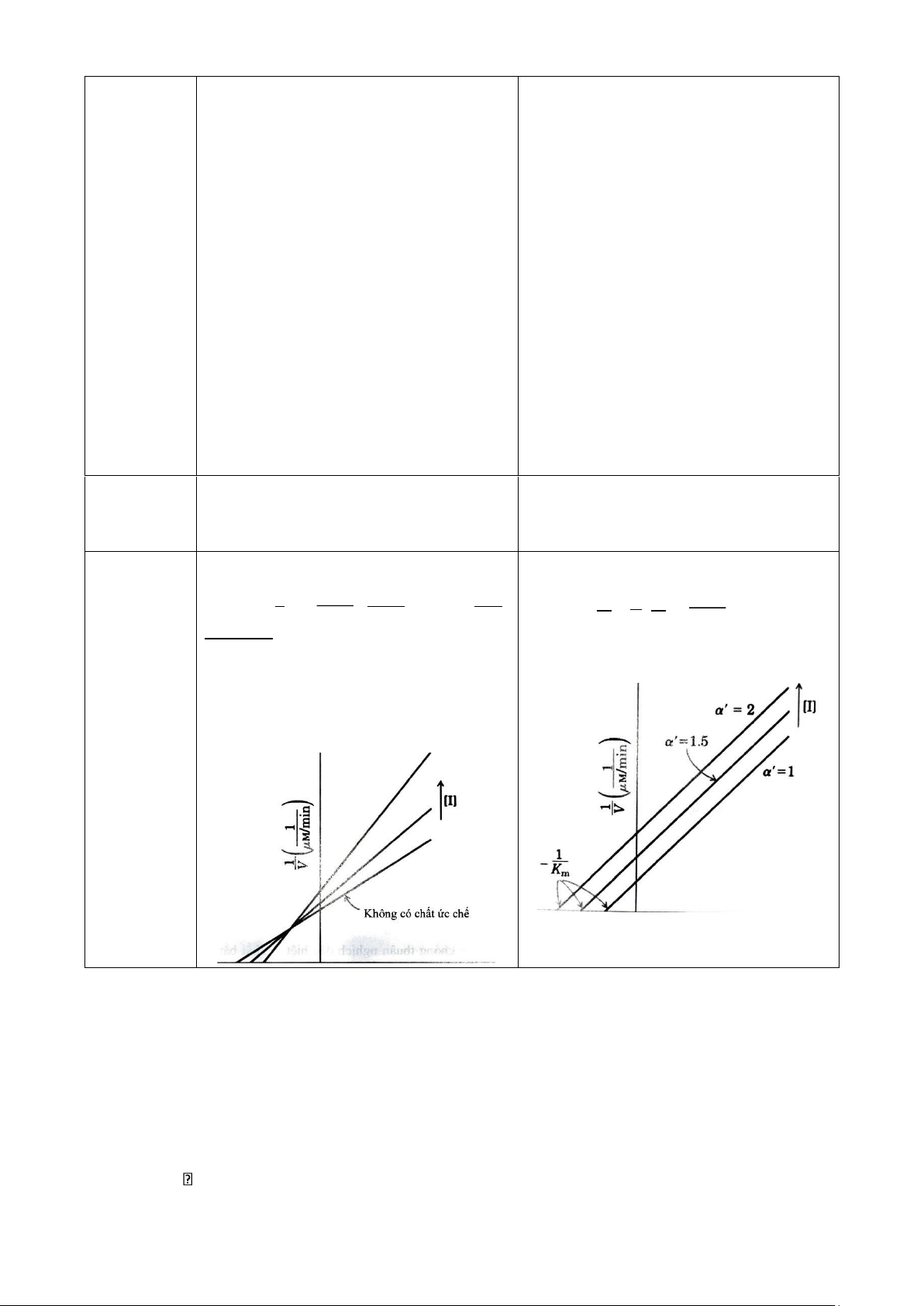
Ức chế không cạnh tranh hỗn hợp
Ức chế không cạnh tranh
Chất gắn vào vị trí dị lập thể của cả
Chất gắn vào phức hợp ES để ngăn xúc
Chất ức chế enzyme tự do và phức tác xảy ra hợp ES Vị trí tác
Vị trí dị lập thể (allosteric site)
Vị trí dị lập thể (allosteric site) động Cơ chế
+ tạo EI hoặc ESI và không tạo ra P
+ tạo phức hợp ESI và không tạo ra P Ảnh
Không làm ảnh hưởng đến sự ức
Tăng sự ức chế do tăng [S] làm 16 lOMoAR cPSD| 59416725 hưởng khi tăng chế không cạnh tranh
tạo thêm nhiều phức hợp ES [S] + Lineweaver-Burk: + Lineweaver-Burk: 1 αKm 1α ' 1 =Km . 1 +α' (8 V Vmax [S] (7 Vmax ) = . +
+ Giảm giá trị Vmax và giảm giá trị Km V Vmax [S] Vmax )
(a = a’) => ức chế phi cạnh tranh Phương
+ Vmax giảm và Km không đổi trình & đồ thị 6.6.2.
Ức chế không thuận nghịch
- Sự ức chế do ức chế không thuận nghịch thường không thể đảo ngược, do:
• Chất ức chế gắn đồng hóa trị vào enzyme
• Chất ức chế phá hủy nhóm chức năng tại active site
• Chất ức chế tạo phức bền vững với enzyme (không bằng lk đồng hóa trị)
- Sử dụng chất ức chế không thuận nghịch để nghiên cứu cơ chế phản ứng của enzyme,
xác định các nhóm chức tại active site thông qua liên kết cộng hóa trị
* Chất bất hoạt tự sát (suicide inactivator)
Được phân giải bởi enzyme như 1 cơ chất bình thường 17 lOMoAR cPSD| 59416725
Thay vì thành sản phẩm, chúng lại chuyển thành chất có hoạt tính cao gắn không
thuận nghịch với enzyme => phức hợp chất bất hoạt (mechanism-based inactivator)
Quan trọng trong nghiên cứu thuốc 18




