









Preview text:
lOMoAR cPSD| 59416725 BÀI 5
NITƠ VÀ CÁC HỢP CHẤT NHÓM VA
Họ tên sinh viên: Tạ Quỳnh Mai Lớp: K16-KTHH Nhóm: 2 Chữ ký của giáo viên Đánh giá kết quả Thí
Quan sát hiện tượng
Viết phương trình phản ứng và giải nghiệm
thích hiện tượng, tính toán kết quả số (nếu có) Thí Cho 2g NaNO2 vào Phương trình phản ứng:
nghiệm ống nghiệm và rót vào 1: Điều
ống 5ml dd NH4Cl bão NaNO2 + NH4Cl -to→ NaCl + N2 ↑ + chế N
hòa ta thấy có bọt khí sủi 2 2H2O nhẹ. Lắp hệ NH4NO2 → N2 + 2H2O
Khi thu được là khí N2 mà khí N2
thì không duy trì sự cháy nên ngọn lửa tắt ngay. Kết luận
thống thu khí như hình vẽ:
Có thể điều chế khí N2 bằng cách
nhiệt phân muối amoni nitrat. Khí N Đun nhẹ thì phản ứng 2 không duy trì sự cháy. mạnh hơn. Thu khí vào
ống nghiệm lớn chứa đầy nước úp ngược trên 1
chậu đựng nước. Lấy vỏ bào đang cháy đưa vào
ống nghiệm chứa khí thu
được thì ngọn lửa tắt lOMoAR cPSD| 59416725 ngay. lOMoAR cPSD| 59416725 Thí a. Cho vào 2 ống
a. Phương trình phản ứng nghiệm
nghiệm nhỏ mỗi ống 3 Zn + 4HNO 2: Tính 3 → Zn(NO3)2 +2NO2 + giọt HNO3 đậm đặc. chất của Ống 1: thêm vào 1 2H2O acid
mẫu Zn kẽm ta thấy Dung dịch Zn(NO3)2 không màu. nitric
kẽm tan ra, có khí màu Khí NO2 có màu nâu. nâu bốc lên, phản ứng tỏa nhiệt mạnh, dd sau
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
Dung dịch Cu(NO3)2 có màu xanh. Khí NO2 có màu nâu. phản ứng không màu. Ống 2: thêm vào 1 mẫu Cu đồng ta thấy đồng tan ra, có khí màu nâu bay ra, phản ứng tỏa nhiệt mạnh, dd
b. Phương trình phản ứng
S + 6HNO3 → H2SO4 + 6NO2 + 2H2O Ba2+ + SO 2– 4 → BaSO4 lOMoAR cPSD| 59416725 sau phan ứng có màu
c . Giải thích hiện tượng xanh.
Dung dịch phía trên có màu vàng nâu
b. Cho vào ống là do Fe2+ bị oxy hóa thành Fe3+ theo phản
nghiệm một ít lưu ứng: huỳnh. Sau đó thêm 1ml HNO
Fe + 2HNO3 + 3H2SO4 → Fe(SO4)3 + 2N 3 đậm đặc.
Đun nhẹ ta thấy lưu O + 4H2O huỳnh tan ra, ống
Do ống nghiệm bị lạnh nên khí NO tạo nghiệm nóng lên. Khi cho 1ml dd Ba
thành bị giữ lại trong dd và tạo phức với 2+ vào
FeSO4 chưa phản ứng thành một phức có màu đen. FeSO4 + xNO → Fe(NO)xSO4 Đen
Do phức trên không bền nên khi ta lắc
mạnh sẽ phân hủy tạo NO thoát ra ngoài
rồi hóa nâu ngoài không khí Fe(NO)xSO4 → FeSO4 + xNO 2NO + O 2 → 2NO2 dd sau phản ứng thì
Dung dịch sau cùng màu nâu đỏ là do
thấy xuất hiện kết tủa Fe (SO ) 2
4 3 thủy phân tạo Fe(OH)3 màu nâu màu trắng.
đỏ. Để kiểm chứng ta cho H2SO4 vào thì
c. Cho vào ống nghiệm màu nâu đỏ nhạt dần do sự thủy phân của
1 ml dung dịch FeSO4 Fe (SO ) 2
4 3 phụ thuộc vào pH của dung bão hòa, 5 - 6 giọt dich. H2SO4 đậm đặc. Làm lạnh ống nghiệm dưới
vòi nước. Thêm từ từ 1 ml HNO3 loãng dọc theo thành ống nghiệm (không lắc). Quan sát hiện tượng ta thấy : lOMoAR cPSD| 59416725 Dung dịch trước khi cho có màu xanh lơ của Fe2+ Khi cho HNO3 vào
thì phần dd phía trên có màu vàng nâu, có bọt
khí đồng thời ở giữa
dần dần xuất hiện lớp phân cách màu đen, dd phía dưới vẫn màu xanh lơ. Khi lắc mạnh dd thì lớp không phân cách màu đen biến mất,
đồng thời có khí bay ra hóa nâu trong không khí và dd sau cùng có màu nâu đỏ. Khi thêm H2SO4 vào thì thấy màu nâu đỏ nhạt dần. Thí
Cho vào 4 ống nghiệm Ống 1: nghiệm mỗi ống 1 ml dung dịch 4: Tính KNO2 hay
5 NO - + 2 MnO - + 6 H+ → 5 NO chất của 2 4 NaNO2. - muối
3 + 2 (Mn)2+ + 3 H2O lOMoAR cPSD| 59416725 nitrit Quan sát hiện tượng ta thấy :
Ống 1: thêm vào dd Ống 2 : KMnO4 loãng có pha 1
giọt H2SO4 đậm đặc. Ta -
thấy màu tím của hỗn NO2 +Fe2+ + 2 H+ → Fe3+ + NO + H2O hợp mất đi và tạo dd trong suốt. FeSO4 + xNO → Fe(NO)xSO4 Ống 2: thêm vào dd Đen FeSO 4 và vài giọt H 2NO + O 2SO4 đậm đặc (không 2 → 2NO2
lắc). Ta thấy xuất hiện Nâu Ống 3: lớp màu nâu đen và có -
bọt khí không màu rồi 4H+ + 2I- + 2NO2 → I2 + 2NO + 2H2O hóa nâu. Tím than
Ống 3 : thêm dd KI có I2 + KI → KI3 pha 1 giọt H2SO4 loãng. Nâu đất
Ta thấy đầu tiên dd có Ống 4: màu vàng nhạt của KI,
sau đó tạo tủa màu tím than. Khi cho dư dd KI -
thì tủa tan tạo dd màu NO2 + H+ → HNO2
nâu đất. Trong quá 3HNO2 → HNO3 + 2NO + H2O
trình phản ứng có bọt Kết luận khí sinh ra.
Muối nitrit vừa có tính khử vừa có tính
oxy hóa. Acid nitrit là acid không bền sẽ Ống 4: thêm vài giọt
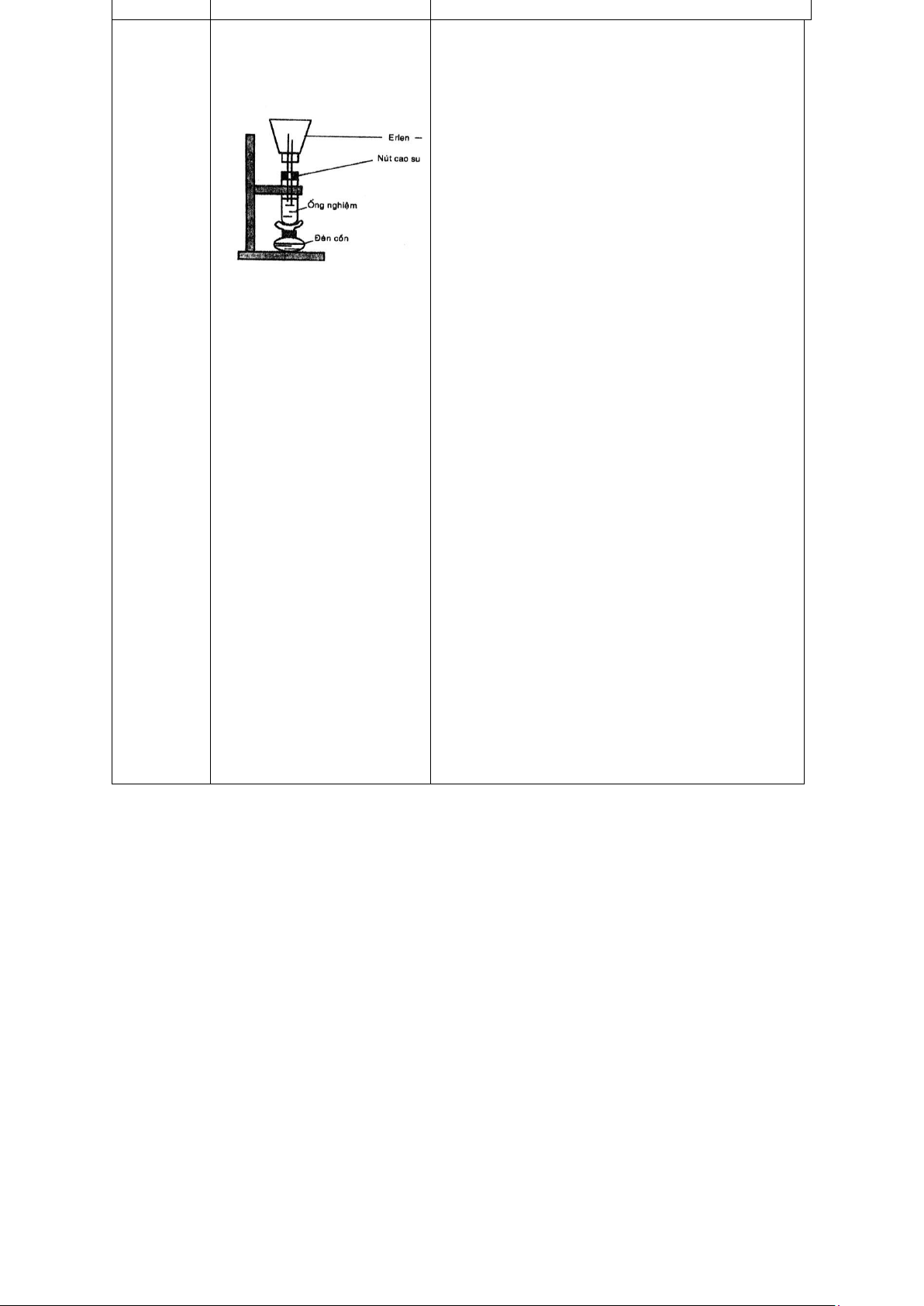
tự phân hủy theo cơ chế tự oxy hóa khử. H2SO4 đặc ta thấy dd có sủi bọt khí không màu. Thí a. Điều chế NH3 nghiệm
Lắp bộ phận điều chế a. 5: Điều NH3. NaOH + NH lOMoAR cPSD| 59416725 chế và 4Cl → NH4OH + NaCl (1) tính NH4OH → NH3 + H2O (2) chất của NH +
3 + H2O → NH4 + OH- (3) amoniac
Phenolphtalein hóa hồng là do có OHsinh
ra. Sở dĩ nước bị hút vào erlen là vì Cho vào ống nghiệm áp suất
trong erlen giảm.Áp suất giảm 3g NH4Cl và 5ml dd do: NaOH đậm đặc. Lắc kĩ
+ 1 mol NH nó chỉ chiếm khoảng 15ml
nhưng nếu 1 bằng đèn cồn và thu ống nghiệm, đun nóng
4OH khi tan trong nước thì khí thoát ra trong 1
4OH ở thể hơi thì nó chiếm đến mol NH 22,41. erlen, khi nghe mùi
NH3 bay ra và thành + NH3 ngưng tụ và tan vào nước. bình mờ như sương b. mù thì ngưng đun. NH + 4Cl → NH4 + Cl-
Phản ứng này làm nồng độ NH,
Đậy ống nghiệm bằng tăng lên làm cân bằng (3) dịch
nút cao su có gắn ống chuyển theo chiều làm giảm OH thủy tinh và
nhúng nên màu hồng nhạt dần. Nhưng ngược bình erlen vào
chậu nước có thêm vài màu hồng không mất hẳn vì bản giọt
phenolphtalein. chất (3) vẫn là phản ứng thuận nghịch. lOMoAR cPSD| 59416725
Quan sát hiện tượng ta H+ + OH- → H₂O
thấy nước từ từ bị hút
vào erlen sau đó bỗng Acid vào trung hòa lượng OHtrong dd.
nhiên phụt mạnh và Khi cho đến dư acid thì hoàn toàn hết
chuyển sang màu hồng OH- nên màu hồng của dd mất hẳn.
Khi đun nóng thì NH3 bay hơi làm cân
bằng phản ứng (3) dịch chuyển theo
chiều làm giảm lượng OH nên màu hồng của dd nhạt dần.
b) Cân bằng trong dung Kết luận: dịch NH NH 3 3 tan nhiều trong nước.
Lấy dd thu được thí Dung dịch NH3 là một bazơ yếu. nghiệm trên cho vào 4 ống nghiệm, mỗi ống nghiệm 1ml Ống 1: thêm một ít dd NH4Cl và lắc cho tan ra ta thấy màu hồng nhạt dần. Cho đến dư thì màu hồng không mất hẳn. Ống 2: thêm từ từ H2SO4 loãng đến dư ta thấy màu hồng nhạt dần rồi mất hẳn. Ống 3: đun nhẹ ta thấy màu hồng nhạt dần nhưng không mất hẳn. Ống 4: giữ để so sánh. So sánh màu trong 4 ống ta thấy màu dung
dịch nhạt dần theo thứ
tự ống 4 > ống 3 > ống 1 > ống 2 lOMoAR cPSD| 59416725 lOMoAR cPSD| 59416725 Thí
Cho một ít tinh thể Do NH4Cl có nhiệt độ phân hủy lớn hơn nghiệm NH
nhiệt độ thăng hoa nên sẽ thăng hoa 4Cl vào ống nghiệm,
6 : Nhiệt đun nóng. Quan sát ta trước. Khi gặp nhiệt độ thấp và hơi nước phân
thấy trên thành ống sẽ đọng lại trên thành ống nghiệm. muối nghiệm có tinh thể amoni
trắng bám lên. Làm NH4Cl → NH3 + HCl
tương tự như trên Đây là hiện tượng thăng hoa vật lý vì
nhưng ta cẩn thận xua trước khi đạt nhiệt độ phân hủy thì
hơi ẩm ra khỏi ống thì NH4Cl đã thăng hoa và không bị biến đổi
không xảy ra hiện chất.
tượng thăng hoa vật lý.
(NH4)2SO4 → 2NH3 + H2SO4 (1) Ba2+ + SO42- → BaSO4
Đây là hiện tượng thăng hoa hóa học vì
(NH4)2SO4 bị phân hủy theo phản ứng (1),
không thể kết hợp lại với nhau.
Làm lại thí nghiệm trên nhưng thay NH4Cl bằng (NH4)2SO4. Ta thấy khi đặt giấy tẩm lOMoAR cPSD| 59416725 phenolphtalein thì giấy xuất hiện những vệt
hồng, đồng thời dd còn
lại tạo tủa trắng với dd Ba2+ và trên thành ống nghiệm không có tinh thể trắng tạo thành. Đây là hiện tượng thăng hoa hóa học.



