

















Preview text:
Chương 7 Cấu trúc acid amin và protein 1 Nội dung Đại cương Acid amin Peptide Protein 2
1 . ĐẠI CƯƠNG Đại cương
Protein là thành phần cơ bản của tế bào, là
nguyên liệu cần thiết để tổng hợp những
thành phần cấu trúc của cơ thể
Là enzym giữ nhiệm vụ xúc tác các quá trình chuyển hóa
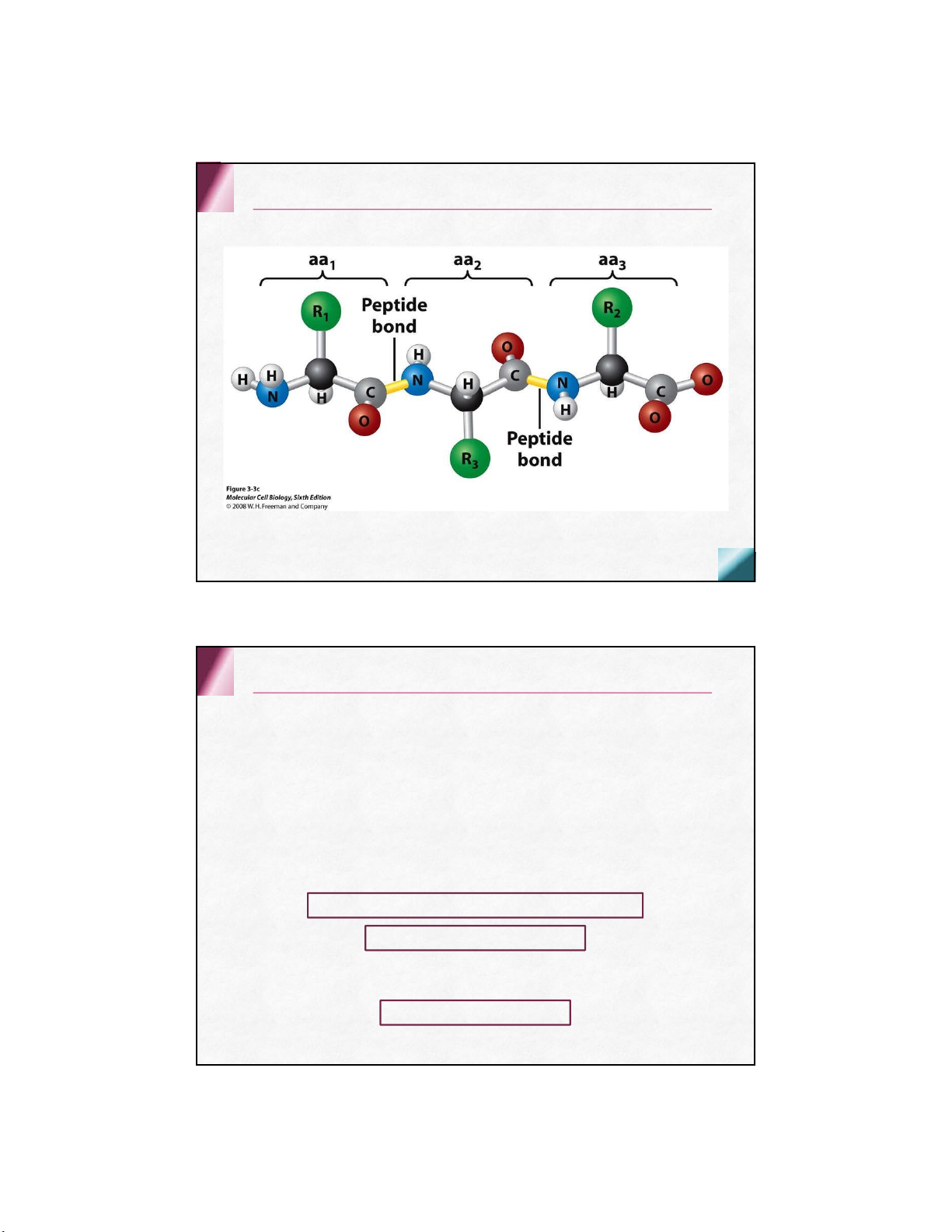
Được cấu tạo bởi nhiều acid amin kết hợp
với nhau bằng liên kết peptide Đại cương
Acid amin: là đơn vị cấu tạo nhỏ nhất của protein
Peptide: là phân tử gồm 2 đến vài chục acid
amine (dưới 50) nối với nhau bằng các liên kết peptide
Protein: là phân tử gồm từ 50 tới cả ngàn
acid amine nối với nhau bằng liên kết peptide 2 . ACID AMIN Cấu tạo hóa học
sản phẩmthủyphâncuốicùngcủapeptide vàprotein
20 acid amin “ chuẩn ”
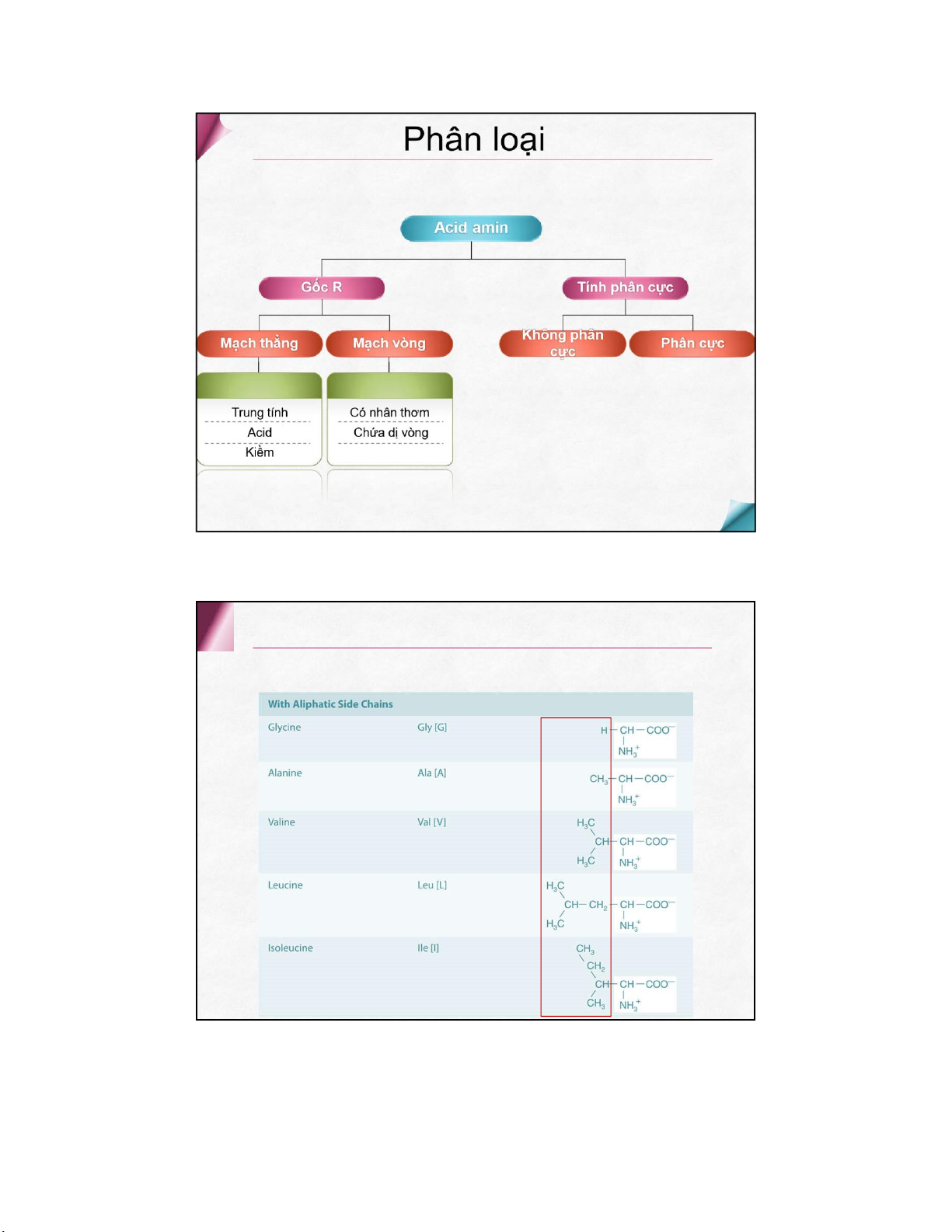
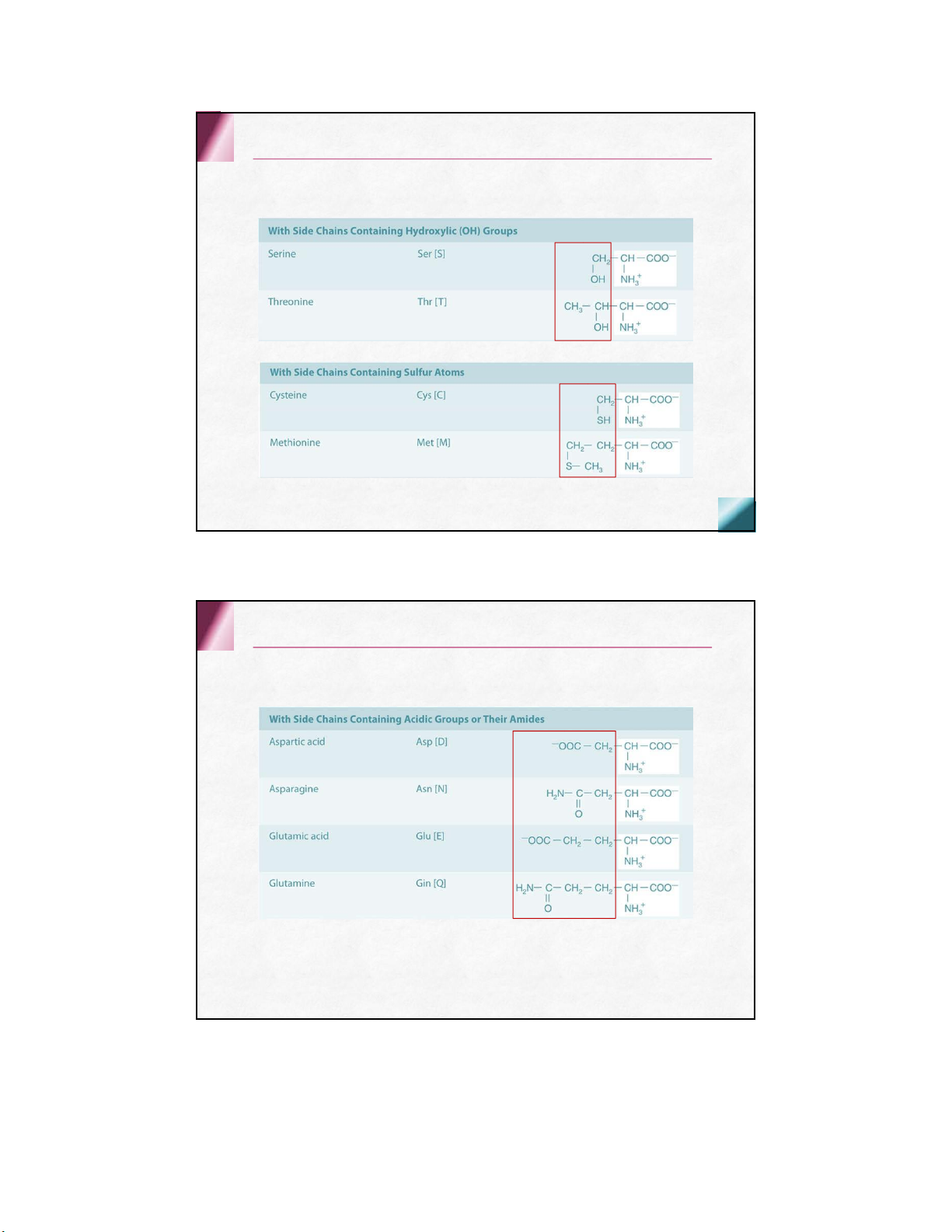
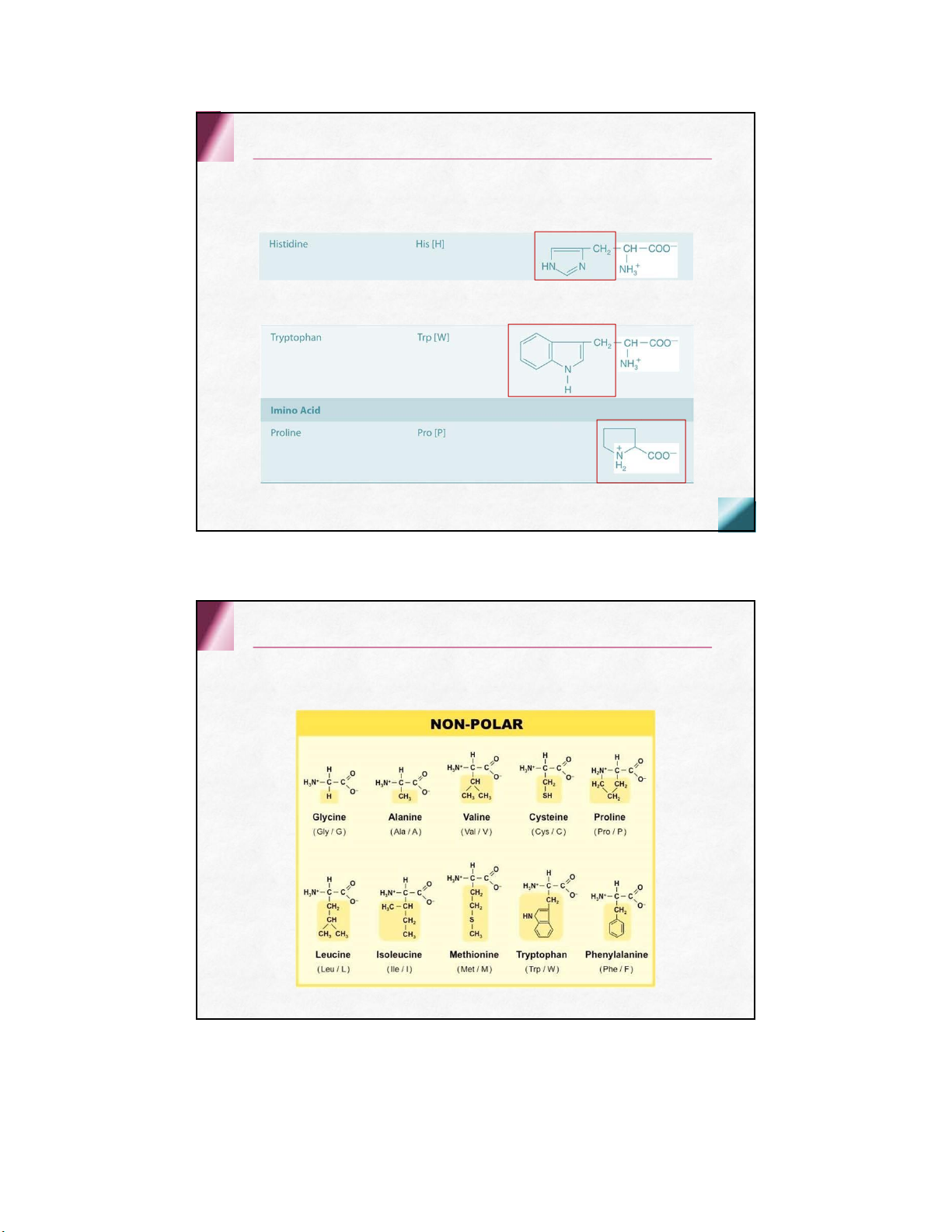
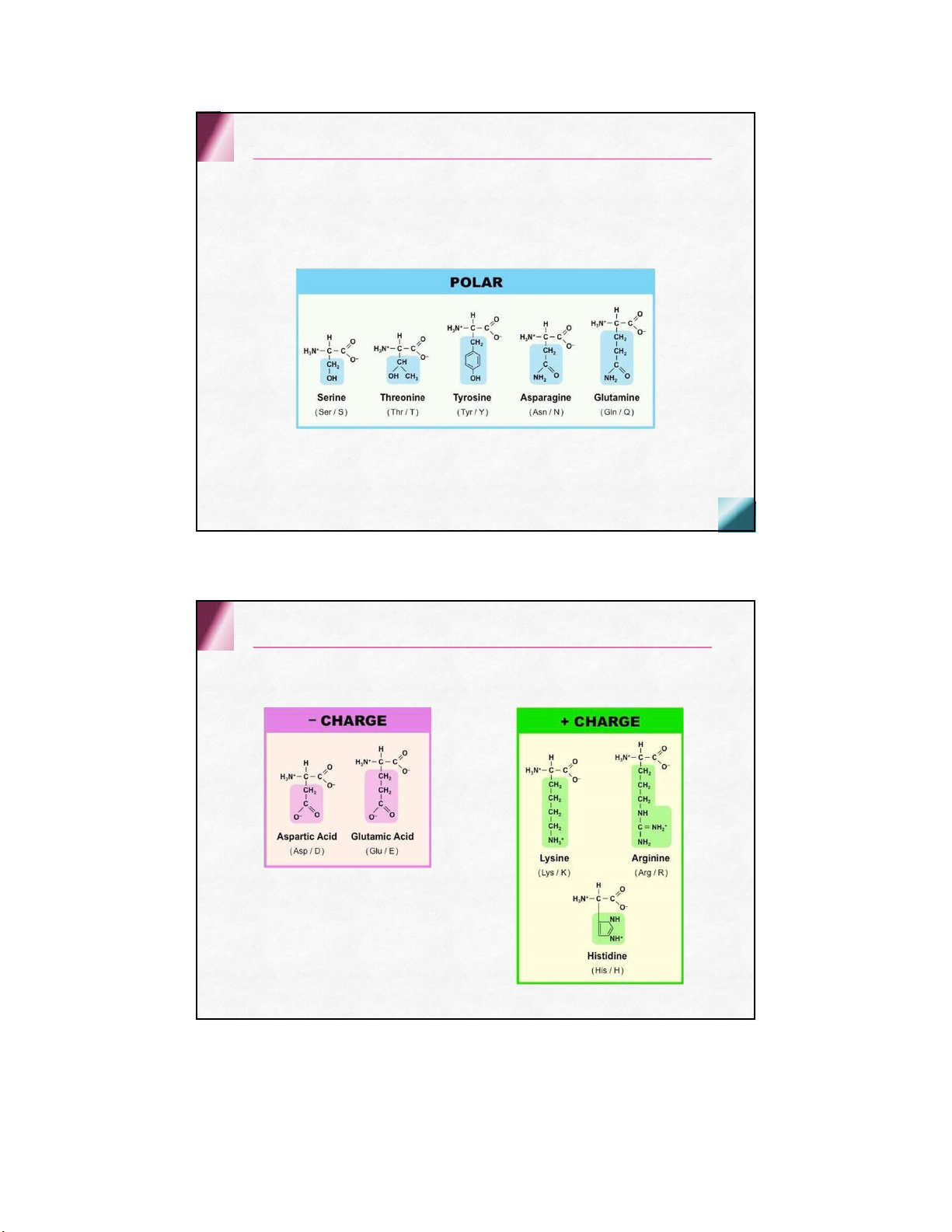
có 8 aa thiết yếu + 2 aa bán thiết yếu Cấu tạo hóa học Thiết yếu Không thiết yếu Valine Alanine Leucine Asparagine Isoleucine Aspartic acid Phenylalanine Cysteine Threonine Glutamic acid Tryptophan Glutamine Methionine Glycine Lysine Proline Histidine Serine Arginine Tyrosine Acid amin mạch thẳng Trung tính Acid amin mạch thẳng Trung tính Acid amin mạch thẳng Acid Acid amin mạch thẳng Kiềm Acid amin mạch vòng Có nhân thơm Acid amin mạch vòng Dị vòng Nhân imidazol Nhân indol Acid amin không phân cực Acid amin phân cực không điện tích Acid amin phân cực điện tích âm điện tíchdương Acid amin thứ 21 & 22
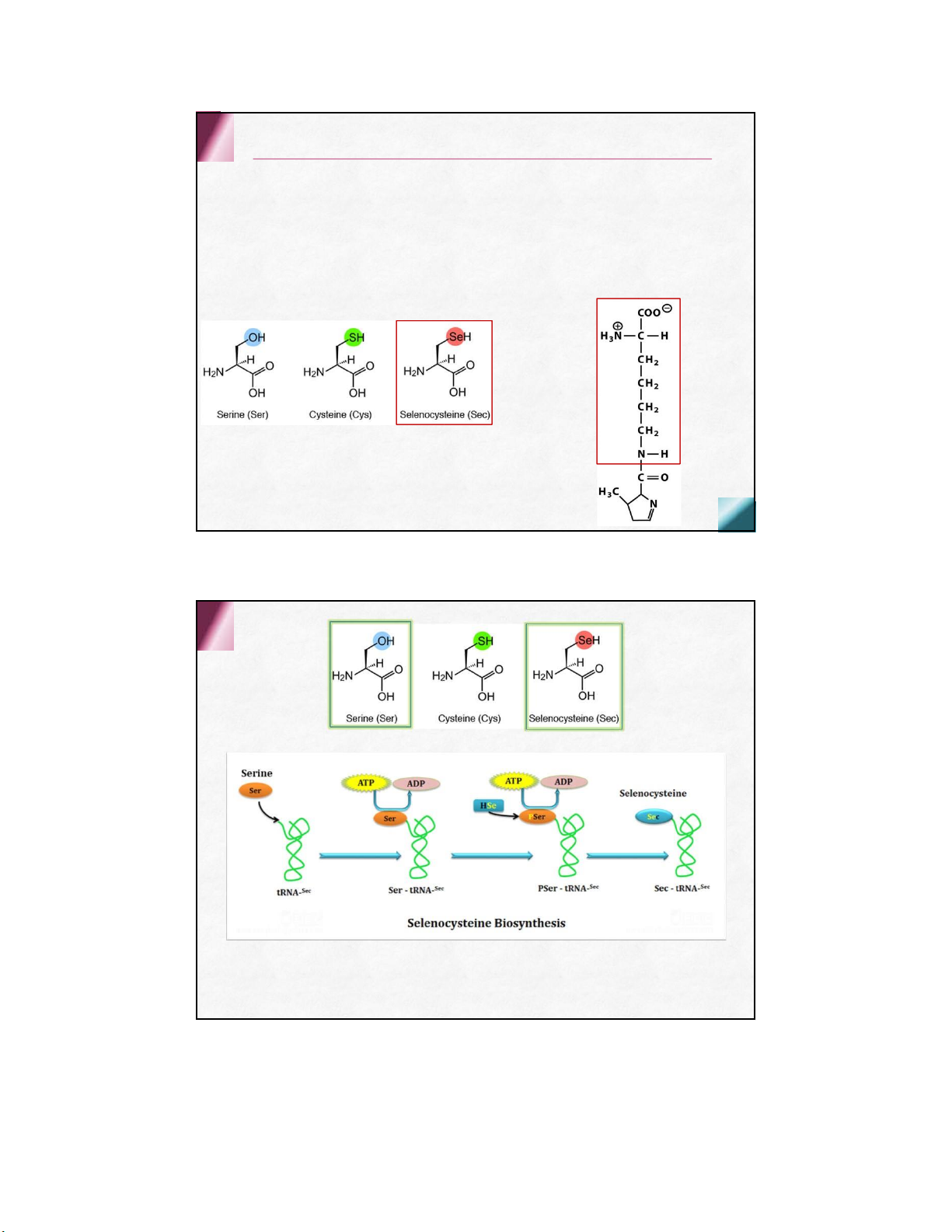
Selenocysteine là acid Pyrrolysine là acid amin amin thứ 21 thứ 22 ( codon stop UAG mã hóa cho Pyrrolysine)
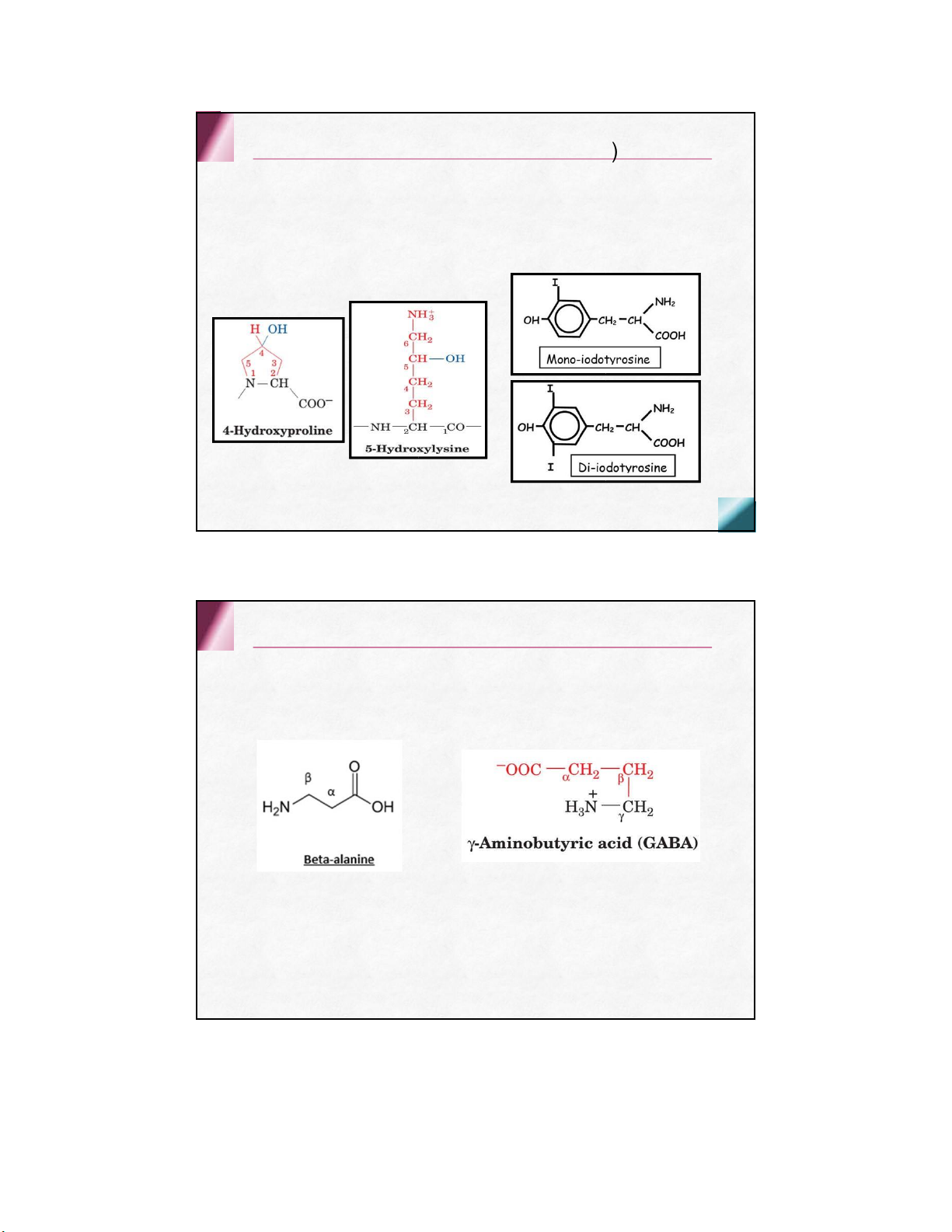
Acid amin hiếmgặp trong protein (d
ẫn xuất của aathường gặp )
Trong collagen và một số
Trong globulin của tuyến protein thực vật giáp 4-h ydroxy proline Monoiodotyrosine 5-h ydroxy lysine Diodotyrosine
Các acid amin không gặp trong protein
ở dạng tự do hay kết hợp
dẫn xuất của aa thường gặp Hóa học lập thể
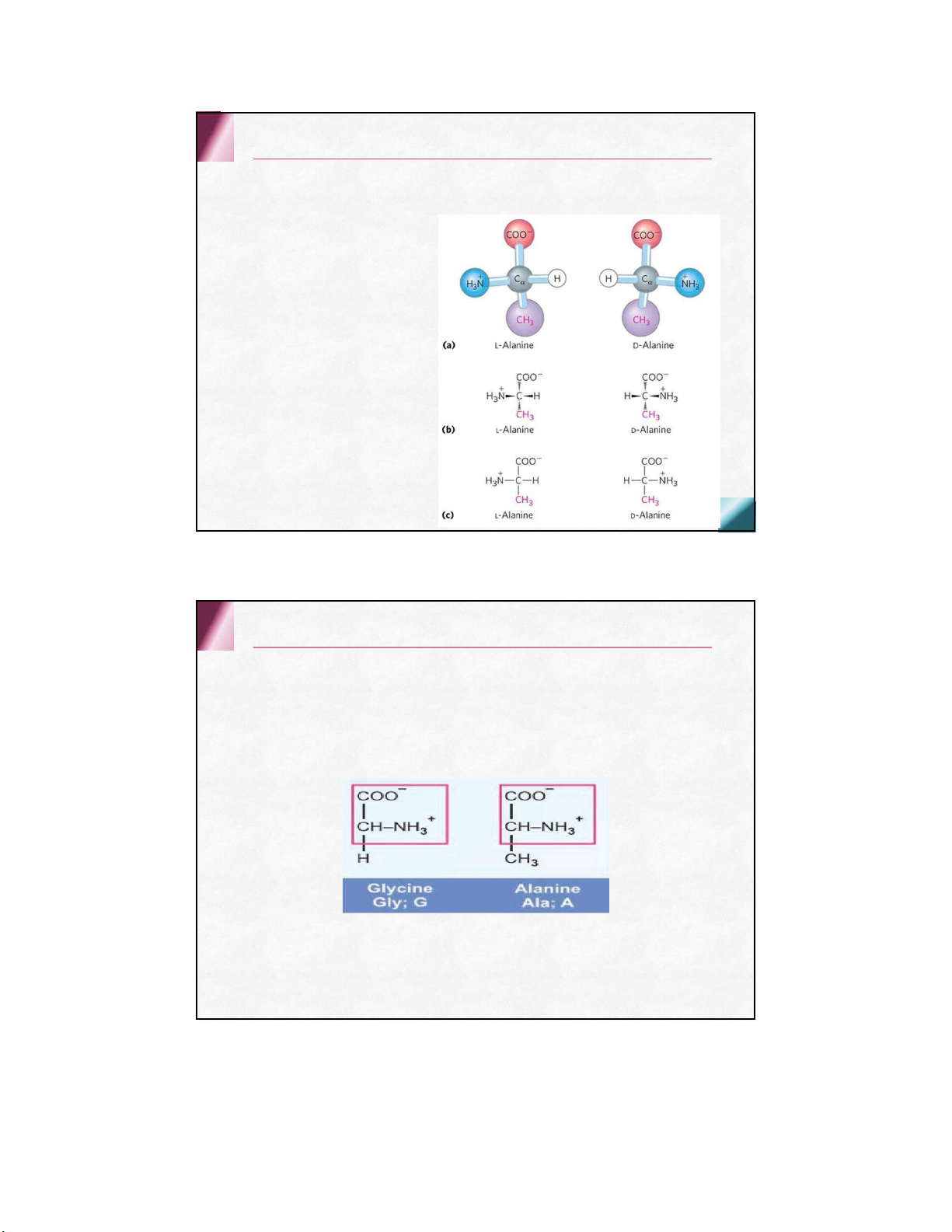
Dùng serin làm tiêu chuẩn so sánh
aa dạng L khi –NH 2 ở bên trái
aa thường gặp dạng L Tính chất vật lý
Dễtantrongnước,tùythuộcvàocấutrúcgốcR
Thườngcóvịngọtkiểuđường,leucinekhôngvị,
isoleucinevàargininecóvịđắng
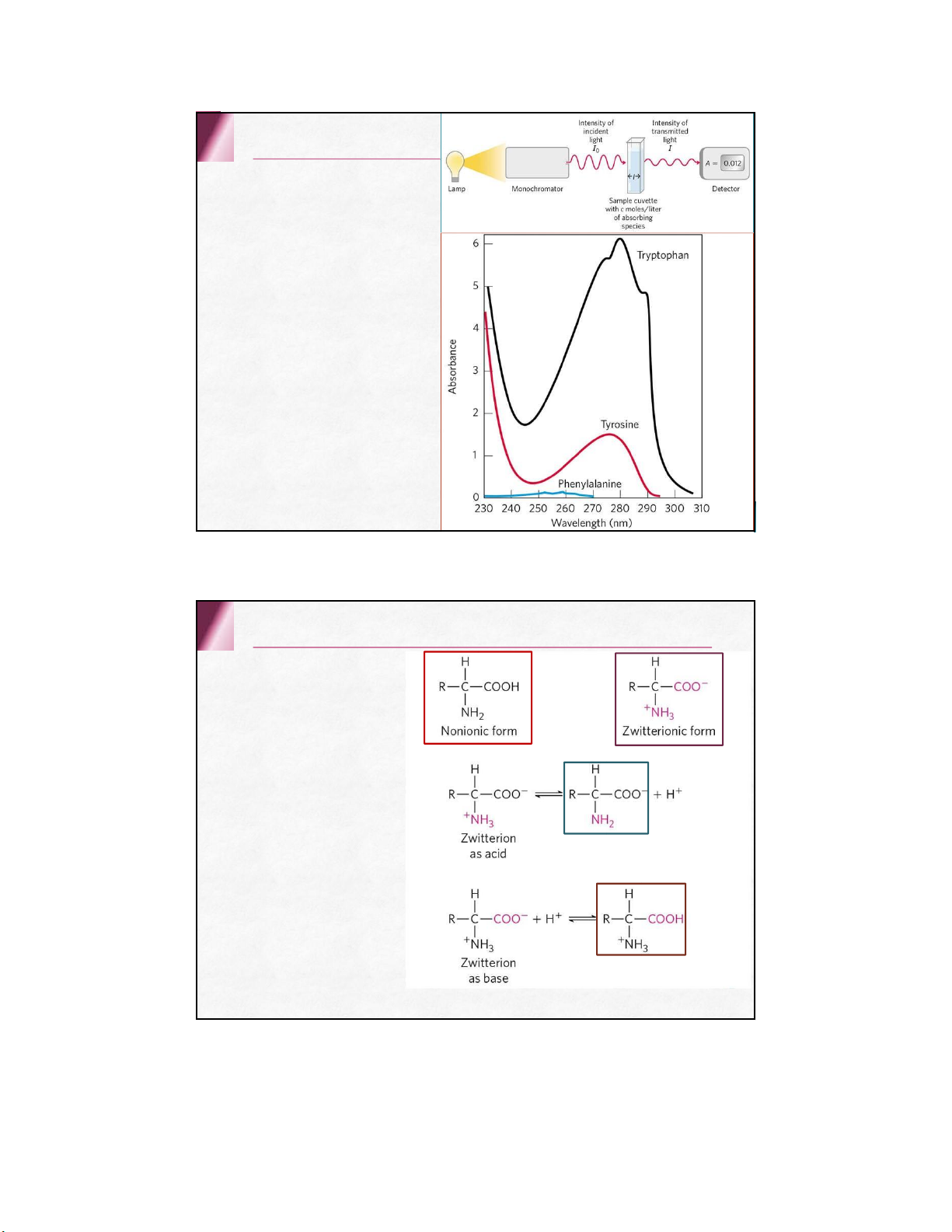
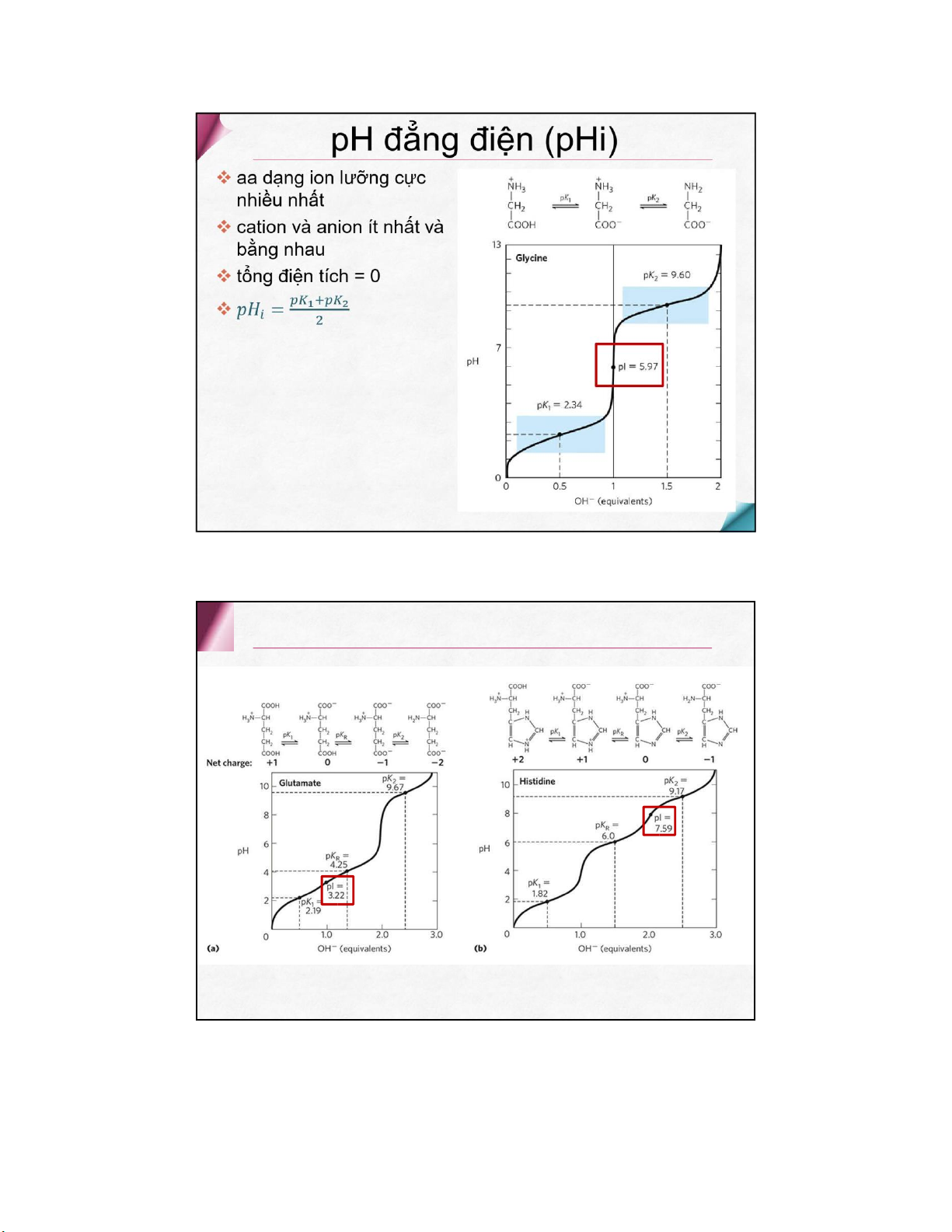
Tínhquanghoạt( trừglycin ) docóCbấtđốixứng Phổ hấp thụ Tyrosine, tryptophan và phenylalanine (240-280 nm ) Cystein hấp thụ yếu ở 240 nm Các acid amine khác hấp thụ ở 220 nm Phần lớn các protein đều chứa tyrosine định lượng protein ở 280 nm Tính lưỡng tính 3 dạng ion Ion lưỡng cực Cation Anion pH đẳng điện (pHi) Tính chất hóa học
Chức α- amin Nhóm carboxyl
2 nhóm chức –NH 2 và –COOH Gốc R Chức α-amin
Phản ứng với acid Nitrơ (HNO 2 )
định lượng N 2 của acid amin Chức α-amin
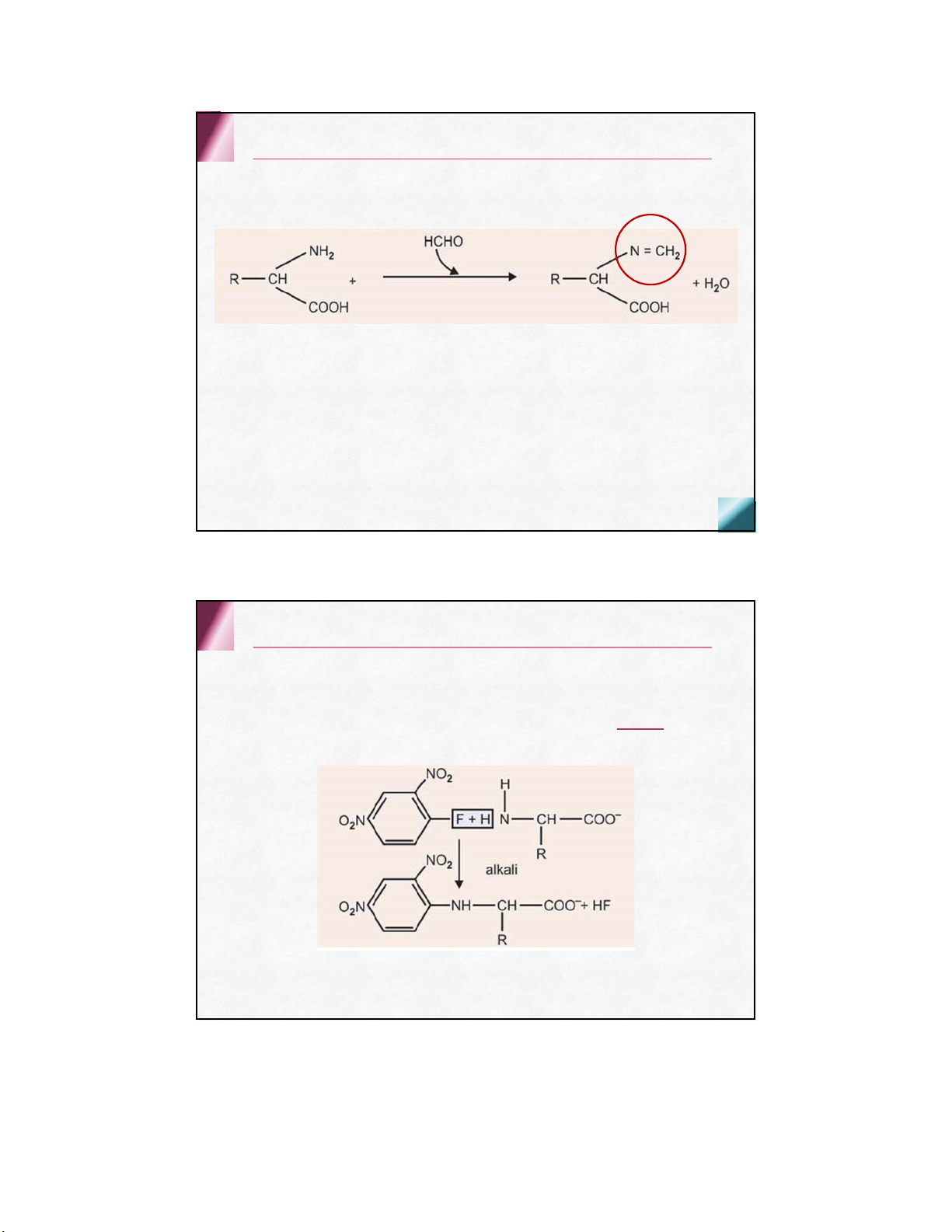
Phản ứng với aldehyl (phản ứng tạo base schiff)
định phân acid amin trong nước tiểu bằng NaOH Chức α-amin
Phản ứng với 2,4 dinitrofluorobenzen (DNFB) ( PƯSanger )
trong mt kiềm yếu, DNFB + nhóm amin tự do tạo
dẫn xuất 2 ,4 dinitrophenyl acid amin ( DNP-aa )
xác định các aa cuối của chuỗi peptide Chức α-amin
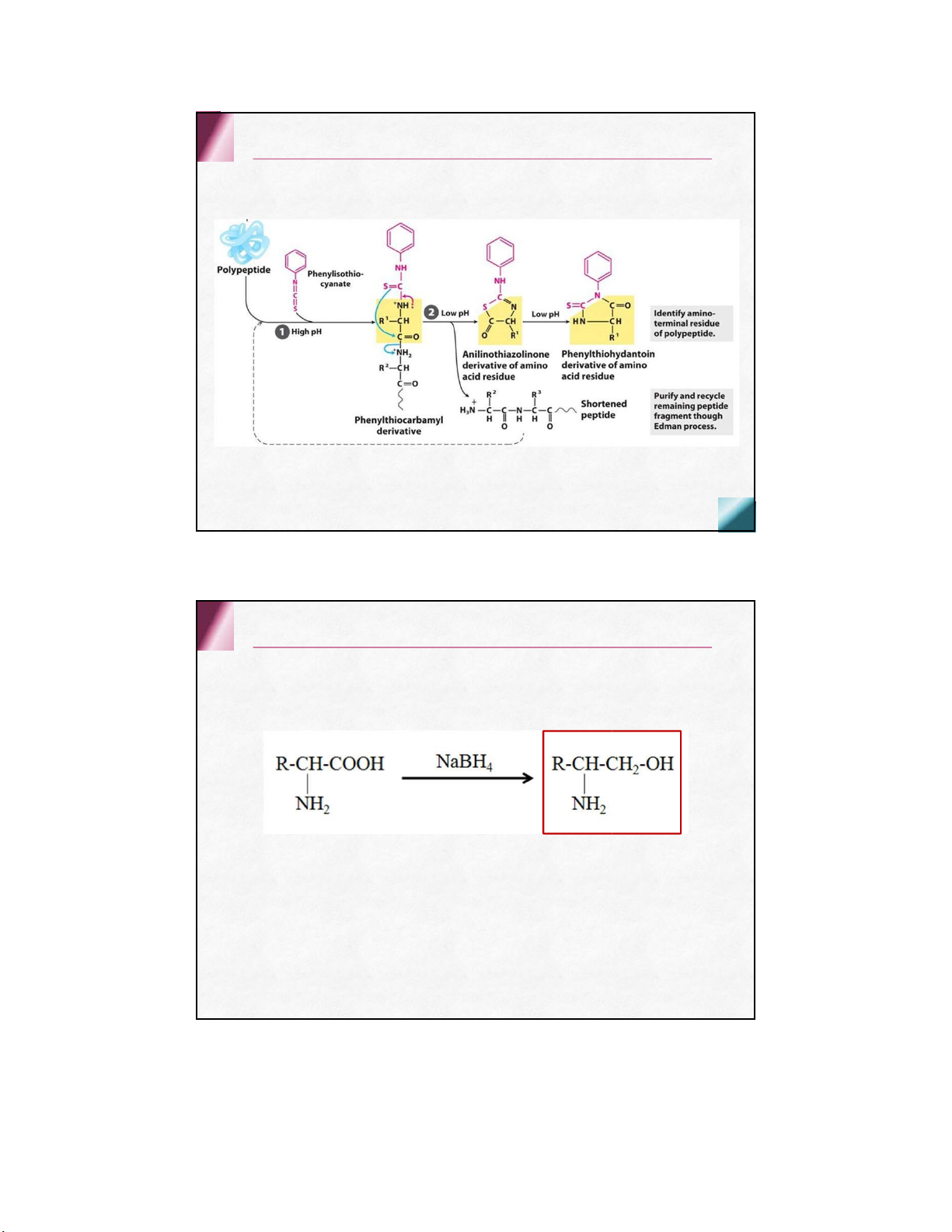
Phản ứng với phenylisothiocyanat (PITC) (PƯ Edman)
xác định amin N cuối của chuỗi polypeptide nhóm carboxyl
Phản ứng khử nhóm carboxyl
tạo thành alcol α-amine nhóm carboxyl
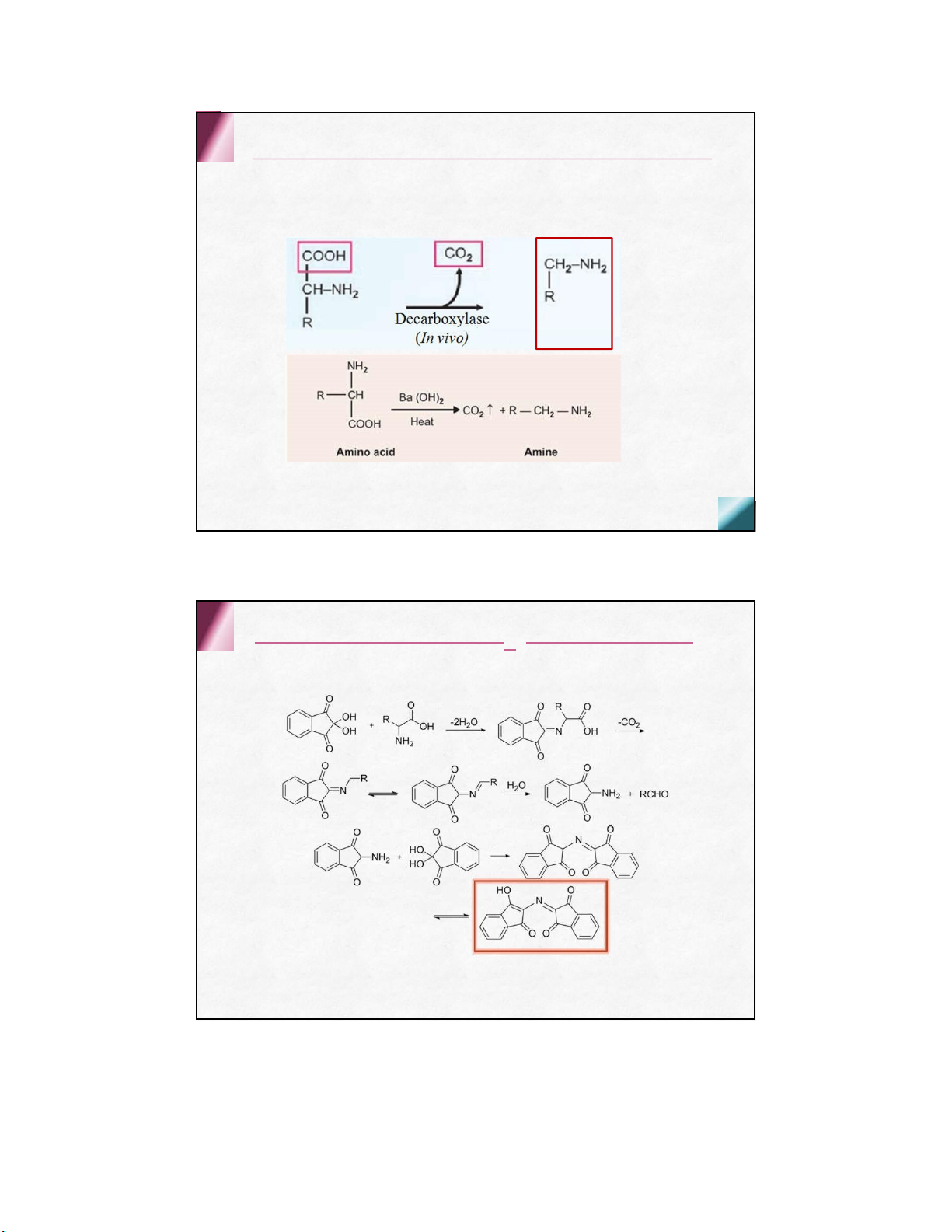
Phản ứng khử carboxyl (decarboxyl hóa) tạo thành amin nhóm chức –NH và –COOH 2 PƯ Ninhydrin
định tính hay định lượng aa(trong sắc ký và điện di) lOMoARcPSD| 36625228 gốc R
gốc R có những nhóm chức khác nhau, cho PƯHH
khác nhau quyết định các phản ứng đặc hiệu của acid amin
–COOH và –NH2 cho PƯ tạo muối
–SH của Cysteine cho PƯ oxi hóa khử
nhân thơm của phenylalanine và tyrosine cho PƯ nitro hóa và halogen hóa
–OH của serine và threonine có thể tham gia PƯ ester hóa
–OH phenol của tyrosine cho phản ứng đặc hiệu với
thuốc thử Millon (HgNO3/HNO3 đđ) cho màu đỏ cam 3 . PEPTIDE Peptide
hợp chất gồm 2 đến vài chục aa nối với nhau bằng lk peptide
trọng lượng phân tử ≤ 6000 trong tự nhiên
dưới dạng tự do có hoạt tính sinh học nhất định
(peptide hormone như insuline, peptide kháng sinh)
hoặc là sản phẩm thủy phân dở dang của protein Cấu tạo và danh pháp Cấu tạo Danh pháp
tên thông dụng (VD: glucagon là 1 peptide có 29 aa)
danh pháp hóa học hữu cơ (gọi theo các gốc aa)
đầu là aa có -NH2 tự do
lần lượt đến aa cuối có –COOH tự do
nguyên tắc: giữ nguyên tên aa cuối và thay đổi tên các aa kia bằng gốc –yl
H2N-seryl-glycyl-tyrosyl-alanyl-leucine-COOH Ala-Ser-Phe-Leu hay A-S-F-L
Nếu trong chuỗi peptide có đoạn nào đó chưa xác định
được thứ tự của các aa thì để trong ngoặc Ala-Gly-(Ala-Ser-Gly)-Tyr Tính chất của peptide Tính acid-base
tính chất lưỡng tính 3 dạng ion trong dung dịch có pH i Tính chất của peptide
Tính chất hóa học
α-NH2 của aa N cuối cho PƯ giống như α-NH2 của aa
α-COOH của aa C cuối cũng cho PƯ aa (khử, khử carboxyl hóa)
gốc R của các aa trong chuỗi peptide cho PƯ
màu đặc trưng của các aa tự do tương ứng
(Tyrosine cho màu đỏ cam với thuốc thử Millon)
Peptide cho phản ứng với đồng sulfat trong môi trường kiềm (PƯ Biuret) • màu xanh tím (ít aa)
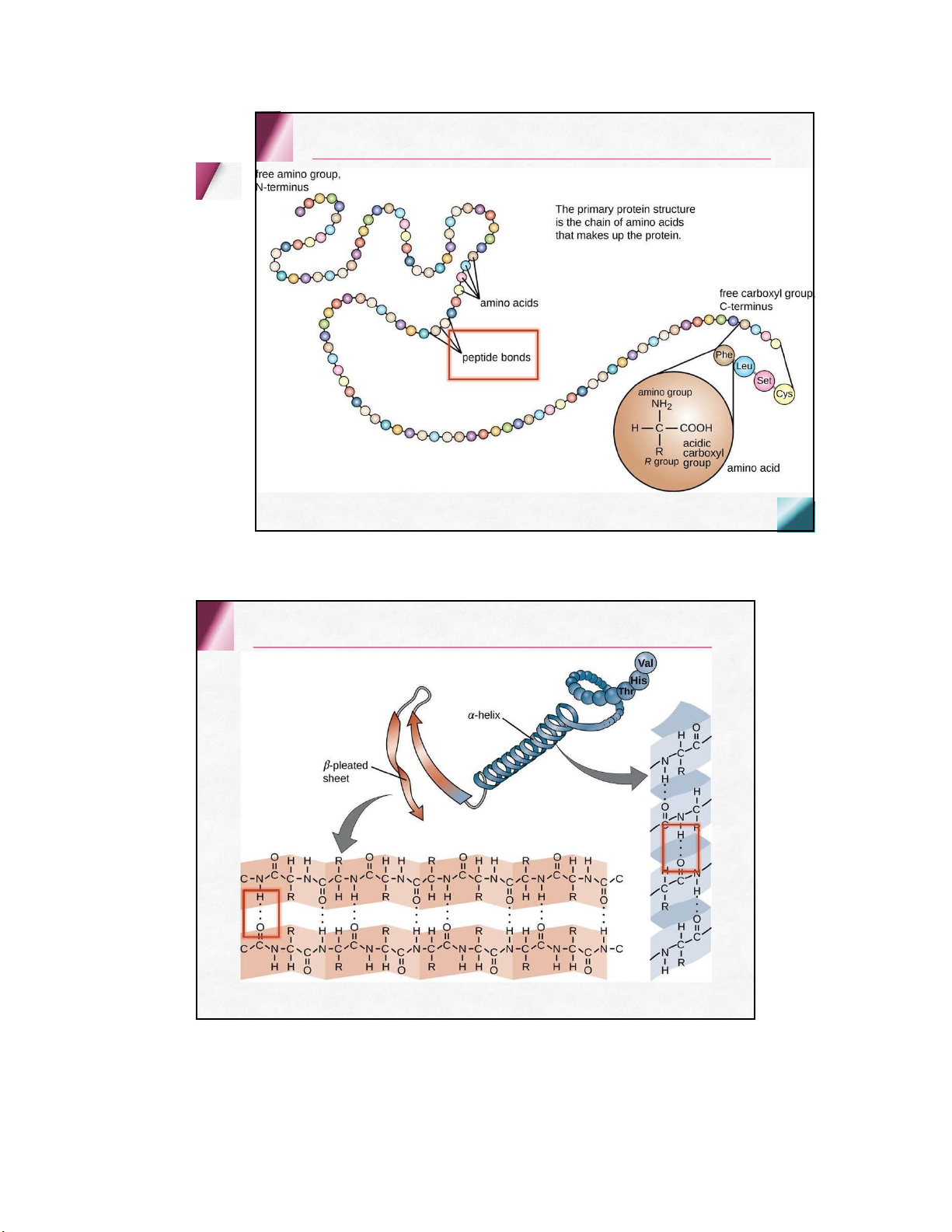
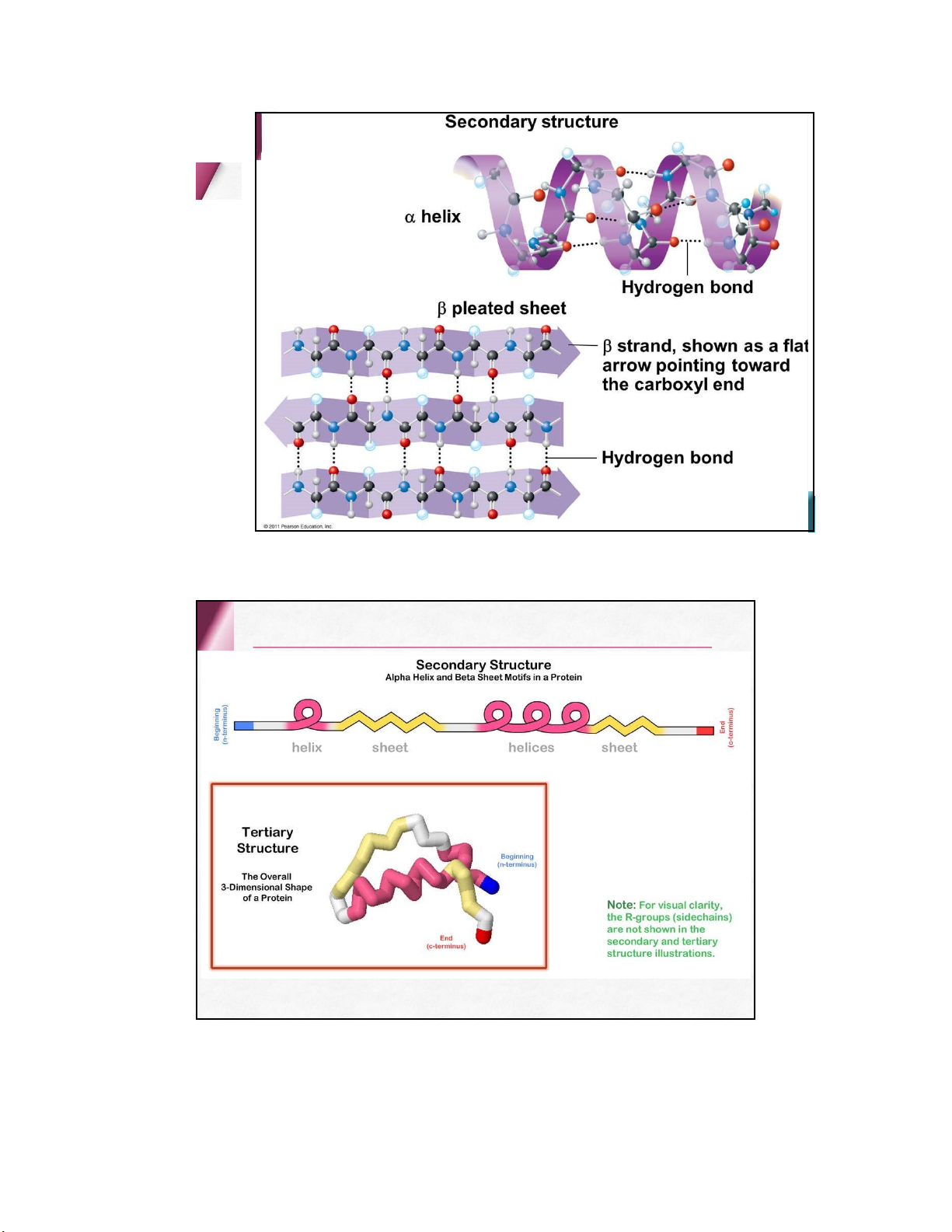
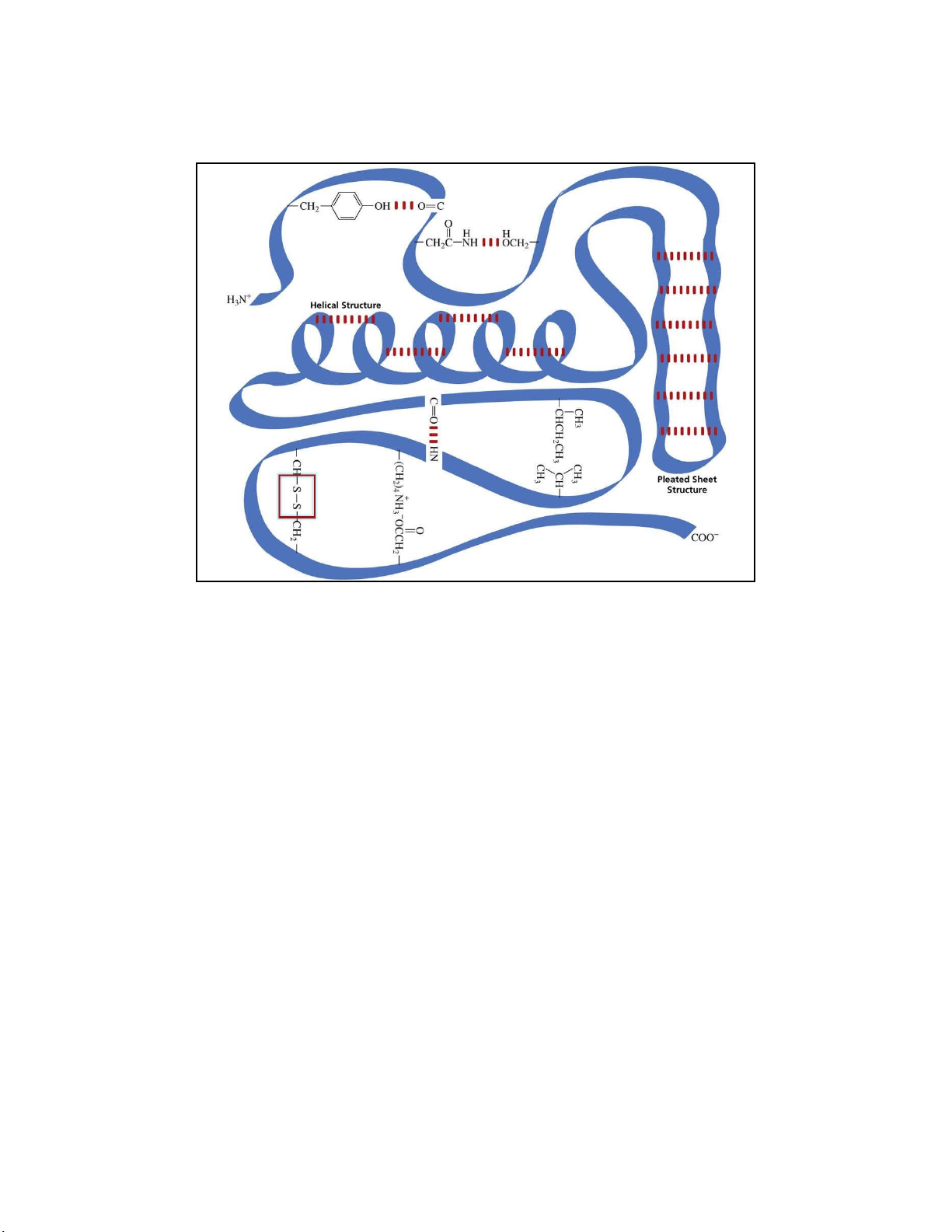
• màu tím hồng (nhiều aa) lOMoARcPSD| 36625228 4 . PROTEIN Cấu trúc protein lOMoARcPSD| 36625228 Bậc 1 Bậc 2 lOMoARcPSD| 36625228 Bậc 3 lOMoARcPSD| 36625228 lOMoARcPSD| 36625228 Bậc 4 ≥ 2 chuỗi polypeptide ( bán đơn vị ) Các liên kết Hydro Van der Waals … lOMoARcPSD| 36625228 Phân loại
Theo nguồn gốc: động vật hay thực vật
Theo chức năng: enzyme, hormone, cấu tạo, dinh
dưỡng, dự trữ, vận động, bảo vệ, điều hòa… Theo
cấu trúc: cầu, sợi…
Theo thành phần hóa học:
Protein thuần hay protein đơn giản (holoprotein): chỉ gồm các aa
Protein phức tạp hay protein tạp (heteroprotein): còn có các nhóm ngoại Phân loại Protein thuần Protein tạp • Albumin • Nucleoprotein • Protamin • Glucoprotein • Histon • Cromoprotein • Globulin • Lipoprotein • Keratin • Phosphoprotein • Prolamin và • Metaloprotein glutalin • Colagen
Tính chất lý hóa của protein
Trọng lượng phân tử
phân tử keo có kích thước lớn (> 0,001 µm) lOMoARcPSD| 36625228
khuếch tán rất chậm trong dung dịch
không qua được các màng thẩm tích
Trọng lượng phân tử của protein thiên nhiên tìm
thấy vào khoảng ≥ 6000 - hàng triệu
Tính chất lý hóa của protein
Biến tính của protein
chịu những thay đổi về tính chất như độ hòa tan
bị giảm → mất đi một số tính chất đặc hiệu
cấu trúc không gian của phân tử protein bị phá
vỡ (trừ liên kết peptide) Hai loại:
• Biến tính thuận nghịch: khi cấu trúc phân tử của
protein có thể trở lại dạng ban đầu
• Biến tính không thuận nghịch: khi protein không trở
lại trạng thái ban đầu Tác nhân:
• Vật lý: nhiệt độ, tia tử ngoại, siêu âm, áp suất cao…
• Hóa học: acid, base, muối kim loại nặng… lOMoARcPSD| 36625228 Tính chất lưỡng tính
Mỗi protein cómộtpH i
Ở mộtpH mt nhất định, tùy thuộcvàopH i mà tíchđiện(+) hay (-)
di chuyểnvềphíacựctráidấutrongđiệntrường. Ứng dụng Tính chất hóa học
Có thể bị thủy phân (nhờ enzyme hay acid, base ở to cao)
dở dang thành các peptide
hoàn toàn thành các acid amine
PƯ với thuốc thử Biuret định lượng
protein bằng phương pháp so màu
Các gốc aa trong phân tử protein cũng cho
những phản ứng đặc trưng của các aa tự do tương ứng lOMoARcPSD| 36625228 Chức năng Xúc tác của enzyme
Vận chuyển: như Hemoglobin, myoglobin
Sự vận động và phối hợp: actin và myosin
Sự chống đỡ cơ học: collagen, elastin
Sự bảo vệ miễn dịch
Sự tạo ra và dẫn truyền xung động thần kinh: Rhodopsin Điều hòa: hormone Dự trữ dinh dưỡng lOMoARcPSD| 36625228 THANK YOU! L.O.G.O 63 34
Downloaded by Jin Dian (dianjin008@gmail.com)




