









Preview text:
lOMoARcPSD| 36625228 Chương 11 Hóa học Hemoglobin 1 Nội dung Đại cương Hemoglobin (Hb) 2 lOMoARcPSD| 36625228
1 . ĐẠI CƯƠNG Cromoprotein
Protein phức tạp có nhóm ngoại là chất màu • Flavoprotein • Hemoglobin
( riboflavin ) • Myoglobin • Feritin (Fe) • Chlorophyl • Homocyanin • Cytocrom ( Cu ) • Catalase lOMoARcPSD| 36625228 Porphyrin Cấu tạo hóa học Nhân cơ bản là porphin • 4 vòng pyrol đánh số I, II, III, IV (chiều KĐH) • 4 cầu nối methylen ký hiệu a, b, g, d • Nhóm thế trên khung đánh số từ 1 đến 8 Porphyrin Cấu tạo hóa học
Porhyrin = nhân porphin + nhóm thế • Methyl (M) • Acetyl (A) • Propionyl (P) • Vinyl (V) Porphyrin Tính chất Có màu
Độ tan phụ thuộc số lượng nhóm carboxyl
Tạo phức với kim loại
Tính kiềm yếu (N nhân pyrol) + tính acid (nhóm
–COOH mạch nhánh). pH i ~ 3-4.5
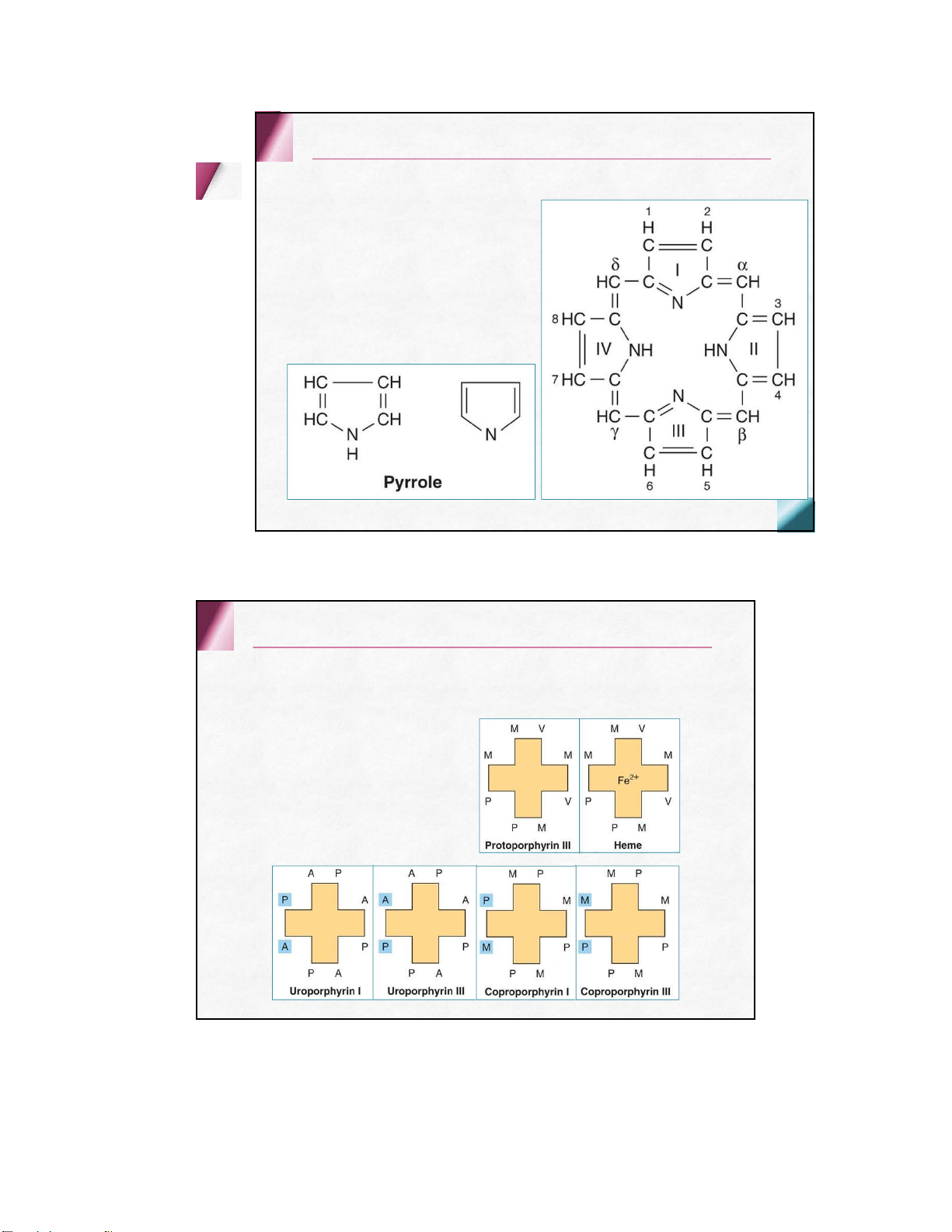
2 . HEMOGLOBIN (HB ) Hb -Protein vậnchuyểnO 2 Kíhiệu:Hb(huyết sắctố, huyếtcầu tố), màuđỏ Hồngcầungười chứa~ 32% Hb (15 g/100 ml máu toànphần) Vaitrò Vận chuyển O 2 , CO 2 hệ đệmquantrọng Cấu tạo hóa học Gồm 2 phần:
Protein thuần : globin (apoprotein )
Nhóm ngoại : hem (nhóm prosthetic ) Hem
Là hợp chất gồm có nhân protoporphyrin IX gắn
với sắt hóa trị II ( Fe 2+ )
Fe 2+ nằmởtrungtâmnốivới4nguyêntửNcủa4
vòngpyrolqua4liênkết(2lkCHTvà2lkphốitrí) Hem
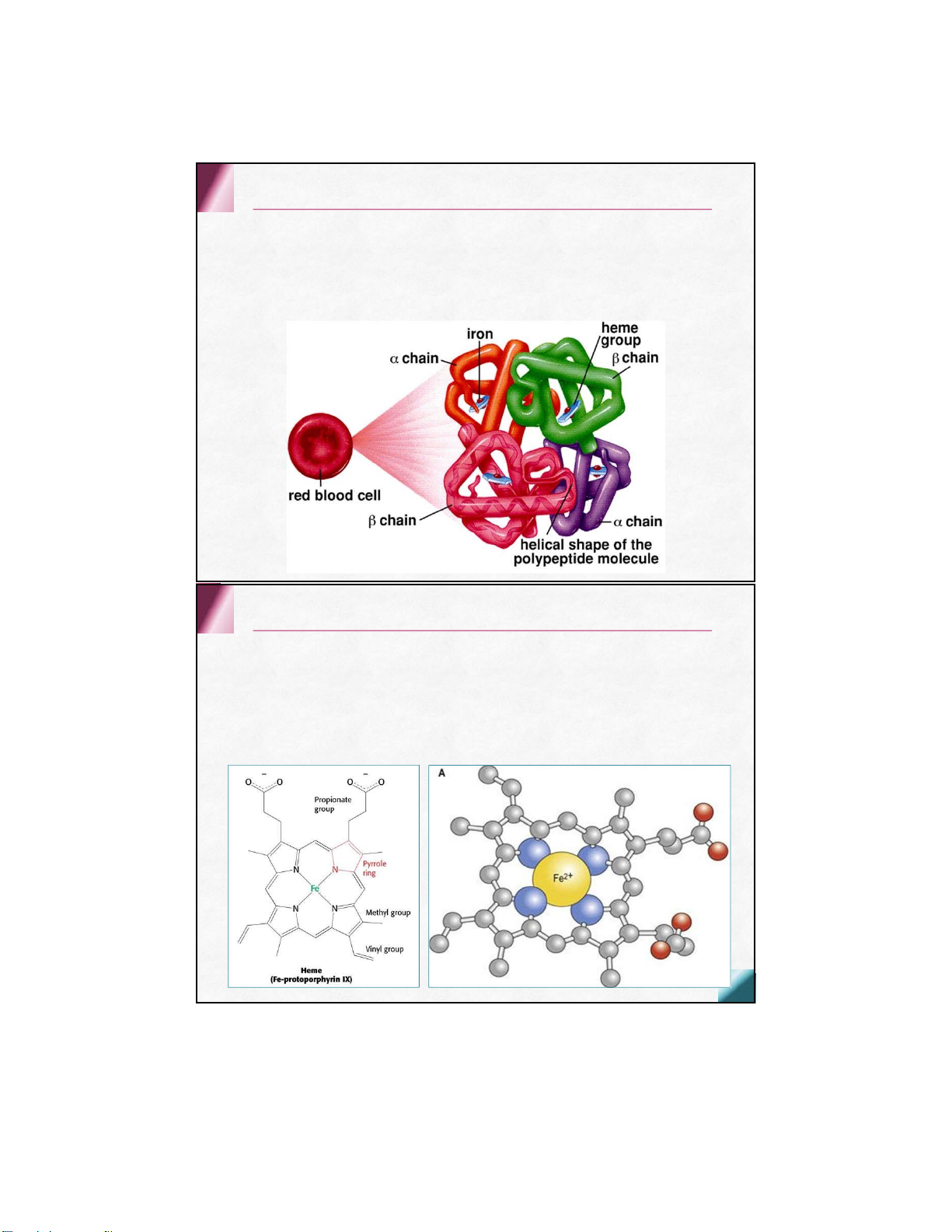
Fe 2+ còn 2 lk phối trí thẳng góc mp phân tử, mỗi lk 1 phía Kết hợp globin Kết hợp O 2 /CO 2 Hem
Hem bị oxi hóa thành hematin , khi đó Fe 2+ biến thành Fe 3+
Hematin kết tinh dạng muối tinh thể clohydrat đặc
biệt(tinh thể Hemin hay Teichman).
Ứng dụng: xác định vết máu trong pháp y Globin
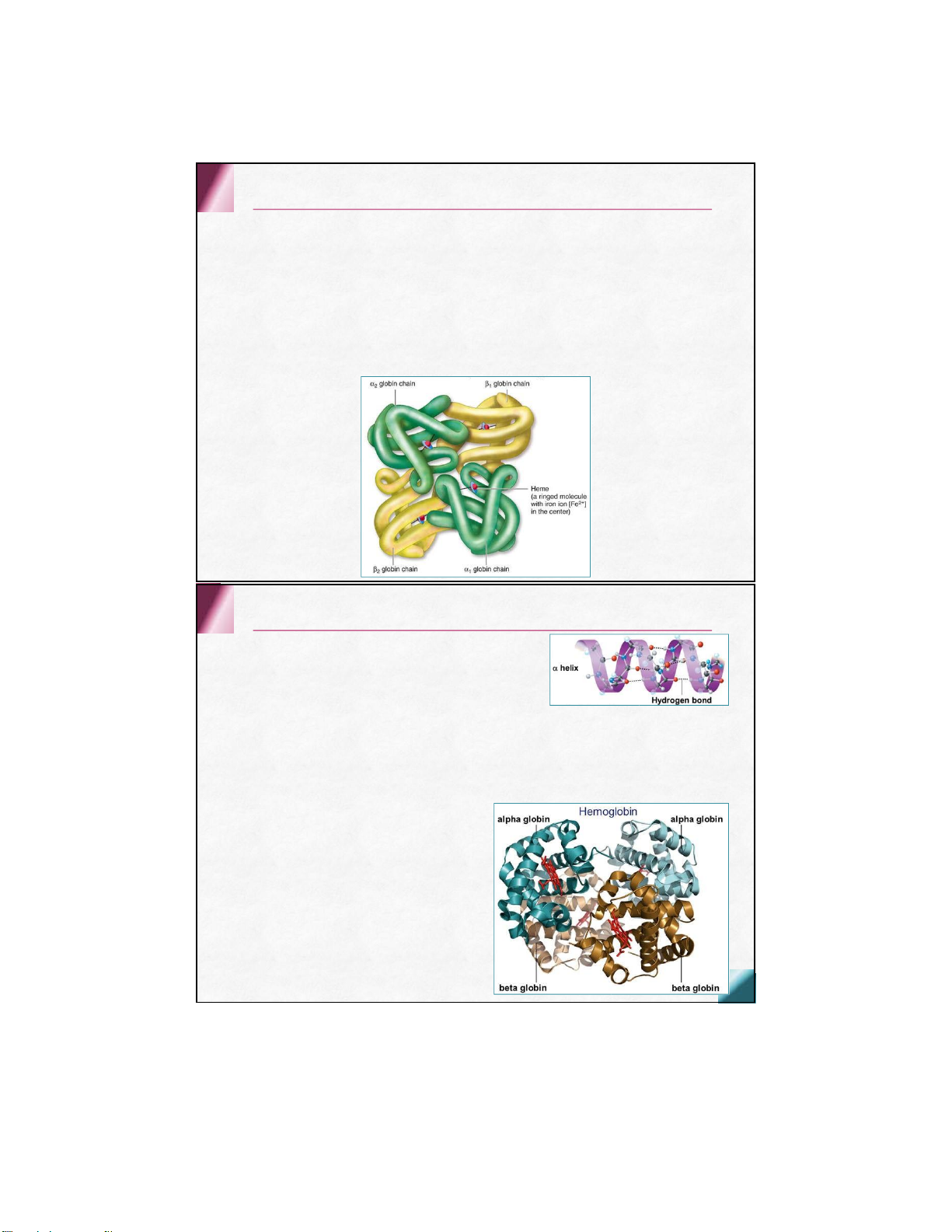
Ở ngườitrưởngthành, globincủaHbA gồm
4 chuỗipolypeptide cócấutrúcbậcI
2 chuỗi α mỗichuỗicó 141 aa
2 chuỗi β mỗichuỗicó 146 aa
Cácchuỗigắn với nhau bằng tương tác không cộnghóa
trịtạothành 2 dimer (αβ) 1 và(αβ) 2 Globin Trong cấu trúc bậc II
chuỗi α tạo nên 7 đoạn xoắn chuỗi β tạo nên 8 đoạn xoắn
Mỗi đoạn xoắn từ 7 – 20 aa, ký hiệu A,B, C…
Trong cấu trúc bậc III
Các chuỗi α, β cuộn khúc tại đoạn aa không xoắn
Mỗi chuỗi polypeptid xoắn và cuộn khúc + Hem = tiểu đơn vị của Hb Về mặt không gian
Globin tạo khe kỵ nước
Hem vùi trong khe kỵ nước Tương tác bằng các lk: • ion • Hydro • Lực Van der waals Cấu trúc của Hemoglobin
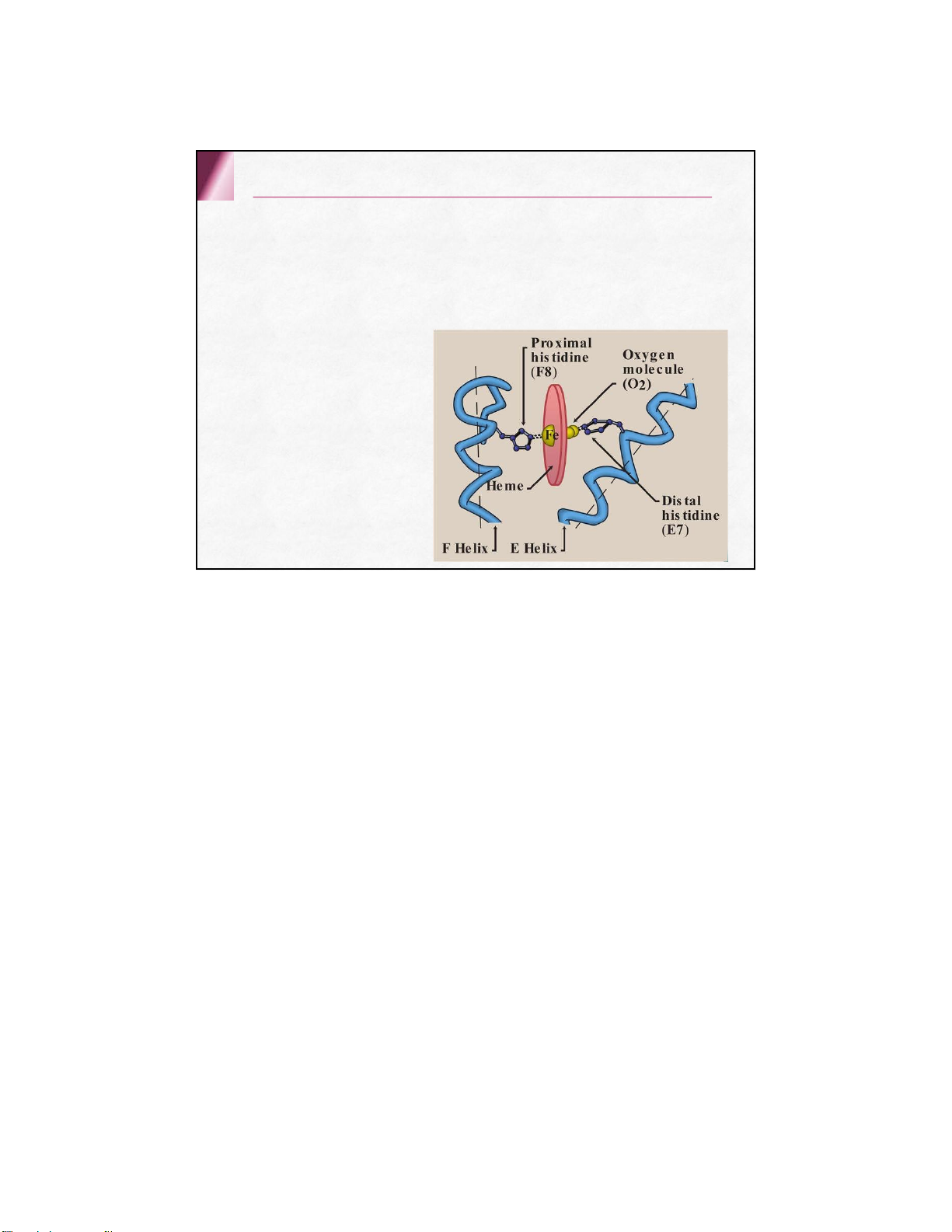
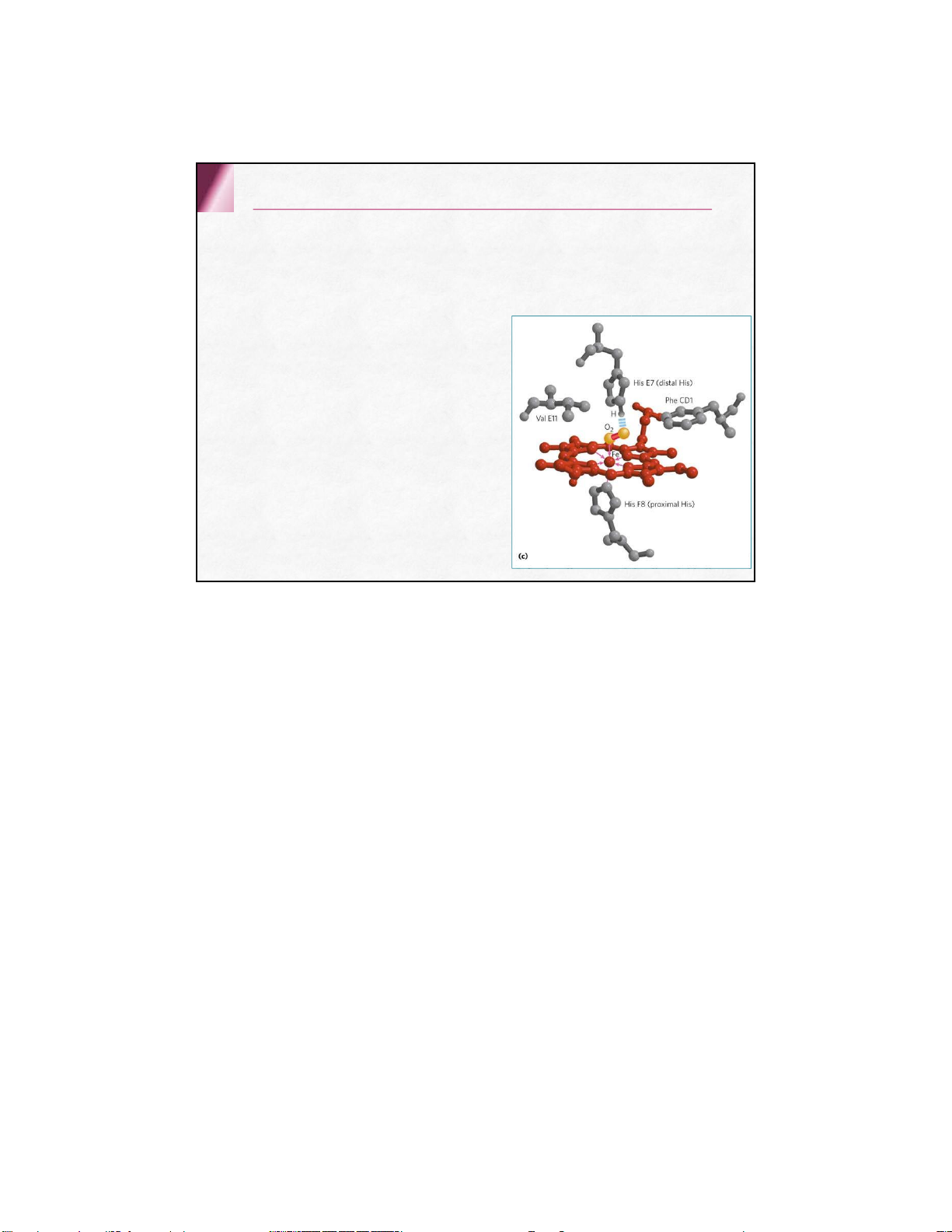
Mỗi chuỗi polypeptide của globin kết hợp 1
Hem qua 2 liên kết phối trí giữa Fe2+ của
Hem với 2 N của nhân imidazol thuộc aa
Histidin trong mỗi chuỗi globin một tiểu đơn vị His F8: his gần ( kết hợp trực tiếp) His E7: his xa 2.2 . Các loại Hemoglobin
Globin quyết định đặc tính chủng loại của Hb Các Globin khác nhau do
thành phần và thứ tự sắp xếpcủa các aa khác nhau
làm thay đổi cấu trúc và tính chấtcủa Hb 2.2. Các loại Hemoglobin Hb bình thường Hb G Phôi thai Hb P Phôi thai
Hb F Bào thai và trẻ sơ sinh Hb A Người trưởng thành Hb A2
2,5% tổng số Hb ở người trưởng thành
Khác nhau về thành phần aa ở đoạn xoắn F của globin Chuỗi
Vị trí xoắn polypetid/Hb F1 F2 F3 F4 F5 F6 F7 F8
F9 Hb A (b) Phe Ala Thr Leu Ser Glu Leu His Cys Hb A2 (d)
Phe Ser Gln Leu Ser Glu Leu His Cys Hb F (g)
Phe Phe Gln Leu Ser Glu Leu His Cys 2.2. Các loại Hemoglobin Hemoglobin bất thường
Sự thay đổi thành phần và thứ tự của các aa trong phân tử Globin
Thay đổi độ tan và độ bền vững của Hb
Ảnh hưởng đến ái lực của Hb đối với oxy cũng
như sự vận chuyển oxy đến các tổ chức
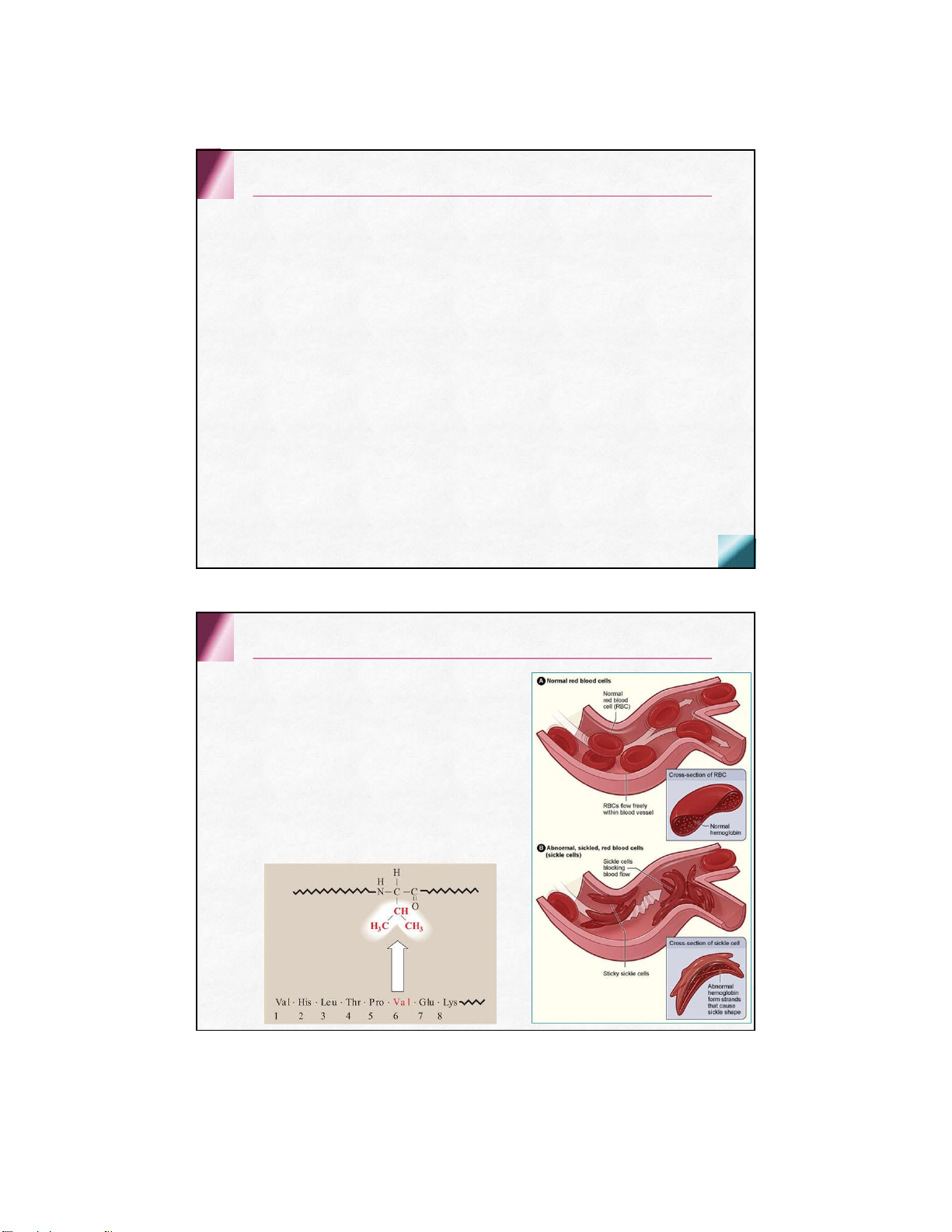
Hb bất thường gây bệnh lý HbS
Glu ở vị trí 6 của chuỗi βđược
thay bằng val , HC có dạng lưỡi liềm
HC bị phá hủy gây thiếu máu tiêu
huyếtmãn tính, đaukéo dài, đột quỵ, suy thận…
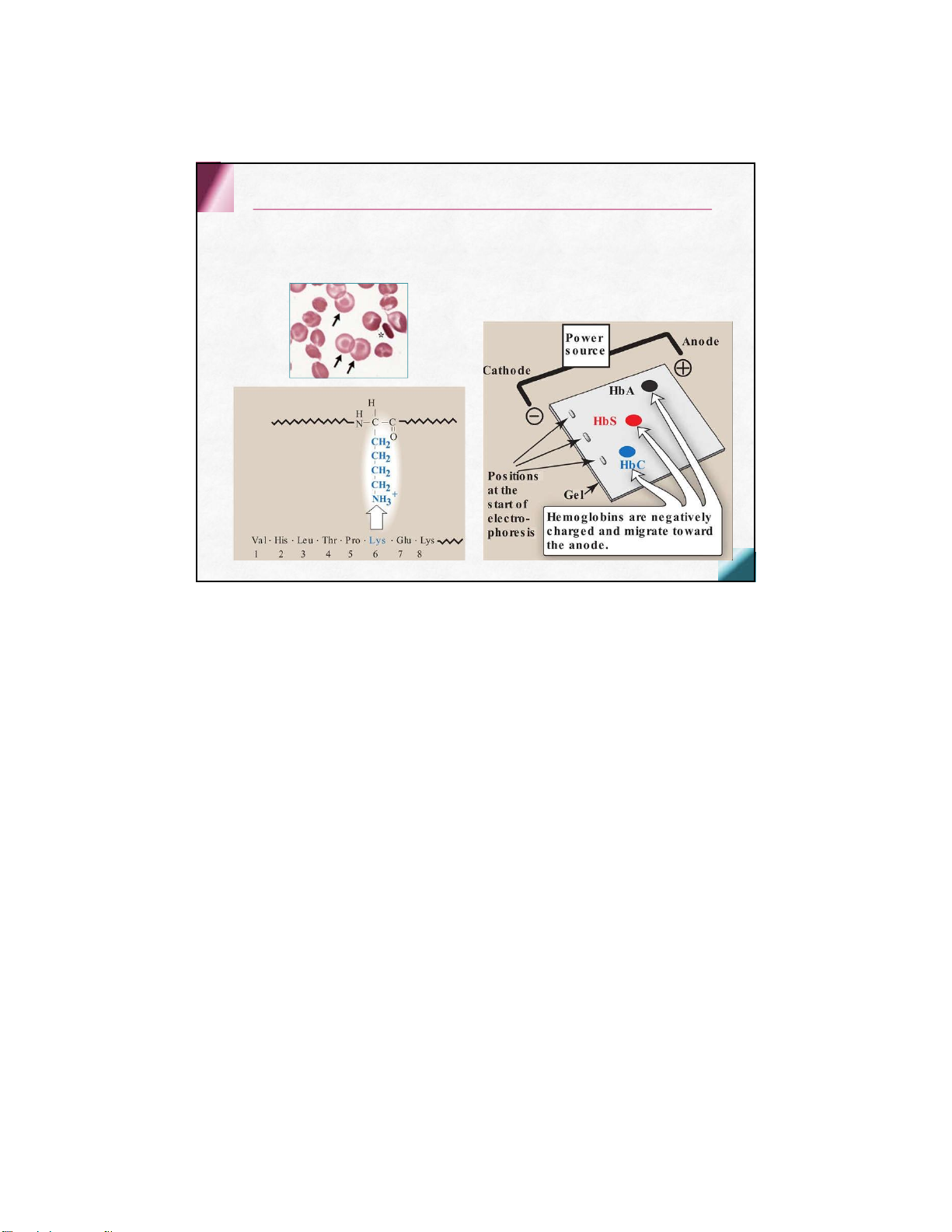
Chẩn đoán: điện di,Hb S chuyển
dịch về anodchậm hơn HbA HbC
Glu ở vị trí 6 của chuỗi βđược thay bằng lysin
Hồng cầu có hình bia Hb M
Fe luôn ở trạng thái Fe 3+ tạo methemoglobin máu
không chữa được bằng thuốc Thalassemia α- Thalassemia
bất thường/tổng hợp chuỗi polypeptidα tạoHb Bart và Hb H
Gây bệnh thiếu máu hồng cầu nhỏ nhược sắc β- Thalassemia
Đột biến/tổng hợp chuỗi β gây bệnh thiếu máu huyết giải
Xảy ra chủ yếu ở vùng Địa Trung Hải 2.2. Các loại Hemoglobin
Hb bất thường (Hb bệnh lý) HbS (α A S 2 β2 )
Hồng cầu có dạng lưỡi liềm HbC (α A C 2 β2 )
Gây thiếu máu huyết giải nhẹ HbM
Hiện tượng tạo methemoglobin máu do
Fe luôn ở trạng thái Fe3+ Thalassemia
Bệnh thiếu máu huyết giải do di truyền
xảy ra vì có sự mất cân bằng trong tổng
hợp các chuỗi polypeptide của globin
•Bệnh α- •Do bất thường trong tổng hợp chuỗi thalassemia polypeptide α
•Bệnh β- •Do có những đột biến trong tổng hợp thalassemia chuỗi β
2.3 . Tính chất của hemoglobin Kết hợp với O 2 Kết hợp với CO 2 Kết hợp CO Sự oxy hóa Hb
Tính chất enzyme của Hb Kết hợp với O 2 Cơ chế kết hợp Hb + O 2 ↔ HbO 2 Hemoglobin oxyhemoglobin
Đây là PƯ gắn oxy hay sự oxygen hóa, không phải PƯ oxh vì ion sắt vẫn còn hóa trị 2
Lk phối trí giữa His E7 và
Fe 2+ bị đứt, 1phân tử O 2
sẽ thế chỗ His E7 để gắn với Fe 2+
1 phân tử Hb gắn được 4 phân tử O 2
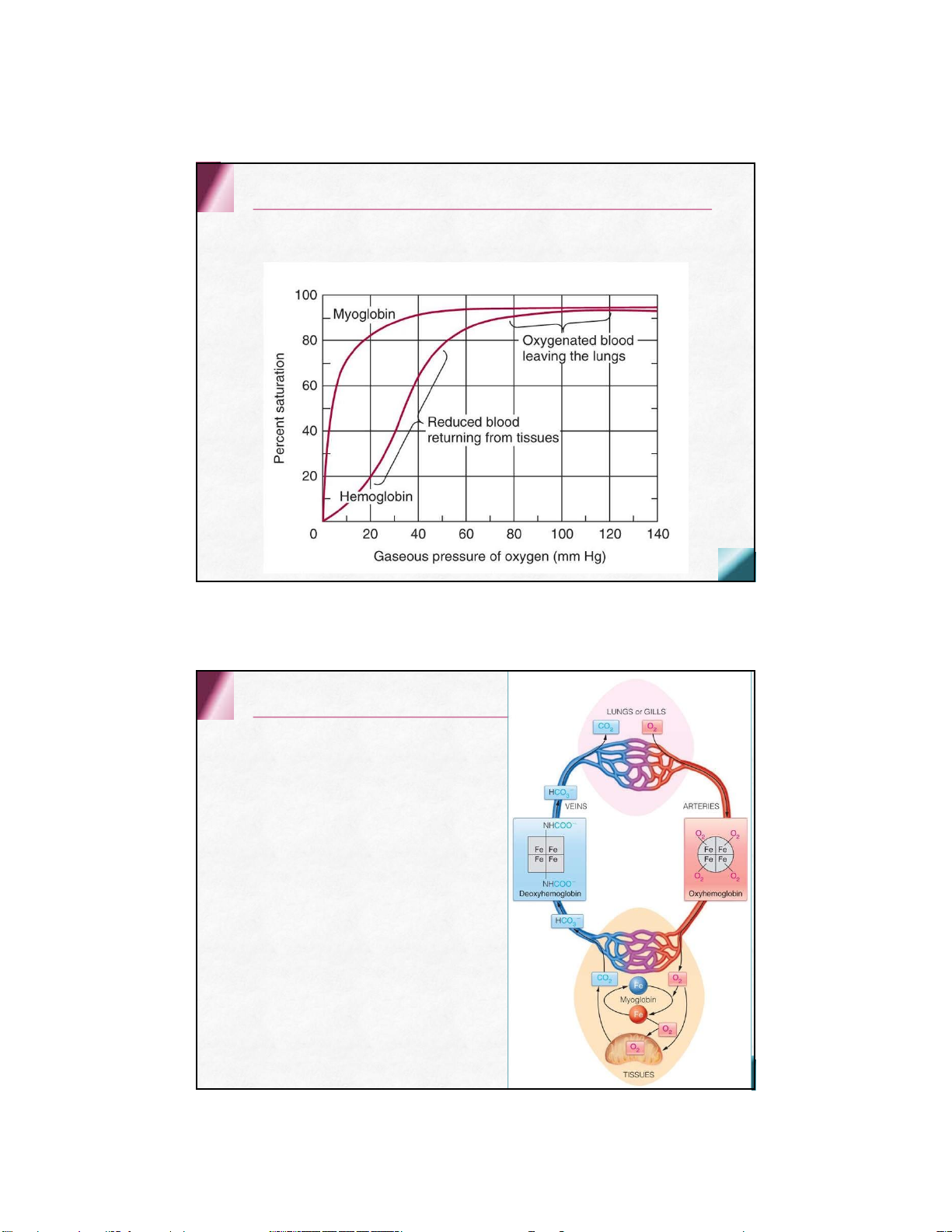
Đường cong bão hòa oxy
Deoxyhemoglobin- Oxyhemoglobin
Cấu hình không gắn oxy (Deoxyhemoglobin)
Dạng “căng” hay (Tense)
Có ái lực yếu đối với oxy
Dimer αβ tương tác với nhau
qua hệ thống lk hydro và ion
Bền vững nhờ sự hình thành
các cầu muối giữa các chuỗi Cấu hình gắn oxy (Oxyhemoglobin)
Dạng “dãn” hay (Relax)
Có ái lực mạnh đối với oxy
Liên kết hydro và ion giữa các
dimer bị cắt đứt, các cầu muối bị phá vỡ, các chuỗi
polypeptid di chuyển tự do hơn
D eoxyhemoglobin-Oxyhemoglobin
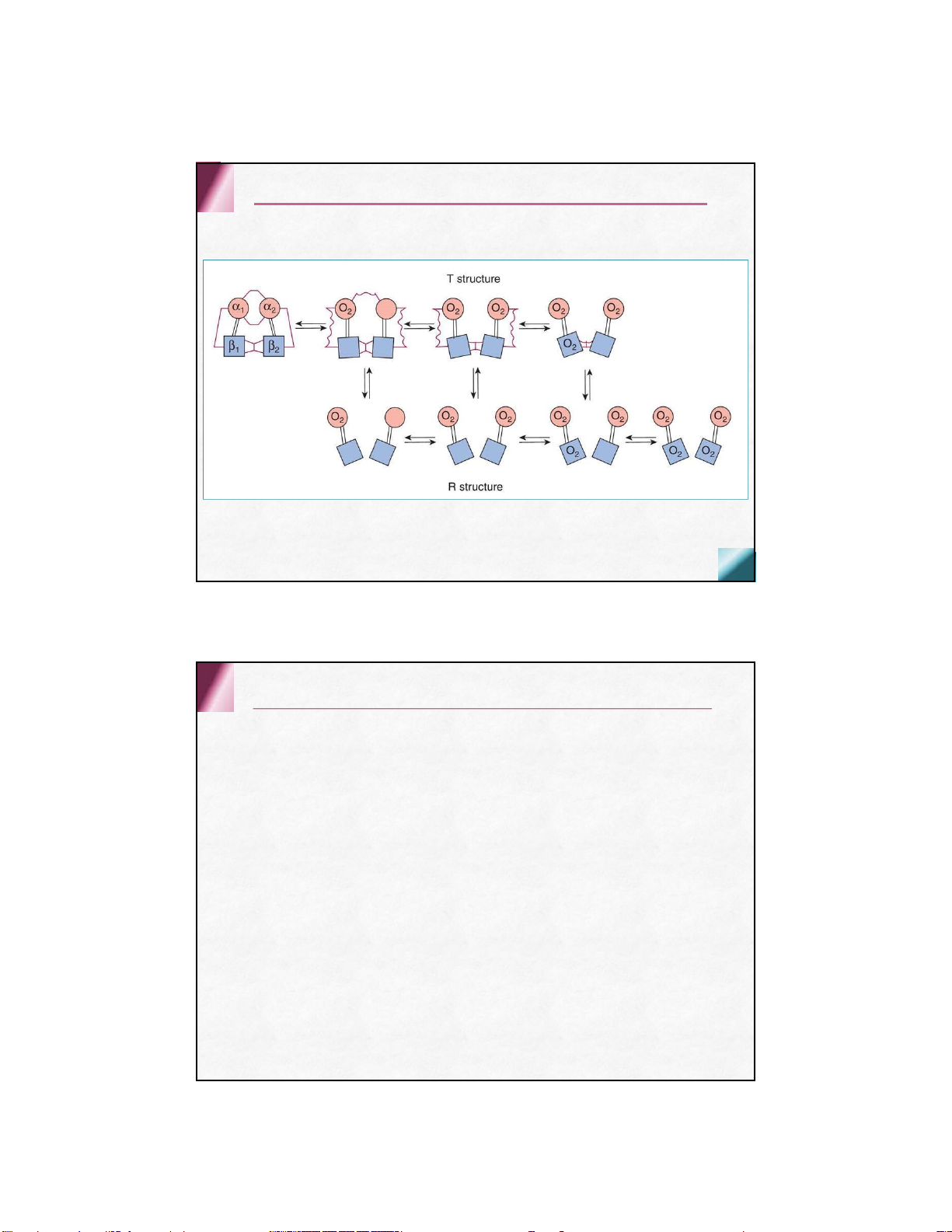
cấu hình không gắn oxy –trạng thái T
cấu hình gắn oxy –trạng thái R
Các YTAH sự kết hợp giữa Hb với O2 Tương tác hem-hem
Các tiểu đơn vị có tác động cộng lực: sự kết
hợp của 1 phân tử oxy với Hem đầu tiên sẽ làm
tăng ái lực của oxy với các Hem còn lại Phân áp của O2 (pO2)
Ở phổi: pO2 cao, PƯ theo chiều thuận tạo HbO2
theo máu đến mô (khoảng 97%-98% Hb được bão hòa O2)
Ở mô: pO2 thấp, PƯ theo chiều nghịch, HbO2 bị
phân ly nhả O2 để cung cấp cho các mô
Hb đóng vai trò vận chuyển O2 từ phổi đến các tổ chức
Các YTAH sự kết hợp giữa Hb với O 2
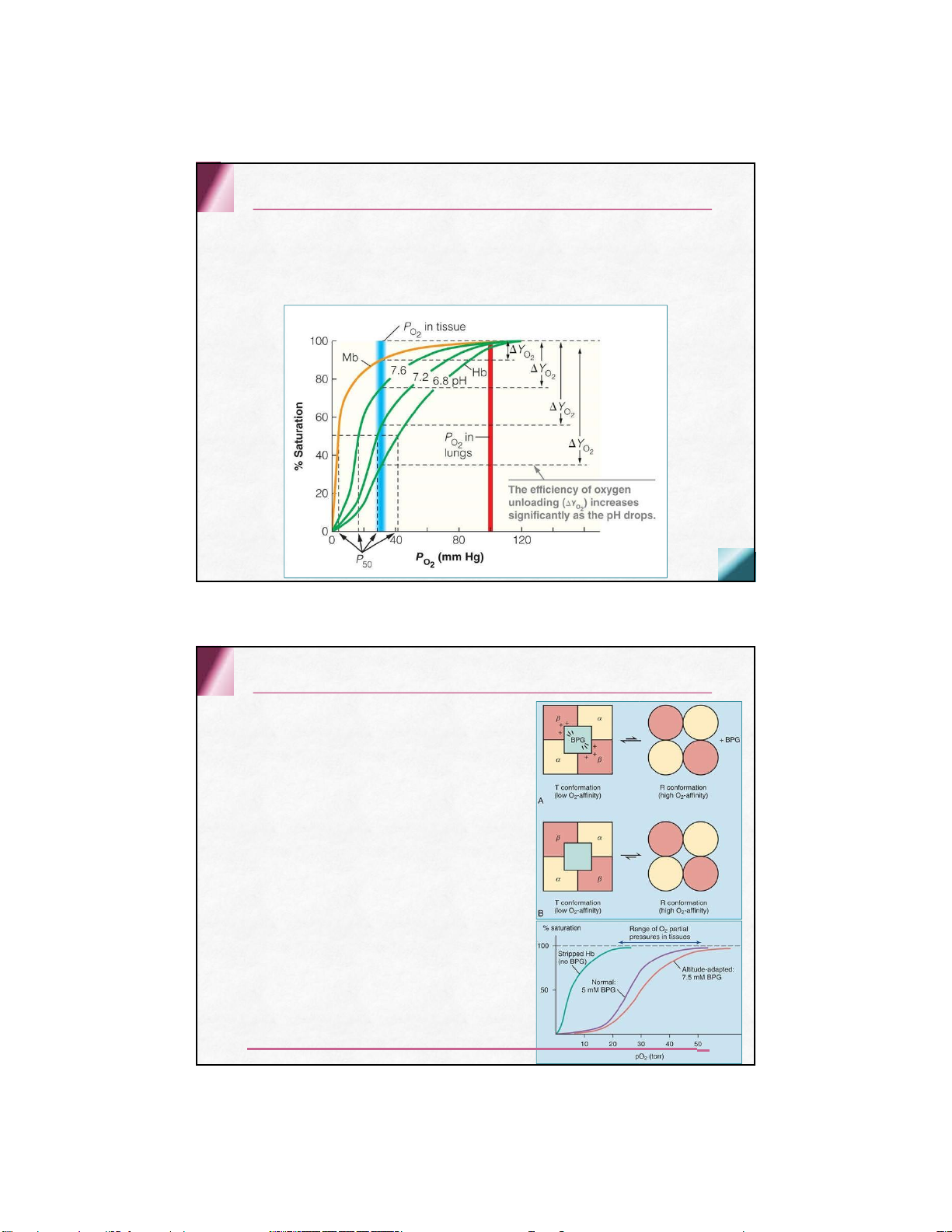
Sự thay đổi của pH –hiệu ứng Bohr
Khi pH của máu giảm hay khi phân áp CO 2 ( pCO 2 ) tăng,
khả năng kết hợp với oxy của Hb giảm
Các YTAH sự kết hợp giữa Hb với O2
Chất điều hòa 2,3-BPG (2,3-biphosphoglycerat)
Sản phẩm trung gian của quá trình thoái hóa glucid
Có khả năng kết hợp và làm bền vững
cấu hình T của phân tử
deoxyhemoglobin, giảm khả năng kết
hợp với oxy, kích thích giải phóng oxy ở các tổ chức
Vị trí kết hợp: khe hở giữa 2 chuỗi β,
trung tâm phân tử deoxyhemoglobin
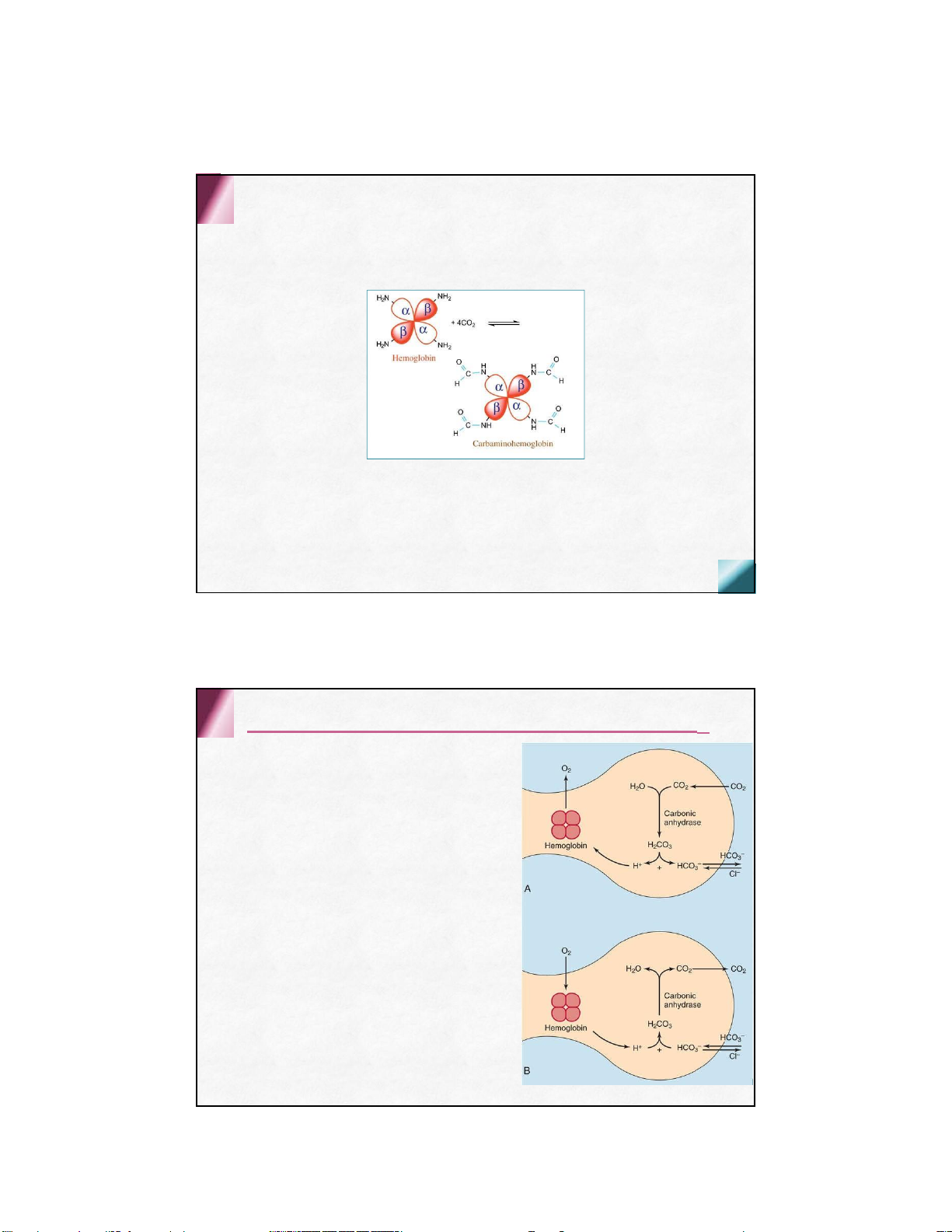
Kết hợp với carbon dioxyd (CO2) Kết hợp trực tiếp
Qua nhóm -NH2 tự do của 4 chuỗi polypeptid tạo dẫn xuất
carbaminohemoglobin (Carbohemoglobin)
Ở mô: pCO2 cao (46mmHg) PƯ theo chiều
thuận, carbohemoglobin được tạo thành theo máu đến phổi
Ở phổi: pCO2 thấp (36mmHg) PƯ theo
chiều nghịch, phân ly giải phóng CO2 và
đào thải ra ngoài theo đường hô hấp
Kết hợp với carbon dioxyd (CO2) Kết hợp gián tiếp Ở mô:
• H+ được tạo thành từ CO2
• H+ kết hợp với Hb vừa phóng
thích 4 phân tử oxy để tạo
thành HHb+ theo máu về phổi
• Sự tạo H+, giảm pH máu, nồng
độ cao CO2 thúc đẩy phóng
thích oxy và kết hợp với CO2 tại mô Ở phổi:
• oxy gắn vào deoxy Hb sẽ đẩy H+ ra khỏi Hb
• H+ kết hợp với bicarbonat giải
phóng CO2 đào thải ra ngoài theo đường hô hấp
Vai trò: vận chuyển CO2 và H+ từ tổ chức
đến phổi để đào thải ra ngoài
Sự kết hợp với carbon monoxyd (CO)
Tạo thành carboxyhemoglobin (HbCO) rất
bền vững, không còn khả năng vận chuyển oxygen Hb + CO → HbCO
CO gắn vào Hb tại vị trí giống oxy, ái lực với
Hb mạnh hơn oxy gấp 220 lần nên dễ dàng đẩy oxy ra khỏi HbO2 HbO2 + CO ↔ HbCO + O2
HbCO gây ngộ độc nặng
Điều trị: hỗn hợp khí carbogen (95% O2 + 5% CO2) Sự oxy hóa hemoglobin
Các chất oxy hóa (nitrit, nitrate, clorate,
ferricanid, nitrobenzen, polyphenol…) có thể
oxy hóa Fe2+ của Hb thành Fe3+ tạo thành
methemoglobin (M-Hb) và giải phóng điện tử
M-Hb không có khả năng gắn với O2 nên
không có chức năng hô hấp Hb ↔ M-Hb + e-
Tính chất enzyme của hemoglobin
Tính chất của peroxidase Hb hay peroxydase H2O2 + AH2 → 2H2O + A
Ứng dụng: tìm máu trong nước tiểu và phân
Tính chất của Catalase Hb hay catalase 2H2O2 → 2H2O + O2 Tính chất đệm
Hb là hệ đệm trong máu quan trọng thứ 2 sau hệ đệm bicarbonate
M yoglobin (Mb) –protein dựtrữO 2
Cấutrúc: 1 chuỗiglobin vàhem
Trongcytosol củatếbàomôcơ Mb liênkếtvớiO đượ 2 cgiảiphóngtừHb lOMoARcPSD| 36625228 5/26/2018 THANK YOU! L.O.G.O 39 22
Downloaded by Jin Dian (dianjin008@gmail.com)




