lOMoARcPSD|44862240
Phần 1: Bài tập ôn tập phần cơ sở hóa phân tích
Các công tính nồng độ dung dịch
Nồng độ Mol:
Nồng độ đương lượng:
Nồng độ % theo thể tích:
Nồng độ % theo khối lượng:
Nồng độ % m/v:
Nồng độ ppm: biểu thị số mg/ml chất tan có trong 1000g/1000ml mẫu
Nồng độ tỷ lệ: biểu thị phần thể tích chất tan đậm đặc so với phần thể tích
dung môi (nước) HCl 1:3
Công thức chuyển đổi: C
N
= n.C
M
C
M
= 10.d.C%/M
ví dụ: DD HCl 1:3 nghĩa là nếu chia dung dịch đó làm 4 phần thể tích thì
HCl chiếm 1 phần thể tích và nước chiếm 3 phần thể tích.
Các công thức tính pH của các dung dịch.
Dung dịch acid mạnh: pH = -lg /H
+
/ = -lg C
A
Dung
dịch base mạnh: pH = 14 + lg C
B
Dung dịch acid yếu: pH = 1/2pK
a
– 1/2 lg C
A
Dung dịch base yếu: pH = 14 - 1/2pK
b
+ 1/2 lg C
B
Dung
dịch đệm acid yếu và muối base mạnh liên hợp :
pH = pK
a
+ lgC
MA
/C
HA
Dung dịch đệm base yếu và muối acid mạnh liên hợp:
pH = 14 – pK
b
– lg C
MB
/C
B
Phần bài tập về nồng độ và pH của dung dịch
Bài 1 Pha 1lít dung dịch HCl có các nồng độ sau: 10%, 15%. 25 % 30% từ
dung dịch HCl 36% (d = 1,18)
Bài 2 Pha 1lít dung dịch H
2
SO
4
có các nồng độ sau: 10%, 25%. 35 % 40%
từ dung dịch H
2
SO
4
96% (d = 1,84)

lOMoARcPSD|44862240
Bài 3 Từ dung dịch NH
4
OH 1:1. Hãy pha 1lít dung dịch NH
4
OH 1:5, dung
dịch NH
4
OH 2:5, dung dịch NH
4
OH 3:5, dung dịch NH
4
OH 1:8, dung dịch
NH
4
OH 1:4
Giải:
+ 1 lít dung dịch NH
4
OH 1:5, như vậy, nếu chia làm 6 phần thể tích thì 1
phần thể tích là: 1000/6 = 167 ml NH
4
OH đđ và (1000 -167) ml nước. Như vậy
thể tích dung dịch NH
4
OH 1:1 cần là 167 x 2 = 333 ml NH
4
OH 1:1. Suy ra, thể
tích nước thêm vào là 1000 -333 = 667 ml. Lấy 333 ml NH
4
OH 1:1, thêm 667
ml nước, khuấy đều, ta có 1lit dung dịch NH
4
OH 1:5
+ 1 lít dung dịch NH
4
OH 2:5, như vậy, nếu chia làm 7 phần thể tích thì 1
phần thể tích là: (1000/7).2 = 286 ml NH
4
OH đđ và (1000 -286) ml nước.
Như vậy thể tích dung dịch NH
4
OH 1:1 cần là 286 x 2 = 573 ml NH
4
OH 1:1.
Suy ra, thể tích nước thêm vào là 1000 -572 = 428 ml. Lấy 572 ml NH
4
OH 1:1,
thêm 428 ml nước, khuấy đều, ta có 1lit dung dịch NH
4
OH 2:5
Bài 4 Pha 1lít dung dịch NaOH có các nồng độ sau: 10%, 15%. 25 % 30%
từ dung dịch NaOH 40% (d = 1,44)
Bài 5 Tính lượng cân Na
2
B
4
O
7
. 10H
2
O để pha 1 lít dung dịch Na
2
B
4
O
7
0,1N.
Bài 6 Tính lượng cân H
2
C
2
O
4
.2H
2
O để pha 1 lít dung dịch H
2
C
2
O
4
0,1N.Dung dịch pha xong dùng thiết lập nồng độ cho dung dịch NaOH Bài 7
Tính số ml HCl 36,5% (d = 1,18g/ml) để pha 1 lít dung dịch HCl
0,1N
Giải
Ta có dung dịch HCl 36,5% (d = 1.18) có
C
M
= 10.d.C%/M = 10.1,18.36,5/36,5 = 11,8M
Dung dịch HCl có C
N
= C
M
= 11,8N
Hệ số pha loãng: 11,8/0,1 = 118 lần
Như vậy: V
bđ
= V
pha
/K
pha loãng
= 1000/118 = 8,5 ml
Lấy 8,5 ml dung dịch HCl 36,5% (d = 1,18g/ml), thêm 500 ml (thực hiện
trong ống đong hay bình định mức), khuấy đều, thêm nước cất đến vạch định
mức.
Bài 8 Tính số ml H
2
SO
4
96% (d = 1,84) để pha 1 lít dung dịch H
2
SO
4
0,1N
Bài 9 Cho dung dịch CuSO
4
0,1M có K
pl
= x, độ điện ly là . Tính độ tan của
dung dịch khi thêm vào 1 lít dung dịch trên 10gam K
2
SO
4
K
pl
= [Cu
2+
].[SO
4
2-
]/[CuSO
4
] = constan không đổi
Bài 10 Cho dung dịch CuSO
4
0,1M có K
pl
= x, độ điện ly là . Tính độ tan
của dung dịch khi thêm vào 1 lít dung dịch trên 20gam Na
2
SO
4

lOMoARcPSD|44862240
Bài 11. Cho 1 lít dung dịch CH
3
COOH 1M, tính thể tích (ml) CH
3
COOH
99% ( d= 1.025) để thêm vào 1 lít dung dịch trên, sao cho nồng độ CH
3
COOH
đạt 3,75M.
Giải ( Xây dựng phương trình, hay hệ phương trình có ẩn số liên uan đến
thể tích cần lấy). Áp dụng định luật bảo toàn số mol
Ta có: Số mol ban đầu + số mol thêm vào = số mol sau khi thêm
Vì: Số mol = nồng độ mol x thể tích
Suy ra: 1. 1 + x.C
Mdd
đđ = (1 + x).3.75
Nồng độ mol của dung dịch CH
3
COOH 99%
C
M
=10.d.C%/M = 10.1.025.99/60 = 16,91M
Thay vào phương trình: 1.1 + x. 16,91 = 3.75(1+x)
Giải ta có x = 0,21 lít tương đương 210 ml dung dịch CH
3
COOH 99%(d= 1,025
g/ml)
Bài 12. Cho 2 dung dịch CH
3
COOH 1M và CH
3
COOH 3,75M. Tính thể tích của
2 dung dịch sao cho, khi trộn 2 thể tích trên ta có 1,5 lít CH
3
COOH 2M.
Ta có: Số mol dd1 + số mol dd 2 = số mol dd sau khi pha
Hay: x.1 + y.3,75 = 1,5.2
Mặt khác: x + y = 1,5
Giải ta có: x = 0,95 lít, y = 0,55 lít
Bài 11 Tính pH của dung dịch HCl 0,1N [H
+
]=0,1->pH=-lg[H
+
]=1;
0,2M [H
+
]=0,2; 0,05M
Bài 12 Tính pH của dung dịch H
2
SO
4
0,1N [H
+
]=0,1; 0,2M[H
+
]=0,4; 0,05M
[H
+
]= 0,1
Bài 13 Tính pH của dung dịch NaOH 0,1N; 0,2M; 0,05M
Bài 14 Tính pH dung dịch CH
3
COOH 0,1M; 0,01M; 0,02M. Cho pk
a
= 4,75
Bài 15 Tính pH dung dịch NH
4
OH 0,1M; 0,01M; 0,02M. Cho pk
b
= 4,75
Bài 16 Tính pH của dung dịch gồmNH
4
OH 0,1M và NH
4
Cl 0,1M. Tính pH
của dung dịch này thay đổi như thế nào khi thêm vào 1lít dung dịch này 200ml
HCl 0,1N. Cho pK
NH4OH
= 4,75
Bài 17 Tính pH của dung dịch gồmCH
3
COOH 0,1M và CH
3
COONa 0,1M.
Tính pH của dung dịch này thay đổi như thế nào khi thêm vào 1lít dung dịch
này 100ml NaOH 0,1N
Bài 18 Cho 500ml dung dịch CH
3
COOH 0,1M ( pK
a
= 4,75). Người ta
thêm từ từ dung dịch NaOH 0,1M vào 500ml dung dịch trên. Tính pH ở các thời
điểm sau:
a. Khi chưa thêm
b. Thêm được 300ml NaOH 0,1N, tạo CH
3
COONa, thành phần dung
dịch
gồm: CH
3
COOH
còn lại
, CH
3
COONa
sinh ra
, kết hợp thành dung dịch đệm có CT
tính: pH = pK
a
+ lgC
MA
/C
HA
= pK
a
+ lgn
MA/
n
A

lOMoARcPSD|44862240
c. Thêm được 500ml NaOH 0,1N (phản ứng xãy ra là vừa đủ, thành phần
dung dịch sau pu là: CH
3
COONa, đây là dung dịch base yếu, CT tính pH là: pH
= 14 – ½ pK
b
+ ½ lgC
B
d. Thêm được 600ml NaOH 0,1N, lúc này NaOH dư, nên dung dịch là
dung dịch base mạnh, suy ra pH = 14 + lgC
B
Giải
Ta có phản ứng: CH
3
COOH + NaOH cho ra CH
3
COONa + H
2
O
a. Khi chưa thêm NaOH thì dung dịch là dung dịch acid yếu CH
3
COOH
Suy ra pH dung dịch được tính như sau: pH = 1/2pKa – ½ lgC
A
= ½.
4,75 – ½ . lg 0,1 = 2,875
b. Khi thểm 300 ml NaOH 0,1N, theo phản xãy ra ta có thành phần chính
của dd là CH
3
COOH và CH
3
COONa. Đây chính là thành phần của dung
dịch đệm.
Suy ra: pH = pKa + lgC
MA
/C
A
pH = pKa + lg n
MA
/n
A
Dựa vào số liệu bài toán ta có: n
MA
= n
Apu
, n
A=
n
Abđ
- n
Apu
Suy ra: n
MA
= 0,3.0,1 = 0,03 mol, n
A =
0,5.0,1 – 0,03 = 0,02 mol
Thay vào: pH = 4,75 + lg 0,03/0,02 = 4,93
c. Thêm 500 ml NaOH 0,1N, ta thấy phản ứng xãy ra vừa đủ, nên thành
phần chính của dung dịch là CH
3
COONa. Đây là dung dịch của base
yếu (CH
3
COO
-
).
Suy ra: pH = 14 - 1/2pK
b
+ 1/2 lg C
B
Với pK
b
= 14 – pKa = 14 – 4.75 = 9,25 C
B
=
n
B
/ V
dd
= n
CH3COONa
/V
dd
= 0,05/1 = 0,05M
Suy ra: pH = 14 – ½.9,25 + 1/2lg0,05 = 8,72
d. Khi thêm 600 ml NaOH 0,1N thì dung dịch là dung dịch của base
mạnh.
Suy ra: pH = 14 + lg C
b
= 14 + lgn
B
/V
dd
= 14 + lg0,01/1,1= 12
Bài tập về nhà:
Cho 500ml dung dịch NH
4
OH 0,1M ( pK
b
= 4,75). Người ta thêm từ
từ dung dịch HCl 0,1M vào 500ml dung dịch trên. Tính pH ở các
thời điểm sau:
a. Khi chưa thêm
b. Thêm được 300ml HCl 0,1M
c. Thêm được 500ml HCl 0,1M
d. Thêm được 600ml HCl 0,1M
Bài 19 Tính pH của dung dịch Na
2
B
4
O
7
0,1M. Cho axit H
3
BO
3
có pk
1
= a và
mpk
2
= b
Bài 20 Tính pH của dung dịch CH
3
COOH 0,1M. Cho pk
CH3COOH
= 4,75,
pk
NH4OH
= 4,75

lOMoARcPSD|44862240
Bài 21. Cho dung dịch CH
3
COOH 0,1M a.
Tính pH của dung dịch
Dung dịch CH
3
COOH là dung dịch acid yếu
Suy ra: pH = ½pK
a
+ ½ lgC
a
= ½ 4,75 – ½ lg0,1 = 2,875
b. Tính lượng gam NaOH cho vào 500ml dung dịch trên, để pH của dung
dịch đạt 5,12 < 7 < 8,72 chứng tỏ thành phần dung dịch khổng thể là
CH
3
COONa. Nên thành phần dung dịch phải là CH
3
COOH
dư
và
CH
3
COONa, đây chính là dung dịch đệm, nên: pH = pK
a
+ lgC
MA
/C
A
,
theo bài thì pH = 5,12, suy ra được lgC
MA
/C
A
=?, suy ra n
MA
/n
A
= ?, (tìm
thêm 1 PT liên hệ giữa n
MA
và n
A
để giải hệ PT) từ đó tính được n
MA
=
n
NaOH
suy ra khối lượng NaOH cho vào
Khi cho NaOH vào ta có phản ứng:
NaOH + CH
3
COOH CH
3
COONa + H
2
O
n
A
= 0,05 - n
MA
Trong dung dịch gồm có 2 thành chính CH
3
COOH, CH
3
COONa. Đây
chính là dung dịch đệm Suy ra: pH= pKa + lgC
MA
/C
A
5,12 = 4,75 + lg n
MA
/n
A
= 4,75 + lg y/x
Mặt khác từ phản ứng ta có : nCH3COOHbđ = nCH3COOHconlai + nCH3COONa
0,1.0,5 = x + y
Giải ta có: x = 0,035 (mol) , y = 0,015 (mol) =
n
CH3COONa
Mà: n
CH3COONa
= n
NaOH
= 0,015. Suy ra số gam NaOH = 0,015.40 = 0,6
gam
Bài 22. Cho dung dịch CH
3
COOH 0,5M aTính
pH của dung dịch
b.Tinh lượng thể tích NaOH 1M cho vào 700ml dung dịch trên, để pH của
dung dịch đạt 5,12
Bài 23. Cho dung dịch NH
4
OH 0,5M aTính
pH của dung dịch a
b.Tinh lượng thể tích HCl 1M cho vào 700ml dung dịch trên, để pH của
dung dịch đạt 8,3
Bài 24: Tính số gam tinh thể CH
3
COONa và số ml dung dịch
CH
3
COOH 99% (d=1.025) để pha 1 lít dung dịch có pH=5
Diễn giải: Pha 1 lít dung dịch có pH = 5, gồm 2 thành phần CH
3
COOH
và CH
3
COONa. Dung dịch có 2 thành phần trên là dung dịch đệm
Suy ra: pH = pK
A
+ lgC
MA
/C
A
= 5
Hay: 5 = 4,75 + lg n
MA
/n
A
Suy ra: n
MA
/n
A
=
1,78 = 1,78/1 = 0,89/0,5 = ….
Chọn: n
MA
= 1,78 mol, suy ra: n
A
= 1 mol
Vậy: nCH3COONa = 1,78 mol, nCH3COOH = 1 mol
Hay: m
CH3COONa
= 1,78x82 = 145,96 gần bằng 146 gam
m
CH3COOH
= 1mol

lOMoARcPSD|44862240
Dung dịch CH
3
COOH 99% (d=1.025) có: C
M
= 10.d.C%/M =
10.1,025.99/60 = 16,91 M
Suy ra thể thích cần thiết là: V
CH3COOH 99% (d=1.025)
= 1000/16,91 = 59,13 ml
Cân 146 gam CH
3
COONa trên cân kỹ thuật, cho vào cốc 1000ml, thêm
500 ml nước cất, khuấy đều cho đến tan, hút bằng pipet 60 ml dung
dịch CH
3
COOH 99% (d=1.025) cho vào cốc trên, khuấy đều, thêm
nước đến vạch 1000ml, sau đó cho vào bình hoá chất 1000ml chứa
dung dịch trên. Nhãn: DD đệm acetat, pH = 5, ngày pha: Từ đó tính
được n
MA
, suy ra được khối lượng CH
3
COONa
Từ đó tính được n
A
, suy ra được thể tích CH
3
COOH 99% (d=1.025)
Ví dụ: n
MA
/n
A
=
1,492 = 1,492/1 = 0,746/0,5 = ……….
Bài 25: Tính số ml HCl 36,5% (d=1.18) và số ml dung dịch NH
4
OH 58%
(d=0.88) để pha 1 lít dung dịch có pH=10
Phần bài tập kết tủa và hòa tan
Bài 1 Tính tích số tan của BaSO
4
ở 20
0
C, biết rằng 100ml dung dịch này
bão hòa tại nhiệt độ đó chứa 0,245mg BaSO
4
Bài 2 Tính độ tan của CaSO
4
, biết tích số tan của nó ở 25
0
C là T
CaSO4
=
9,1.10
-6
Bài 3: Tính độ tan của CaSO
4
trong dung dịch K
2
SO
4
0,02M và so sánh với
độ tan của nó trong nước là S = 3.10
-3
, biết T
CaSO4
= 9,1.10
-6
Bài 4 Tính độ tan của BaSO
4
trong dung dịch Na
2
SO
4
0,01M và so sánh với
độ tan của nó trong nước là S =1,05.10
-5
, biết T
BaSO4
= 1,03.10
-10
Bài 5 Tính độ tan của CaC
2
O
4
trong dung dịch có pH = 4. Biết rằng
T
CaC2O4
=2,3.10
-9
và bỏ qua sự tương tác của ion C
2
O
4
2-
với H
+
trong dung dịch
Bài 6 Tính độ tan của Ag
2
S trong nước. Biết rằng T
Ag2S
=6,3.10
-50
và bỏ qua
sự tương tác S
2-
và H
+
trong dung dịch
Bài 7.Một dung dịch AgNO
3
0,001M có thể tích là 500ml, người ta thêm
vào dung dịch đó 1ml Na
2
S 0,001M. Hảy xác định có kết tủa xuất hiện không ?
Cho TAg2S= 6,3.10-50
Bài 8 Người ta kết tủa ion Ba
2+
trong 100ml dung dịch BaCl
2
0,01M bằng
dung dịch 10ml Na
2
SO
4
0,1M. Hỏi có kết tủa hình thành không?Kết tủa của
Ba
2
SO
4
có hoàn toàn không nếu chấp nhận lúc đó [Ba
2+
] < 10
-6
. Biết T
BaSO4
=
1,03.10
-10
.
Bài 9 Người ta kết tủa ion Ag
+
trong 100ml dung dịch AgNO
3
0,01M bằng
dung dịch 5ml NaCl 0,1M. Hỏi có kết tủa hình thành không?Kết tủa của AgCl
có hoàn toàn không nếu chấp nhận lúc đó [Ag
+
] < 10
-6
. Biết T
AgCl
= 10
-10
.

lOMoARcPSD|44862240
Phần bài tập định lượng
1. Để xác định hàm lượng H
3
PO
4
người ta hút 5ml dung dịch cần xác định,
hòa tan định mức thành 250ml. Lấy 10ml sau khi định mức, đem chuẩn trực tiếp
với NaOH 0,086N chỉ thị phenolphtalein. Thể tích NaOH tiêu tốn cho quá
trình chuẩn độ là 15,75ml. Các thành phần tồn tại ở các nấc
Nấc 1: NaH
2
PO
4
, Nấc 2: Na
2
HPO
4
, Nấc 3: Na
3
PO
4
( PP: 8-10)
Viết các phản ứng xảy ra?
Tính hàm lượng g/lit H
3
PO
4
?
Giải
V
mẫu
= 5 ml, V
đm
= 250 ml, V
xđ
= 10 ml,
Các phản ứng: NaOH + H
3
PO
4
cho ra NaH
2
PO
4
+ H
2
O (1)
NaOH + NaH
2
PO
4
cho ra Na
2
HPO
4
+ H
2
O (2)
Tiếp tục NaOH với Na
2
HPO
4
cho ra Na
3
PO
4
(3)
Xác định phản ứng dừng lại ở nấc nào. Đề xác định nấc phản ứng phải dựa
vào chỉ thị dùng cho phản ứng chuẩn độ.
Ở đây dùng PP (có khoảng chuyển màu từ 8 đến 10), tại điểm tương đương
dung dịch chuyển từ không màu ua màu hồng nhạt. Vì vậy, pH tại điểm
tương đương là pH của dung dịch base yếu. Nên phản ứng chuẩn độ dừng ở
nấc thứ 2. Vì vậy Đ
H3PO4
= M/2
Theo định luật đương lượng: (NV)
H3PO4
=(NV)
NaOH
Trong 1 phản ứng hoá học các chất tham gia, hay các chất hình thành sau
phản ứng có số mđlg hay đlg bằng nhau
= mdlgH
3
PO
4
.(NV)
NaOH
. V
đm
/V
xđ.
1000/V
bđ
Ta có: g/lit H
3
PO
4
= mdlgH
3
PO
4
.(NV)
H3PO4
. V
đm
/V
xđ
. 1000/V
bđ
= M/2.1000. (NV)
NaOH
. 250/10. 1000/5
= 98/2.1000.(0,086.15,75).250/10.1000/5
= 332gam/lít
Nếu chỉ thị là MO (3,1 đến 4,4). Hỏi thể tích NaOH tiêu tốn là bao nhiêu?
Màu dung dịch chuẩn độ sẽ chuyển từ Hồng nhạt qua màu vàng cam
Như vậy, pH của dung dịch tại điểm cuối của ua trình chuẩn độ là pH
của dung dịch acid yếu NaH
2
PO
4
.
Nên ĐH3PO4 = M/1, suy ra VNaOH tiêu tốn = 15,75/2
g/lít H
3
PO
4
= M/1.1000. (0,086. 15,75/2)
NaOH
. 250/10. 1000/5
= 332 gam/ lít
2. Để xác định hàm lượng Na
2
CO
3
sử dụng trong thực phẩm, người ta
cân 5 gam mẫu cần xác định, hòa tan định mức thành 250ml. Lấy 15 ml sau
khi định mức, đem chuẩn trực tiếp với dung dịch HCl 0,096N chỉ thị MO. Thể
tích HCl tiêu tốn cho quá trình chuẩn độ là 14,75ml. Viết các phản ứng xảy ra?
m
bđ
= 5 gam, V
đm
= 250ml, V
xđ
= 15ml, V
tt
= 14,75ml, N
HCl
= 0,096N
Na
2
CO
3
+ HCl cho ra NaHCO
3
+ NaCl (1)

lOMoARcPSD|44862240
NaHCO
3
+ HCl cho ra NaCl + H
2
CO
3
(2)
Như vậy phản ứng dừng ở nấc 2 để tạo ra ra mt acid
Suy ra: Đ
NàCO3
= M/2
Ta có: (NV)HCl =(NV)Na2CO3
Tính hàm lượng % Na
2
CO
3
= mdlgNa
2
CO
3
.(NV)
HCl
. V
đm
/V
xđ
. 100/m
bđ
= 106/2.1000. 0,096.14,75.250/15.100/5
= 0,053. 1,416. 16,67. 20
= 25,02%
Nếu dùng chỉ thị PP, thì Đ
NàCO3
= M/1, V
HCl
= 14,75/2 ml
3. Để xác định hàm lượng NH
4
OH người ta hút 5ml dung dịch cần
xác định, hòa tan định mức thành 100ml. Lấy 10ml sau khi định mức, đem
chuẩn trực tiếp với H
2
SO
4
0,086N chỉ thị phenolphtalein. Thể tích H
2
SO
4
tiêu
tốn cho quá trình chuẩn độ là 18,75ml.
Viết các phản ứng xảy ra ?
Tính hàm lượng g/lit NH
4
OH
g/lit NH
4
OH = mđlgNH
4
OH.(NV)
NH4OH
.V
đm
/V
xđ
. 1000/v
bđ
= M/1.1000. (NV)H
2
SO
4
. 100/10.1000/5
= 35/1000.0,086.18,75.100/10.1000/5
= 112,9 gam/lít
4. Để thiết lập nồng độ H
2
SO
4
người ta hút 10ml dung dịch cần xác
định đem chuẩn trực tiếp với Na
2
B
4
O
7
0,096N chỉ thị phenolphtalein. Thể tích
Na
2
B
4
O
7
tiêu tốn cho quá trình chuẩn độ là 12,75ml.
Viết các phản ứng xảy ra ?
Tính nồng độ H
2
SO
4
vừa thiết lập
Na
2
B
4
O
7
+ 7H
2
O
cho ra 2NaOH + 4H
3
BO
3
2NaOH
+ H
2
SO
4
cho ra Na
2
SO
4
+ 2H
2
O
Phản ứng tổng: Na
2
B
4
O
7
+ 5H
2
O + H
2
SO
4
cho ra Na
2
SO
4
+ 4H
3
BO
3
Suy ra: Đ
Na2B4O7
= M/2
Theo định luật đương lượng: (NV)
Na2B4O7
= (NV)
H2SO4
Suy ra: NH2SO4+ = (NV) Na2B4O7/VH2SO4 = 12,75. 0.096/10 = 0,1224N
5. Để xác định hàm lượng CH
3
COOH người ta hút 25ml dung dịch
cần xác định, hòa tan định mức thành 500ml. Lấy 20 ml sau khi định mức, đem
chuẩn trực tiếp với NaOH 0,096N chỉ thị phenolphtalein. Thể tích NaOH tiêu
tốn cho quá trình chuẩn độ là 21,75ml. Viết các phản ứng xảy ra ?
Tính hàm lượng % CH
3
COOH cho d
CH3COOH
= 1,025g/ml
6. Để thiết lập nồng độ NaOH người ta hút 15 ml dung dịch cần xác
định,đem chuẩn trực tiếp với H
2
C
2
O
4
0,096N chỉ thị phenolphtalein. Thể tích
H
2
C
2
O
4
tiêu tốn cho quá trình chuẩn độ là 14,75ml. Viết các phản ứng xảy ra?
2NaOH + H
2
C
2
O
4
cho ra Na
2
C
2
O
4
+ 2H
2
O
Tính nồng độ NaOH vừa thiết lập?

lOMoARcPSD|44862240
Theo định luật đương lượng: (NV)
NaOH
= (NV)
H2C2O4
N
NaOH
= 0,096.14,75/15 = 0,095N
7. Để xác định hàm lượng H
2
S trong môi trường làm việc của một
nhà máy, người ta dùng một máy hút khí có công suất là 2000 lít/giờ. Tiến hành
hút khí liên tục trong 2 giờ, khí sau khi hút được hấp thụ và giải hấp thụ bằng
dung môi thích hợp, sau đó định mức đúng 100ml. Hút 10ml dung dịch sau khi
định mức, cho vào một lượng dư 20ml dung dịch I
2
0,099N. Sau đó chuẩn
lượng dư I
2
còn lại bằng Na
2
S
2
O
3
0,088N, chỉ thị hồ tinh bột. Thể tích Na
2
S
2
O
3
tiêu tốn là 12,75 ml.
Viết các phản ứng xảy ra?
H
2
S + I
2 dư
2HI + S
I
2du
+ Na
2
S
2
O
3
NaI + Na
2
S
4
O
6
Theo định luật đương lượng: (NV)H
2
S = (NV)I
2
– (NV)
Na2S2O3
Tính hàm lượng H
2
S/m
3
gamH
2
S/m
3
= M/2.1000. (NV)H
2
S. V
đm
/Vxđ.1000/2.2000
= M/2.1000. {(NV)
I2
– (NV)Na
2
S
2
O
3
}. V
đm
/V
xđ
.1000/2.2000
= 34/2.1000.{20.0,099 – 12,75.0,088}.100/10.1000/4000
= 0,0364gam/m
3
8. Để xác định hàm lượng CO
2
trong môi trường làm việc của một
nhà máy, người ta dùng một máy hút khí có công suất là 1000 lít/giờ. Tiến
hành hút khí liên tục trong 1,5 giờ, khí sau khi hút được hấp thụ bằng 1000
ml dung dịch Na
2
CO
3
0,099N. Hút 20ml dung dịch Na
2
CO
3
sau khi hấp thụ
đem chuẩn độ với HCl 0,089N với hai chỉ thị PP. Cho thể tích tiêu tốn HCl
khi chuẩn với PP là 10,05ml.
Viết các phản ứng xảy ra ?
Tính hàm lượng CO
2
/m
3
9. Hãy pha 1 lít nước có độ cứng theo CaCO
3
là 500 mg, từ CaCl
2
.
6H
2
O và MgCl
2
.7H
2
O. Biết rằng tỷ lệ số mđlg của Ca
2+
và Mg
2+
là 3:5.
10.Để xác định hàm lượng Protein có trong sữa tươi người ta hút 10 ml sữa
tươi đem đi vô cơ hóa mẫu trong bình KenDahơn, môi trường là H
2
SO
4
đậm
đặc, xúc tác CuSO
4
, chất trợ nhiệt là K
2
SO
4
. Sau khi dung dịch có màu xanh
trong suốt người ta chỉnh môi trường cho đến khi có tính kiềm. Đem chưng cất
ở nhiệt độ 70
0
C, khí NH
3
sinh ra được hấp thụ bằng 100 ml dung dịch H
2
SO
4
0,097N. Sau khi hấp thụ hoàn toàn lượng dư H
2
SO
4
được chuẩn lại bằng dung
dịch NaOH 0,088N. Thể tích NaOH tiêu tốn cho mẫu trắng là 75ml, mẫu thực là
55ml.
Viết các phản ứng xảy ra ?
Tính hàm lượng Protein có trong sữa tươi, biết rằng hệ số chuyển đổi từ
%N sang % Protein là 6,25 và d
sưa’
= 1,25 g/ml?

lOMoARcPSD|44862240
11. Để xác định hàm lượng Ca có trong sữa bột, người ta cân 10,025gam sữa
bột cho chén nung. Tiến hành nung ở nhiệt độ 800
0
C trong vòng 1,5
giờ, sau đó đem hòa tan hoàn toàn bằng một bằng một lượng nhỏ HCl
1N. Dung dịch sau khi hòa tan được trung hòa bằng NH
4
OH 10%với
chỉ thị MO cho đến khi có màu vàng. Lượng Ca có trong dung dịch
được đem kết tủa hoàn toàn bằng thuốc thử (NH
4
)
2
C
2
O
4
4%. Sau đó
đem lọc rửa, nung ở 800
0
C trong 1giờ rồi đem cân. Khối lượng dạng
cân cân được là 0,577gam.
Viết các phản ứng xãy ra?
Ta có : m
bđ
= 10,025g, m
cân
= 0,577g
Gọi C
x
H
y
O
z
N
t
+ O
2
CO
2
+ H
2
O + N
x
O
y
CaO + HCl CaCl
2
+ H
2
O
Canxi trong sữa sau khi cháy cho ra CaO, ngoài ra có Fe
2
O
3
, MgO ,,,
Ca2+ + C2O42- CaC2O4 kết tủa màu trắng
CaC
2
O
4
khi nung tạo CaO + CO + CO
2
Sau khi nung tạo ra CaO, mcân chính là mCaO sau khi nung lần 2
Tính hàm lượng % Ca có trong sữa bột
% Ca = m
cân
.f. 100/m
bđ
, trong đó f là hệ số chuyển
Ý nghỉa của hệ số f: khối lượng dạng cân khi nhận với f sẽ bằng khối lượng
dạng xác định
% Ca = 0,577.M
Ca
/M
CaO
. 100/10,025 = 0,577.40/56.100/10,025 = 41,11%
12. Để xác định hàm lượng Fe có trong bột cá, người ta cân 10,025gam bột cá
cho chén nung. Tiến hành nung ở nhiệt độ 8000C trong vòng 1,5 giờ,
sau đó đem hòa tan hoàn toàn bằng một bằng một lượng dư HCl 1N,
tiến hành định mức thành 100 ml. Lấy 50ml dung dịch sau khi định
mứv để tiến hành phân tích. Lượng Fe có trong dung dịch được đem
kết tủa hoàn toàn bằng NH4OH 10%, trong môi trường nóng. Sau đó
đem lọc rữa, nung ở 8000C trong 1giờ rồi đem cân. Khối lượng dạng
cân cân được là 0,677gam.
a. Viết các phản ứng xãy ra ?
b. Tính hàm lượng % Fe có trong bột cá
13.Để xác định hàm lượng PO
4
3-
có trong bột cá, người ta cân 15,225gam
bột cá cho chén nung. Tiến hành nung ở nhiệt độ 850
0
C trong vòng 1,5
giờ, sau đó đem hòa tan hoàn toàn bằng một bằng một lượng dư HCl
1N. Sau khi loại bỏ các chất gây trở ngại, lượng PO
4
3-
có trong dung
dịch được đem kết tủa hoàn toàn bằng MgCl
2
trong môi trường
NH
4
OH. Sau đó đem lọc rữa, nung ở 800
0
C trong 1giờ rồi đem cân.
Khối lượng dạng cân cân được là 0,467gam.
Viết các phản ứng xãy ra ?
Tính hàm lượng % PO
4
3-
có trong bột cá

lOMoARcPSD|44862240
14.Để xác định hàm lượng chất béo có trong bột sữa, người ta cân
5,825gam bột sữa cho vào túi giấy biết trước khối lượng là 0,505gam.
Tiến hành trích ly bằng dung môi dietylete theo phương pháp Sochlech
cho đến hoàn toàn.Túi giấy chứa phần bột sữa sau khi trích ly được
đuổi sạch ete cân được là 5,755 gam.
15.Hàm lượng đường tổng có trong trái cây được xác định bằng phương
pháp Bertran như sau: mẫu sau khi đồng nhất được cân 5gam đem đi
thủy phân trong môi trường axit HCl 2%, sau đó cho Zn(CH
3
COOH)
2
30% và K
4
[Fe(CN)
6
] vào để loại tạp, rồi định mức thành 250ml. Hút
20ml dung dịch sau khi định mức cho vào 10 Felling A (dung dịch
CuSO
4
), 10ml Felling B (dung dịch kalinatritactrat) đun nóng cho đến
khi kết tủa Cu
2
O xuất hiện hoàn toàn. Lọc, rữa kết tủa, đem hòa tan
bằng một lượng dư Fe
2
(SO
4
)
3
5%. Chuẩn lượng Fe
2+
sinh ra bằng
KMnO
4
0,1N. Thể tích KMnO
4
0,1N tiêu tốn là 15,50ml.
Viết các phản ứng xãy ra?
Giã sử khi tra bảng thể tích 15,50ml KMnO
4
0,1N tương ứng với 22,30
mg. Tính % đường tổng
16.Hàm lượng đường khử có trong trái cây được xác định bằng phương
pháp Bertran như sau: mẫu sau khi đồng nhất được cân 4,25gam đem
đi thủy phân trong môi trường cồn, sau đó cô khô và rồi định mức
thành 100ml. Hút 20ml dung dịch sau khi định mức cho vào 10 Felling
A (dung dịch CuSO
4
), 10ml Felling B (dung dịch kalinatritactrat) đun
nóng cho đến khi kết tủa Cu
2
O xuất hiện hoàn toàn. Lọc, rữa kết tủa,
đem hòa tan bằng một lượng dư Fe
2
(SO
4
)
3
5%. Chuẩn lượng Fe
2+
sinh
ra bằng KMnO
4
0,1N. Thể tích KMnO
4
0,1N tiêu tốn là 8,50ml.
Viết các phản ứng xãy ra?
Giã sử khi tra bảng thể tích 8,50ml KMnO
4
0,1N tương ứng với 12,10
mg. Tính % đường khử
17.Hàm lượng NaCl có trong nước mắm được xác định bằng phương
pháp Monh: mẫu sau khi đồng nhất được hút 20ml pha loãng bằng
nước cất, rồi định mức thành 100ml. Hút 10ml dung dịch sau khi
định mức cho vào 5 giọt K
2
CrO
4
5%, rồi đem chuẩn bằng AgNO
3
0,025N. Thể tích AgNO
3
0,025N tiêu tốn là 7,50ml.
Viết các phản ứng xãy ra?
NaCl + AgNO
3
AgCl + NaNO
3
AgNO3 + K2CrO4 Ag2CrO4 kết tủa đỏ gạch + KNO3
Theo định luật đương lượng, ta có: (NV)
AgNO3
= (NV)
NaCl
Suy ra: gam/ lít NaCl = mdlgNaCl. (NV)
AgNO3
.V
đm
/V
xđ
. 1000/V
bđ
= 58,5/1.1000. 0.025. 7,5. 100/10. 1000/20
= 54,8 gam/lít

lOMoARcPSD|44862240
18.Hàm lượng NaCl có trong cá hộp được xác định bằng phương pháp
Volhard: mẫu sau khi đồng nhất được cân 1,055gam rồi thủy phân
trong môi trường nước sau đó định mức thành 100ml. Hút 10ml dung
dịch sau khi định mức cho vào 15ml AgNO
3
0,05N, 5 giọt Fe
2
(SO
4
)
3
5%, rồi đem chuẩn bằng NH
4
SCN 0,025N. Thể tích NH
4
SCN 0,025N
tiêu tốn là 10,50ml.
Viết các phản ứng xãy ra?
Theo định luật đương lượng, ta có: (NV)
NaCl
= (NV)
AgNO3
– (NV)
NH4SCN
Tính hàm lượng % NaCl trong cá hộp
19.Hàm lượng CO
2
có trong beer được xác định như sau: mẫu sau khi giữ
ở 4
0
C được hút 10ml rồi tha từ từ vào erlen 250 có chứa một lượng dư
100ml Na
2
CO
3
0,1N. Chuẩn lượng dư Na
2
CO
3
bằng HCl 0,1N, chỉ thị
PP.Thể tích HCl tiêu tốn là 22,50ml.
Viết các phản ứng xãy ra?y
Tính hàm lượng gam/ lít CO
2
trong beer
20.Độ cứng toàn phần của nước được xác định như sau: mẫu sau khi đồng
nhất hóa được hút 100ml, thêm vào 5ml NH
4
OH 10%, 10ml đệm
amoni, nửa hạt bắp chỉ thị ETOO. Tiến hành chuẩn bằng dung dịch
EDTA 0,05N cho đến khi có màu xanh dương. Giả sử thể tích EDTA
tiêu tốn là 22,10ml.
Viết các phản ứng xãy ra?
Tính độ cứng của nước theo đơn vị mg CaCO
3
Các phản ứng:
H
4
Y (ethylendiaminetetraacetic) là acid yếu, đa acid nên khả năng hoà ta
kém. Trong phân tích thể tích các phản ứng chuẩn độ phải thĩa mãn các
yêu cầu sau:
- Phản ứng xãy ra nhanh
- Hoàn toàn
- Theo chiều nhất định
- Có chỉ thị
Dùng muối dinatri, Na
2
H
2
Y
Hind
2-
+ Mg
2+
cho ra phức màu đỏ nho MgInd
-
+ H
+
H
2
Y
2-
+ Ca
2+
cho ra CaY
2-
+ 2 H
+
H
2
Y
2-
+ Mg
2+
cho ra MgY
2-
+ 2 H
+
H
2
Y
2-
+ MgInd
-
+ OH
-
cho ra MgY
2-
+ Hind
2-
+ H
2
O
Đỏ nho xanh dương
Theo định luật đương lượng: (NV)
Ca,Mg
= (NV)
H2Y
ĐCTT = mdlgCaCO
3
(NV
Ca,Mg
. 1000/V
bđ
(mg CaCO
3
)
= 50 . 22,1/ 0,05.1000/100 = 552,5 mg CaCO
3

lOMoARcPSD|44862240
21.Hàm lượng Mg có trong nước được xác định như sau: mẫu sau khi
đồng nhất hóa được hút 100ml, thêm vào 5ml NH
4
OH 10%, 10ml đệm
amoni, nửa hạt bắp chỉ thị ETOO. Tiến hành chuẩn bằng dung dịch
EDTA 0,05N cho đến khi có màu xanh dương. Giả sử thể tích EDTA
tiêu tốn là 22,10ml.
Cùng với mẫu nước trên hút 100ml cho vào 2-3ml NaOH 2N, ½ hạt bắp
chỉ thị murexit, rồi chuẩn bằng EDTA 0,05N như trên. Giả sử thể tích
EDTA tiêu tốn là 12,10ml.
Viết các phản ứng xãy ra?
Tính hàm lượng g/lít Ca và g/lít Mg có trong nước.
22.Hàm lượng Fe có trong bột huyết được xác định như sau : mẫu sau khi
đồng nhất được cân 10gam, nung ở 800
0
C trong 2giờ, mẫu sau khi
nung hóa tan bằng 5 HNO
3
đậm đặc, 5ml HCl 1M, sau đó định mức
thành 250ml. Hút 20ml chỉnh pH = 3, thêm 5 giọt chỉ thị H
2
SSal. Tiến
hành chuẩn bằng dung dịch EDTA 0,05N. Hàm lượng Fe được tính là
1,5%. Tính thể tích EDTA tiêu tốn trong quá trình chuẩn độ.
Phần 2 Bài tập phân tích thực phẩm I
Phần bài tập trích ly
1. Một chất hửu cơ có trong dịch lỏng thực phẩm. Người ta chiết chất
hửucơ này bằng dung môi có hệ số phân bố K= 4. Cho rằng nồng độ ban
đầu của chất hửu cơ 0,15M, thể tích dịch lỏng là 100ml. Tính % số mol
còn lại trong hai trường hợp sau:
a.Chiết 1 lần với thể tích dung môi là 200ml.
b.Chiết 2 lần với thể tích dung môi là 100ml.
2. Một baz hửu cơ có trong dịch lỏng thực phẩm có k
b
= 4.10
-2
.
Người ta chiết acid này bằng dung môi có hằng số phân bố K= 2,5. Cho
rằng nồng độ ban đầu của acid là 0,1M, thể tích dịch lỏng là 100ml. Tính
% số mol còn lại trong hai trường hợp sau:
a.Chiết 2 lần mỗi lần là 50ml ở pH= 10
b.Chiết 1 lần với thể tích dung môi là 100ml ở pH=10
3. Một acid hửu cơ có trong dịch lỏng thực phẩm có k
a
= 2.10
-2
.
Người ta chiết acid này bằng dung môi có hằng số phân bố K= 3,0. Cho
rằng nồng độ ban đầu của acid là 0,15M, thể tích dịch lỏng là 150ml. Tính
% số mol còn lại trong hai trường hợp sau:
a.Chiết 2 lần mỗi lần là 100 ml ở pH= 1
b.Chiết 1 lần với thể tích dung môi là 200ml ở pH= 1
4. Một baz hửu cơ có trong dịch lỏng thực phẩm có k
b
= 2.10
-3
.
Người ta chiết baz này bằng dung môi có hằng số phân bố K= 4. Cho rằng

lOMoARcPSD|44862240
nồng độ ban đầu của baz là 0,15M, thể tích dịch lỏng là 100ml. Tính % số
mol còn lại trong hai trường hợp sau:
a.Chiết 2 lần mỗi lần là 50ml ở pH= 9
b.Chiết 1 lần với thể tích dung môi là 100ml ở pH=11
c. Chiết 1 lần với thể tích chiết là 100ml ở pH=11
5. Một baz hửu cơ có trong dịch lỏng thực phẩm có k
b
= 2.10
-3
. Người ta
chiết baz này bằng dung môi có hằng số phân bố có K= 2,5. Cho rằng nồng
độ ban đầu của baz là 0,1M, thể tích dịch lỏng là 100ml. Tính % số mol
còn lại trong hai trường hợp sau:
a.Chiết 2lần mỗi lần là 50ml ở pH= 10
b.Chiết 1 lần với thể tích dung môi là 100ml ở pH=11
c. Tính số lần chiết với V
B
= 50ml ở pH=11 để hiệu suất đạt được hơn 95%
6. Một acid hửu cơ có trong dịch lỏng thực phẩm có k
a
= 4.10
-3
. Người ta
chiết acid này bằng dung môi có hằng số điện môi thích hợp có K= 2,5.
Cho rằng nồng độ ban đầu của acid là 0,1M, thể tích dịch lỏng là 100ml.
Tính % số mol còn lại trong hai trường hợp sau: a.Chiết 2lần mỗi lần là
50ml ở pH= 2
b.Chiết 1 lần với thể tích dung môi là 100ml ở pH=2
c. Tính số lần chiết với V
B
= 50ml ở pH= 1 để hiệu suất đạt được hơn 90%
Phần bài tập chương phân tích nước
1. Độ cứng toàn phần của nước được xác định như sau: mẫu sau khi
đồngnhất hóa được hút 100ml, thêm vào 5ml NH
4
OH 10%, 10ml đệm
amoni, nửa hạt bắp chỉ thị ETOO. Tiến hành chuẩn bằng dung dịch
EDTA0,05N cho đến khi có màu xanh dương. Giả sử thể tích EDTA
tiêu tốn là 22,10ml.
a. Viết các phản ứng xãy ra?
b. Tính độ cứng của nước theo đơn vị mg CaCO
3
2. Hàm lượng Mg có trong nước được xác định như sau: mẫu sau khi
đồngnhất hóa được hút 100ml, thêm vào 5ml NH
4
OH 10%, 10ml đệm
amoni, nửa hạt bắp chỉ thị ETOO. Tiến hành chuẩn bằng dung dịch
EDTA 0,05N
cho đến khi có màu xanh dương. Giả sử thể tích EDTA tiêu tốn là
22,10ml.Cùng với mẫu nước trên hút 100ml cho vào 2-3ml NaOH 2N, ½
hạt bắp chỉ thị murexit, rồi chuẩn bằng EDTA 0,05N như trên. Giả sử
thể tích EDTA tiêu tốn là 12,10ml. a. Viết các phản ứng xãy ra?
b. Tính hàm lượng g/lít Ca và g/lít Mg có trong nước.
lOMoARcPSD|44862240
3. Độ cứng tạm thời của nước được xác định như sau: mẫu sau khi đồng
nhất hóa được hút 100ml, chuẩn bằng HCl 0,05N, thể tích tiêu tốn là
22.5ml. Cùng mẫu nước trê sau khi đã đun sôi lấy 50ml chuẩn bằng
HCl 0,02N, thể tích tiêu tốn là 5,75ml. Tính độ cứng tạm thời theo đơn
vị mg CaCO
3
4. Hàm lượng Fe có trong nước được xác định như sau : mẫu sau khi
đồngnhất được hút 100ml, thêm 1ml HNO
3
đậm đặc, 5ml CH
3
COOH
1M, 5ml đệm pH = 3, 5 giọt chỉ thị H
2
SSal. Tiến hành chuẩn bằng dung
dịch EDTA 0,05N, cho thể tích EDTA tiêu tốn là 7,55ml. a. Viết các
phản ứng xãy ra
b. Tính hàm lượng ppm Fe có trong nước.
5. Hãy pha 1 lít nước có độ cứng theo CaCO
3
là 500 mg, từ CaCl
2
. 6H
2
O
và MgCl
2
.7H
2
O. Biết rằng tỷ lệ số mđlg của Ca2+ và Mg2+ là 3:5.
6. Hàm lượng NO
2
-
có trong nước thải được xác định bằng PP Diazoni
(λmax = 520nm) có những thông số như bảng dưới đây. Cho V
bd
= 50ml,
V
đm
= 200ml.
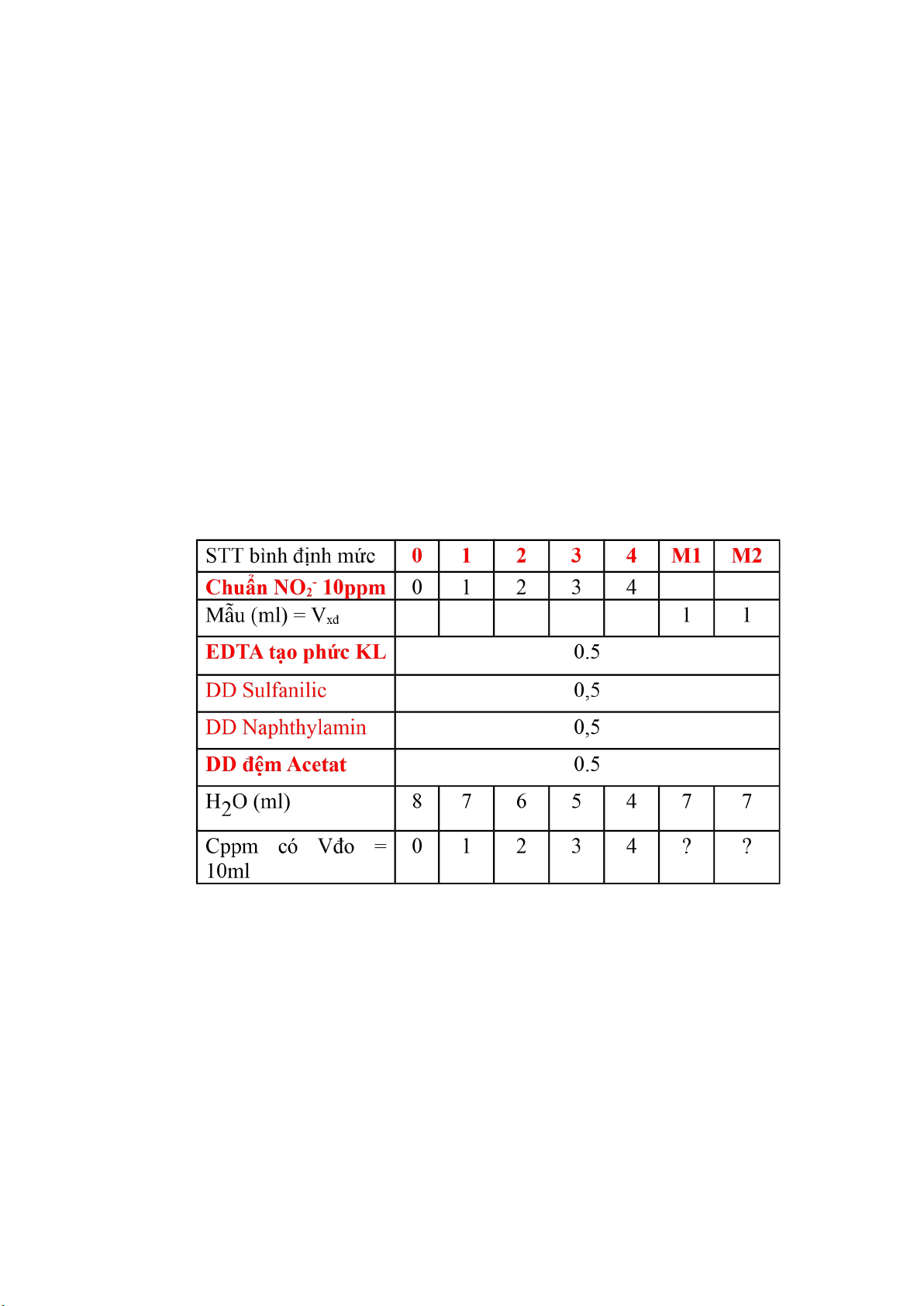
a. Tính số gam KNO
2
để pha 500ml có C
NO2
= 500ppm
Dung dịch KNO
2
(39 + 14 + 32)500ppm nghĩa là 1 lít dung dịch đó
chứa 500mg tương đương 0,5 gam NO
2
-
.
Trong phân tử KNO
2
, ta thấy
cứ 86 gam KNO
2
có 46 gam NO
2
-
. Bài toàn cần 0,25 gam NO
2
-
= 0,5
lít. 0,5 gam = 0,25 gam
Như vậy: 500ml dung dịch lượng gam KNO
2
cần thiết là: a
KNO2
= 0,5.
0,5. M
KNO2
/M
NO2
= 0,462 gam
b. Tính số ml NO
2
-
500ppm để pha 100ml NO
2
-
10ppm K
pl
= 500/10 = 50
lần
Suy ra: V
bđ
= V
pha
/K
pha loãng
= 100/50 = 2 ml
c. Tính C
0
, C
1
, C
2
, C
3
, C
4
lOMoARcPSD|44862240
C0 = 0 ppm; C1 = 1ppm; , C2 = 2ppm; , C3 = 3ppm; , C4 = 4ppm
d. Cho A
0
=0,A
1
=0,135,A
2
=0,280,A
3
=0,401, A
4
=0,556,
A
M1
= 0,782,A
M2
= 0,778. Tính ppm NO
2
-
có trong nước thải Dùng
phần mềm trên excel để đưa ra phương trình hồi uy tuyến tính, thông
ua giá trị A và C của các mẫu chuẩn Ta có: y = 0.1378x - 0.0012 (R² =
0.999).
A
tb mẫu
= (0,782 + 0,778)/2 = 0,780
Thay vào phương trình ta có : 0,78 = 0,1378.x – 0,0012
Giải ta có: x = 5,67 (ppm) = C
mẫu
. Có nghĩa là 1 lít dung dịch đo chứa
5,67 mg NO
2
-
ppm NO
2
-
= C
mẫu
.V
đo
/1000. V
đm
/V
xđ
.1000/V
bđ
= 5,67. 10/1000. 200/1.1000/50 = 226,8 ppm
7. Hàm lượng NO
3
-
có trong nước thải được xác định bằng PP Brucine có
những thông số như bảng dưới đây. Cho V
bd
= 10ml, V
đm
= 200ml.
a. Tính số gam KNO
3
để pha 500ml có C
NO3
-= 750ppm
b. Tính số ml KNO
3
có C
NO3
-= 750ppm để pha 100ml NO
3
-
10ppm
c. Tính C
0
, C
1
, C
2
, C
3
, C
4
d. Cho Cho A
0
= 0, A
1
= 0,145, A
2
= 0,301, A
3
= 0,460, A
4
= 0,790,
A
M1
= 0,582, A
M2
= 0,578. Tính ppm NO
3
-
có trong nước
Giải
Phản ứng: NO
3
-
+ Brucine cho ra phức màu vàng, đo ở bước sóng hấp thu
cực đại 410nm
a. Chuẩn mẹ có C = 750ppm, V = 500ml, từ KNO
3
Nồng độ 750ppm nghĩa là trong 1000ml dung dịch có 750 mg
Suy ra số gam NO
3
-
cần thiết là :750. 500/1000 = 325mg hay 0,325g
Suy ra số gam KNO
3
= 0,325.M
KNO3
/ M
NO3-
= 0,530 gam
AKNO3 = 0,5. 0,75.MKNO3/MNO3- =
b. Tính số ml KNO
3
có nồng độ 750ppm để pha 100ml chuẩn 10ppm
Hệ số pha loãng K = 750/10 = 75 lần
Suy ra: V
bđ
= V
pha
/K
pl
= 100/75 = 1,33 ml
c. Ta có: C
0
= 0, C
1
= 1, C
2
= 2, C
3
= 3, C
4
= 4 (ppm)
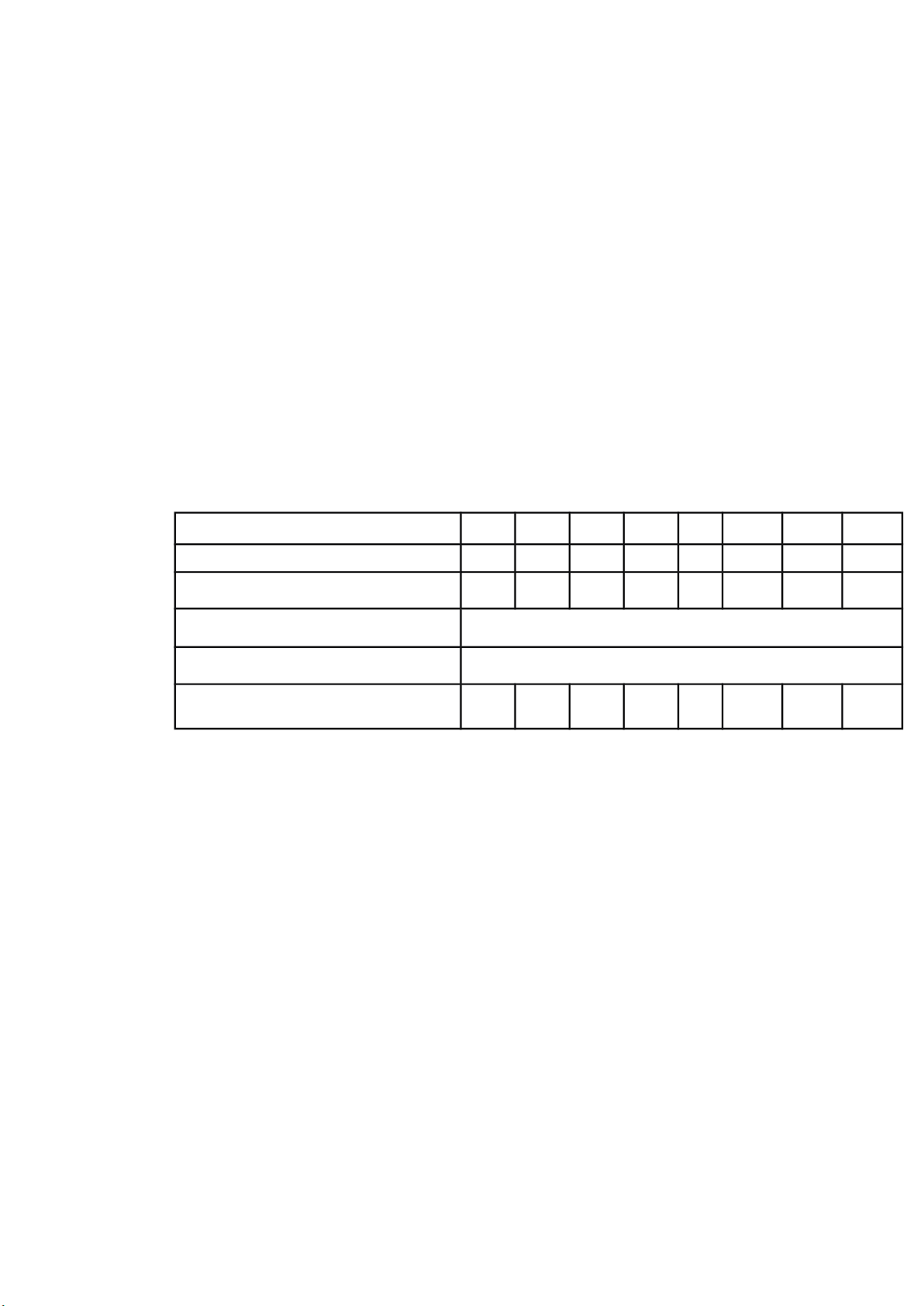
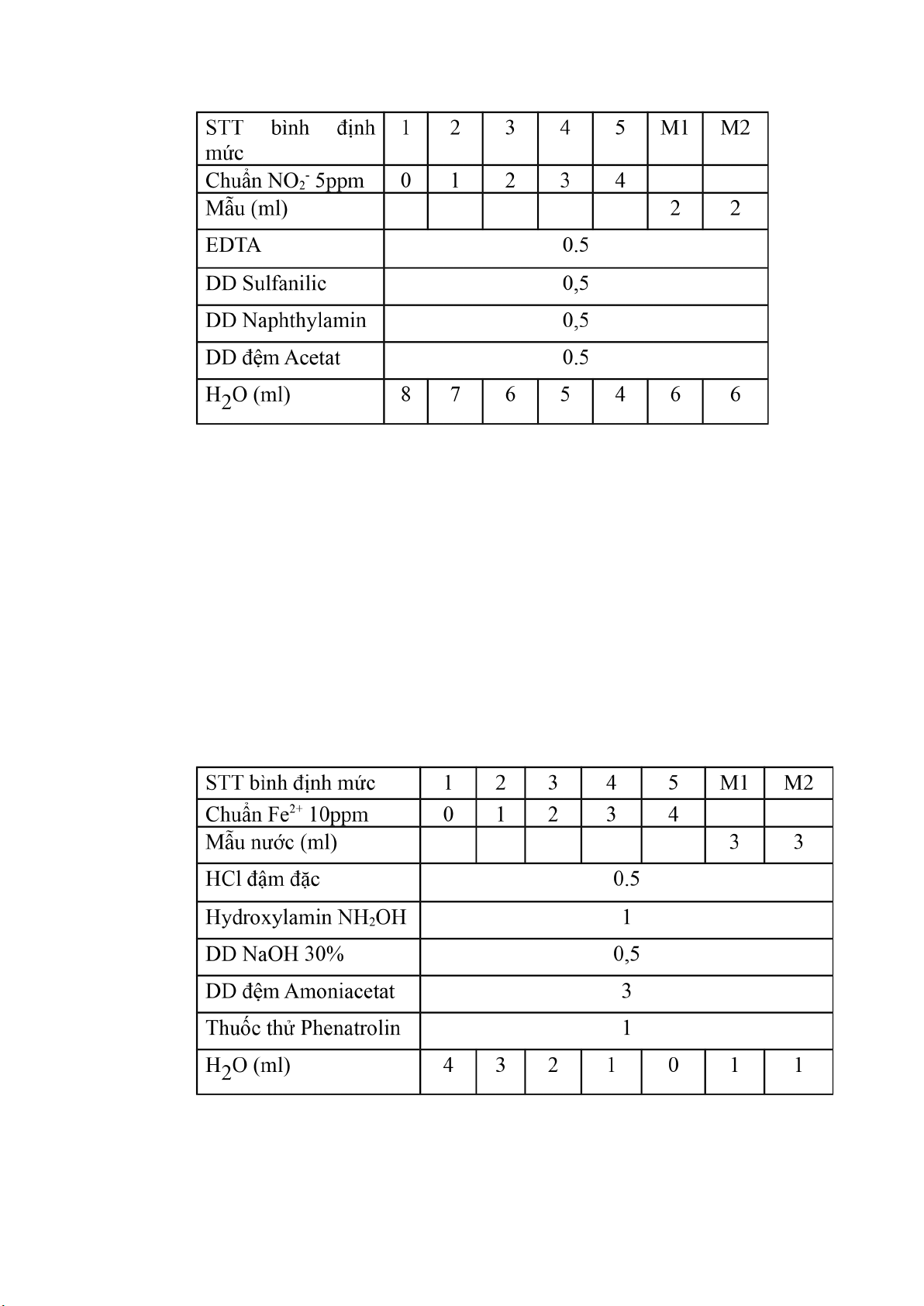
STT bình định mức 10ml M20 M141 2 3
Chuẩn NO
3
-
40 10ppm (làm việc) 21 3
Mẫu (ml) 4 4
DD H
2
SO
4
3 đậm đặc
Thuốc thử Brucine 1
H
2
O (ml) 6 5 4 3 2 2 2
lOMoARcPSD|44862240
d. Ta có: y = 0,19x – 0,04, A
tb
= (0,582 + 0,578)/2 = 0,580 Thay vào
phương trình ta có: x = 3,26ppm ppmNO
3
-
= C
x
.V
đo
/1000.V
đm
/V
xđ
.
1000/V
bđ
ppmNO
3
-
= 3,26.10/1000.200/4.1000/10 = 163 ppm
8. Hàm lượng NH
3
có trong nước thải được xác định bằng PP Nessler có
những thông số như bảng dưới đây. Cho V
bd
= 10ml, V
đm
= 100ml.
a. Tính số gam NH
4
Cl để pha 500ml có C
NH3
= 750ppm
b. Tính số ml NH
3
750ppm để pha 100ml NH
3
10ppm
c. Tính C
0
, C
1
, C
2
, C
3
, C
4
d. Cho phương trình đường chuẩn là y= 0,352x, A
M1
= 0,782,A
M2
= 0,778.
Tính ppm NH
3
có trong nước thải.
Giải
a. Chuẩn mẹ có C = 750ppm, V = 500ml, từ NH
4
Cl Nồng độ
750ppm nghĩa là trong 1000ml dung dịch có 750 mg
Suy ra số gam NO3- cần thiết là :750. 500/1000 = 325mg hay 0,325g
Suy ra số gam KNO3 = 0,325.M
NH4Cl
/ M
NH4+
= 1,10 gam
A
NH4Cl
= 0,5. 0,75.M
NH4Cl
/M
NH4+
= 1,11 gam
b. Tính số ml NH
4
Cl có nồng độ 750ppm để pha 100ml chuẩn
10ppm
Hệ số pha loãng K = 750/10 = 75 lần Suy
ra: Vbđ = Vpha/Kpl = 100/75 = 1,33 ml
c. Ta có: C
0
= 0, C
1
= 1, C
2
= 2, C
3
= 3, C
4
= 4 (ppm)
d. Ta có: y= 0,352x, A
M1
= 0,782, A
M2
= 0,778 Suy ra: A
tb
= 0,780,
thay vào pt ta có C
x
= 2,215 ppm ppmNH
3
=
Cx.Vđo/1000.Vđm/Vxđ. 1000/Vbđ ppm NH
3
=
2,215.10/1000.100/6.1000/10 = 36,9 ppm
9. Hàm lượng NO
2
-
có trong nước thải được xác định bằng PP Diazoni có
những thông số như bảng dưới đây. Cho V
bd
= 20ml, V
đm
= 250ml.
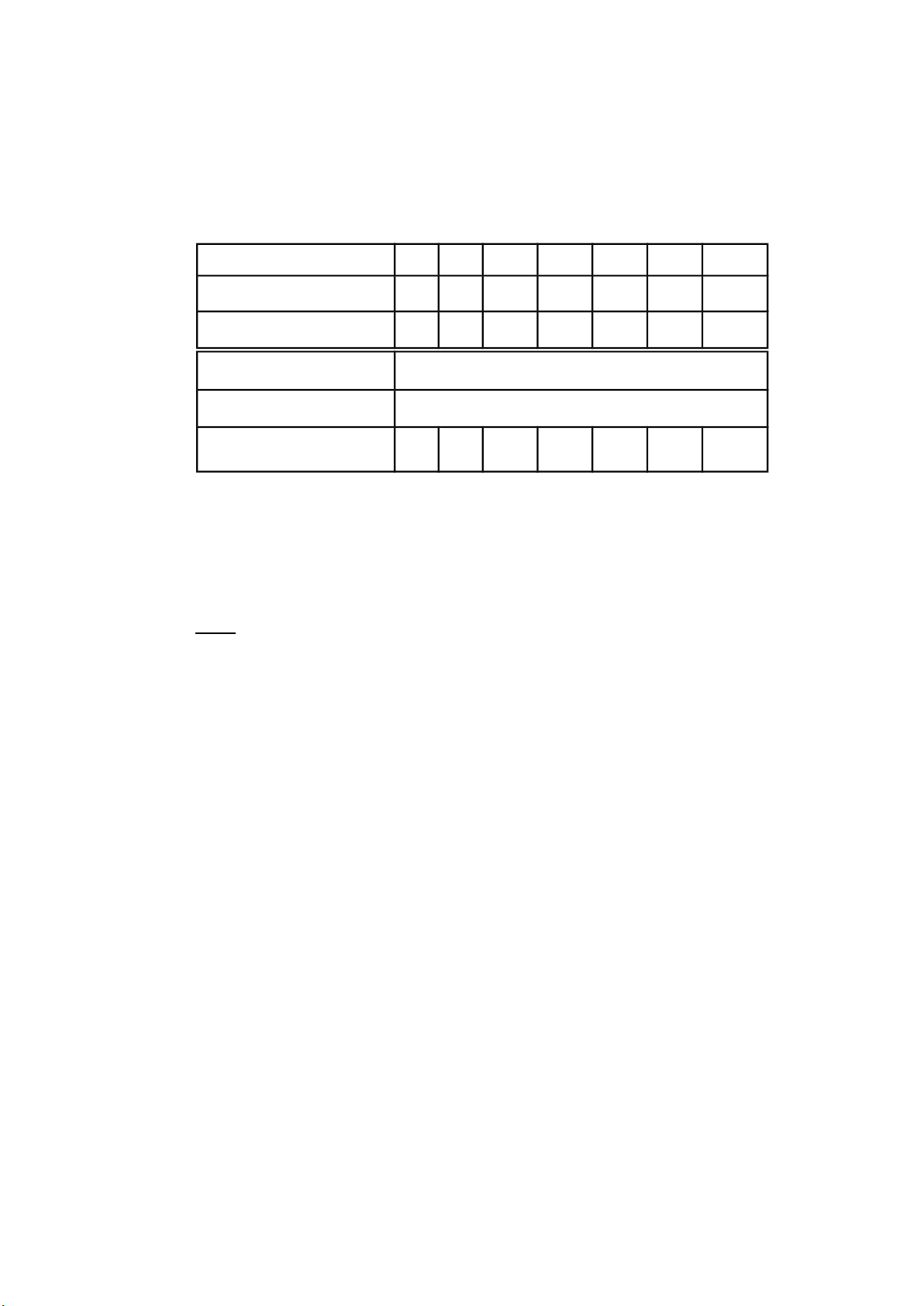
STT bình định mức M25 M11 32 4
Chuẩn NH
3
10ppm 2 31 40
Mẫu (ml) 6 6
KOH 30% (ml) 1
Nessler (ml) 1
H
2
O (ml) 8 6 5 4 2 27
lOMoARcPSD|44862240
a. Tính số gam KNO
2
để pha 500ml có C
NO2
= 750ppm
b. Tính số ml NO
2
-
750ppm để pha 100ml NO
2
-
5ppm
c. Tính C
0
, C
1
, C
2
, C
3
, C
4
d. Cho phương trình đường chuẩn là y= 0,352x, A
M1
= 0,782,A
M2
=
0,778. Tính ppm NO
2
-
có trong nước thải.
10.Hàm lượng sắt có trong đất được tạo với 1.10 Phenantrolin có những
thông số như bảng dưới đây. Cho m
bd
= 5,05gam, V
đm
= 100ml.
a. Tính số gam FeSO
4
.7H,
2
O để pha 500ml có C
Fe2+
= 750ppm Số gam
FeSO
4
.7H
2
O = 0,5.0,75.M
FeSO4.7H2O
/M
Fe
=1,86 gam

lOMoARcPSD|44862240
b. Tính số ml Fe
2+
750ppm để pha 100ml Fe
2+
10ppm K
pl
= 750/10 =
75 lần
V
bđ
= V
pha
/K
pl
= 100/75 = 1,33 ml
c. Tính C
1
, C
2
, C
3
, C
4
, C
45
Ta có: C
1
= 0, C
2
= 1, C
3
= 2, C
4
= 3, C
5
= 4 ppm
d. Cho A
1
= 0, A
2
= 0,115, A
3
= 0,240, A
4
= 0,350, A
5
= 0,456,, A
M1
=
0,382,A
M2
= 0,378. Tính % Sắt có trong đất. Ta có: y = 0,115x +
0,003, A
tb
= 0,380
Thay vào ta có: C
x
= 3,04 ppm
% Fe = Cx.Vđo/1000.Vđm/Vxđ. 100/m
bđ
= 3,04/1000.10/1000.100/3.100/5,05 = 0,01%
11.Khi xác định hàm nước bằng phương pháp KarlFisher trong dầu ăn.
Người ta tiến hành hai thí nghiệm, một thí nghiệm xác định hệ số Titer
và một thí nghiệm xác định hàm lượng nước có trong mẫu.
Ở TN 1: Với mẫu nước chuẩn là 0,0278 gam, thể tích thuốc thử tiêu tốn
là 0,575ml.
Ở TN 2: Thể tích mẫu dầu 10ml, lượng thể tích thuốc thử tiêu tốn cho
quá trình chuẩn là 5,755ml.
a. Viết các phản ứng xãy ra
b. Tính số ml nước/ lít dầu ăn
12.Khi xác định hàm nước bằng phương pháp KarlFisher trong sữa đặc.
Người ta tiến hành hai thí nghiệm, một thí nghiệm xác định hệ số Titer
và một thí nghiệm xác định hàm lượng nước có trong mẫu.
Ở TN 1: Với mẫu nước chuẩn là 0,0478 gam, thể tích thuốc thử tiêu tốn
là 0,675ml.
Ở TN 2: Thể tích mẫu sữa xác định là 4,45ml, lượng thể tích thuốc thử
tiêu tốn cho quá trình chuẩn là 7,755ml. a. Viết các phản ứng xãy ra
b. Tính % hàm lượng nước có trong sữa đặc, cho d = 2.576g/ml Phần
bài tập protein
Câu hỏi lý thuyết
1. Trình bày nguyên tắc, viết các phản ứng xãy ra và cho công
thứctính hàm lượng Protein trong phương pháp KjelDahn
2. Trình bày nguyên tắc, viết các phản ứng xãy ra và cho công
thứctính hàm lượng Protein trong phương pháp Dusma
3. Trình bày quá trình tinh sạch protein bằng phương pháp trao đổi
ion
4. Trình bày quá trình tinh sạch protein bằng phương pháp rây phân
tử
5. Trình bày quá trình tinh sạch protein bằng phương pháp pha đảo
lOMoARcPSD|44862240
6. Trình bày quá trình tinh sạch protein bằng phương pháp kết
tủaphân đoạn
7. Trình bày phương pháp xác định hàm lượng protein bằng
phươngpháp Lowry
8. Trình bày phương pháp xác định hàm lượng protein bằng
phươngpháp BCA (Bicinchoninic acid)
9. Trình bày phương pháp xác định hàm lượng protein bằng
phươngpháp nhuộm màu ion âm
So sánh sự giống và khác nhau giữa hai phương pháp Lowry và BCA
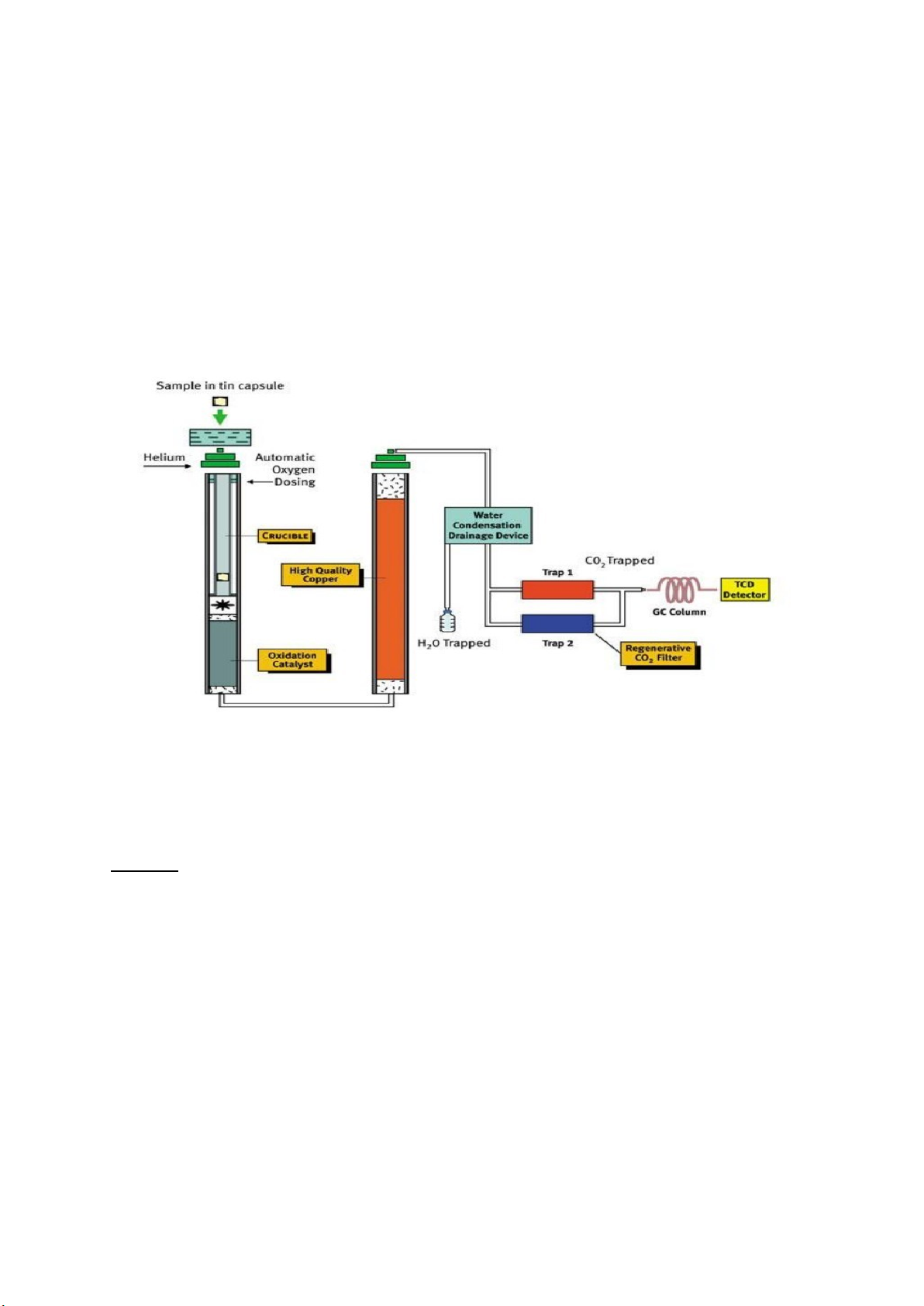
10. Mô tả quá trình xãy ra trong sơ đồ bên dưới:
Từ đó so sánh về mặt phương pháp giữa hai phương pháp KjelDahn và Dusma khi xác
định hàm lượng Protein
11. Giải thích vai trò của aldehyde Formic trong tiến trình xác định
TMA-N
Bài tập
1. Để xác định hàm lượng Protein có trong sữa tươi, người ta định lượng
bằng phương pháp Kjeldahl. Kết quả thu được những thông số quá
trình như sau: V
bđ
= 10 ml, V
đm
= 100ml, V
xđ
= 50ml, V
NaOHBlank
= 48,75ml,
VNaOH thực = 22,45ml, NNaOH= 0,089N.
a. Viết các phản ứng xảy ra?
b. Tính % protein cho d = 1,45gam/ml
2. Để xác định hàm lượng Protein có trong cá hộp, người ta định lượng
bằng phương pháp Kjeldahl. Kết quả thu được những thông số quá
trình như sau: m
bđ
= 4,55gam, V
đm
= 100ml, V
xđ
= 50ml, V
NaOHBlank
=
24,75ml,
Bấm Tải xuống để xem toàn bộ.