



Preview text:
TRƯỜNG ĐH NÔNG LÂM KHOA KHOA HỌC
THÍ NGHIỆM HÓA ĐẠI CƯƠNG BỘ MÔN HÓA BÁO CÁO THÍ NGHIỆM
BÀI 3: TỐC ĐỘ PHẢN ỨNG
A. CHUẨN BỊ BÀI THÍ NGHIỆM
(Sinh viên phải hoàn thành trước khi vào PTN làm thí nghiệm)
1. Mục tiêu thí nghiệm
Có những kiến thức về :
- Ảnh hưởng của nồng độ đến tốc độ phản ứng
- Ảnh hưởng của nhiệt độ đến tốc độ phản ứng
- Ảnh hưởng của chất xúc tác đến tốc độ phản ứng
- Xác định bậc phản ứng phân hủy Na2S2O trong môi 3 trường acid
2. Cơ sở lý thuyết liên quan (trả lời các câu hỏi lý thuyết 1 4 trong phần câu - hỏi ôn tập)
Câu 1: Nêu định nghĩa của tốc độ phản ứng, tốc độ phản ứng trung bình, tốc độ phản ứng tức thời?
- Tốc độ phản ứng là đại lượng đặc trưng cho diễn biến nhanh hay chậm của một phản
ứng hóa học, được xác định bằng đo độ giảm nồng độ của tác chất, hoặc độ tăng nồng
độ của sản phẩm theo thời gian phản ứng.
- Tốc độ phản ứng trung bình thường được xác định bằng
độ biến thiên nồng độ của một trong các chất phản ứng
hoặc sản phẩm trong một đơn vị thời gian.
- Tốc độ phản ứng tức thời tỷ lệ với tích số nồng độ tại
thời điểm của các chất tham gia phản ứng (với số mũ xác định nào đó).
Câu 2: Yếu tố nồng độ ảnh hưởng như thế nào đến tốc độ phản ứng?
- Nồng độ tác chất ảnh hưởng rất lớn đến tốc độ phản ứng.
- Khi nồng độ chất phản ứng tăng, tốc độ phản ứng tăng.
- Khi nồng độ chất phản ứng giảm, tốc độ phản ứng giảm.
Câu 3: Thế nào là bậc phản ứng, phân tử số, chúng giống và khác nhau thế nào?
- Bậc phản ứng: là tổng số mũ của nồng độ các chất phản ứng. Nếu tổng các số mũ đó
là 1, 2, 3… thì phản ứng được gọi là phản ứng bậc một, bậc hai, bậc ba …
- Phân tử số: là số phân tử tham gia vào một tác dụng đơn giản. Người ta phân biệt
phản ứng đơn phân tử, lưỡng phân tử, tam phân tử …
- Giống nhau : đối với các phản ứng đơn giản, bậc phản ứng trùng phân tử số. - Khác nhau : 1
+ Trong các phản ứng phức tạp, bậc của phản ứng được xác định bởi giai đoạn chậm
nhất nên bậc của phản ứng không trùng với phân tử số.
+ Bậc phản ứng có thể bằng không hoặc không phải là số nguyên.
Câu 4: Năng lượng hoạt hóa là gì? Làm cách nào để xác định năng lượng hoạt hóa của một phản ứng?
- Năng lượng hoạt hóa là năng lượng tối thiểu của các phân tử và nguyên tử cần phải
có để có thể tham gia vào phản ứng hóa học.
- Năng lượng hoạt hóa càng nhỏ thì càng có nhiều tiểu phân tử hoạt động nên tốc độ phản ứng càng lớn hơn.
B. BÁO CÁO QUÁ TRÌNH THÍ NGHIỆM
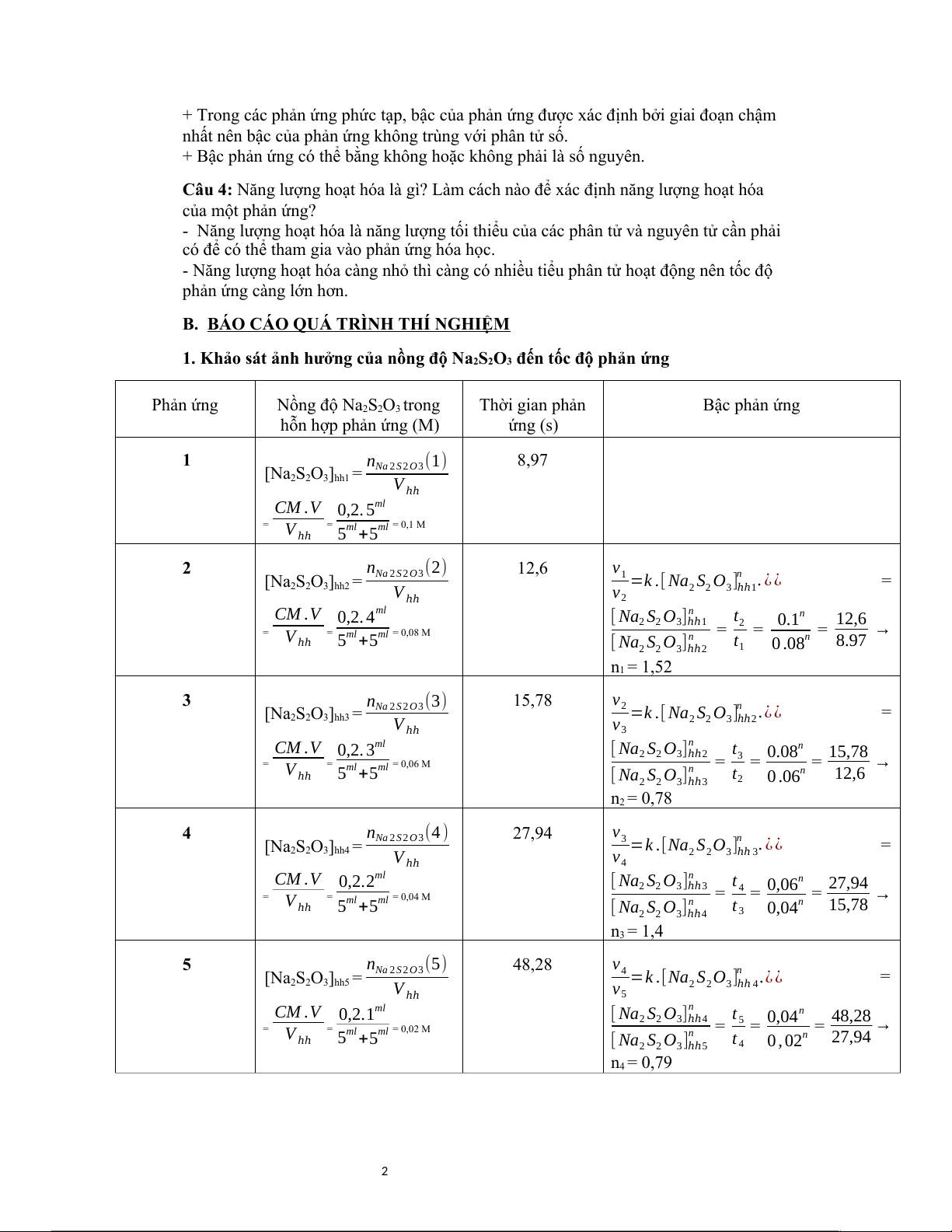
1. Khảo sát ảnh hưởng của nồng độ Na2S2O đến tốc độ phản ứng 3 Phản ứng Nồng độ Na2S2O3 trong Thời gian phản Bậc phản ứng hỗn hợp phản ứng (M) ứng (s) 1 n (1) 8,97 [Na
Na 2 S 2 O 3 2S O 2 3]hh1 = V ℎℎ CM .V 0,2. 5ml = V = ℎℎ
5ml +5ml = 0,1 M 2 n (2) 12,6 v [Na
Na 2 S 2 O 3 1 n 2S O 2 3]hh2 = =k .[ Na S O ] . ¿ ¿ = V v 2 2 3 ℎℎ1 ℎℎ 2 CM .V 0,2. 4ml [ Na S O ]n t 2 2 3 ℎℎ1 2 12,6 = = = 0.1n = V = → n ℎℎ
5ml +5ml = 0,08 M [ Na S O ] t 0 .08n 8.97 2 2 3 ℎℎ2 1 n1 = 1,52 3 n (3) 15,78 v [Na
Na 2 S 2 O 3 2 n 2S O 2 3]hh3 = =k .[ Na S O ] .¿ ¿ = V v 2 2 3 ℎℎ2 ℎℎ 3 CM .V n 0,2. 3ml [ Na S O ] t 2 2 3 ℎℎ2 3 = = = 0.08n = 15,78 V = → n ℎℎ
5ml +5ml = 0,06 M [ Na S O ] t 0 .06n 12,6 2 2 3 ℎℎ3 2 n2 = 0,78 4 n (4 ) 27,94 v [Na
Na 2 S 2 O 3 3 n 2S O 2 3]hh4 = =k .[Na S O ] . ¿ ¿ = V v 2 2 3 ℎℎ 3 ℎℎ 4 CM .V 0,2.2ml [ Na S O ]n t 2 2 3 ℎℎ3 4 = = = 0,06n = 27,94 V = → n ℎℎ
5ml +5ml = 0,04 M [ Na S O ] t 0,04n 15,78 2 2 3 ℎℎ4 3 n3 = 1,4 5 n (5) 48,28 v [Na
Na 2 S 2 O 3 4 n 2S O 2 3]hh5 = =k .[Na S O ] .¿ ¿ = V v 2 2 3 ℎℎ 4 ℎℎ 5 CM .V n 0,2.1ml [ Na S O ] t 2 2 3 ℎℎ4 5 =
= = 0,04n = 48,28 → V = n ℎℎ
5ml +5ml = 0,02 M [ Na S O ] t 0 , 02n 27,94 2 2 3 ℎℎ5 4 n4 = 0,79 2
Bậc phản ứng n theo nồng độ Na2S2O3 + + +
n = 1,52 0,78 1,4 0.79 = 1,1225≈ 1 4 Kết luận:
- Vì n ≠ 0 thì tốc độ phản ứng phụ thuộc vào nồng độ Na2S2O3
- Nồng độ Na2S2O giảm thì tốc độ phản ứng giảm 3
2. Khảo sát ảnh hưởng của nồng độ H2SO đến tốc độ phản ứng 4 Phản
Nồng độ trong H2SO4 hỗn hợp phản ứng Thời Bậc phản ứng ứng (M) gian phản ứng (s) 1 n CM .V 11,34 [ H SO H ¿¿ 2 SO ] = 2 4 ¿ = 4 ℎℎ = 1 V V ℎℎ ℎℎ 0,5. 5ml = 0,25M 5ml +5ml 2 n CM .V 9,59 v [ H SO 1 n H ¿¿ 2 SO ] = 2 4 ¿ = =k .[ Na S O ] . ¿ ¿ = 4 ℎℎ = 2 V V v 2 2 3 ℎℎ1 ℎℎ ℎℎ 2 m 0,5. 4ml [ H SO ] t 2 4 ℎℎ 1 2 = 0,2M
= = 0,25m = 9,59 → m 5ml +5ml [ H SO ] t 0 , 2m 11,34 2 4 ℎℎ 2 1 m1 = -0,75 3 n CM .V 11,44 v [ H SO H ¿¿ n 2 SO ] = 2 4 ¿ = 2 =k .[ Na S O ] .¿ ¿ = 4 ℎℎ = 3 V V v 2 2 3 ℎℎ2 ℎℎ ℎℎ 3 m 0,5. 3ml [ H SO ] t 2 4 ℎℎ 2 3 11,44 = 0,15M = = 0,2m = 5ml +5ml [ H SO ] m t 0 ,15m 9,59 2 4 ℎℎ 3 2 →m2 = 0,61 4 n 13,06 v [ H SO H ¿¿ n 2 SO ] = 2 4 ¿ = CM .V 3 =k .[Na S O ] . ¿ ¿ = 4 ℎℎ = 4 V V v 2 2 3 ℎℎ 3 ℎℎ ℎℎ 4 m 0,5.2ml [ H SO ] t 2
4 ℎℎ3 = 4 = 0,15m = 13,06 → 5ml +5ml = 0,1M [ H SO ] m t 0 , 1m 11,44 2 4 ℎℎ 4 3 m4 = 0,32 5 n CM .V 15,9 v [ H SO 4 n H ¿¿ 2 SO ] = 2 4 ¿ = =k .[Na S O ] .¿ ¿ = 4 ℎℎ = 5 V V v 2 2 3 ℎℎ 4 ℎℎ ℎℎ 5 m 0,5.1ml [ H SO ] t 2 4 ℎℎ 4 5 = 0,05M = = 0,1m = 15,9 5ml +5ml [ H SO ]m t 0 , 05m 13,06 2 4 ℎℎ5 4 →m5 = 0,28
Bậc phản ứng m theo nồng độ H2SO4 + + +
m = −0,75 0,61 0,32 0,28 = 4 0,115 ≈ 0 3 Kết luận:
- Vì m ¿ 0 thì nồng độ chất không ảnh hưởng tới tốc độ phản ứng
Tính bậc trung bình tổng quát = n +m = 1,1225 + 0,115 = 1,2375
3. Khảo sát ảnh hưởng của nhiệt độ đến tốc độ phản ứng Phản
Nhiệt độ phản ứng (°C) Thời gian phản Hệ số nhiệt độ ứng ứng (s) 1 T ° = T ° = 28 t 1 P 1 = 58,44 2
T ° = T °+10 = 38 t2 = 40,66 2 1 3
T ° = T °+10 = 48 t3 = 25,15 γ2 = 3 2 4 T ° °+10 = 58 t4 = 12,65 γ3 = 4 = T 3 5
T ° = T °+10 = 68 t5 = 7,79 γ4 = 5 4
Hệ số nhiệt độ trung bình γ =
4. Thí nghiệm 4: Khảo sát ảnh hưởng chất xúc tác đồng thể Phản Thời gian
Giải thích và viết phương trình phản ứng ứng phản ứng (s)
- Khi không có MnSO4 thì thời gian làm mất màu khá lâu 1 t1 = 16,19 2KMnO4 + 5H C 2 O 2 4 + 3H SO 2
4 → 2MnSO4 + K2SO4 + 10CO2 +8H O 2
- Khi cho MnSO4 vào thì thời gian làm mất màu diễn ra nhanh 2 t2 = 5,57 chóng
3H2SO4 + 5H2C2O4 + 2KMnO → 2MnSO 4 4 + K SO 2 4 + 10CO2 + 8H O 2
2KMnO4 + 3MnSO4 + 2H O → 5MnO 2 + 2KHSO 2 + H 4 2SO4
C. TRẢ LỜI CÂU HỎI
(Các câu hỏi 5 10 trong phần câu hỏi ôn tập) -
Câu 5: Sự khác nhau của xúc tác đồng thể và dị thể, ưu và nhược điểm của từng loại?
Thử nêu một số ví dụ (phản ứng) có sử dụng xúc tác dị thể?
Câu 6: Ở thí nghiệm 1 và 2, nếu thay đổi thứ tự: cho dung dịch Na2S2O vào ống 3
nghiệm chứa dung dịch chứa H2SO để thực hiện phản ứng thay vì ngược lại thì kết 4
quả thời gian phản ứng thay đổi theo chiều hướng nào? Giải thích?
Câu 7: Ở 150°C một phản ứng kết thúc sau 16 phút. Hỏi ở 80°C và 200°C phản ứng
kết thúc sau bao lâu? Cho hệ số nhiệt độ của phản ứng là 2,5.
Ta có : giảm 10C thì tốc độ giảm 2,5 lần 4
Giảm 150-80 = 70C thì tốc độ giảm 2,57= 610,35 lần
Ở 80C phản ứng kết thúc sau : 16 × 610,35 = 9765,6 phút 162 giờ
Tương tự : tăng 10C thì tốc độ tăng 2,5 lần
Tăng 200-150 = 50C thì tốc độ tăng 2,55= 97,65 lần
Ở 200C phản ứng kết thúc sau : 16 ÷ 97,65 = 0,16384 phút 9,8 giây
Câu 8: Một phản ứng có hệ số nhiệt độ là 3,5. Cho biết:
a. Khi tăng nhiệt độ từ 30°C lên 50°C thì tốc độ phản ứng thay đổi như thế nào? ΔT = T – T 2 = 50 – 30 = 20 1 t v ΔT 1 = 2=γ 10 = 12,25 t v 2 1
Vậy khi tăng nhiệt độ từ 30C lên 50C thì tốc độ phản ứng thay đổi 12,25 lần
b. Muốn tốc độ phản ứng tăng lên 10 lần thì cần tăng nhiệt độ lên bao nhiêu, với nhiệt độ ban đầu là 30°C t v T − T 2 1
Áp dụng công thức : 1 = 2=γ 10 = 10 → T ≈ 48,38°C 2 t v 2 1
Câu 9: Một phản ứng có hằng số tốc độ là 0,02 s-1 ở 15°C và bằng 0,38 s-1 ở 52°C
a. Tính năng lượng hoạt hóa của phản ứng
b. Tốc độ phản ứng trên sẽ thay đổi như thế nào khi tăng nhiệt độ từ 15°C lên 30°C
Câu 10: Cho cân bằng A (k) + B 2
(k) ↔ 2AB (k), có hệ số nhiệt độ của phản ứng 2
thuận và nghịch lần lượt là 2 và 3. Hỏi khi tăng nhiệt độ thì cân bằng trên dịch chuyển
the chiều nào và từ đó suy ra dấu ∆ H của phản ứng, giải thích. 5




