













Preview text:
TRƯỜNG ĐẠI HỌC BÁCH KHOA HÀ NỘI
VIỆN CÔNG NGHỆ SINH HỌC & CÔNG NGHỆ THỰC PHẨM
BÁO CÁO THÍ NGHIỆM
KIỂM SOÁT VI SINH VẬT TRONG THỰC PHẨM
Giảng viên hướng dẫn : Nguyễn Thị Hoài Đức Sinh viên thực hiện : Lý Thị Loan Mã số SV : 20180492 Mã lớp TN : 713720 Thí nghiệm đợt : KSCL 1
Hà Nội, tháng 12/2021
I. CHUẨN BỊ MẪU THÍ NGHIỆM
1.1. Chuẩn bị môi trường
1.1.1. Môi trường thạch
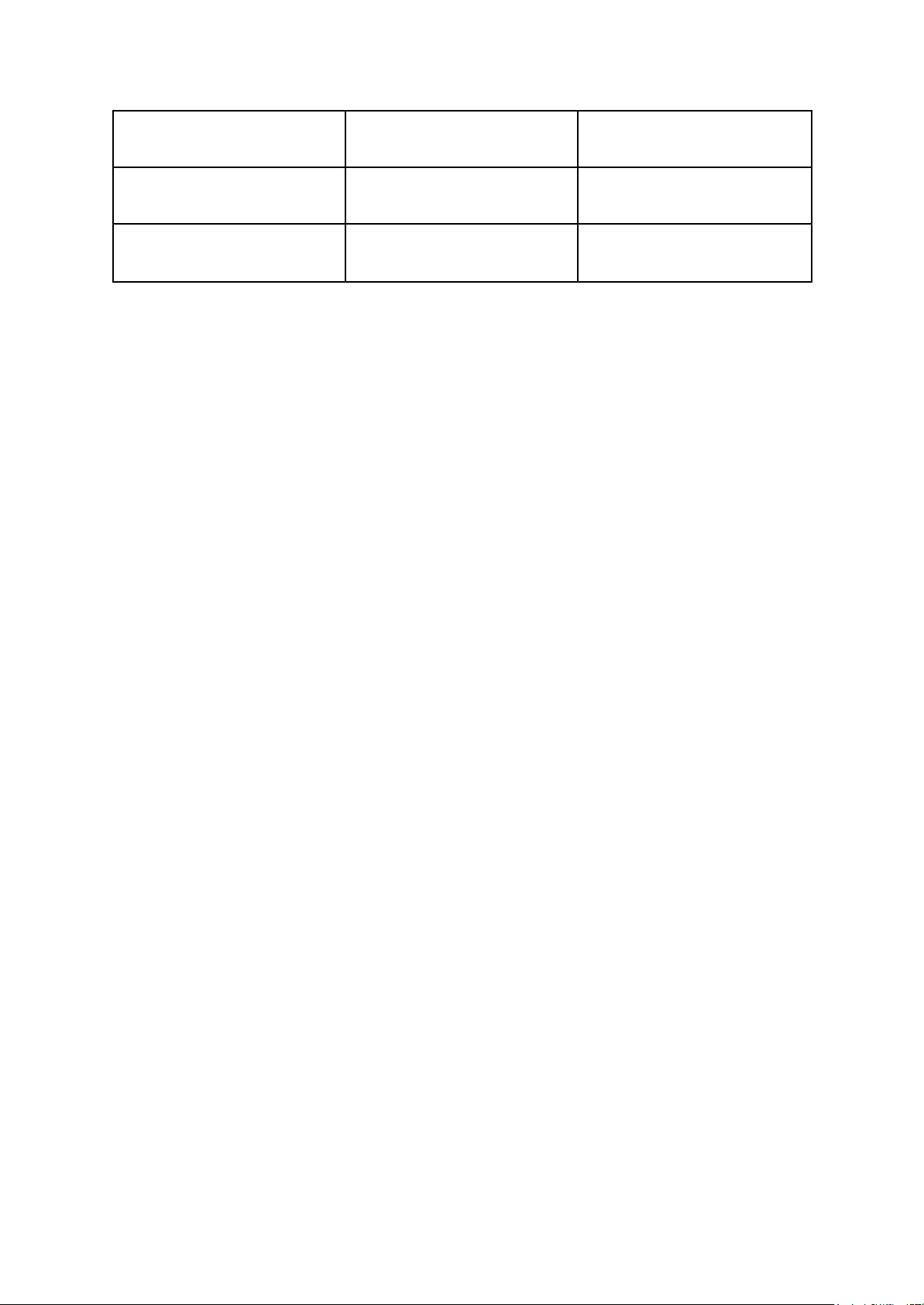
Mỗi mẫu, mỗi chỉ tiêu 2 độ pha loãng, mỗi độ pha loãng 2 đĩa, mỗi đĩa đổ 15 – 18ml môi trường.
Nên với mỗi chỉ tiêu cần pha: 20ml x 4 đĩa x 4 nhóm = 320ml môi trường pha dư lên 400 ml môi trường Tên môi trường Định lượng Khối lượng Định mức lên (ml) TGA VSV tổng số 9,4g 400 Endo Coliforms 400 E.Coli YGC Nấm men, nấm mốc 16g 400 Baird-Parker + nhũ 27,42g + 21ml 400 tương lòng đỏ trứng
(cho vào sau khi hấp Staphylococcus aureus làm nguội đến 50 độ C) TSC + D- cycloserin 18,8g + 0,14ml 400 (D- cycloserin cho
vào sau khi hấp làm Clostridium nguội đến 50 độ C) perfringens
Cần tiệt trùng môi trường trước khi phân phối vào các đĩa petri.
1.1.2. Môi trường cho phương pháp MPN
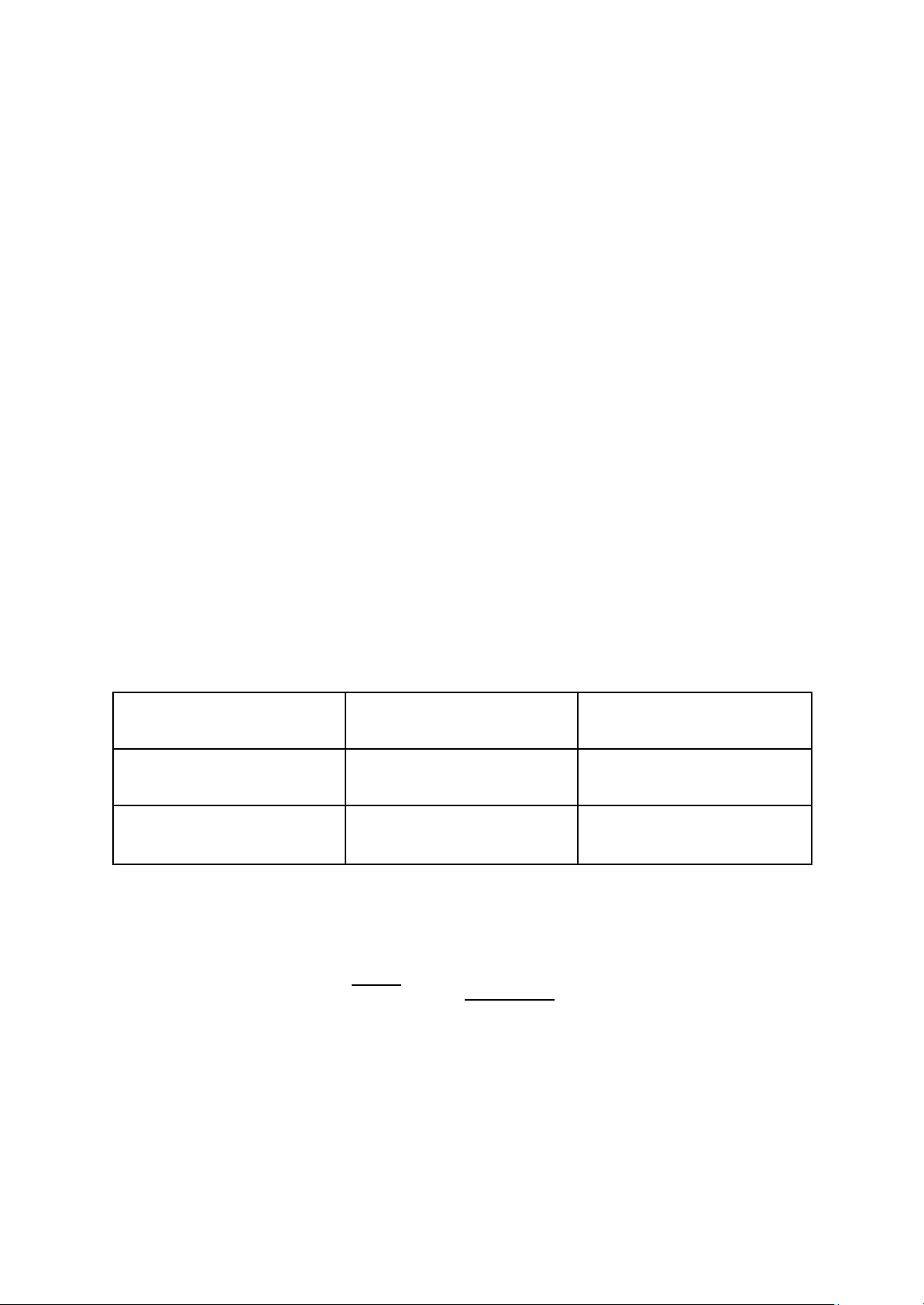
Mỗi mẫu, mỗi chỉ tiêu, mỗi loại môi trường cần 9 ống falcon (3 độ pha loãng liên tiếp,
mỗi độ 3 ống), mỗi ống 9ml môi trường Môi trường Định lượng Khối lượng Định mức lên (ml) TLS Coliforms 28,5g 800 E.Coli BGBLB 24g 600 EC 22.22g 600 Trypton 20g 500
Phân phối môi trường vào từng ống falcon có sẵn ống durham trước khi đem tiệt trùng ở 121oC, 20 phút
1.1.3. Nước muối sinh lý 0,85%
Cần pha 90ml pha loãng mẫu x 4 nhóm + 9ml cho ống falcon x 3 độ pha loãng tiếp
theo x 4 nhóm = 468ml → pha 540ml.
Cần phân phối nước muối vào các ống falcon trước khi đem tiệt trùng
1.1.4. Chuẩn bị các dụng cụ
- Các dụng cụ cần đem tiệt trùng
Mỗi nhóm cần: 1 bình tam giác 250ml, 1 hộp đầu côn vàng (pipet 100-1000μl), 1 hộp
đầu côn xanh (pipet 1 – 5ml) 1 ống đong
- Các dụng cụ khác (có thể tiệt trùng bằng cồn nêu cần)
Mỗi nhóm cần: 1 bộ cối chày, 1 kéo lấy mẫu, 2 pipet (100 – 1000μl và 1 – 5ml), 2 que
trang, 1 que cấy tròn, 1 đèn cồn, 1 bình xịt cồn, 1 bút viết kính II. XỬ LÝ MẪU
Mẫu thực phẩm: Dưa chua
Nguồn mẫu thực phẩm: chợ Bách Khoa Ngày lấy mẫu: 04/12/2021
Tình trạng mẫu: mẫu thực phẩm có mùi vị đặc trưng, không bị hư hỏng, không có mùi lạ 2.1. Lấy mẫu
- Tiệt trùng kéo và chày cối bằng cồn
- Cân lấy 10g mẫu ở các vị trí khác nhau vào cối
- Dùng kéo cắt nhỏ, lấy chày nghiền nhuyễn mẫu 2.2. Pha loãng mẫu
- Lấy sẵn 90ml nước muối sinh lý vào ống đong
- Chuyển toàn bộ mẫu từ cối vào bình tam giác, tráng rửa chày cối nhiều lần bằng
nướcmuối trong ống đong (ít nhất 3 lần)
- Cho toàn bộ phần nước muối còn lại trong ống đong vào bình tam giác, lắc kỹ ta đượcđộ pha loãng 10-1
- Lấy 3 ống falcon chứa 9ml nước muối sinh lý đã tiệt trùng
- Dùng pipet lấy 1ml dịch từ bình tam giác cho vào ống falcon thứ nhất rồi lắc đều
tađược độ pha loãng 10-2
- Tiếp tục dùng pipet lấy 1ml từ ống 10-2 cho vào ống falcon thứ hai rồi lắc đều ta được độ pha loãng 10-3
- Tiến hành tương tự với độ pha loãng 10-4
BÀI 1. CHỈ TIÊU VI SINH VẬT TỔNG SỐ 1. Nguyên tắc -
Vi sinh vật tổng số là tất cả các vi sinh vật có thể tồn tại và phát triển được trên
môi trường dinh dưỡng chung, ở nhiệt độ 30˚C sau một thời gian nuôi cấy nhất định (24 – 72 giờ). -
Nuôi cấy một lượng mẫu nhất định hoặc mẫu đã pha loãng trên môi trường
thạch dinh dưỡng ở nhiệt độ 30 ± 1˚C trong điều kiện hiếu khí, thời gian 48 – 72 giờ.
Đếm tất cả số khuẩn lạc mọc trên đó. Từ tổng số khuẩn lạc đếm được sẽ suy ra số
lượng tế bào sống có trong mẫu phân tích. -
Chú ý: phương pháp này không thể xác định được các loại vi sinh vật yếm khí
nghiêm ngặt mà chỉ xác định được vi sinh vật hiếu khí và yếm khí tùy tiện.
Cần chọn độ pha loãng thích hợp sao cho số khuẩn lạc mọc trên mỗi hộp petri khoảng từ 30 – 300. 2. Dụng cụ
- Dụng cụ chuẩn bị mẫu (cối chày, kéo,..) - Bình tam giác
- Hộp petri, ống fancol dùng để pha loãng mẫu. - Micropipet 1 ml và 0,1 ml
- Đầu côn dùng cho 2 micropipet - Que chang
3. Hóa chất, môi trường
- Môi trường TGA (Tryton Glucoza Agar): Trypton 5 g; glucoza 4 g; cao nấm men 2,5
g; thạch 15 g; H2O cho đủ 1000 ml. (Trong bài này chúng ta chuẩn bị môi trường
tương đương với 16 đĩa petri cho cả 4 nhóm). Môi trường đem hấp khử trùng ở 121˚C trong 20 phút.
- Dung dịch pha loãng: nước muối sinh lý vô trùng (0,85% NaCl). 4. Tiến hành
- Mẫu thí nghiệm: Dưa chua
- Rửa sạch và khử trùng các dụng cụ cũng như dung dịch pha loãng.
- Chú ý: Khi thao tác cần khử trùng tay và làm việc gần ngọn lửa đèn cồn.
- Cân 10g mẫu, cắt nhỏ bằng kéo, nghiền nhỏ bằng cối và chày. Chuyển mẫu vào bình
tam giác, thêm 90 ml nước muối sinh lý vô trùng, lắc đều.
- Pha loãng thập phân mẫu phân tích đến 10-3.
- Cấy giống trên bề mặt thạch:
+ Môi trường sau khi hấp khử trùng thì rót vào các đĩa petri, mỗi đĩa cho 15 -18 ml
môi trường. Xếp các đĩa trên mặt phẳng ngang, để yên cho đến khi thạch nguội và
đông hoàn toàn (có thể để 2-3 ngày ở nhiệt độ 30˚C để kiểm tra độ vô trùng của các
hộp). Khi cấy chọn các hộp petri còn hoàn toàn vô trùng.
+ Lấy 0,1 ml mẫu đã pha loãng cho vào hộp petri đã chứa môi trường thạch dinh
dưỡng (làm tại 2 độ pha loãng 10-3, 10-4, mỗi độ pha loãng làm 2 hộp). Chang đều trên mặt thạch.
+ Lật ngược đĩa, đặt vào tủ ấm để nhiệt độ 30 ± 1˚C trong thời gian 24 – 72 giờ. 5. Kết quả
Sau khi khuẩn lạc mọc, đếm số lượng khuẩn lạc mọc trên đĩa, nhóm 3 thu được: Độ pha loãng Đĩa 1 Đĩa 2 10-2 49 63 10-3 3 6
Số lượng vi sinh vật trung bình có trong 1g mẫu tính được: Trong đó:
N = (𝑛1+0,1∑. 𝐶𝑛2).𝑓1.𝑣 = (2+490+163+3+ 6 −2 .0,1 = 5,5.104 (CFU/g) , .2).10
∑C là tổng số khuẩn lạc đếm được trên tất cả các đĩa thạch n1 số đĩa đếm
ở nồng độ pha loãng thứ nhất (nồng độ pha loãng thấp nhất) n1 số đĩa đếm
ở nồng độ pha loãng thứ hai f1 hệ số pha loãng của đĩa đếm ở nồng đô
pha loãng thứ nhất v thể tích mẫu cấy vào đĩa petri 6. Nhận xét:
So với TCVN của sản phẩm rau quả muối đối với chỉ tiêu vi sinh vật tổng số là 104
CFU/g thì vi sinh vật tổng số của sản phẩm cao gấp 5,5 lần. Nguyên nhân: -
Do dưa muối là sản phẩm của quá trình lên men lactic nên trong sản phẩm có rất
nhiềuvi khuẩn lactic – vi khuẩn không có hại cho sức khỏe, bên cạnh đó quá trình lên
men lactic có khả năng ức chế hoạt động sống của nhiều vi sinh vật khác trong đó có
các vi sinh vật gây hại. -
Dưa muối được mua ở chợ, được làm ra bởi các hộ gia đình nhỏ lẻ nên không
thể đảmbảo vệ sinh trong quá trình sản xuất, vận chuyển, bảo quản và mua bán. -
Thí nghiệm tiến hành có thể có sai số trong quá tình tiến hành: chọn sai độ pha
loãngnên số khuẩn lạc trên 1 đĩa petri quá lớn, hút nhầm nồng độ, có nhiễm vi sinh vật
từ bên ngoài trong quá trình xử lý mẫu, trang mẫu, đếm khuẩn lạc không chính xác, sai
số do dụng cụ hay các sai số thí nghiệm khác.
BÀI 2. CHỈ TIÊU NẤM MEN, NẤM MỐC
1. Tổng quan và nguyên tắc -
Mục đích thí nghiệm: xác định số lượng nấm men – nấm mốc có trong sản phẩm
thực phẩm để đánh giá chất lượng, tình trạng vệ sinh và các điều kiện bảo quản sản
phẩm và dự đoán khả năng hư hỏng của sản phẩm. -
Môi trường dinh dưỡng YGC (Yeast Glucose Chloramphenicol) chứa chất ức
chế sự phát triển của vi khuẩn là Chloramphenicol. -
Cấy lên bề mặt thạch của môi trường YGC một lượng mẫu đã được pha loãng
nhất định và nuôi ở nhiệt độ 30 ± 1˚C trong điều kiện hiếu khí, thời gian 48 – 72 giờ.
Đếm tất cả số khuẩn lạc mọc trên đó từ đó suy ra lượng nấm men và nấm mốc trong mẫu phân tích.
2. Dụng cụ, thiết bị
- Dụng cụ chuẩn bị mẫu (thìa, cối chày, kéo..) - Bình tam giác
- Hộp petri, ống fancol dùng để pha loãng mẫu. - Micropipet 1 ml và 0,1 ml
- Đầu côn dùng cho 2 micropipet - Que chang
3. Hóa chất, môi trường
- Môi trường YGC (Yeast Glucose Chloramphenicol): Glucose 20 g; Cao nấm men
5g; thạch 15g; Chloramphencol (hoăc Tectracylin hay Oxytectracylin) 0,1g; H2O đủ
1000ml.Trong thí nghiệm này chúng ta dùng môi trường YGC pha sẳn đủ cho 16 hộp
petri cho cả 4 nhóm. Môi trường hấp khử trùng ở nhiệt độ 121˚C trong 20 phút.
- Dung dịch pha loãng: nước muối sinh lý vô trùng (0,85% NaCl). 4. Tiến hành
- Mẫu thí nghiệm: dưa chua
- Rửa sạch và khử trùng các dụng cụ cũng như dung dịch pha loãng.
- Chú ý: khi thao tác cần khử trùng tay và làm việc gần ngọn lửa đèn cồn.
- Cân 10 g mẫu, cắt nhỏ bằng kéo, nghiền nhỏ bằng cối và chày. Chuyển mẫu vào bình
tam giác, thêm 90 ml nước muối sinh lý vô trùng, lắc đều.
- Pha loãng thập phân mẫu phân tích đến 10-2
- Cấy giống trên bề mặt thạch:
+ Môi trường sau khi hấp khử trùng thì rót vào các đĩa petri, mỗi đĩa cho 15 -18 ml
môi trường. Xếp các đĩa trên mặt phẳng ngang, để yên cho đến khi thạch nguội và
đông hoàn toàn (có thể để 2-3 ngày ở nhiệt độ 30˚C để kiểm tra độ vô trùng của các
hộp). Khi cấy chọn các hộp petri còn hoàn toàn vô trùng.
+ Lấy 0,1 ml mẫu đã pha loãng cho vào hộp petri đã chứa môi trường thạch dinh
dưỡng (làm tại 2 độ pha loãng 10-1, 10-2, mỗi độ pha loãng làm 2 hộp). Chang đều trên mặt thạch.
+ Lật ngược đĩa, đặt vào tủ ấm để nhiệt độ 30 ± 1˚C trong thời gian 48 – 72 giờ. 5. Kết quả
Sau khi khuẩn lạc mọc, đếm số lượng khuẩn lạc mọc trên đĩa, nhóm 2 thu được: Độ pha loãng Đĩa 1 Đĩa 2 10-1 9 13 10-2 2 2
Số lượng vi sinh vật trung bình có trong 1g mẫu được tính theo công thức: Trong đó:
N = (𝑛1+0,1∑. 𝐶𝑛2).𝑓1.𝑣 = (2+90+,113.2)+. 2+−21.0,1 = 1,2.103 (CFU/g) 10
∑C là tổng số khuẩn lạc đếm được trên tất cả các đĩa thạch n1 số đĩa đếm
ở nồng độ pha loãng thứ nhất (nồng độ pha loãng thấp nhất) n1 số đĩa đếm
ở nồng độ pha loãng thứ hai f1 hệ số pha loãng của đĩa đếm ở nồng đô
pha loãng thứ nhất v thể tích mẫu cấy vào đĩa petri 6. Nhận xét:
So với TCVN của sản phẩm rau quả muối đối với chỉ tiêu nấm men, nấm mốc là 10
CFU/g thì lượng nấm men, nấm mốc có trong sản phẩm dưa muối cao gấp 1,2 lần. Nguyên nhân:
- Do dưa muối được mua ở chợ, được làm ra bởi các hộ gia đình nhỏ lẻ nên
khôngthể đảm bảo vệ sinh trong quá trình sản xuất, vận chuyển, bảo quản và mua bán.
- Thí nghiệm tiến hành có thể có sai số trong quá tình tiến hành: hút nhầm nồng
độ,có nhiễm vi sinh vật từ bên ngoài trong quá trình xử lý mẫu, trang mẫu, đếm
khuẩn lạc không chính xác, sai số do dụng cụ hay các sai số thí nghiệm khác.
BÀI 3: CHỈ TIÊU COLIFORMS VÀ E. COLI -
Mục đích thí nghiệm: xác định Coliform và E.coli cho biết mức độ nhiễm và
tình trạng vệ sinh trong phân xưởng sản xuất, hoặc chính xác hơn là mức độ nhiễm phân của sản phẩm.
A. Định lượng Coliform I. Phương pháp MPN 1. Nguyên tắc -
Mẫu được pha loãng ít nhất ở ba độ pha loãng liên tiếp nhau và mỗi độ pha
loãng được cấy trong 3 ống fancol lặp lại có chứa môi trường tăng sinh chọn lọc (
môi trường lỏng Tryptoza Lauryl Sulffat, TLS). -
Sau thời gian nuôi cấy, quan sát và ghi nhận các ống dương tính và cấy tiếp
sang môi trường khẳng định ( môi trường lỏng mật lactoza lục sáng – Brilliant Green
Bile Lactoza Broth, BGBLB). Từ các ống nghiệm có phản ứng dương tính, tra bảng
Mac Grady để suy ra số lượng coliform có trong mấu phân tích. 2. Dụng cụ
- Dụng cụ chuẩn bị mẫu - Ống durham, pipet
3. Hóa chất, môi trường -
Môi trường TLS ( tryptoza lauryl sulfat): tryptoza 20g; lactoza 5g; K2HPO4
2,75g; KH2PO4 2,75g; NaCl 5g; natri lauryl sulfat 0,1g; H2O cho đủ 1000ml. -
Hòa tan các chất và phân phối môi trường vào các ống fancol có Durham. Mỗi
nhóm chuẩn bị 12 ống, mỗi ống chứa 9 ml môi trường. Đem ống TLS Hấp khử trùng
ở nhiệt độ 121oC trong 20 phút. -
Môi trường BGBLB (canh thang mật lactoza lục sáng – Brilliant Green Bile
Lactoza Broth): Pepton 10g; lactoza 10g; mật bò khô 20g; lục sáng 0,0133g; H2O cho đủ 1000ml.
Trong thí nghiệm này ta dùng môi trường BGBLB chuẩn bị sẵn. Mỗi nhóm chuẩn bị 9
ống fancol có sẵn ống durham, mỗi ống chứa 9 ml môi trường. Đem ống TLS hấp khử
trùng ở nhiệt độ 121oC trong 20 phút. 4. Tiến hành -
Tuần tự cấy 1ml dịch mẫu đã pha loãng ở các nồng độ 10-1, 10-2, 10-3 vào các
ống nghiệm có chứa môi trường tăng sinh chọn lọc TLS, mỗi độ pha loãng làm 3 ống
lặp lại. Để các ống đã cấy trong tủ ấm ở nhiệt độ 37±1oC trong 48h. Quan sát và ghi
nhận các ống có sinh khí và đục (có kết quả dương tính). -
Dùng pipet cấy chuyển 1 ml mẫu từ các ống nghiệm dương tính sang các ống
nghiệm có chứa môi trường BGBLB. Để các ống đã cấy trong tủ ấm ở nhiệt độ
37±1oC trong 48h. Với độ pha loãng, tính tổng số ống có sinh khí và đục ( có kết quả dương tính). 5. Kết quả -
Nhận thấy có các ống bị làm đục và sinh khí trong ống durham dương tính Môi trường
Số ống dương tính Nồng độ Nồng độ Nồng độ 10-1 10-2 10-3 TLS 2 1 0 BGBLB 2 1 0
Tra bảng, ta chọn được chỉ số đặc trưng với 3 ống lặp lại (trong đó không có độ pha
loãng nào có 3 ống dương tính) là 210 với độ pha loãng thấp nhất là 10-1 giá trị
MPN theo số đặc trưng là 1,5
Vậy số lượng tế bào sống có chứa trong 1ml mẫu ban đầu là
Để xác định giới hạn tin cậy, ta tra bảng kèm theo. Giới hạn này phụ thuộc vào hệ sốN
= 𝐶ℎ 𝑝ℎ𝑎ỉ 𝑠 ố𝑙𝑜 𝑀𝑃𝑁ã𝑛𝑔 𝑡ℎấ𝑝 𝑛ℎấ𝑡 = 110,−51 = 150 𝐺𝑖á 𝑡𝑟ị độ
pha loãng, mức xác suất tin cậy (P) và số lượng ống nghiệm được cấy.
Số lượng ống nghiệm cấy lặp lại là 3, hệ số pha loãng cao nhất là cho chỉ số MPN
210 là 10-1. Từ phụ lục 15 với P0.95% là 0,5 và 5,0
Vậy số lượng tế bào sống có chứa trong 1ml mẫu ban đầu sẽ nằm trong khoảng 100, 5
− 1 : 105−1 = 5 : 50 tế bào/g 6. Nhận xét
So với TCVN của sản phẩm rau quả muối đối với chỉ tiêu Coliforms là 10 CFU/g
thì lượng Coliforms có trong sản phẩm dưa muối cao gấp 15 lần. Không đạt tiêu chuẩn Nguyên nhân:
- Do dưa muối được mua ở chợ, được làm ra bởi các hộ gia đình nhỏ lẻ nên
khôngthể đảm bảo vệ sinh trong quá trình sản xuất, vận chuyển, bảo quản và mua bán.
- Thí nghiệm tiến hành có thể có sai số trong quá tình tiến hành: hút nhầm nồng
độ,có nhiễm vi sinh vật từ bên ngoài trong quá trình xử lý mẫu, trang mẫu, đếm
khuẩn lạc không chính xác, sai số do dụng cụ hay các sai số thí nghiệm khác.
II. Đếm khuẩn lạc 1. Nguyên tắc
Môi trường Endo có chứa natri sulfit và fucshin, có khả năng ức chế các vi khuẩn
gram (+). Trong quá trình phát triển trên môi trường này, coliform lên men đường
lactoza tạo thành aldehyt và axit, aldehyt tác động đến phức chất fucshin-sulfit và giải
phóng fucshin, sau đó fucshin nhuộm các khuẩn lạc từ màu hồng đến màu đỏ cánh
sen, tròn, bờ đều, có thể có ánh kim hoặc không.
2. Hóa chất, môi trường
- Môi trường Endo: pepton 10g; lactoza 10g; K2HPO4 2,5g; natri sulfit 3g; fucshin
kiềm 0,3g; thạch 15g; H2O cho đủ 1000ml; pH = 7,5. (Trong thí nghiệm này sử dụng
môi trường Endo đã có sẵn các thành phần)
- Hòa tan các chất và môi trường hấp khử trùng ở 121oC trong thời gian 20 phút. 3. Tiến hành -
Lấy độ pha loãng mẫu 10-1, 10-2. Cấy 1 giọt mẫu vào đĩa petri đã có môi
trường thạch Endo và trang đều trên mặt thạch, mỗi nồng độ pha loãng làm 2 đĩa.
Nuôi cấy trong tủ ấm ở nhiệt độ 37±1oC trong 48-72h. -
Trên mỗi hộp petri đã nuôi, chọn các khuẩn lạc có màu hồng đến màu đỏ cánh sen, tròn, bờ đều. 4. Kết quả
Kết quả đếm khuẩn lạc: Độ pha loãng Đĩa 1 Đĩa 2 10-1 0 0 10-2 0 0 5. Nhận xét
Không phát hiện có coliforms trong mẫu dưa phân tích Đạt tiêu chuẩn
Nguyên nhân: Do trong dưa có nhiều axit lactic ức chế sự phát triển của coliforms
nên không phát hiện sự có mặt của coliforms Nhận xét chung:
Khi phân tích Coliforms bằng phương pháp MPN và phương pháp đếm khuẩn lạc
cho ra hai kết quả khác nhau do cả hai phương pháp đều có sự sai lệch của dụng cụ,
của thao tác và độ chính xác của 2 phương pháp cũng không phải là tuyệt đối.
Phương pháp MPN cho kết quả dao động khá lớn nên thường biểu diễn kết quả theo
giới hạn tin cậy, tuy nhiên vẫn có sự khác nhau với kết quả ở phương pháp đếm khuẩn lạc.
B. Định lượng E.coli I. Phương pháp MPN 1. Nguyên tắc
Mẫu được pha loãng ở ba độ pha loãng liên tiếp nhau và mỗi nồng độ pha loãng được
cấy trong 3 ống nghiệm lặp lại chứa môi trường tăng sinh chọn lọc ( môi trường lỏng
Tryptoza Lauryl Sulffat, TLS). Sau thời gian nuôi cấy, quan sát và ghi nhận các ống
dương tính và cấy tiếp sang môi trường EC. Từ các ống nghiệm có phản ứng dương
tính cấy sang các ống nghiệm có chứa nước trypton. Sau khi đã nuôi cấy ở nhiệt độ
44oC thì kiểm tra có sinh indol hay không. Đếm số ống nghiệm nuôi cấy trên môi
trường EC dương tính ứng với các ống có sinh indol, tra bảng Mac Grady để từ đó suy
ra số lượng E.coli có trong mẫu phân tích.
2. Hóa chất, môi trường -
Môi trường TLS (tryptoza lauryl sulfat): tryptoza 20g; lactoza 5g; K2HPO4 4g;
KH2PO4 1,5g; NaCl 5g; H2O cho đủ 1000ml. Hòa tan các chất và phân phối môi
trường vào các ống fancol có Durham. Mỗi nhóm chuẩn bị 12 ống, mỗi ống chứa 9 ml
môi trường. Đem ống TLS Hấp khử trùng ở nhiệt độ 121oC trong 20 phút. -
Môi trường EC: tryptoza 20g; lactoza 5g, muối mật ( bile salts) số 3 1,5g; lục
sáng 0,00133g ; H2O cho đủ 1000ml. Hòa tan các chất và phân phối môi trường vào
các ống fancol có Durham. Mỗi nhóm chuẩn bị 9 ống, mỗi ống chứa 9 ml môi trường.
Đem ống EC hấp khử trùng ở nhiệt độ 121oC trong 20 phút. -
Dung dịch trypton: trypton 10g; NaCl 5g; H2O cho đủ 1000ml; pH = 7,3 ở nhiệt
độ 20˚C. Hòa tan các chất và phân phối môi trường vào các ống fancol có Durham.
Mỗi nhóm chuẩn bị 9 ống, mỗi ống chứa 9 ml môi trường. Đem ống trypton hấp khử
trùng ở nhiệt độ 121oC trong 20 phút. -
Thuốc thử indol: 4-dimethylaminobenzaldehyt 5g; 2-metyl butan-1-ol ( hoặc
pental- 1-ol) 75ml; HCl đậm đặc 25ml. -
Hòa tan 4-dimethylaminobenzaldehyt trong 2-metyl butan-1-ol ( hoặc pental-1-
ol), hoặc đun nhẹ trong nồi cách thủy 50-55oC. Làm nguội và cho axit vào, bảo quản
chỗ tối ở nhiệt độ thấp. Thuốc thử có màu vàng sáng. 3. Tiến hành
- Chuẩn bị mẫu pha loãng ở 3 nồng độ 10-1, 10-2, 10-3.
- Tuần tự cấy 1ml dịch mẫu đã pha loãng vào các ống nghiệm chứa môi trường tăng
sinh chọn lọc TLS, mỗi độ pha loãng làm 3 ống lặp lại. Để các ống cấy trong tủ ấm
ở nhiệt độ 44±1oC trong 24-48h. Quan sát và ghi nhận các ống có sinh khí và đục (
có kết quả dương tính).
- Dùng pipet cấy chuyển 1 ml dịch mẫu từ các ống nghiệm dương tính sang các ống
nghiệm có chứa môi trường EC. Để các ống đã cấy trong tủ ấm ở nhiệt độ 44±1oC trong 48h.
Phép thử khẳng định:
- Dùng que cấy vòng cấy chuyển dịch mẫu từ các ống nghiệm có chứa môi trường EC
dương tính sang các ống nghiệm có chứa nước trypton. Để các ống đã cấy trong tủ
ấm ở nhiệt độ 44±1oC trong 48h.
- Thêm 0,5ml thuốc thử indol vào các ống chứa dd trypton đã nuôi cấy, lắc đều và sau
1 phút thì quan sát và ghi nhận số lượng các ống có màu đỏ (kết quả dương tính) cho mỗi độ pha loãng. 4. Kết quả Môi trường
Số ống dương tính Nồng độ Nồng độ Nồng độ 10-1 10-2 10-3 TLS 2 0 0 EC 1 0 0 Trypton Thử Indol
Tra bảng, ta chọn được chỉ số đặc trưng với 3 ống lặp lại (trong đó không có độ pha
loãng nào có 3 ống dương tính) là với độ pha loãng thấp nhất là 10-1 giá trị
MPN theo số đặc trưng là
Vậy số lượng tế bào sống có chứa trong 1ml mẫu ban đầu là
N = 𝐺𝑖á 𝑡𝑟ị 𝐶ℎ 𝑝ℎ𝑎ỉ 𝑠 ố𝑙𝑜 𝑀𝑃𝑁ã𝑛𝑔 𝑡ℎấ𝑝 𝑛ℎấ𝑡 = 10 = độ −1
Để xác định giới hạn tin cậy, ta tra bảng kèm theo. Giới hạn này phụ thuộc vào hệ số
pha loãng, mức xác suất tin cậy (P) và số lượng ống nghiệm được cấy.
Số lượng ống nghiệm cấy lặp lại là 3, hệ số pha loãng cao nhất là cho chỉ số MPN
là 10-1. Từ phụ lục 15 với P0.95% là và
Vậy số lượng tế bào sống có chứa trong 1ml mẫu ban đầu sẽ nằm trong khoảng : = : tế bào/g 10 −1 10−1 5. Nhận xét
So với TCVN của sản phẩm rau quả muối đối với chỉ tiêu E. Coli là không được
phép có thì lượng E. Coli có trong sản phẩm dưa muối cao gấp nhiều lần.
Không đạt tiêu chuẩn Nguyên nhân:
- Do dưa muối được mua ở chợ, được làm ra bởi các hộ gia đình nhỏ lẻ nên
khôngthể đảm bảo vệ sinh trong quá trình sản xuất, vận chuyển, bảo quản và mua bán.
- Thí nghiệm tiến hành có thể có sai số trong quá tình tiến hành: hút nhầm nồng
độ,có nhiễm vi sinh vật từ bên ngoài trong quá trình xử lý mẫu, trang mẫu, đếm
khuẩn lạc không chính xác, sai số do dụng cụ hay các sai số thí nghiệm khác.
II. Đếm khuẩn lạc 1. Nguyên tắc
Môi trường endo có natri sulfit và fucshin, có khả năng ức chế các vi khuẩn gram
(+). Trong quá trình phát triển trên môi truoưngf này Coliform chịu nhiệt và E.coli
lên men đường lactoza ở 44 oC tạo thành aldehyt và axit, aldehyt tác động đến phức
chất fucshin-sulfit và giải phóng fucshin, sau đó fucshin nhuộm các khuẩn lạc thành
màu hồng đến màu đỏ cánh sen, tròn, bờ đều, có thể có ảnh kim hoặc không. Nếu
khuẩn lạc hồng có ánh kim có thể giả định là E.coli thì kiểm tra có sinh indol hay không.
2. Hóa chất, môi trường -
Môi trường Endo: pepton 10g; lactoza 10g; K2HPO4 2,5g; sulfit natri 3,3g;
fucshin kiềm 0,3g; thạch 15; H2O đủ 1000ml; pH=7,5. -
Hòa tan các chất và môi trường hấp khử trùng ở nhiệt độ 121 oC trong thời gian 20 phút. -
Dung dịch trypton: trypton 10g; NaCl 5g; H2O cho đủ 1000ml; pH = 7,3.
Thanh trùng ở nhiệt độ 121 oC trong 15 phút. -
Thuốc thử indol: 4-dimethylaminobenzaldehyt 5g; 2-metyl butan-1-ol ( hoặc
pental- 1-ol) 75ml; HCl đậm đặc 25ml. -
Hòa tan 4-dimethylaminobenzaldehyt trong 2-metyl butan-1-ol ( hoặc pental-1-
ol), hoặc đun nhẹ trong nồi cách thủy 50-55oC. Làm nguội và cho axit vào, bảo
quản chỗ tối ở nhiệt độ thấp. Thuốc thử có màu vàng sáng. 3. Tiến hành -
Chuẩn bị mẫu pha loãng. Cấy 1 giọt mẫu vào petri đã có môi trường thạch endo,
mỗi độ pha loãng cấy vào 2 đĩa, và trang đều lên mặt thạch. Nuôi cấy trong tủ ấm ở
nhiệt độ 44±1 oC trong 48-72h. -
Trên mỗi đĩa petri đã nuôi, chọn các khuẩn lạc nghi ngờ có đặc tính như có màu
hồng, đỏ cánh sen, tròn, bờ đều và có ánh kim để tiến hành khẳng định là E.coli
Phép thử khẳng định: -
Chọn khuẩn lạc nghi ngờ, dùng pipet cấy chuyển 1 ml sang các ống nghiệm có
chứa nước trypton. Để các ống đã cấy trong tủ ấm ở nhiệt độ 44±1 oC trong 48h. -
Thêm 0,5ml thuốc thử indol vào các ống chứa dung dịch trypton đã nuôi cấy,
lắc đều và sau 1 phút thì quan sát và ghi nhận số lượng các ống có màu đỏ chứng tỏ
có indol (kết quả dương tính) cho mỗi độ pha loãng. 4. Kết quả
Kết quả đếm khuẩn lạc: Độ pha loãng Đĩa 1 Đĩa 2 10-1 0 0 10-2 0 0 5. Nhận xét
Không phát hiện có E. Coli trong mẫu dưa phân tích
Nguyên nhân: Do trong dưa có nhiều axit lactic ức chế sự phát triển của E. Coli nên
không phát hiện sự có mặt của E. Coli. 6. Nhận xét chung
Khi phân tích E. Coli bằng phương pháp MPN và phương pháp đếm khuẩn lạc cho
ra hai kết quả khác nhau do cả hai phương pháp đều có sự sai lệch của dụng cụ,
của thao tác và độ chính xác của 2 phương pháp cũng không phải là tuyệt đối.
Phương pháp MPN cho kết quả dao động khá lớn nên thường biểu diễn kết quả
theo giới hạn tin cậy, tuy nhiên vẫn có sự khác nhau với kết quả ở phương pháp đếm khuẩn lạc.
BÀI 4. ĐỊNH LƯỢNG STAPHYLOCOCCUS AUREUS
1. Tổng quan và nguyên tắc -
Mục đích của chỉ tiêu: Staphylococcus aureus còn được gọi là tụ cầu khuẩn gây
bệnh do đó cần xác định để biết mẫu sản phẩm thực phẩm phân tích có mang mối
nguy hiểm cho người tiêu dùng hay không. -
Dựa vào tính chất đặc biệt của vi khuẩn St.aureus là phát triển được trên môi
trường muối mannitol như trên môi trường Chapman tạo khuẩn lạc màu vàng hoặc
trên môi trường Baird-Packer cho khuẩn lạc màu đen. -
Nếu sau khi nuôi cấy, không có khuẩn lạc mọc trên môi trường thạch chọn lọc
nói trên, thì cũng chưa thể khẳng định được là không có St.aureus trong mẫu phân tích
vì vi khuẩn này thường ở lượng rất nhỏ. Trong trường hợp này nên làm tăng lượng vi
khuẩn này bằng cách nuôi cấy trên môi trường thạch Chapman chọn lọc. Như vậy ta
có thể xác định được số lượng ít nhất của St.aureus trong thể tích sản phẩm ban đầu.
2. Dụng cụ, thiết bị
- Dụng cụ chuẩn bị mẫu (cối chày, kéo,..) - Bình tam giác
- Hộp petri, ống fancol dùng để pha loãng mẫu. - Micropipet 1 ml và 0,1 ml
- Đầu côn dùng cho 2 micropipet - Que chang
3. Hóa chất, môi trường -
Môi trường Baird-Parker: pepton 10g; cao nấm men 1g; cao thịt 5g; pyruvat
natri 10g; glycocol 12g; dịch nhũ lòng đỏ trứng 50ml; tellurit kali 0,1g; LiCl 5g;
K2TeO3 0,1g; Thạch 20g; pH= 7,2; H2O đủ 1000ml.
Ở thí nghiệm này ta dùng môi trường Baird-Parker đã chuẩn bị sẵn. Chuẩn bị 250 ml
môi trường tương đương với 16 đĩa petri. Hòa tan các chất và môi trường hấp khử
trùng ở 121oC trong 15 phút. 4. Tiến hành
- Mẫu thí nghiệm: dưa chua
- Rửa sạch và khử trùng các dụng cụ cũng như dung dịch pha loãng.
- Chú ý: khi thao tác cần khử trùng tay và làm việc gần ngọn lửa đèn cồn.
- Cân 10g mẫu, cắt nhỏ bằng kéo, nghiền nhỏ bằng cối và chày. Chuyển mẫu vào bình
tam giác, thêm 90 ml nước muối sinh lý vô trùng, lắc đều.
- Pha loãng thập phân mẫu phân tích đến 10-2
- Cấy giống trên bề mặt thạch:
+ Môi trường sau khi hấp khử trùng thì rót vào các đĩa petri (môi trường thạch
BairdParker đã bổ sung dịch nhũ lòng đỏ trứng), mỗi đĩa cho 15 -18 ml môi trường.
Xếp các đĩa trên mặt phẳng ngang, để yên cho đến khi thạch nguội và đông hoàn toàn
(có thể để 2-3 ngày ở nhiệt độ 30˚C để kiểm tra độ vô trùng của các hộp). Khi cấy
chọn các hộp petri còn hoàn toàn vô trùng.
+ Lấy 0,1 ml mẫu đã pha loãng cho vào hộp petri đã chứa môi trường thạch dinh
dưỡng (làm tại 2 độ pha loãng 10-1, 10-2, mỗi độ pha loãng làm 2 hộp). Chang đều trên mặt thạch.
+ Lật ngược đĩa, để vào tủ nuôi nhiệt độ 37˚C trong thời gian 24-72 giờ.
- Quan sát khuẩn lạc mọc trên đĩa, đếm các khuẩn lạc màu đen bóng, có một mép viền
màu trắng xám, xung quanh khuẩn lạc có một vùng sáng trong, rộng (trong khi đó bề mặt môi trường đục).
Phép thử khẳng định:
Chọn khuẩn lạc nghi ngờ, dùng que cấy vòng cấy chuyển sang các ống nghiệm có
chứa 0,5ml dịch huyết tương thỏ. Lắc nhẹ để trộn đều môi trường. Để các ống đã cấy
trong tủ ấm ở nhiệt độ 37±1 oC trong 2h. Theo dõi phản ứng đông huyết tương sau
mỗi 2h. Tiếp tục nuôi cấy đến 24h thì ngừng nếu không thấy xuất hiện khối kết tụ. 5. Kết quả
Kết quả đếm khuẩn lạc: Độ pha loãng Đĩa 1 Đĩa 2 10-1 30 16 10-2 3 3
Dựa vào số khuẩn lạc nghi ngờ, ta tính được lượng Staphylococcus aureus trung bình có trong 1ml mẫu ban đầu
Số lượng Staphylococcus aureus có trong 1 g mẫu được tính theo công thức: ∑𝐶 Trong đó:
N = 𝑛 . 𝑓. 𝑣 . 𝑅 = 302+.1016−+1.03,+13 . 0 = 0
∑𝑛𝐶 tổng số khuẩn lạc đếm được trên tất cả các đĩasố đĩa petri đã nuôi cấy thạch 𝑓
thể tích mâu cấy vào mỗi đĩa petri
hệ số pha loãng của mẫu
𝑣𝑅 số ống thử phản ứng coagulase dương tính/tổng số ống thử