







Preview text:
lOMoAR cPSD| 59062190 KHOA DƯỢC
BỘ MÔN KIỂM NGHIỆM – HÓA PHÂN TÍCH – ĐỘC CHẤT BÁO CÁO THỰC HÀNH
HỌC PHẦN: HÓA PHÂN TÍCH 2
Tên bài học: CHUẨN ĐỘ H3PO4 BẰNG PHƯƠNG PHÁP CHUẨN ĐỘ ĐIỆN THẾ
I. Trình bày kết quả hiệu chuẩn máy
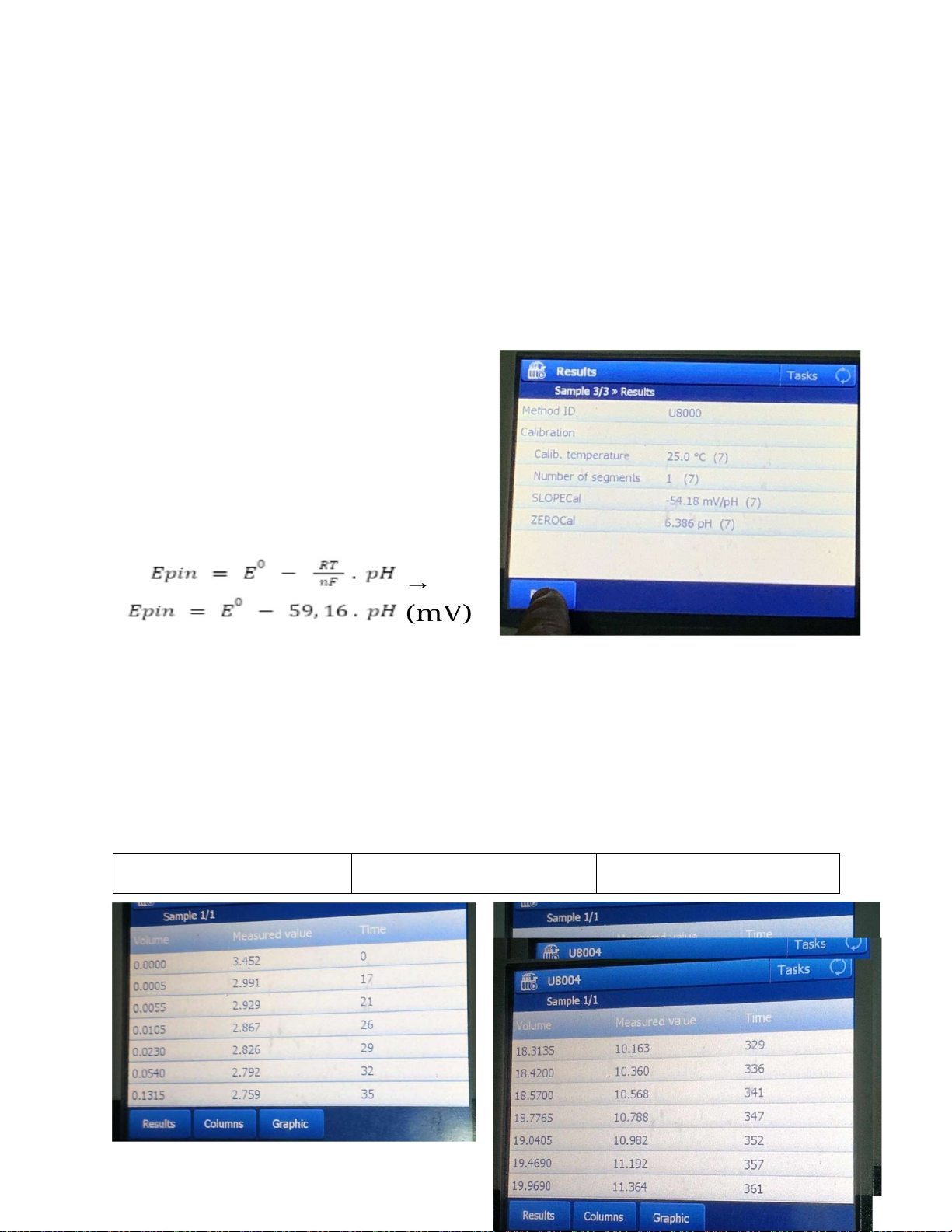
Kết quả thu được từ máy: ZEROCal = 6.386 pH SLOPECal = -54.18 mV/pH Nhận xét kết quả: Ta có:
→ % SLOPECal = ( -54,18/-59,16) x100%≈ 91.58 % nằm trong khoảng cho phép (90 – 110%).
ZEROCal = 6.386 pH không nằm trong khoảng cho phép pH = 7 ± 0,5
Vậy máy không đạt yêu cầu theo các giới hạn cho phép.
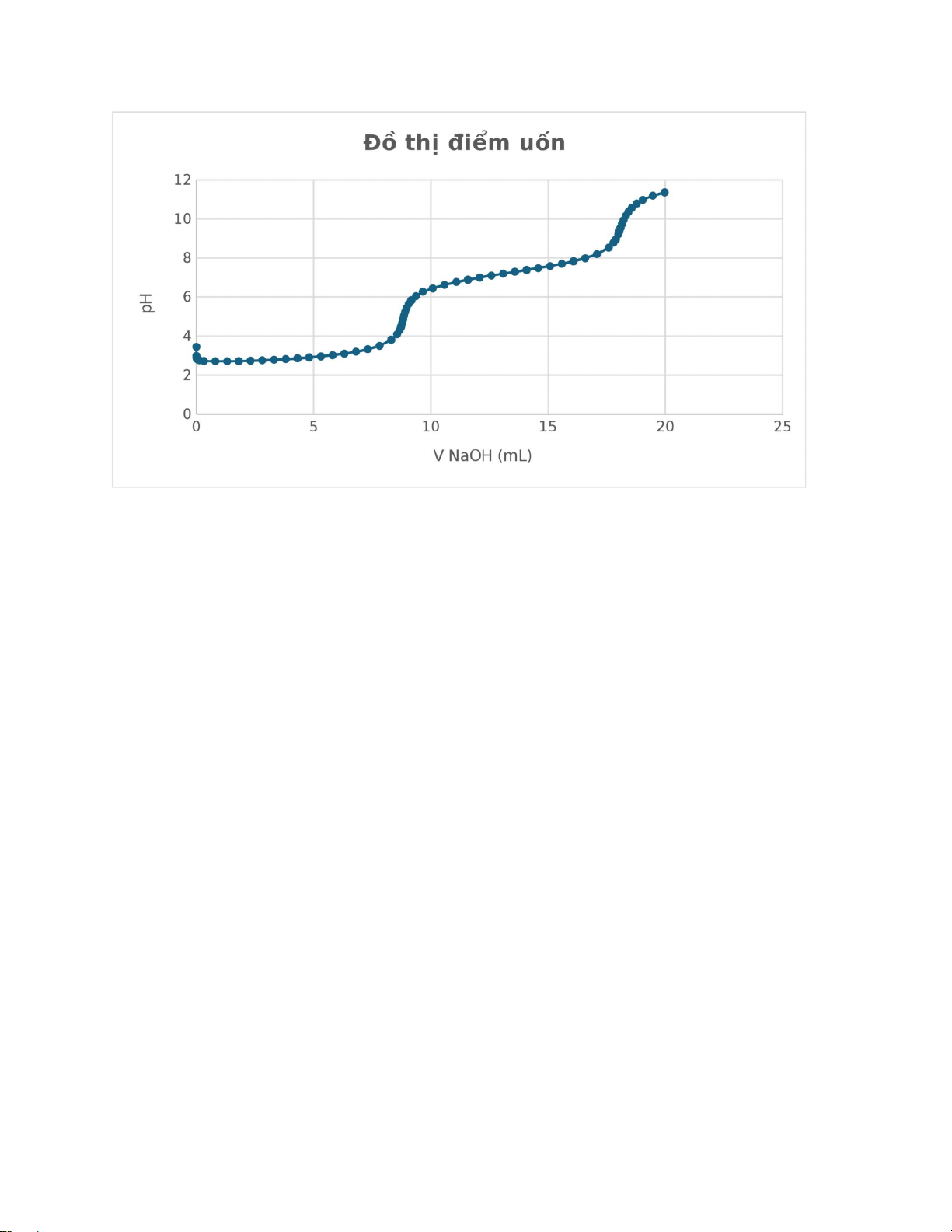
II. Chuẩn độ acid H3PO4 bằng dung dịch NaOH theo phương pháp đo thế: Ta có bảng số liệu: Phương pháp điểm uốn
Phương pháp đạo hàm bậc 1
Phương pháp đạo hàm bậc 2 lOMoAR cPSD| 59062190 V NaOH pH ΔpH/ΔV Vtb NaOH ΔpH2/ΔV2 V’ NaOH (ml) ( mL) ( mL) 0.0000 3.452 0.0005 2.991 -922 0.00025 0.0055 2.929 -12.4 0.003 330763.636 0.001625 0.0105 2.867 -12.4 0.008 0.000 0.0055 0.0230 2.826 -3.28 0.01675 1042.286 0.012375 0.0540 2.792 -1.096774194 0.0385 100.378 0.027625 0.1315 2.759 -0.425806452 0.09275 12.368 0.065625 0.3255 2.722 -0.190721649 0.2285 1.732 0.160625 0.8105 2.711 -0.022680412 0.568 0.495 0.39825 1.3105 2.709 -0.004 1.0605 0.038 0.81425 1.8105 2.717 0.016 1.5605 0.040 1.3105 2.3105 2.735 0.036 2.0605 0.040 1.8105 2.8105 2.759 0.048 2.5605 0.024 2.3105 3.3105 2.786 0.054 3.0605 0.012 2.8105 3.8105 2.820 0.068 3.5605 0.028 3.3105 4.3105 2.861 0.082 4.0605 0.028 3.8105 4.8105 2.908 0.094 4.5605 0.024 4.3105 5.3105 2.962 0.108 5.0605 0.028 4.8105 5.8105 3.028 0.132 5.5605 0.048 5.3105 6.3105 3.104 0.152 6.0605 0.040 5.8105 6.8105 3.203 0.198 6.5605 0.092 6.3105 lOMoAR cPSD| 59062190 7.3105 3.329 0.252 7.0605 0.108 6.8105 7.8105 3.506 0.354 7.5605 0.204 7.3105 8.3105 3.812 0.612 8.0605 0.516 7.8105 8.5590 4.098 1.150905433 8.43475 1.440 8.247625 8.6590 4.290 1.92 8.609 4.414 8.521875 8.7265 4.475 2.740740741 8.69275 9.800 8.650875 8.7820 4.683 3.747747748 8.75425 16.374 8.7235 8.8240 4.882 4.738095238 8.803 20.315 8.778625 8.8600 5.057 4.861111111 8.842 3.154 8.8225 8.9035 5.239 4.183908046 8.88175 -17.037 8.861875 8.9630 5.430 3.210084034 8.93325 -18.909 8.9075 9.0510 5.647 2.465909091 9.007 -10.091 8.970125 9.1650 5.833 1.631578947 9.108 -8.261 9.0575 9.3650 6.052 1.095 9.265 -3.418 9.1865 9.6585 6.271 0.746166951 9.51175 -1.414 9.388375 10.0825 6.445 0.410377358 9.8705 -0.936 9.691125 10.5825 6.625 0.36 10.3325 -0.109 10.1015 11.0825 6.770 0.29 10.8325 -0.140 10.5825 11.5825 6.889 0.238 11.3325 -0.104 11.0825 12.0825 7.000 0.222 11.8325 -0.032 11.5825 12.5825 7.101 0.202 12.3325 -0.040 12.0825 13.0825 7.198 0.194 12.8325 -0.016 12.5825 13.5825 7.293 0.19 13.3325 -0.008 13.0825 14.0825 7.388 0.19 13.8325 0.000 13.5825 14.5825 7.485 0.194 14.3325 0.008 14.0825 lOMoAR cPSD| 59062190 15.0825 7.589 0.208 14.8325 0.028 14.5825 15.5825 7.704 0.23 15.3325 0.044 15.0825 16.0825 7.834 0.26 15.8325 0.060 15.5825 16.5825 7.992 0.316 16.3325 0.112 16.0825 17.0825 8.201 0.418 16.8325 0.204 16.5825 17.5825 8.536 0.67 17.3325 0.504 17.0825 17.7905 8.786 1.201923077 17.6865 1.503 17.5095 17.8910 8.949 1.621890547 17.84075 2.723 17.76363 17.9885 9.209 2.666666667 17.93975 10.553 17.89025 18.0380 9.376 3.373737374 18.01325 9.620 17.9765 18.0890 9.549 3.392156863 18.0635 0.367 18.03838 18.1520 9.751 3.206349206 18.1205 -3.260 18.092 18.2235 9.949 2.769230769 18.18775 -6.500 18.15413 18.3135 10.163 2.377777778 18.2685 -4.848 18.22813 18.4200 10.360 1.849765258 18.36675 -5.374 18.31763 18.5700 10.568 1.386666667 18.495 -3.611 18.43088 18.7765 10.788 1.065375303 18.67325 -1.802 18.58413 19.0405 10.982 0.734848485 18.9085 -1.405 18.79088 19.4690 11.192 0.49008168 19.25475 -0.707 19.08163 19.9690 11.364 0.344 19.719 -0.315 19.48688
1. Phương pháp điểm uốn lOMoAR cPSD| 59062190
Từ đồ thị độ E theo V có 2 vùng bước nhảy chuẩn độ:
1. V = 8,7265 mL (pH= 4,683); V = 8,9035 mL (pH= 5,239).
2. V = 9,165 mL (pH= 5,833); V = 9,365 mL (pH= 6,052).
⇨ Điểm tương đương 1 là trung điểm của 2 điểm (8,7265;4,683) , (8,9035;5,239): V1 = 8,815 mL; pH = 4,961
⇨ Điểm tương đương 2 là trung điểm của 2 điểm (9,165;5,833) , (9,365;6,052): V2 = 9,265 mL; pH = 5,9425
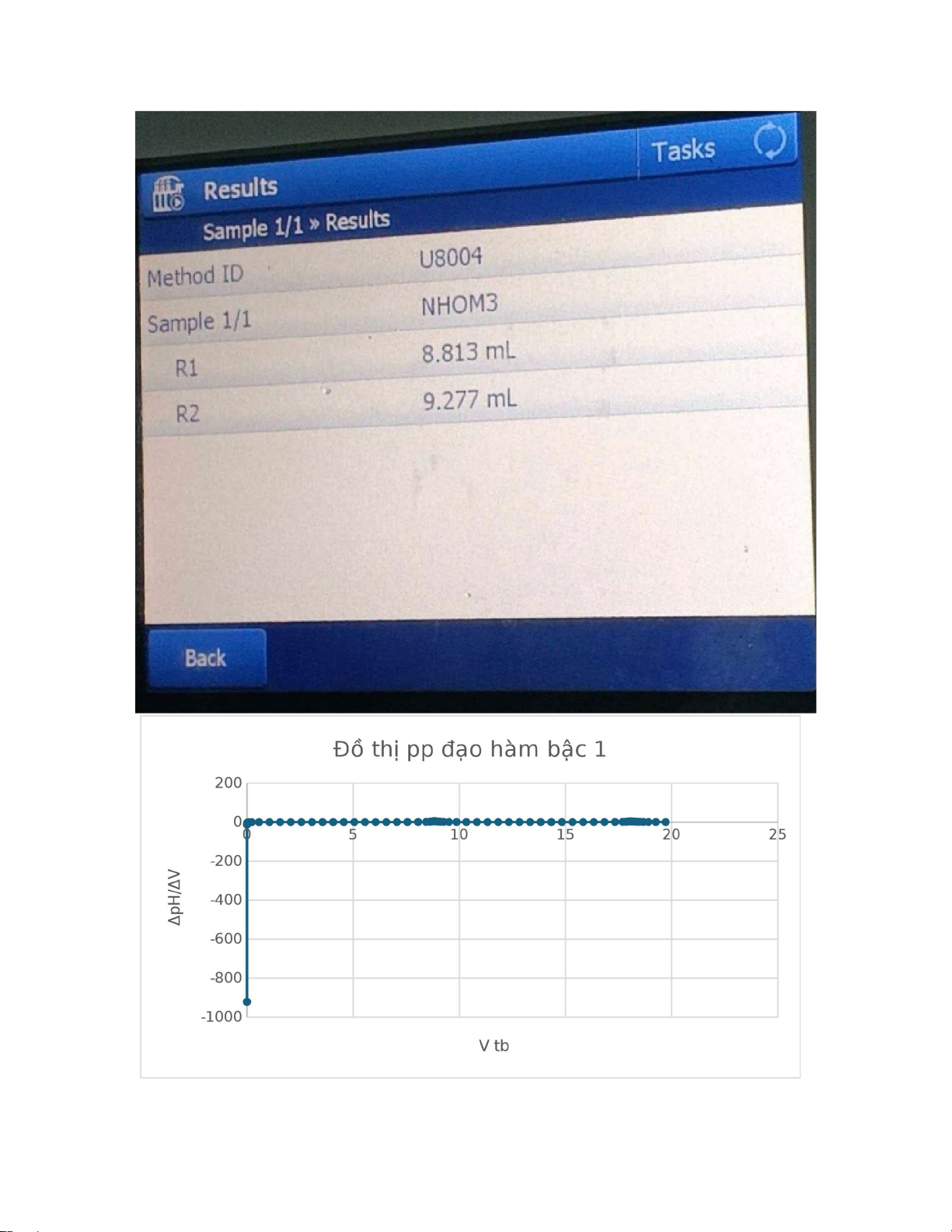
2.Phương pháp đạo hàm bậc 1 lOMoAR cPSD| 59062190 lOMoAR cPSD| 59062190
Vì chênh lệch các giá trị Δ2E/Δ2V quá lớn dẫn đến khó quan sát đồ thị, ta có thể
tạm thời bỏ qua các số liệu quá lớn và thu được đồ thị như sau:
- Điện cực so sánh là điện cực Calomen hay Ag/AgCl.
- Điện cực chỉ thị là thủy tinh đo pH , đây là nhóm điẹn cực màng. - Ta có :
+ VH3PO4 = 10mL, CNaOH = 0,1 N
+ R1 = 8,813 mL , R2 = 9,277 mL Vtd1 = R1 = 8,813 mL
Vtd2 = R1+ R2 = 8,813 + 9,277 = 18,09 mL
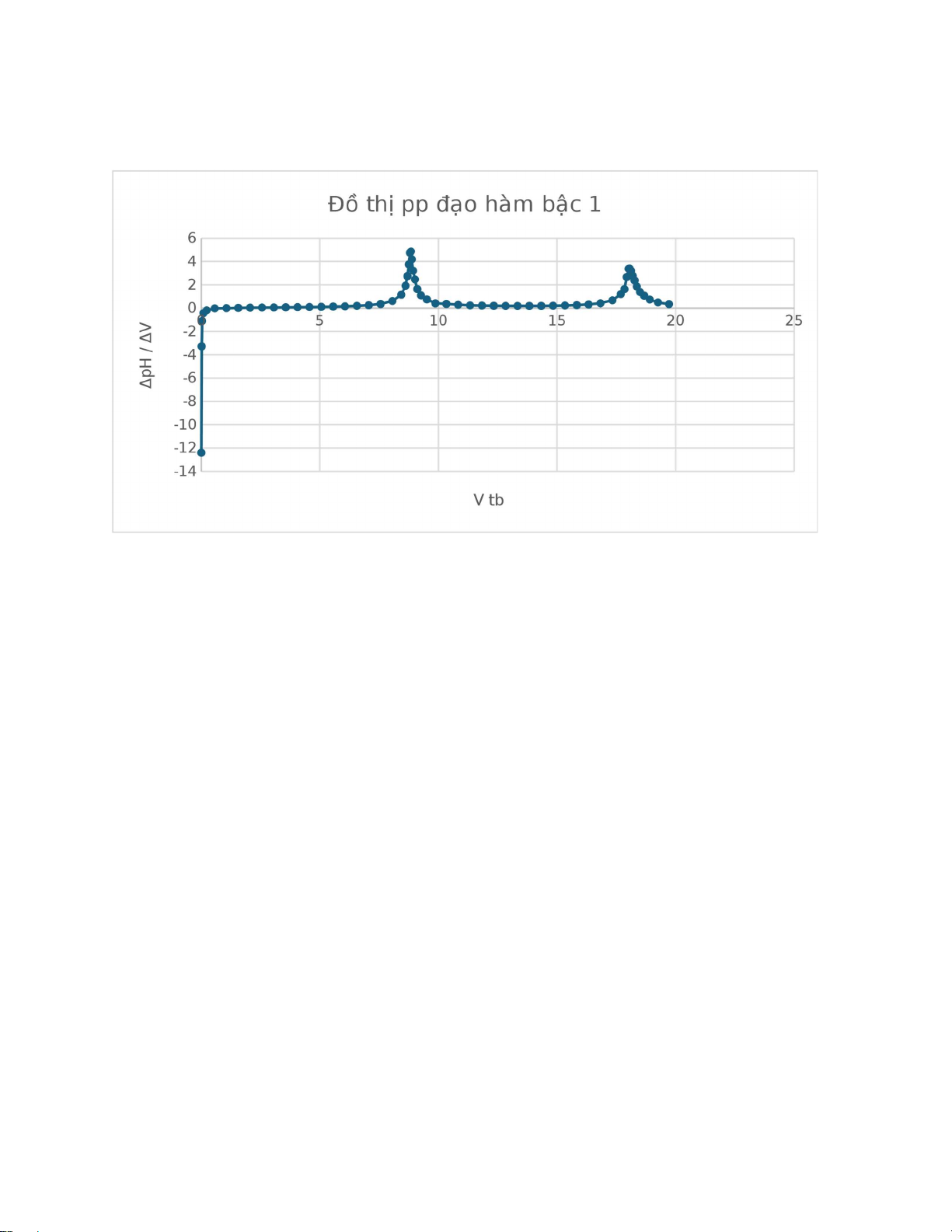
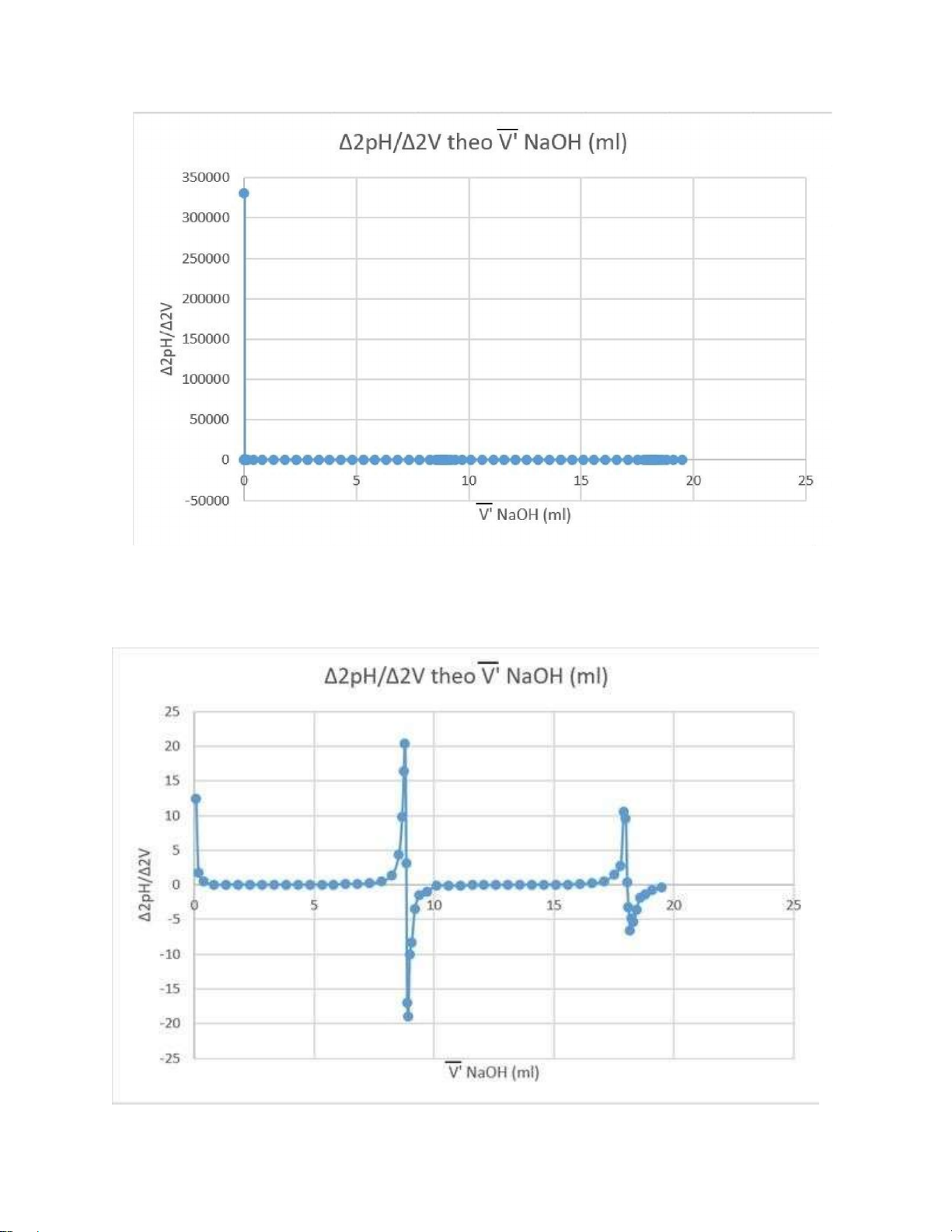
3. Phương pháp đạo hàm bậc 2: lOMoAR cPSD| 59062190
Vì chênh lệch các giá trị Δ2E/Δ2V quá lớn dẫn đến khó quan sát đồ thị, ta có thể
tạm thời bỏ qua các số liệu quá lớn và thu được đồ thị như sau: lOMoAR cPSD| 59062190
Thể tích tương đương theo đạo hàm bậc hai tính theo công thức sau: ∆V .|∆2Et| Vtđ = Vt + 2 2 |∆ Et|+|∆ Es| Trong đó: •
Vt, Vs là thể tích dung dịch NaOH 0, 1N ứng với giá trị Δ2E dương liền kề với giá trị Δ2E âm; •
Δ2Et và Δ2Es là 2 giá trị Δ2E dương, âm liền kề; • ΔV = Vs – Vt Ta có:
+ Vt1 = 8.8225 mL; Vs1 = 8.861875 mL
ΔV1 = Vs1 – Vt1 = 8.861875 – 8.8225 = 0,039375 ml ∆V 1. ∆
=>Vtđ1 = Vt1 |∆2Et1|+|∆2E | |3.154|+|−17.037| 8.8287 mL s1
+ Vt2 = 18.03838 mL; Vs2 = 18.092 mL
ΔV2 = Vs2 – Vt2 = 18.092 – 18.03838 = 0.05362 ml ∆V 2. ∆
=>Vtđ2 = Vt2 |∆2Et2|+|∆2Es2| |0.367|+|−3.260| mL
Từ thể tích Vtđ tính nồng độ CM của dung dịch H3PO4 (VH3PO4 = 3 mL):
Vtđ . NNaOH = VH3PO4 . NH3PO4 V .N 0.0180438∗0.1 ⇨ NH3PO4 N 3PO 4 N H 3PO 4 0.60146 0.30073 mol/L ⇨ CM (H3PO4) = = =¿ 2 2 lOMoAR cPSD| 59062190
III. Trả lời câu hỏi lượng giá
Câu 1. Hãy nêu tắc của phương pháp đo pH bằng đo thế:
- Dùng máy đo có điện cực kép gồm điện cực chỉ thị màng thủy tinh và điệncực so sánh là Ag/ AgCl.
- Khi nhúng các cực này vào dung dịch đo có pH trong khoảng thì quan hệ
giữathế của cực chỉ thị và pH là tuyến tính chỉ phụ thuộc vào nhiệt độ theo phương trình: E = E 0 + 2,303. RTF . log aH+ 0 - 2,303. RTF . Ph = E
( trong đó: E 0 const, phụ thuộc nhiệt độ và bản chất mỗi điện cực; ở 25oC trị RT số 2.303. F = 59,16 mV).
Câu 2. Nguyên tắc của phương pháp chuẩn độ đo thế.
- Thực chất của phương pháp đo thế là đo suất điện động của một pin tạo bởimột
điện cực có thể thay đổi phụ thuộc và nồng độ ion chất cần xác định (gọi là điện
cực chỉ thị) và một điện cực có thể không thay đổi (gọi là điện cực so sánh), cả
hai điện cực đều được nhúng vào điện cực nghiên cứu: lOMoAR cPSD| 59062190
E = E chỉ thị - E so sánh
⇨ Vì vậy nếu tìm được điện cực chỉ thị cho một ion (chất) nào đó, chúng ta có
thể xác định được nồng độ của nó bằng phương pháp đo thế tùy theo hai kỹ thuật thực hiện sau:
- Tiến hành đo thế các dung dịch chuẩn và dung dịch cần xác định rồi từ đó
suyra nồng độ ion cần xác định theo phương pháp so sánh, đường chuẩn...:
điển hình cho kỹ thuật này trong phân tích là đo pH, đo pM (M là ion nào đó).
- Tiến hành đo thế của dung dịch trong quá trình chuẩn độ, từ đó suy ra điểm
tương đương để tính toán nồng độ dung dịch, gọi là phương pháp chuẩn độ đo thế.
Câu 3. Trình bày cách tính kết quả của phương pháp chuẩn độ đo thế.
E = E chỉ thị - E so sánh
Tiến hành đo thế của dung dịch trong quá trình chuẩn độ, từ đó suy ra điểm
tương đương để tính toán nồng độ dung dịch:
- Khi nhúng các điện cực này vào dung dịch đo có pH trong khoảng 0thì quan hệ giữa thế của cực chỉ thị và pH là tuyến tính chỉ phụ thuộc vào nhiệt độ theo phương trình: E = E 0 + 2,303. RTF . log aH+ 0 - 2,303. RTF . Ph lOMoAR cPSD| 59062190 = E
- Dựa vào 3 cách sau để xác định V tđ :
+ Cách 1 : Điểm kết thúc là điểm uốn của đường cong biểu diễn sự phụ thuộc của E theo V.
+ Cách 2 : Điểm kết thúc là cực đại của đường đạo hàm bậc nhất ∆E/∆V theo NaOH .
+ Cách 3: Đạo hàm bậc 2 ∆ 2 E/∆ 2 V theo ’ NaOH . Điểm kết thúc là giao điểm
của đồ thị với trục hoành.
Thể tích tương đương theo đạo hàm bậc 2 tính theo công thức sau: ∆V .|∆2Et| Vtđ = Vt + 2 2 |∆ Et|+|∆ Es|
Từ thể tích V tđ tính nồng độ CM của dung dịch H3PO4 :
Vtđ . NNaOH = VH3PO4 . NH3PO4
Câu 4. Thế nào là điện cực chỉ thị, điện cực so sánh. Cho thí dụ.
- Điện cực so sánh là điện cực có thế không thay đổi, không phụ thuộc vào
dungdịch điện ly mà nó nhúng vào.
Ví dụ: điện cực hydro, điện cực Ag-AgCl, điện cực Calomel.
- Điện cực chỉ thị là điện cực có thể phụ thuộc vào nồng độ chất cần khảo
sáttrong dung dịch mà điện cực này nhúng vào gồm:
+Điện cực chỉ thị kim loại là loại điện cực có nhiệm vụ chuyển các electron vào
hay từ các phân tử trong dung dịch. lOMoAR cPSD| 59062190
Ví dụ: Điện cực Ag, điện cực chỉ thị cho hệ thống oxi hoá - khử…
+Điện cực màng đôi khi còn gọi là điện cực plon bởi vì các số liệu nhân được
thường biểu diễn dưới dạng hàm p- chẳng hạn như pH, pCa hay pNO3. Ví dụ:
Điện cực thuỷ tinh, điện cực màng rắn, điện cực màng lỏng…



