


Preview text:
lOMoAR cPSD| 59062190
Bài 6. CHUẨN ĐỘ AXIT H3PO4 BẰNG DUNG DỊCH
NAOH THEO PHƯƠNG PHÁP ĐO THẾ * Mục tiêu
- Trình bày được bản chất của phép đo pH bằng đo thế và phương pháp chuẩn độ đo thế.
- Thực hành được động tác đo pH. Đo đạt sai số không quá ±0,2 đơn vị pH.
- Làm được phép chuẩn độ đo thế.
I. Cơ sở lý thuyết 1. Bản chất của phương pháp
Thực chất của phương pháp đo thế là
đo suất điện động của một pin tạo bởi một
điện cực có thể thay đổi phụ thuộc và nồng
độ ion chất cần xác định (gọi là điện cực chỉ
thị) và một điện cực có thể không thay đổi
(gọi là điện cực so sánh), cả hai điện cực
đều được nhúng vào điện cực nghiên cứu: E = E Hình 7.1 pH kế chỉ thị - Eso sánh
Vì vậy nếu tìm được điện cực chỉ thị cho một ion (chất) nào đó, chúng ta có
thể xác định được nồng độ của nó bằng phương pháp đo thế tùy theo hai kỹ thuật thực hiện sau:
* Tiến hành đo thế các dung dịch chuẩn và dung dịch cần xác định rồi từ đó
suy ra nồng độ ion cần xác định theo phương pháp so sánh, đường chuẩn…: điển
hình cho kỹ thuật này trong phân tích là đo pH, đo pM (M là ion nào đó).
* Tiến hành đo thế của dung dịch trong quá trình chuẩn độ, từ đó suy ra điểm
tương đương để tính toán nồng độ dung dịch, gọi là phương pháp chuẩn độ đo thế.
2. Xác định pH của dung dịch bằng phương pháp đo thế: lOMoAR cPSD| 59062190
Dùng điện cực chỉ thị là thủy tinh đo pH, điện cực khí hidro.... Điện cực so
sánh là calomen hay Ag/AgCl. Để cho gọn có thể dùng điện cực tổ hợp là điện
cực kép gồm một điện cực chỉ thị và một điện cực so sánh (thường hay dùng thủy
tinh + calomen; thủy tinh + Ag/AgCl; kim loại quý + calomen). Khi nhúng các
cực này vào dung dịch đo có pH trong khoảng 0 < pH < 12 thì quan hệ giữa thế
của cực chỉ thị và pH là tuyến tính chỉ phụ thuộc vào nhiệt độ theo phương trình: E = E 0 + 2,303. . log aH+ = E0 - 2,303. . pH
( trong đó: E0 const, phụ thuộc nhiệt độ và bản chất mỗi điện cực; ở 25oC trị số 2.303 59,16 mV).
Vì vậy khi sử dụng máy đo thế (pH metre) có thể xác định được pH của dung dịch cần thử.
3. Chuẩn độ acid H3PO4 bằng dung dịch NaOH theo phương pháp đo thế
Cặp điện cực hay dùng là: Thủy tinh + calomen (hay Ag/AgCl) hoặc điện cực
tổ hợp Thủy tinh – calomen, Thủy tinh - Ag/AgCl.
Phương trình của phản ứng định lượng là: H3PO4 + NaOH = NaH2PO4 + H2O (1)
NaH2PO4 + NaOH = Na2HPO4 + H2O (2) Na2HPO4 + NaOH = Na3PO4 + H2O (3)
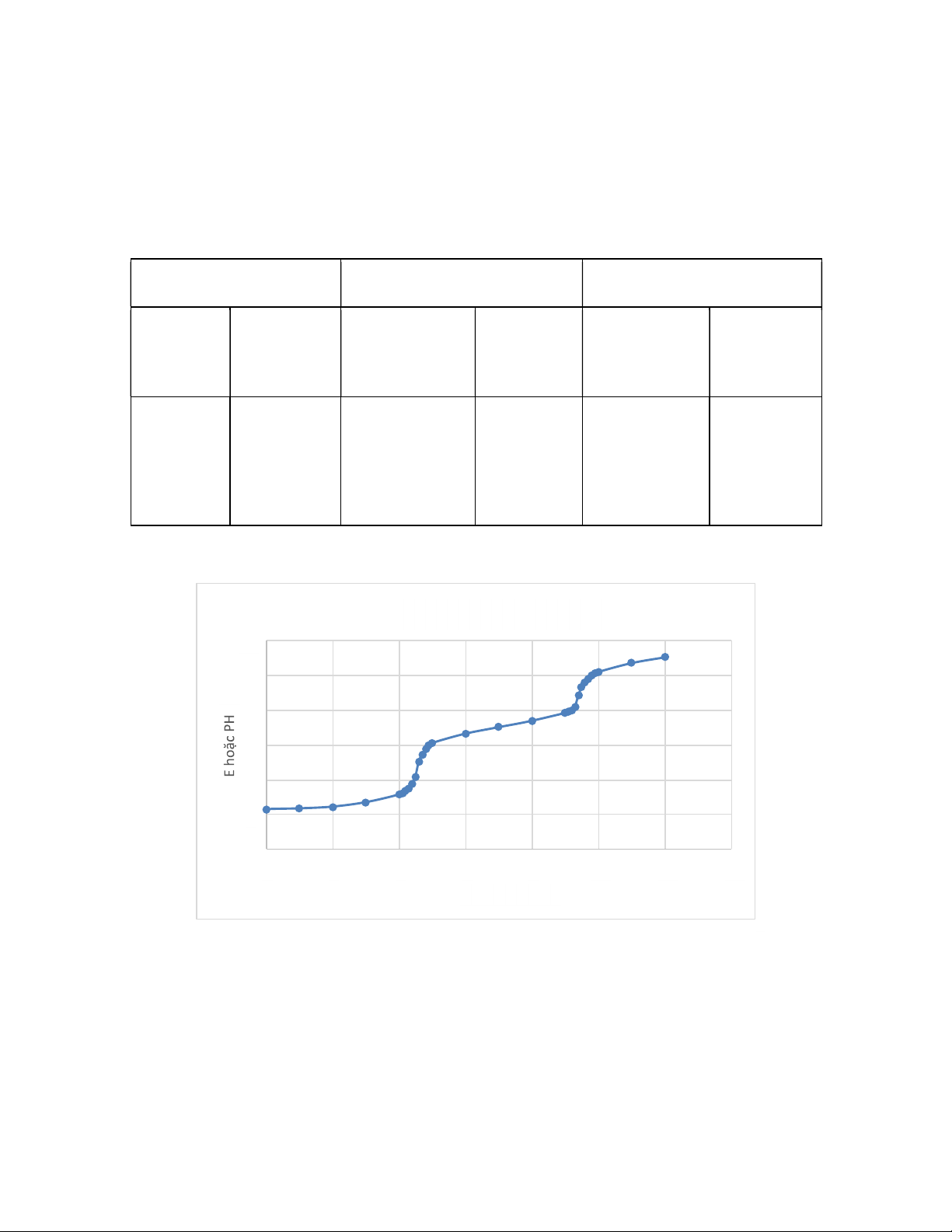
Như vậy trong quá trình định lượng, pH hoặc điện thế của dung dịch liên tục
thay đổi và tại các điểm tương đương (1), (2); có sự thay đổi đột ngột của pH
(điểm tương đương (3) không rõ ). Nếu ta ghi chép quan hệ giữa thể tích dung
dịch (V ml) chuẩn NaOH cho vào dung dịch cần định lượng H3PO4 với điện thế
E của dung dịch (hoặc pH) sau mỗi lần cho NaOH, rồi vẽ đồ thị ta sẽ được đường
cong chuẩn độ. Từ đồ thị hoặc bảng theo dõi ta xác định được thể tích dung dịch
chuẩn NaOH ở điểm tương đương. Từ đó tính được nồng độ của dung dịch H3PO4. lOMoAR cPSD| 59062190
II. Chuẩn bị 1. Hóa chất
- Dung dịch đệm pH = 7,0; pH = 4,0; pH = 10,0 - Chỉ thị màu vạn
năng. - Dung dịch cần định lượng (H3PO4). - Dung dịch NaOH 0,1N. 2. Dụng cụ - Máy đo pH. - Máy khuấy từ. - Que khuấy. - Cốc để dung dịch. - Burret.
- Điện cực thủy tinh, Ag/AgCl (hoặc điện cực tổ hợp).
III. Qui trình thực hành 1. Đo pH của dung dịch
* Hiệu chuẩn máy: tham khảo bài 1 – cách sử dụng máy. - Cài đặt nhiệt độ. - Chọn hệ đệm. - Hiệu chuẩn. * Đo pH dung dịch.
Chú ý: Mỗi khi thay dung dịch đo phải dùng bình phun nước cất rửa sạch
cực, lau khô bằng giấy sạch mịn và mềm.
Yêu cầu đo pH của dung dịch không được sai quá ± 0,20 đơn vị pH.
2. Chuẩn độ acid H3PO4 bằng dung dịch NaOH theo phương pháp đo thế
Lấy chính xác 10,00 ml H3PO4 cần định lượng cho vào cốc 250 ml đặt trên
máy khuấy từ. Thêm que khuấy lắp điện cực và nối với máy (chú ý điện cực để
cách đáy cốc khoảng 2 cm để tránh que khuấy chạy làm vỡ cực). Thêm nước cất
cho ngập điện cực. Đổ dung dịch NaOH 0,1 N lên trên buret.
Bật máy đo ở chế đọ đo thế E (mV) (hoặc đo pH). Ghi giá trị thế E (hoặc pH) ban đầu.
Chuẩn độ sơ bộ: Bật máy khuấy từ , nhỏ NaOH 0,1N từ trên buret xuống,
sau mỗi lần thêm 1 ml NaOH 0,1N (∆V=1 ml), tắt máy khuấy (hoặc hệ thống
khuấy sẽ sẽ có chế độ tự tắt), ghi thế E hoặc pH. Theo dõi cho đến khi có 2 bước
nhảy thế, ghi nhớ thể tích NaOH 0,1N tương ứng với lân cận 2 điểm này (điểm tương đương). lOMoAR cPSD| 59062190
Chuẩn độ chính xác: Lặp lại động tác chuẩn độ trên, nhưng với lưu ý rằng ở
lân cận 2 điểm tương đương thăm dò qua chuẩn độ trên, ta cho NaOH 0,1N xuống
với ∆V=0,1 ml lại tắt máy khuấy và ghi giá trị thế E hoặc pH của dung dịch. Kết
quả được ghi vào bảng sau: Phương pháp điểm uốn
Phương pháp đạo hàm bậc 1 Phương pháp đạo hàm bậc 2 VNaOH ∆2E/∆2V (ml) E(mV) ∆E/∆V hoặc 𝑉̅NaOH hoặc 𝑉̅′NaOH hoặc pH ∆pH/∆V (ml) (ml) ∆2pH/∆2V
Cách 1: Điểm kết thúc là điểm uốn của đường cong biểu diễn sự phụ thuộc của E (hoặc pH) theo V E (hoặc pH) theo V 12 10 8 6 4 2 0 0 2 4 6 8 10 12 14 VNaOH (ml)
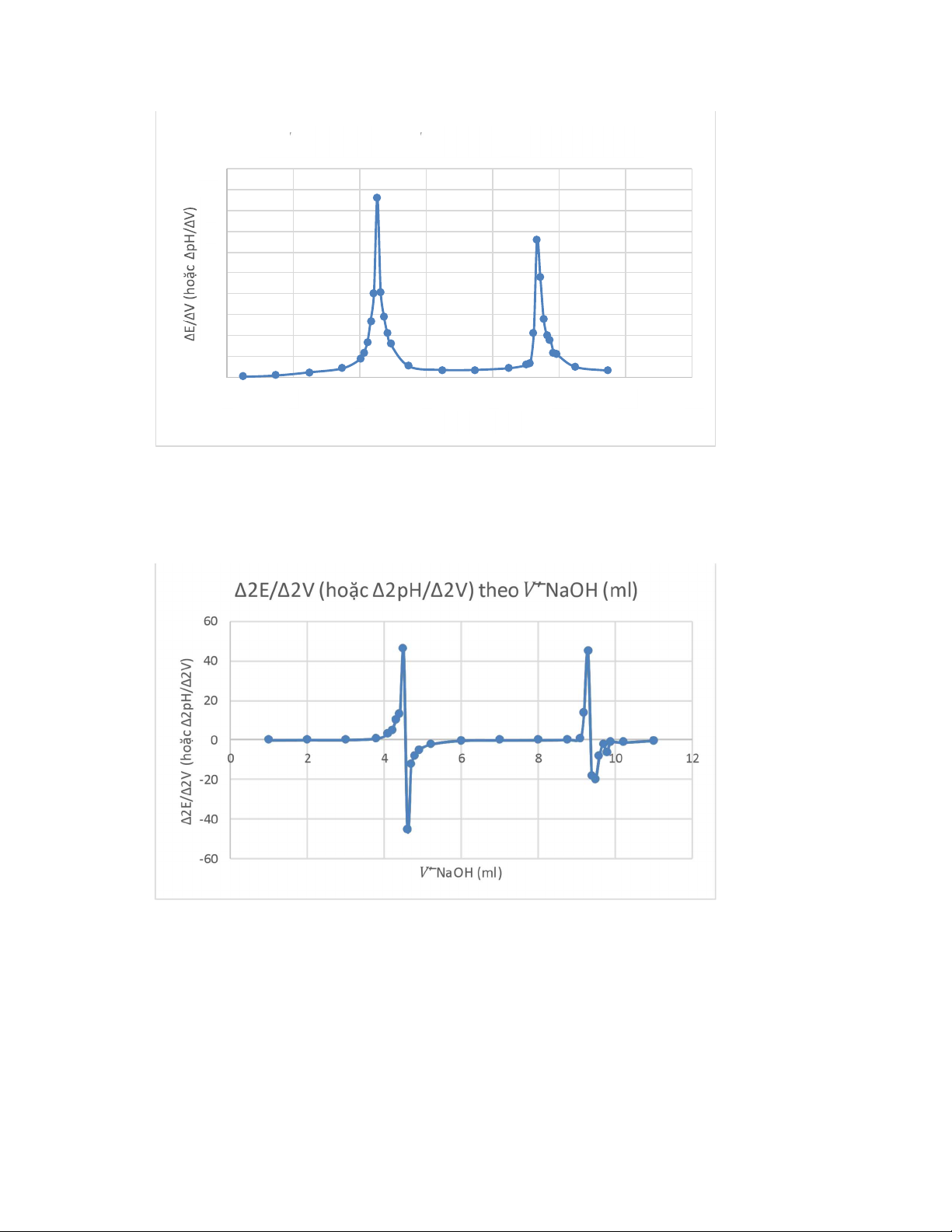
Cách 2: Điểm kết thúc là cực đại của đường đạo hàm bậc nhất ∆E/∆V (hoặc
∆pH/∆V) theo 𝑉 NaOH (ml)̅ lOMoAR cPSD| 59062190
∆ E/ ∆ V (hoặc ∆ pH/ ∆ V) theo 𝑉 NaOH (ml) 10 9 8 7 6 5 4 3 2 1 0 0 2 4 6 8 10 12 14 𝑉 NaOH (ml)
Cách 3: Đạo hàm bậc hai ∆2E/∆2V hoặc ∆2pH/∆2V theo 𝑉̅′NaOH (ml). Điểm
kết thúc là giao điểm của đồ thị với trục hoành (tọa độ của 2 điểm đạo hàm bậc 2
có giá trị âm dương liền kề nhau) lOMoAR cPSD| 59062190
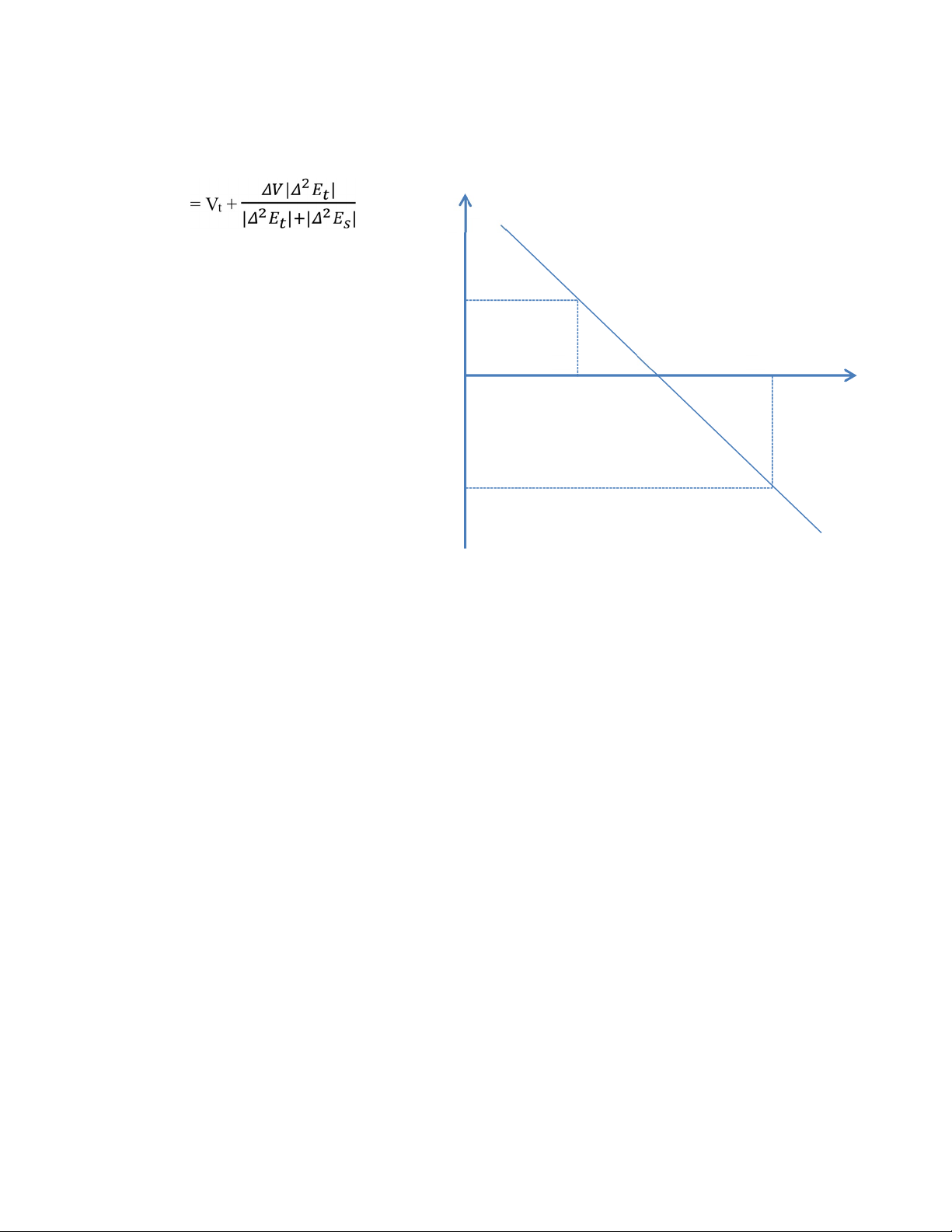
Thể tích tương đương theo đạo hàm bậc hai tính theo công thức sau: V 𝛥 2 𝐸 td 𝛥2𝐸𝑡 V t V td V s 0 𝛥2𝐸𝑠
(ở đây: Vt, Vs là thể tích dung dịch NaOH 0,1N ứng với giá trị 𝛥2𝐸 dương
liền kề với giá trị 𝛥2𝐸 âm;
𝛥2𝐸𝑡 và 𝛥2𝐸s là 2 giá trị 𝛥2𝐸 dương, âm liền kề; ΔV = Vs - Vt)
Từ thể tích Vtd tính nồng độ CM của dung dịch H3PO4. IV. Câu hỏi lượng giá 1.
Hãy nêu nguyên tắc của phương pháp đo pH bằng đo thế. 2.
Nguyên tắc của phương pháp chuẩn độ do thế. 3.
Trình bày cách tính kết của phương pháp chuẩn độ do thế. 4. Thế nào
là điện cực chỉ thị, điện cực so sánh. Cho thí dụ.



