































Preview text:
TRƯỜNG ĐẠI HỌC CÔNG NGHIỆP
THÀNH PHỐ HỒ CHÍ MINH
VIỆN CÔNG NGHỆ SINH HỌC VÀ THỰC PHẨM
BÁO CÁO THỰC HÀNH VI SINH THỰC PHẨM GVHD: BÙI HỒNG QUÂN
LỚP: ĐHTP5 – NHÓM 5
SVTH: Lê Thị Mỹ Vân MSSV: 09078531
Thành phố Hồ Chí Minh, tháng 11 năm 2011 1 MỤC LỤC
Bài 1: Thiết bị, dụng cụ phòng thí nghiệm và các phương pháp
tiệt trùng vi sinh vật.................................................................................................3
Bài 2: Phương pháp pha chế môi trường nuôi cấy vi sinh vật...............................6
Bài 3: Phương pháp nuôi cấy vi sinh vật..............................................................10
Bài 4: phương pháp quan sát vi sinh vật bằng kính hiển vi quang học...............16
Bài 5: Phương pháp nhuộm màu vi sinh vật........................................................19
Bài 6: Phương pháp phân lập vi sinh vật..............................................................20
Bài 10: Khảo sát đặc tính sinh hóa của vi sinh vật...............................................23
Bài 13: Định lượng vi sinh vật bằng phương pháp đếm trực tiếp........................35
Bài 14: Định lượng tổng vi khuẩn hiếu khí bằng
phương pháp đếm khuẩn lạc..................................................................................37
Bài 15: Định lượng Coliform bằng phương pháp MPN.......................................39
Bài 19: Phương pháp định lượng E.coli trong thực phẩm...................................41
Bài 20: Phương pháp phân tích Salmonella spp. trong thực phẩm......................43
Bài 21: Phương pháp phân tích định lượng Bacillus cereus trong thực phẩm....46
Bài 22: Phương pháp phân tích định lượng Staphilococcus aureus
trong thực phẩm....................................................................................................48
Bài 24: Phương pháp phân tích Clostridium perfringens trong thực phẩm.........50 2
BÀI 1: THIẾT BỊ, DỤNG CỤ PHÒNG THÍ NGHIỆM VI SINH VẬT VÀ
CÁC PHƯƠNG PHÁP TIỆT TRÙNG VI SINH VẬT
Báo cáo thực tập
1. Trình bày yêu cầu của việc bao gói dụng cụ nuôi ấy vi sinh vật?
Yêu cầu của việc bao gói dụng cụ nuôi cấy vi sinh vật:
- Phần giấy bao bên ngoài phải chặt và kín
- Bao bằng giấy dầu với dụng cụ hấp ướt
- Bao bằng giấy báo với dụng cụ sấy khô khi khử trùng ướt.
- Với các dụng cụ như pipet, que trang phải dùng giấy bao kín toàn bộ. Có thể dùng hộp
nhôm để đựng các dụng cụ trên để khử trùng.
2. Công dụng và cách sử dụng các dụng cụ, thiết bị phòng thí nghiệm vi sinh vật?
Công dụng và cách sử dụng các dụng cụ, thiết bị phòng thí nghiệm vi sinh vật:
a. Nồi hấp ướt (autoclave):
Thiết bị này cấp nhiệt bằng hơi nước ở áp suất cao, được sử dụng để hấp khử trùng
mô trường, một số nguyên liệu và dụng cụ thí nghiệm. b. Kính hiển vi:
Công dụng: dùng để nghiên cứu, quan sát tế bào vi sinh vật về đặc điểm hình thái,
sinh lý nhờ vào khả năng phóng đại của kính.
c. Các dụng cụ thí nghiệm
Dụng cụ thủy tinh có nhiều loại với nhiều kích cỡ khác nhau như bình tam giác,
ống nghiệm, đĩa petri, lam kính, đũa thủy tinh, que trang, ống đong, cốc đong, bình định mức…
- Phiến kính (lame): dùng làm tiêu bản quan sát hình thái, sinh lý tế bào vi sinh vật.
- Lá kính (lamelle): dùng để đậy lên vết bôi trên tiêu bản cố định vi sinh vật trong qua trình nghiên cứu.
- Đĩa petri: dùng để nghiên cứu các đặc điểm hình thái, đặc điểm nuôi cấy và phân lập của tế bào vi sinh vật.
- Que trãi: phân lập vi sinh vật theo phương pháp trãi đĩa. 3 - Que cấy:
+ Que cấy đầu tròn: dùng để thao tác vi sinh trên đối tượng đơn bào như vi khuẩn, nấm men.
+ Que cấy nhón: dùng để cấy sâu trên môi trường rắn.
+ Que cấy móc: dùng để lấy khuẩn ty hay một đoạn tơ nấm.
- Micro pipette: sử dụng khi cần hút một lượng chính xác môi trường.
4.Trình bày phương pháp tiệt trùng dụng cụ và môi trường nuôi cấy vi sinh vật?
Phương pháp tiệt trùng dụng cụ và môi trường nuôi cấy vi sinh vật:
a. Phương pháp lý học: Nhiệt khô:
- Đối với dụng cụ cấy kim loại, đôi khi cả thủy tinh, phương pháp thường dùng là đốt
trục tiếp trên ngọn lửa đèn cồn.
- Đối với dụng cụ thủy tinh có thể gói và sấy ở 1600C trong 1-2 giờ hoặc 1800C trong 30 phút. Nhiệt ẩm:
- Phương pháp luộc: cho vật khử trùng vào nước sôi, nhiệt sẽ thấm nhanh vào mẫu vật
làm cho protein đông kết, dẫn đến giết chết vi sinh vật. Chỉ diệt tế bào sinh dưỡng, bào tử vẫn còn.
- Phương pháp Pasteur: chỉ diệt vi khuẩn gây bệnh, không diệt bào tử và vi khuẩn hoại
sinh. Phương pháp này thường dùng ở nhiệt độ 70-750C trong thời gian 10-15 phút.
- Phương pháp Tyndall: đun cách thủy nhiều lần ở nhiệt độ 70-800C, mỗi lần 30-60
phút và liên tiếp trong ba ngày liền.
- Phương pháp hơi nước bão hòa ở áp suất cao: dùng autoclave. Thường dùng ở nhiệt độ 1210C trong 15-30 phút.
Diệt trùng bức xạ:
- Tia tử ngoại hay UV: chỉ sát trùng bề mặt, không xuyên sâu vào mẫu vật.
- Tia âm cực dùng trong tiệt trùng dụng cụ giải phẫu, thuốc, thực phẩm. Vật khử trùng phải bao gói kính.
Diệt trung bằng cách lọc: 4
- Dụng cụ lọc thường là những màng xốp bằng sứ, aminate, cellulose,… có kích thước
lỗ lọc từ 0,2-0,45μm, thường dùng để lọc những vật phẩm lỏng không khử trùng bằng nhiệt được.
- Đối với khử trùng không khí thì thiết bị khử trùng là một máy lọc khí có trang bị
màng lọc hay hấp phụ vi khuẩn.
b. Phương pháp hóa học.
- Chỉ sát khuẩn ngoài da: xà phòng, cồn, iode, phẩm màu.
- Chất diệt khuẩn và tẩy uế: phenol, formol, hợp chất clor… 5
BÀI 2: CÁCH PHA CHẾ CÁC LOẠI MÔI TRƯỜNG I. TRẢ LỜI CÂU HỎI
1. Trình bày khái niệm môi trường và phân loại môi trường nuôi cấy vi sinh vật
• Khái niệm môi trường dinh dưỡng
Môi trường dinh dưỡng là hỗn hợp các chất dinh dưỡng và các chất này có
nhiệm vụ duy trì thế oxy hóa khử, áp suất thẩm thấu của tế bào và sự ổn định của pH
trong môi trường. trong đó các chất dinh dưỡng là những hợp chất tham gia vào quá
trình trao đổi chất nội bào.
• Phân loại môi trường dinh dưỡng o Theo nguồn gốc
Môi trường tự nhiên: có thành phần là các sản phẩm tự nhiên như: trứng, sữa,
khoai tây, dịch chiết nấm men, đường, cám.
Môi trường tổng hợp: chứa các chất hóa học mà thành phần của chúng được
xác định và định lượng một cách cụ thể và chính xác. Ví dụ như: Czapeck, Hansen, EMB
Môi trường bán tổng hợp: chứa cả các chất hóa học lẫn các sản phẩm tự nhiên,
ví dụ như: PGA, giá đậu đường o Theo trạng thái vật lý
Môi trường lỏng: thành phần môi trường này không chứa agar và thường được
sử dụng để nghiên cứu quá trình tổng hợp của vi sinh vật.
Môi trường đặc: cứ 1000ml môi trường có 15 – 20 Agar
Môi trường bán lỏng: chứa khoảng 0,3 – 0,7% agar o Theo công dụng 6 Môi trường phân lập Môi trường tăng sinh
Môi trường nuôi giữ giống: nghèo dinh dưỡng
Môi trường thử nghiệm sinh hóa
2. Trình bày qui trình pha chế môi trường nuôi cấy vi sinh vật Bao gồm các bước sau: • Chuẩn bị dụng cụ • Cân hóa chất
• Phối chế tạo môi trường nuôi cấy
• Điều chỉnh độ pH của môi trường
• Phân phối môi trường vào dụng cụ
• Khử trùng môi trường
• Làm thạch nghiên, thạch đứng, đổ thạch vào đĩa petri
• Kiển tra độ vô trùng và bảo quản
3. Yêu cầu của môi trường trong đĩa petri, ống nghiệm thạch nghiêng và thạch đứng • Làm thạch nghiêng:
Cần tiến hành ngay sau khi khử trùng môi trường và môi trường chưa đông đặc.
- Đặt ống nghiệm có môi trường lên giá đặt nghiêng và không được
để môi trường chạm vào nút bông.
- Để yên cho đến khi môi trường đông đặc. Yêu cầu mặt thạch phải thẳng, nhẵn và liên tục • Làm thạch đứng:
- Đặt các ống nghiệm có môi trường là thạch đứng vào giá, để yên cho môi trường đông đặc
• Đổ môi trường vào đĩa petri:
- Toàn bộ quá trình đổ thạch vào đĩa petri được thực hiện trong tủ cấy vô
trùng và gồm các thao tác sau:
o Mở bao giấy gói các đĩa petri
o Một tay cầm dụng cụ chứa môi trường 7
o Tay còn lại mở nút bông và hơ miệng bình trên ngọn lửa đền cồn.
o Mở hé nắp đĩa petri. Nghiêng bình và rót môi trường vào đĩa petri.
o Đậy nắp đĩa lại, xoay tròn đĩa để môi trường được phân phối đều bên trong đĩa.
o Để yên cho môi trường đông đặc.
o Lật ngược đĩa lại và bảo quản.
4. Giải thích tại sao không phân phối môi trường vào đĩa petri trước khi khử trùng
Vì sẽ làm nhiễm các vi sinh vật không mong muốn, có thể nhiễm một số tạp
chất vì vậy sau quá trình nuôi cấy khó có thể xác định được kết quả. Có thể tránh được
hơi nước tiếp xúc vào môi trường nuôi cấy và vì sau khi cấy phải để yên môi trường để cứng môi trường
5. Đĩa petri chứa môi trường trước khi cấy vi sinh vật nên úp hay ngửa? Tại sao?
Nên để ngửa bởi vì làm kín khu vực nuôi cấy, tránh lây nhiễm các vi sinh vật
khác và cũng tránh tiếp xúc với hơi nước.
6. Ý nghĩa của việc pha chế môi trường?
Chúng ta phải pha chế môi trường cho vi sinh vật vì môi trường dinh dưỡng là hỗn
hợp gồm các chất dinh dưỡng và các chất có nhiệm vụ duy trì thế oxy hóa- khử, áp
suất thẩm thấu của tế bào và sự ổn định độ pH của môi trường để vi sinh vật có thể
sinh trưởng và phát triển một cách tối ưu nhất có thể.
Làm môi trường để thực hiện việc phân lập, nhân giống, giữ giống vi sinh vật, đồng
thời để nuôi cấy và nghiên cứu các đặc điểm sinh học của chúng
7. Yêu cầu của một môi trường dinh dưỡng nuôi cấy?
Yêu cầu của môi trường dinh dưỡng: có đủ chất dinh dưỡng cần thiết, có độ pH
phù hợp. có độ nhớt nhất định, không chứa các yếu tố độc hại, hoàn toàn vô trùng,
đảm bảo sự phát triển ổn định của vi sinh vật.
8. Nêu ý nghĩa của các thành phần trong môi trường nuôi cấy? 8
Peptone chiết xuất cao thịt bò dùng làm nguồn cacbon, năng lượng và nitơ. Cao
thịt bò chứa các axit amin, peptit, nuclêôtit, axit hữu cơ, vitamin và một số chất
khoáng. Cao nấm men là nguồn phong phú các vitamin nhóm B cũng như nguồn nitơ và cacbon.
9. Có bao nhiêu loại peptone? Có 3 loại peptone
o Từ động vật: chiết xuất từ thịt, cao thịt bò, dịch thuỷ phân một phần của thịt bò,
cazêin,… dùng làm nguồn cacbon, năng lượng và nitơ. Cao thịt bò chứa các
axit amin, peptit, nuclêôtit, axit hữu cơ, vitamin và một số chất khoáng.
o Từ thực vật: chiết xuất từ đậu nành,….
o Nấm men: cao nấm men, Cao nấm men là nguồn phong phú các vitamin nhóm
B cũng như nguồn nitơ và cacbon).
10. Cơ chế làm trong nước của lòng trắng trứng
Cách làm trong nước bằng lòng trắng trứng: lòng trắng trứng: nước tỉ lệ 1:1→
đánh tan nổi bọt → cho vào 1 lít môi trường → đun sôi khoảng 5 phút → để nguội → lắng cặn →lọc.
Cơ chế: các protein trong lòng trắng trứng như albumin, ovalbumin dưới tác động
của sự khuấy trộn và gia nhiệt bị biến tính không thuận nghịch, các liên kết trong
protein được kéo dãn làm lộ ra nhiều nhóm chức → hình thành lực hút tĩnh điện với
các ion, bụi bẩn có trong nước → sau khi lắng, lọc nước trong hơn. 9
BÀI 3: PHƯƠNG PHÁP NUÔI CẤY VI SINH VẬT PHÂN LẬP SINH VẬT I. Nguyên tắc
1. Mục đích của việc nuôi cấy
- Phát hiện sự có mặt của vi sinh vật trong các nguyên liệu vật phẩm cần nghiên cứu.
- Tiến hành việc phân giống các vi sinh vật một cách nhanh chóng.
- Bảo tồn các giống vi sinh vật thuần khiết.
- Nghiên cứu các đặc tính sinh học và sự phát triển từng loại của vi sinh vật.
2. Nguyên tắc nuôi cấy vi sinh vật
Mọi thao tác nuôi cấy đều phải thực hiện trong điều kiện vô trùng để tránh tạp
nhiễm các vi sinh vật không mong muốn từ môi trường ngoài.
Môi trường và dụng cụ nuôi cấy đều phải khử trùng triệt để. Duy trì tốt các điều
kiện nuôi cấy để vi sinh vật phát triển thuận lợi. II.
Dụng cụ, môi trường và hóa chất III.
Tiến hành thí nghiệm
1. Phương pháp cấy truyền thạch (môi trường thạch). 1.1.
Cấy truyền trên thạch đĩa
Có thể cấy trên đĩa pêtri theo 1 trong 2 cách sau:
* Dùng que cấy đầu tròn và thực hiện theo trình tự sau:
- Để đĩa pêtri lên bàn.
- Dùng que cấy lấy canh trường vi sinh vật theo thứ tự và yêu cầu ở phương pháp chung.
- Tay trái hé mở nắp đĩa pêtri vừa đủ để cho que cấy vào.
- Nhẹ nhàng và nhanh chóng lướt que cấy lên mặt thạch theo một trong các kiểu sau:
+ Theo hình chữ chi trên toàn bộ mặt thạch (hình 3.3a)
+ Theo những đường song song (hình 3.3b)
+ Theo 4 hình chữ chi 4 góc (hình 3.3c)
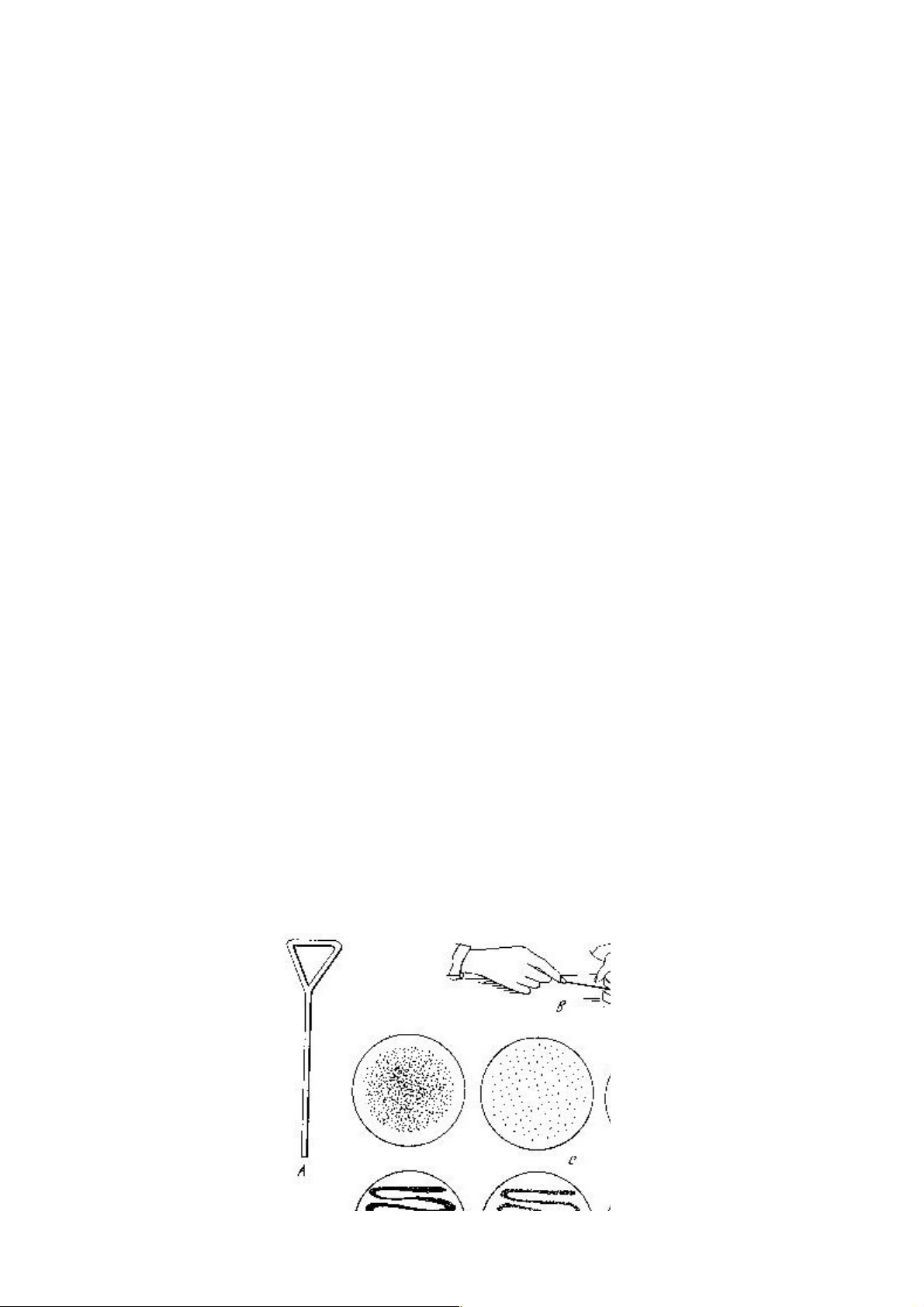
Hình 3.1 Các kiểu cấy trên thạch đĩa 10
Hình 3.2: Cách dàn vi sinh vật lên bề mặt môi trường
A – que gạt B – dàn bằng que gạt; C: Sự sinh trưởng của VSV sau khi dàn đều
bằng que gạt; D : Sự sinh trưởng của VSV sau khi dàn bằng que cấy 1.2.
Phương pháp cấy trên thạch nghiêng
- Phương pháp này dùng để cấy truyền các vi sinh vật hiếu khí.
- Sử dụng que cấy đầu tròn tiến hành các thao tác theo đúng trình tự nói trên
- Thực hiện việc cấy giống vào ống thạch nghiêng bằng các thao tác tiếp theo:
+ Hoà giống ở đầu que cấy vào giọt nước ở đáy ống nghiệm.
+ Nhẹ nhàng lướt que cấy trên mặt thạch theo các kiểu (hình 3.1) - Hình chữ chi - Hình vòng xoắn - Hình vạch ngang song song d
Hình 3.2: Một số kiểu cấy trên ống thạch nghiêng 1.3.
Phương pháp cấy trên thạch đứng: cấy sinh vật kị khí
• Sử dụng que cấy hình kim
• Sau khi lấy giống vi sinh vật, dùng que cấy này đâm sâu vào phần khối thạch hình trụ.
• Đâm sát đáy ống nghiệm và đâm thành 3 đường: 1 đường chính giữa, 2 đường sát thành ống tuỳ yêu cầu.
• Đường cấy phải thẳng, nhẹ nhàng để không gây nứt, vỡ môi trường IV. Trả lời câu hỏi.
1. Các phương pháp gieo cấy vi sinh vật 11
- Cấy truyên vi sinh vật trên môi trường lỏng: cấy truyền bằng pipette Pasteur, cấy
truyền bằng que cấy vòng.
- Cấy truyền trên môi trường lỏng: cấy truyền trên ống truyền thạch nghiêng, trên ống
nghiệm thạch đứng, cấy truyền trên thạch đĩa.
2. Các phương pháp giữ ống vi sinh vật
a. Phương pháp cấy truyền định kỳ trên môi trường mới
Ưu điểm: phương pháp này đơn giản, dễ làm, thời gian bảo quản không lâu.
Nhược điểm: tốn môi trường, công sức và thời gian. Dễ bị tạp nhiễm và dễ dẫn đến
mất chủng giống gốc. Mất hay nhầm lẫn nhãn hiệu giữa các chủng trong quá trình bảo
quản. Phải nghiên cứu và theo dõi thời gian cấy truyền thích hợp cho các chủng bảo
quản. Giống gốc có thể bị mất do sai sót khi dùng môi trường cấy truyền không thích
hợp. Chủng vi sinh vật đễ bị thay đổi các đặc tính sinh học do đột biến xuất hiện sau mỗi làn cấy truyền.
b. Phương pháp giữ giống trên môi trường thạch có lớp dầu khoáng
Ưu điểm: đơn giản nhưng hiệu quả cao nhờ khả năng làm chậm quá trình biến
dưỡng và hô hấp nên vi sinh vật phát triển chậm lại. Môi trường không bị mất nước và khô.
c. Phương pháp giữ giống trên đất, cát, hạt…
Ưu điểm: dễ bảo quản các chủng bào tử tiềm sinh, thời gian bảo quản có thể kéo dài đến 1 năm.
Nhược điểm: khử trùng môi trường trước
d. Phương pháp lạnh đông
Ưu điểm: nhanh, thuận lợi cho việc bảo quản một số lượng lớn mẫu. vi sinh vật
được bảo quản từ 10-20 năm, tiết kiệm công sứcvà sai sót nhãn mác, tạp nhiễm.
Nhược điểm: giá thành thiết bị, độ ổn định của các chủng vi sinh vật bảo quản theo
các đợt bảo quản là khác nhau. Trước khi đem ra sử dụng phải được hoạt hoá trên môi
trường thích hợp một số lần để đảm bảo phục hồi các đặc tính sinh học của chủng vi sinh vật.
e. Phương pháp bảo quản lạnh sâu 12
Ưu điểm: thích hợp cho nhiều đối tượng vi sinh vật khác nhau như nấm men, vi
khuẩn, nấm mốc, vỉut, tảo và các dòng tế bào động vật. thời gian bảo quản lâu.
Nhược điểm: đầu tư kinh phí cho thiết bị, điện quá cao, rủi ro cháy nổ, không thích
hợp cho các chủng vi sinh vật hay dùng đến thường xuyên.
3. Trình bày nguyên tắc và mục đích của quá trình phân lập.
- Nguyên tắc: tách rời các tế bào vi sinh vật, nuôi cấy các tế bào trong môi trường dinh
dưỡng để tạo khuẩn lạc riêng rẽ.
- Mục đích: phân tách các chủng vi sinh vật trong môi trường tự nhiên và cô lập chúng
nhằm chọn lựa giống vi sinh vật thuần khiết cho những mục đích khác nhau.
4. Muốn phân lập nấm men, nấm mốc, vi khuẩn thì nguồn mẫu cần chọn là gì? Trả lời:
- Phân lập vi khuẩn: nguồn mẫu là cỏ khô cắt nhỏ.
- Nấm mốc: nguồn mẫu là cơm nguội, xôi làm mốc tương, bánh mì để khô
- Nấm men: nguồn mẫu là bề mặt trái cây, dịch ép như táo, lê hoặc trong rượu nếp, bia, nước mía.
5. So sánh sự giống và khác nhau của cách phân lập vi sinh vật hiếu khí và kị khí. Trả lời:
- Giống nhau: nhằm phân tách các chủng vi sinh vật trong môi trường tự nhiên và cô
lập chúng nhằm chọn lựa những giống vi sinh vật thuần khiết.Khác nhau:
Phân lập vi sinh vật hiếu khí
Phân lập vi sinh vật kị khí
- Hút dịch mẫu đã pha loãng cho
- Dùng môi trường đặc trong ống nghiệm đem
vao dĩa petri có môi trường thích
chưng cách thủy để loại bỏ không khí. hợp.
- Để nguội môi trường còn 45-50oC
- Dùng que gạt thủy tinh phân phối
- Hút dịch nghiên cứu cho vào ống môi trường, đậy
dịch mẫu trải đều khắp mặt thạch.
nút lại, lắc tròn quanh trục ống nghiệm.
- Tiếp tục dùng que gạt mẫu cho
- Rút nhanh, đậy nhanh tránh cho ống nghiệm có
đều khắp mặt thạch đĩa thứ 2 rồi không khí. đĩa thứ 3.
- Dùng parafin hàn kín phần tiếp xúc giữa 2 đĩa
- Ủ ấm ở nhiệt độ thích hợp sau
petri và ủ ở nhiệt độ thích hợp
một thời gian nhất định ta sẽ nhận
- Sau khi vi sinh vật phát triển, chọn các khuẩn lạc
được các khuẩn lạc riêng rẽ từ các
riêng rẽ trong môi trường, dùng que cấy cắt cả khối đĩa thứ 2, 3
môi trường rồi cấy vào môi trường lỏng thích hợp.
6. Tại sao khi đi cân hoá chất chỉ cần 2-3 người?
Do dụng cụ trong phòng hoá chất có hạn, đi cân hoá chất cần 2-3 người đã đảm
bảo về thời gian,hiệu quả làm việc 13
BÀI 4: PHƯƠNG PHÁP QUAN SÁT KÍNH HIỂN VI BẰNG KÍNH HIỂN VI QUANG HỌC
1. Trình bày cấu tạo và nguyên tắc hoạt động của kính hiển vi quang học a. Cấu tạo
Kính hiển vi quang học gồm có hai phần:
- Hệ thống cơ học: giá kính gồm có chân kính, thân kính, trụ đỡ và xoay thị kính, ổ gắn
và xoay vật kính, bán kính, thanh trượt di chuyển tiêu bản, ốc di chuyển thanh trượt,
kẹp giữ tiêu bản, ốc di chuyển tụ quang kính, ốc điều chỉnh thô sơ cấp, ốc điều chỉnh thứ cấp (vi cấp).
- Hệ thống quang học gồm: thị kính, vật kính, tụ quang kính, màng chắn sáng, nguồn
chiếu sáng (đèn điện chiếu sáng hoặc kính chiếu sáng). Ngoài ra, ở kính dùng nguồn
chiếu sáng là đèn điện thì có thêm bộ phận cung cấp điện như phích cắm, dây điện,
cầu chì, mạch điện (trong chân kính) và nút điều chỉnh cường độ chiếu sáng.
b. Nguyên tắc hoạt động 14
Vật kính là hệ thống quang học phức tạp gồm một số thấu kính, trực tiếp phóng đại
mẫu vật. Các thấu kính sắp xếp theo thứ tự, thấu kính nhỏ ngoài cùng hướng vào tiêu
bản có độ phóng đại lớn nhất. Độ phóng đại của kính phụ thuộc vào tiêu cự, tức bán
kính cong của thấu kính. Thấu kính càng cong, tiêu cự càng ngắn thì khả năng phóng đại càng lớn. Có hai loại vật kính
• Vật kính khô độ phóng đại nhỏ như x4,x10,x15,x40.
• Vật kính dầu có độ phóng đại lớn như x90,x100.
Thị kính cũng có độ phóng đại phức tạp, gồm hai thấu kính, một hướng về phía
mắt người xem, một hướng về vật kính. Thị kính phóng đại một lần nữa ảnh do vật
kính thu vào, làm ảnh to lên, xem rõ hơn.
Độ phóng đại của kính = Độ phóng đại của vật kính x độ phóng đại của thị kính.
Ví dụ: Độ phóng đại của vật kính x100, độ phóng đại của thị kính x10. Như vậy độ
phóng đại của kính : 100x10=1000 lần.
Năng suất phân ly của kính quan trọng hơn độ phóng đại, và là tiêu chuẩn chính để chọn kính hiển vi.
2. Có bao nhiêu loại kính hiển vi? Đặc điểm của từng loại? Có 5 loại kính hiển vi. - Kính hiển vi viền đen
Ánh sáng thường chiếu từ dưới lên, qua rìa của tụ quang nền đen, chiếu hắt vào
xung quanh tiêu bản, những tia sáng này bị tiêu bản làm khúc xạ rồi đưa vào vật kính.
Tiêu bản được soi sáng rực trên nền đen, giống như trong phòng tối có một tia sáng
chiếu vào, giúp ta thấy rõ từng hạt bụi trong không khí bị tia sáng chiếu vào. Chức
năng: quan sát hình thái và đặc tính của một số vi khuẩn mà kính hiển vi thường khó quan sát. 15 - Kính hiển vi đổi pha
Ánh sáng thường bị đổi pha và biên độ dao động bởi cấu trúc đặc biệt của tụ quang
kính, vật kính và thị kính. Chức năng: dùng quan sát rõ nét các cấu trúc nhỏ như tiên mao, các lớp màng.
- Kính hiển vi huỳnh quang
Chùm tia tử ngoại chiếu vào các tiêu bản đã nhuộm màu bằng các chất huỳnh
quang. Trong tế bào, các cấu trúc khác nhau sẽ phát quang với màu sắc khác nhau.
Chức năng: quan sát và phân biệt các cấu trúc khác nhau trong tế bào vi sinh vật. - Kính hiển vi điện tử
Chùm tia điện tử bước sóng rất ngắn, năng suất phân li rất lớn nên độ phân giải
cao, giúp phân biệt hai điểm rất gần nhau. Chức năng: quan sát vỉut, cấu trúc phân tử của tế bào. - Kính hiển vi quang học
Dùng bước sóng 500 nm – 560 nm trong chùm ánh sáng thường để tạo năng suất
phân li lớn giúp phân biệt hai điểm cách nhau khoảng 0.2 µm trở lên. Hệ thống phóng
to của kính hiển vi quang học gồm hai bộ phận: vật kính và thị kính. Mỗi bộ phận là
một hệ thống thấu kính hội tụ phức tạp. Chức năng của kính hiển vi quang học là dùng
để quan sát tế bào vi sinh vật, kí sinh trùng, tế bào động vật, thực vật.
3. Tại sao khi quan sát ở vật kính 100 phải cho 1 giọt dầu soi kính?
Do chiết suất ánh sáng của không khí nhỏ hơn thuỷ tinh, nên tia sáng khi đi qua
tiêu bản thuỷ tinh sẽ bị khúc xạ một phần. Phần phía ngoài cuả tia sáng do bị khúc xạ
nên không đi vào được vật kính. Vật kính có độ phóng đại càng lớn thì đường kính
của thấu kính càng nhỏ, lượng tia sáng đi vào vật kính rất ít nên không nhìn rõ ảnh.
Để hạn chế nhược điểm này ta dùng dầu soi kính có chiết suất ánh sáng gần bằng
thuỷ tinh. Thuỷ tinh và dầu soi được xem là một môi trường đồng nhất. ánh sáng đi
qua không bị khúc xạ nên tập trung đầy đủ vào vật kính, giúp xem rõ ảnh. 16
BÀI 5. PHƯƠNG PHÁP NHUỘM MÀU VI SINH VẬT
Báo cáo thực tập
1. Sau khi nhuộm, vi khuẩn Gram dương có màu xanh đen hay tím, Gram âm
có màu đỏ vàng hay đỏ tía. Giải thích nguyên nhân?
Sau khi nhuộm Gram, vi khuẩn Gram dương sẽ có màu xanh đen hay tím, còn vi
khuẩn Gram âm có màu đỏ vang (nhuộm safranin O) hay đỏ tía (Fuchsin Ziehl). Sở dĩ
có màu như vậy là do vi khuẩn Gram dương và vi khuẩn Gram âm có sự khác biệt về
thành phần hóa sinh của thành tế bào vi khuẩn. Thành tế bào vi khuẩn Gram dương thì
có nhiều peptidoglycan (phức chất protein-đường) và các peptidoglycan này được liên
kết chặt chẽ với nhau từ đó có thể giúp cho tế bào kháng lại chất tẩy màu nên sau khi
rửa bằng cồn thì crystal violet không bị rửa trôi và vẫn giữ được màu tím, sau đó
nhuộm bổ sung bằng dung dịch safranin O hoặc Fuchsin Ziehl, nhưng không có sự
thay đổi màu nhiều. Thành tế bào vi khuẩn Gram âm có thành phần lipid ở nồng độ
cao cho nên chúng có thể hòa tan trong chất khử màu (aceton, alcohol,…) và bị rửa
trôi cùng với crystal violet (màu tím), sau khi nhỏ dung dịch tẩy màu, ta nhuộm them
bằng dung dịch safranin O hoặc Fuchsin Ziehl, lúc này vi khuẩn Gram âm có màu đỏ vàng hay đỏ tía. 17
2. Nếu không nhuộm bổ sung thuốc thử safranin hoặc fuchsin, vi khuẩn
Gram âm có màu gì? Tại sao?
Nếu không nhuộm bổ sung thuốc thử safranin hoặc fuchsin, vi khuẩn Gram âm sẽ
không có màu. Bởi vì ở giai đoạn tẩy màu bằng cồn đã rửa trôi crystal violet (có màu
tím) nên sau giai đoạn tẩy màu vi khuẩn Gram âm đã bị mất màu của crystal violet
được nhuộm ở trước đó. Hoặc trường hợp vi khuẩn Gram âm sẽ có màu tím cũng có
thể ở giai đoạn tẩy rửa, ta không tẩy màu cho đến khi giọt dung dịch cuối cùng chảy ra
khỏi phiến kính là không màu.
BÀI 6. PHƯƠNG PHÁP PHÂN LẬP VI SINH VẬT
1. Trình bày nguyên tắc và phương pháp phân lập vi khuẩn thuần khiết? Nguyên tắc:
- Gieo cấy vi khuẩn đã pha loãng trên môi trường dinh dưỡng đặc trưng (2% thạch hay còn gọi là agar).
- Nuôi dưỡng trong điều kiện thích hợp cho mọc các khuẩn lạc tách biệt nhau.
- Cấy tách từ khuẩn lạc mọc tách biệt sang ống môi trường dinh dưỡng thạch nghiêng
để thu nhận chủng vi khuẩn thuần khiết.
Phương pháp phân lập vi khuẩn thuần khiết: 1.1.
Phương pháp tạo khuẩn lạc đơn các vi sinh vật hiếu khí:
Có nhiều kỹ thuật ria khác nhau để thực hiện hộp ria và tạo khuẩn lạc đơn. Một số
kỹ thuật ria thường dùng: kỹ thuật ria chữ T , kỹ thuật ria bốn góc ,kỹ thuật ria tia ,kỹ thuật ria liên tục
Thao tác kỹ thuật tạo khuẩn lạc đơn được thực hiện như sau: 18
a. Kỹ thuật hộp ria:
- Dùng que cấy vòng thao tác vô trùng thu giống.
- Ria các đường trên đĩa pêtri chứa môi trường thích hợp (ria chữ T và ria bốn góc). Sau
mỗi đường ria, đốt khử trùng đầu que cấy và làm nguội trước khithực hiện đường ria tiếp theo.
- Bao gói đĩa pêtri, ủ ở nhiệt độ và thời gian thích hợp trong tủ ấm.
b. Kỹ thuật hộp trải:
- Dùng pipetman và đầu típ vô trùng, thao tác vô trùng chuyển 0,1 ml dịch chứa giống
vi sinh vật lên bề mặt môi trường trong đĩa pêtri.
- Nhúng đầu thanh gạt (que trải) thuỷ tinh vào cồn 700, hơ qua ngọn lửa để khử trùng.
Để đầu thanh gạt nguội trong không gian vô trùng của ngọn lửa.
- Mở đĩa pêtri, đặt nhẹ nhàng thanh gạt lên bề mặt thạch của đĩa petri.
- Dùng đầu thanh gạt xoay, trải đều dịch giống lên bề mặt thạch. Trong khi trải, thực
hiện xoay đĩa một vài lần, mỗi lần khoảng 1/2 chu vi đĩa tạo điều kiện cho thanh gạt
trải dịch giống đều khắp bề mặt môi trường.
- Rút thanh gạt khỏi đĩa, đậy đĩa, gói và ủ ở nhiệt độ và thời gian thích hợp trong tủ ấm.
c. Kỹ thuật hộp đổ:
- Dùng pipetman và đầu típ vô trùng, thao tác vô trùng chuyển 1 m dịch chứa giống vi
sinh vật lên bề mặt môi trường trong đĩa pêtri.
- Đổ khoảng 15 - 20 ml môi trường đã đun chảy và để nguộ đến 45 - 550C vào đĩa petri đã cấy mẫu.
- Xoay nhẹ đia petri cùng chiều và ngược chiều kim đồng hồ vài lần để dung dịch giống
được trộn đều trong môi trường cấy.
- Đậy nắp đĩa pêtri, để đông tự nhiên. 19 1.2.
Phương pháp tạo khuẩn lạc đơn các vi sinh vật hiếu khí:
- Dùng môi trường đặc trong ống nghiệm đem chưng cách thuỷ để loại bỏ không khí trong môi trường.
- Để nguội môi trường còn 45 - 500C.
- Hút 0,1 ml dịch nghiên cứu cho vào ống môi trường, đậy nút lại, lắc tròn quanh trục ống nghiệm.
- Rót nhanh môi trường ở ống nghiệm vào nắp dưới của đĩa pêtri và đậy thật nhanh nắp
trên lại, sao cho giữa mặt nắp và môi trường không còn không khí.
- Dùng parafin hàn kín phần tiếp xúc giữa 2 nắp của đĩa petri và ủ ở nhiệt độ thích hợp.
- Sau khi vi sinh vật phát triển, chọn các khuẩn lạc riêng rẽ trong khối môi trường, dùng
que cấy cắt cả khối môi trường rồi cấy vào môi trường lỏng thích hợp.
2. Nguyên tắc của việc nuôi tích lũy?
Nguyên tắc của việc nuôi tích lũy: trường hợp số vi khuẩn có trong mẫu ít thì
phải nuôi tích lũy bằng cách ủ mẫu, bổ sung chất dinh dưỡng và các điều kiện lý hóa
cần thiết hoặc bổ sung các chất ức chế sinh trưởng của các vi sinh vật đi kèm.
3. Thế nào là chuẩn vi khuẩn thuần khiết (chủng sạch)?
Chuẩn vi khuẩn thuần khiết (hay còn gọi là chủng sạch) được hiểu là thế hệ con,
cháu, dòng có nguồn gốc từ một tế bào riêng lẻ. Các chủng vi sinh vật được thu nhận
từ khuẩn lạc phân lập lần đầu chưa chắc đã thuần khiết vì một khuẩn lạc có thể được
hình thành bởi một hoặc nhiều tế bào, bào tử, vì thế phải làm sạch nhiều lần mới thu
được chủng vi sinh vật thuần khiết. 20
BÀI 10: CÁC PHẢN ỨNG SINH HÓA
1. Phản ứng tạo indol
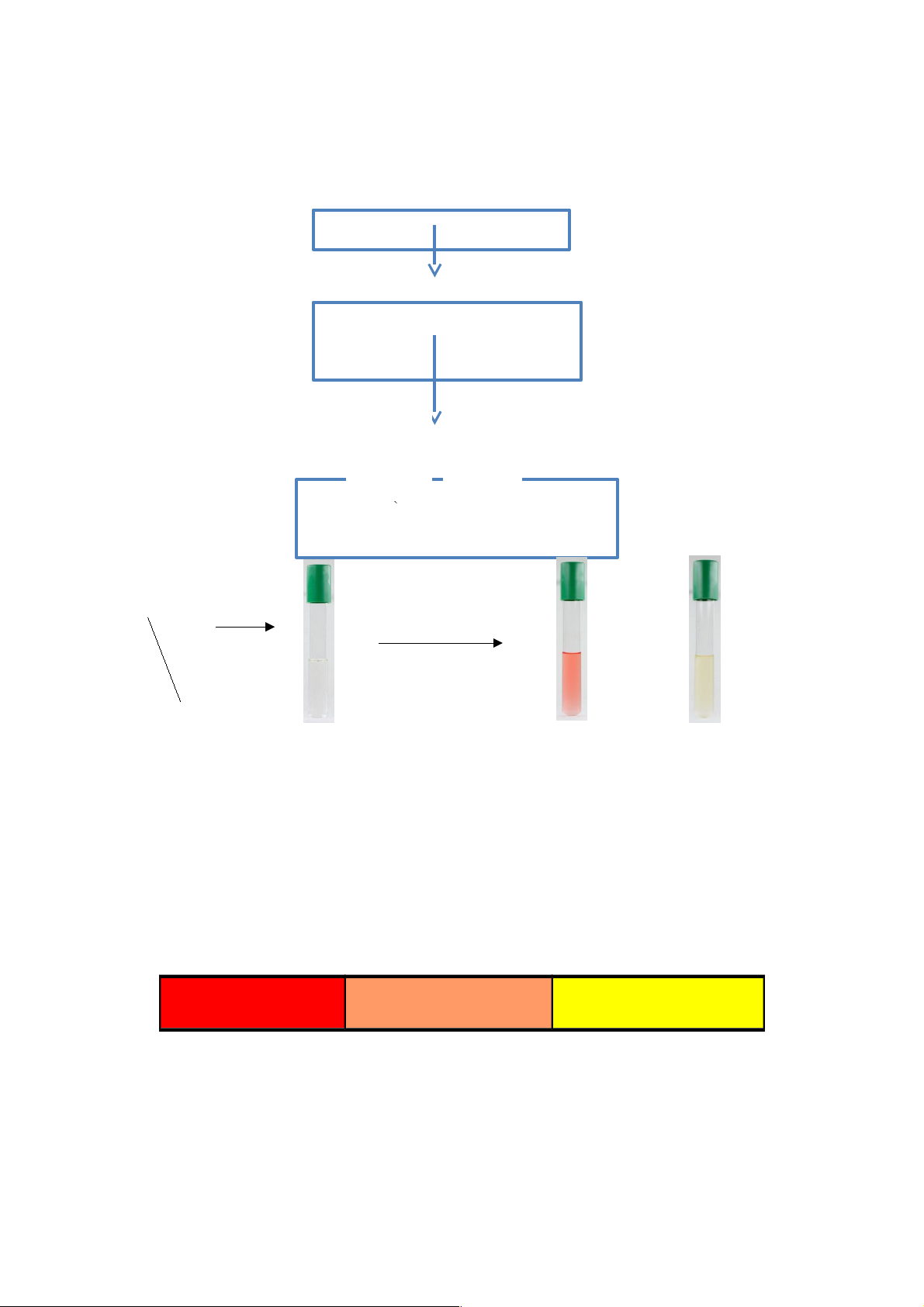
Mục đích: Phát hiện các VSV có khả năng sinh indol các VSV có hệ emzym tryptophanase Sơ đồ: Chủng Vi Sinh Vật Môi Trường: NB và Tripton Thuốc 37oC thử 24h Kovac’s 21
Kết quả, dương tính (màu
hồng) và âm tính (màu vàng) 37oC / 24h Âm tính Chủng Môi Trường Vi Sinh Vật Dương tính Âm tính
Cơ chế phép thử: Vi sinh vật tiết enzyme tryptophannase chuyển hóa tryptophan trong
môi trường thành Indol. Indol sẽ kết hợp với para-dimethylaminbenzaldehyd trong
thuốc thử kovac’s tạo thành phức chất có màu hồng cánh sen. Ý nghĩa:
• Phép thử cho biết các chủng loại vi sinh vật có khả năng tiết enzyme
tryptophannase, giúp ta định danh được một số chủng loại vi sinh vật.
Là phản ứng giúp phân biệt
◦ E. coli (+) với Klebsiella (-)
◦ Proteus mirabilis (-) với Proteus khác (+)
◦ Bacillus alvei (+) với Bacillus khác (-)…
Đối chứng (+) Proteus rettgeri
(-) Serratia marcescens 22
2. Phản ứng MR (methyl red)
Mục đích: xác định vi sinh vật sản xuất và duy trì các acid bền trong quá trình lên men glucose. Chủng vi sinh vật Môi trường MR-VP Methyl 24h, 37oC Red
Kết quả, màu đỏ (Dương tính), màu vàng: (âm tính) 2-4 ngày Chủng Môi Trường Dương tính Âm tính Vi Sinh Vật Cơ chế: Cơ sở sinh hóa:
◦ Chất chỉ thị pH: methyl red Dưới 4,4 5,0 – 5,8 Trên 6,0
◦ MR (+) – càng kéo dài thời gian nuôi cấy – môi trường càng acid
◦ MR (-) – càng kéo dài thời gian nuôi cấy – các chất có tính acid bị
chuyển hóa – môi trường dần trung tính 23
Thời gian ủ 2 – 5 ngày ở 37oC
Cơ chế: một số vi sinh vật có khả năng chuyển hóa Glucose qua quá trình đường
phân tạo thành acid pyruvic, rồi từ Acid pyruvic chuyển hóa thành acetyl coenzyme
A, đi qua chu trình Kreps tạo ra các acid: acid citric, acid succinic, acid fomic, a cid
malic, a cid oxalic… hoặc từ Acid pyruvic chuyển trực tiếp thành các acid lactic, acid fomic,…
Trong môi trường MR-VP có PH= 6.9±0.2 có K2HPO4 (đệm phosphat) giúp ổn
định PH, khi có mặt các acid hữu cơ mạnh sẽ tấn công và phá vỡ thế PH ổn định làm
cho PH giảm mạnh, PH<4.3, Với sự có mặt của thuốc thử MR (Methyl Red) sẽ làm
môi trường chuyển sang màu đỏ (Phản ứng dương tính)
Ý nghĩa: Định danh một số vi sinh vật có khả năng chuyển hóa Glucose (thường là gram -).
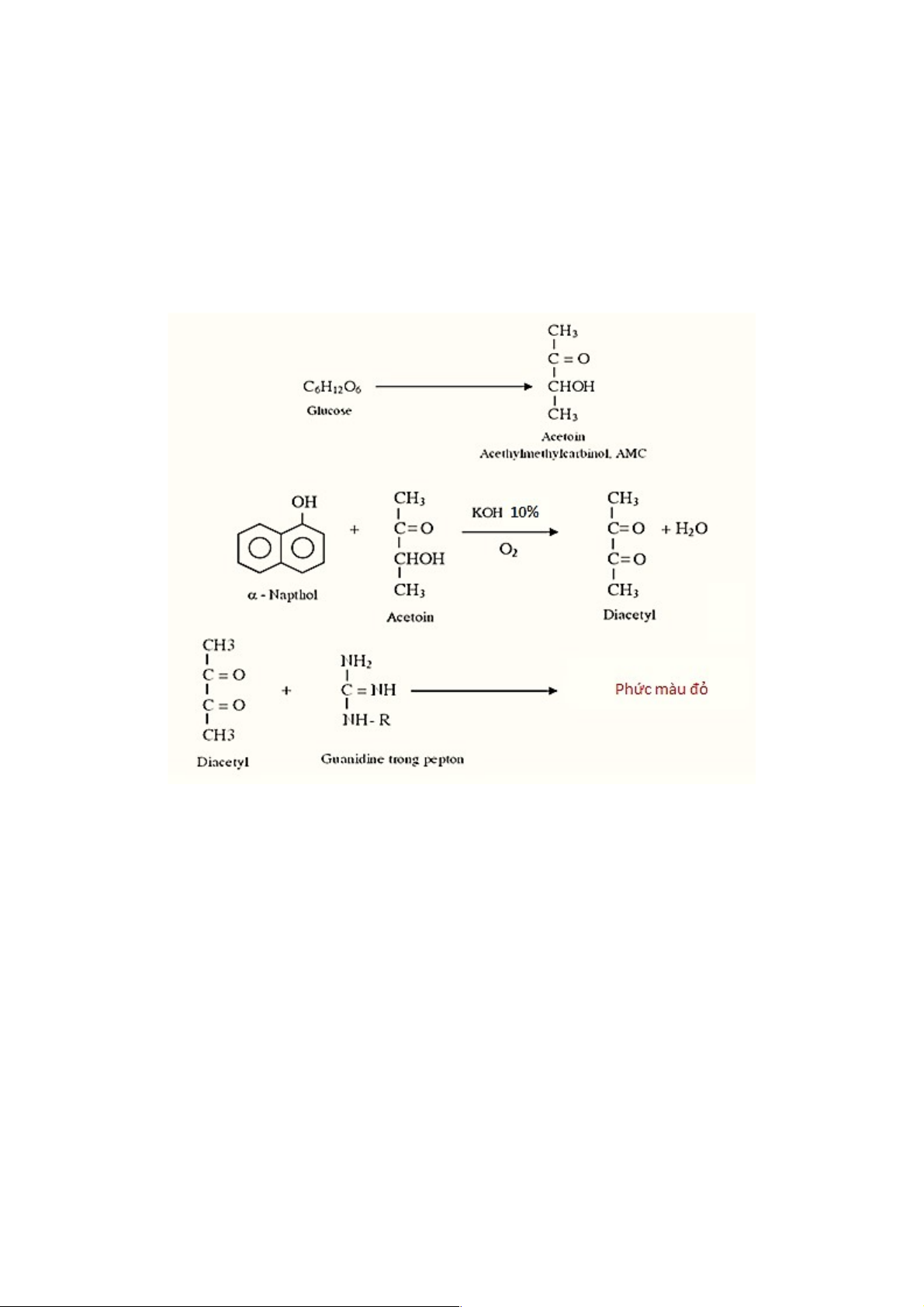
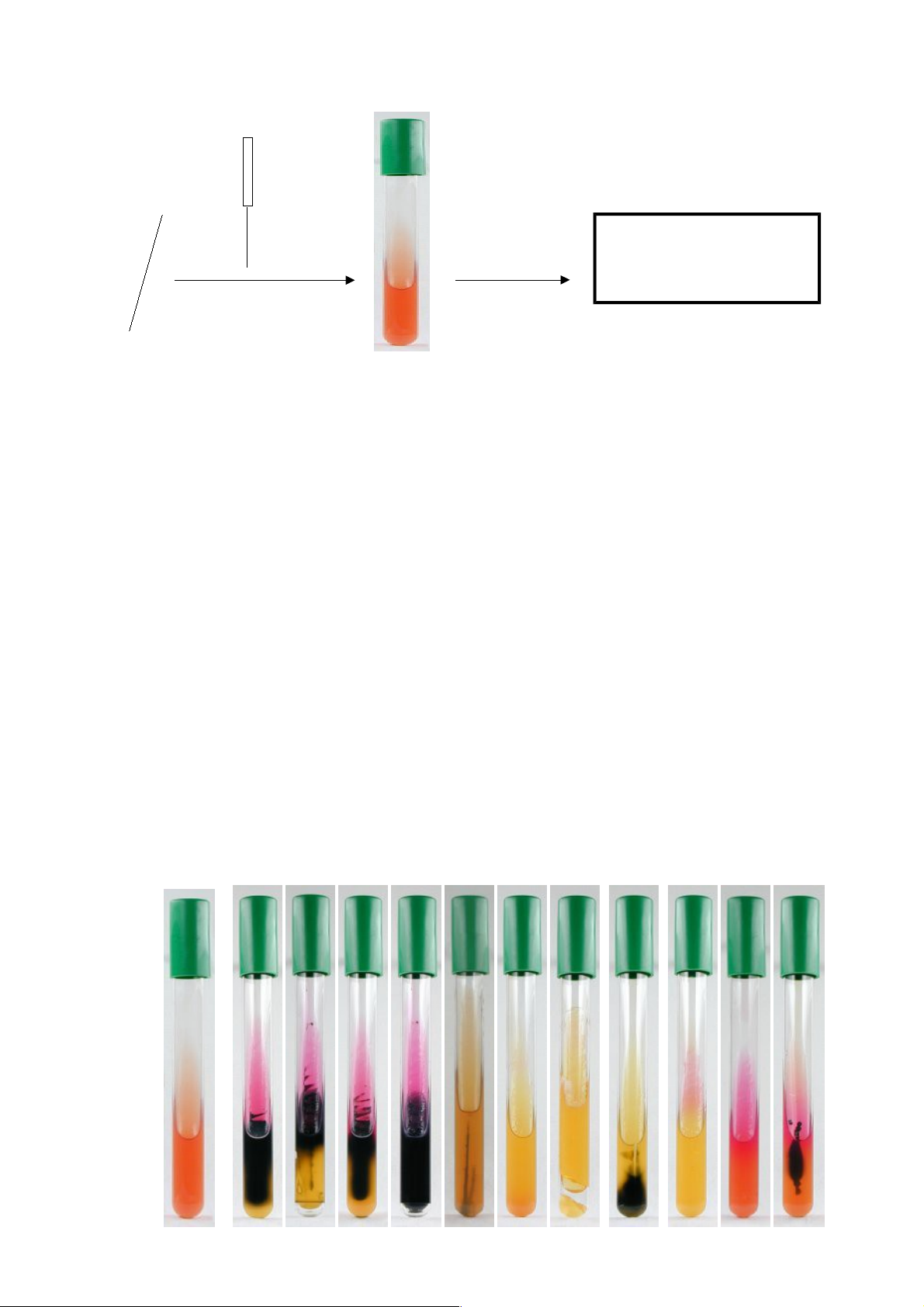
3. Phản ứng VP
Mục đích: Phát hiện vsv tạo sản phẩm trung tính (acetoin) trong quá trình lên men glucose. Chủng vi sinh vật Môi trường MR-VP 24h, 37oC KOH 10% (NaOH 40%) -naphthol
Kết quả,màu đỏ hồng (Dương tính), không đổi màu (âm tính) 24 Âm tính Dương tính Quy trình hóa học:
Ý nghĩa: Định danh vi sinh vật tạo sản phẩm trung tính (acetoin) trong quá trình
lên men glucose, thường là gram (-)
4. Thử nghiệm Citrate
Mục đích: Xác định khả năng vi sinh vật sử dụng nguồn citrat như là nguồn cacbon duy nhất. Cơ sở sinh hóa:
◦ VSV sử dụng citrate, sinh ra CO2 làm kiềm hóa MT
◦ VSV sử dụng muối ammonium là nguồn đạm duy nhất tạo ra NH3 làm kiềm hóa MT 25
Môi trường Simmon citrate agar Ammonium dihydrogen phosphate 1.0g Dipotassium hydrogen phosphate 1.0g NaCl 5g Sodium citrate 2g MgSO4 0,2g Bromothymol blue 0,08g Agar 13g Chủng vi sinh vật Môi trường Simmon citrate 24h, 37oC
Kết quả, màu xanh dương (Dương tính), màu xanh lục (âm tính) Đối chứng trắng Pứ âm tính Pứ dương tính 26
Cơ chế: Một số vi sinh vật có enzyme citrate permease có khả năng sử dụng citrate
trong môi trường có Na. Citrate là nguồn cacbon duy nhất.
Khi sử dụng citrate, chúng giải phóng ra môi trường ion Na+ làm tăng PH của môi
trường, đồng thời những vi sinh vật có khả năng sử dụng citrate làm nguồn cacbon thì
cũng có khả năng sử dụng muối amonium vô cơ NH4H2PO4 làm nguồn Nito tạo ra
NH3 cũng làm kiềm hóa môi trường, sự thay đổi PH của môi trường được nhận biết
nhờ chỉ thị màu Bromothymol blue.
Ý nghĩa: định danh được một số vi sinh vật có khả năng sử dụng citrate như một nguồn cacbon duy nhất.
5. Thử nghiệm KIA/TSI
Mục đích: phát hiện khả năng
◦ Sử dụng các nguồn cacbonhydrate ◦ Sinh H2S ◦ Tạo hơi (gas) -
Môi trường KIA chỉ có hai loại đường 0.1% glucose, 1% lactose. -
Môi trường TSI có thành phần giống KIA, có bổ sung thêm 1%sucrose Chủng vi sinh vật Môi trường KIA/TSI 24h, 37oC Kết quả 27 Quan sát: Phần 370C/24h nghiêng / phần sâu / hơi / H2S
Cơ chế: Có ba trường hợp xảy ra:
- Chỉ sử dụng glucose, sau 18-24h nuôi cấy phần nghiêng (bề mặt) trở nên có PH kiềm
và phần đứng (phần sâu trong ống nghiệm) có PH acid. Do Glucose trên bề mặt của
môi trường được vi sinh vật oxy hóa hoàn toàn thành CO2 và nước để thu lấy năng
lượng, đáp ứng nhu cầu năng lượng trong tăng trưởng. Vi sinh vật tiếp tục dị hóa
peptone qua đó giải phóng NH3 làm phần bề mặt của môi trường có PH kiềm. Trong
khi đó, ở phần sau trong môi trường có điều kiện oxy không đầy đủ, glucose được lên
men kị khí sinh các acid hữu có làm PH môi trường giảm.
- Sử dụng cả glucose và Lactose, sau 18-24h, toàn bộ môi trường đều trở nên có PH
acid vì sự biến dưỡng đồng thời cả hai loại đường giúp vi sinh vật đủ năng lượng để
tăng trưởng mà chưa cần sử dụng đến peptone. Nếu kéo dài thời gian nuôi cấy quá
24h bề mặt PH sẽ trở nên kiềm do hết nguồn cacbon vì vi sinh vật phỉa sử dụng đến peptone.
- Không sử dụng glucose, lactose: vi sinh vật sẽ biến dưỡng peptone để thu lấy năng
lượng và vật chất cho sự tăng trưởng. tuy nhiên do peptone chỉ được biến dưỡng trong
điều kiện hiếu khí nên hiện tượng kiềm hóa của môi trường chỉ diễn ra trên bề mặt môi trường.
- Khả năng sinh H2S do trong môi trường sodium thiosunfat, vi sinh vật khử sunface có
thể khử chất này, nhờ có enzyme thiosunfat reductase để giải phóng H2S, H2S sẽ phản
ứng với Ion Fe2+ của chỉ thị amonium citrate tạo kết tủa màu đen F2S.
Một số trường hợp có thể xảy ra khi dùng môi trường KIA/TSI 28 ĐC 1 2 3 4 5 6 7 8 9 10 11
Ý nghĩa: định danh các loại vi khuẩn có khả năng: sử dụng các nguồn cacbon khác
nhau và có khả năng sinh H2S, khả năng sinh hơi. Thường được dùng để định danh
các vi khuẩn gram (-), vi sinh đường ruột.
6. Phản ứng LDC
Mục đích: dùng để định danh các loài vi khuẩn có khả năng sinh enzyme Lysine
decarboxylase, thường dùng để định danh salmonella…
Cơ chế: Trong môi trường có NH2-CH2-(CH2)3-CH2-NH2-COOH, trong môi trường
có vi sinh vật có khả năng tiết enzyme Lysine decarboxylase, enzyme Lysine
decarboxylase cắt đứt gốc –COOH ra khỏi hợp chất NH2-CH2-(CH2)3-CH2-NH2-
COOH, tạo thành CO2 và gốc NH2-CH2-(CH2)3-CH2-NH2, gốc này sẽ làm cho PH của môi trường tăng lên.
Glucose sẽ bị phân giải thành acid làm PH của môi trường giảm cho môi trường có
màu vàng, nhưng sau 3-4 tiếng, glucose sẽ cạn kiệt và PH tăng lên theo lysine.
Kết hợp hai quá trình trên sẽ tạo ra môi trường có pH lớn. Chất chỉ thị:
- Bromocresd purple có màu vàng với pH<2.2, có màu tím khi 5.2< pH <6.8, và có màu tím đỏ khi pH>6.8.
- Cresol red có màu vàng tím khi pH<7.2, có màu tím khi 7.2đỏ khi pH>8.3 29
Vì sau khi vi khẩn phân huỷ NH2-CH2-(CH2)3-CH2-NH2-COOH và Glucozo môi
trường có pH lớn nên môi trường có màu tím đỏ của thuốc thử Bromocresd purple và Cresol red.
Ý nghĩa: Định danh các loài vi khuẩn có khả năng sinh enzyme Lysine decarboxylase.
7. Phản ứng di động
Mục đích: Xác định khả năng di động của vi sinh vật
Môi trường: môi trường bán lỏng NA, MIU,SIM để đứng.
Cơ chế: Một số loài vi khuẩn có tiêm mao có thể di động trong môi trường bán
lỏng, làm đục môi trường hay mọc giống rễ cây xung quanh đường cấy. Cách thực hiện: Vi sinh vật Dùng que cấy thẳng Môi trường 37oC, ủ trong 24-48h Đọc kết quả
Cách đọc kết quả: vi sinh vật có tiêm mao có khả năng mọc lan ra khỏi đường cấy,
nếu không có khả năng mọc lan thì chỉ có thể phát triển trên đường cấy 30 - + +
Ý nghĩa: dùng để định danh một số loại vi sinh vật có tiêm mao hoặc không có
tiêm mao,. Thường dùng để dịnh danh những con cầu khuẩn không có tiêm mao và không tạo bào tử.
8. Phản ứng Coagulase test
Cơ chế: một số vi sinh vật có khả năng tổng hợp enzym coagulase, enzyme này có
khả năng làm đông huyết tương người hoặc thỏ. Khi cấy vi sinh vật vò môi trường,
nếu vi sinh vật có khả năng tiết enzyme coagulase, enzyme coagulase có khả năng
phân cắt fibrinogen tạo thành fibrin và prothromibis, tạo thành cách khối đông.
Môi trường: Huyết tương người hay thỏ đông khô dạng thương phẩm.
Cách đọc kết quả: 31
(+) khi xuất hiện khối đông tụ huyết tương
(-) không xuất hiện khối đông tụ, dung dịch đồng nhất.
Ý nghĩa: Phản ứng coagulase test thường được dùng để định danh vi sinh vật có
khả năng tiết enzyme coagulase, thường là các vi khuẩn gây bệnh (thường dùng định danh Staphylococus).
9. Phản ứng sinh H2S
Cơ chế: Vi sinh vật có khả năng phân giải một số chất chứa lưu huỳnh, ta có thể
dùng Na2S2O3, Na2SO3, peptone hay trptone, tạo thành khí H2S. Cách đọc kết quả:
- Bổ sung vào ion Fe2+ hoặc Fe3+ tạo thành kết tủa đen.
- Dùng giấy chỉ axetat để trên ống nghiệm.
10. Phản ứng phân huỷ Nitrate thành Nitrit.
Một số vi sinh vật có khả năng tạo thành enzyme reductase có khả năng phân huỷ NO- - -
3 thành NO2 . Để kiểm tra NO2 có trong dung dịch, ta dùng: - Cress A có A.sulfanilic - Cress B có -naphthilamine
Cress A và Cress B có khả năng kết hợp với NO -2 tạo thành phức chất có màu nâu đỏ hồng (dương tính).
Cấy vi khuẩn vào môi trường có chứa Nitrate => ủ các ống nghiệm ở 37oC trong
24h => nhỏ thuốc thử Cress A và Cress B=> đọc kết quả. 32 BÀI 13:
ĐỊNH LƯỢNG VI SINH VẬT BẰNG PHƯƠNG PHÁP ĐẾM TRỰC TIẾP
Báo cáo thực tập
1. Nguyên tắc và cách tiến hành của phương pháp định lượng vi sinh vật bằng
phương pháp đếm trực tiếp a. Nguyên tắc
Dựa trên sự quan sát và đếm trực tiếp số lượng tế bào VSV bằng kính hiển vi
và buồng đếm. Phương pháp này dùng để xác định số lượng các loại VSV đơn bào có
kích thước lớn như: nấm men, tảo đơn bào, bào tử mốc dễ quan sát trên kính hiển vi.
Quy trình đếm đơn giản, cho phép xác định nhanh chóng số lượng VSV. Tuy nhiên,
do quan sát và đếm bằng mắt trên kính hiển vi nên có một số trở ngại
- Không phân biệt các tế bào VSV sống và chết trong mẫu.
- Không phân biệt các tế bào VSV và hạt vật thể.
- Hạn chế đối với huyền phù có mật độ thấp do lượng dd đem đếm nhỏ
Tùy mức độ có mặt của VSV trong mẫu ban đầu, dd đem đếm cần được pha
loãng đến mức phù hợp ( số tb trong một ô nhỏ không quá 10 tb). Nguyên tắc pha loãng:
- Mẫu phải được pha loãng. Tùy theo mức độ nhiễm khuẩn của mẫu ta có sự
ước lượng pha loãng 1/5, 1/10, 1/20 hay 1/10, 1/100, 1/1000…
- Dung dịch pha loãng mẫu thường là NaCl 9% hay phosphat đệm đã được vô trùng. - Cách pha:
+ Mẫu 1/5: 1ml mẫu+4ml NaCl 9%
+ Mẫu 1/10: 1ml mẫu+9ml NaCl 9%\
- Từ mẫu 1/10 lấy 1ml +9ml NaCl 9% ta có độ pha loãng 10-2, cứ như vậy ta
có các độ pha loãng tiếp theo 10-3, 10-4,… b. Cách tiến hành
- Đặt lamelle sạch phủ lên khung đếm.
- Dùng ống nhỏ giọt hút dd nấm men đã pha loãng, bơm nhẹ và rãnh buồng
đếm, dd thấm vào kẽ buồng đếm và lamelle.
- Dung dịch chảy tràn từ từ vào các rãnh, lan tỏa lấp đầy khắp lamelle. Nếu bị
bọt mắc lại trong lamelle thì phải làm lại.
- Đặt buồng đếm lên bàn kẹp của kính hiển vi, dùng kẹp cố định buồng đếm. 33
- Thao tác kính hiển vi, dùng vật kình x10 để điều chỉnh sơ bộ trước, sau đó
dùng vật kính x40 để đếm.
- Đếm số TB trong 5 ô lớn (4 ô góc, 1 ô giữa), đếm lần lượt từng ô nhỏ trong 1 ô lớn.
- Trường hợp 1 ô lớn có 16 ô nhỏ: đếm tất cả 80 ô nhỏ trong 5 ô lớn.
- Trường hợp 1 ô lớn có 25 ô nhỏ: đếm tất cả 125 ô nhỏ trong 5 ô lớn.
2. Phương pháp định lượng vi sinh vật bằng cách đếm trực tiếp thường áp dụng cho
những đối tượng vi sinh vật nào? Giải thích
Đối tượng: những vi sinh vật có kích thước lớn nấm men, tảo đơn bào, bào tử mốc
dễ quan sát trên kính hiển vi.
Do quan sát bằng kính hiển vi ở vật kính x40, nghĩa là độ phóng đại lên 400 lần
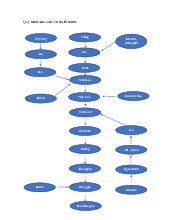
nên chỉ có thể đếm được những vi sinh vật có kích thước lớn. Mẫu
Đồng nhất mẫu ( hút 1ml mẫu trong 9 ml nước muối sinh lý)
Pha loãng mẫu ( pha loãng thành 10-2, 10-3, 10-4…)
Tăng sinh ( chọn 3 nồng độ liện tiếp thích hợp cấy 1 ml mẫu vào 10ml BGBL, mỗi nồng độ cấy 3 ống, ủ 370C/48h)
Ghi nhận số ống dương ởmỗi nồng độ pha loãng
Chọn ống (+) cấy sang môi trường nước tryptone ủ 440C/24h Tra bảng MPN
Thử phản ứng Indole bằng thuốc thử Kowac’s 34
Tra bảng MPN, tính mật độ E.coli
BÀI 14: ĐỊNH LƯỢNG TỔNG VI KHUẨN HIẾU KHÍ TRONG THỰC PHẨM
BẰNG PHƯƠNG PHÁP ĐẾM KHUẨN LẠC Nguyên tắc
Tổng số vi khuẩn hiếu khí là tổng số những vi khuẩn thuộc nhóm vi khuẩn hiếu
khí tồn tại trong môi trường. Tổng số các nhóm vi khuẩn này trong thực phẩm có thể
xác định bằng phương pháp nuôi cấy trải lên bề mặt thạch hoặc bằng phương pháp tạo
hộp đổ. Thông qua số lượng khuẩn lạc đếm được trên các đĩa peptri cho phép xác định
được lượng vi sinh vật còn có khả năng sinh trưởng trong môi trường trong mẫu ban đầu
Để đếm kết quả chính xác thì số vi khuẩn trong đĩa phải trong giới hạn 25-250
khuẩn lạc. Nếu vượt quá giới hạn thì phải tiến hành pha loãng và chọn những độ pha loãng lớn hơn.
Báo cáo thực tập
1. Trình bày phương pháp định lượng tổng vi khuẩn hiếu khí trong mẫu bằng
phương pháp đếm khuẩn lạc.
Có 2 phương pháp là đếm trực tiếp và đếm gián tiếp
- Cách đếm trực tiếp: đối với những vi sinh vật có kích thước lớn tảo, nấm men… thì ta
có thể đếm trực tiếp bằng buồng đếm hồng cầu. Phương pháp này nhanh, tuy nhiên
không chính xác vì ta không thể phân biệt số lượng tế bào chết với tế bào sống, ngoài
ra còn có sự nhầm lẫn do các vật thể khác trong mẫu.
- Cách đếm gián tiếp bằng cách đếm số lượng khuẩn lạc mọc trên môi trường thạch:
phương pháp này đã được trình bày trong quá trình tiến hành ở trên.
2. So sánh ưu nhược điểm của phương pháp tạo hộp đổ và phương pháp cấy trải
Phương pháp cấy trải:
• Ưu điểm: độ đồng đều cao (khuẩn lạc mọc đều) nên dễ nhận dạng
các khuẩn lạc đặc trưng • Nhược điểm: oThời gian trải lâu oThể tích mẫu cấy nhỏ 35
Phương pháp tạo hộp đổ:
• Ưu điểm: thể tích mẫu cấy lớn, mật độ vi sinh vật cao
• Nhược điểm: Dễ làm vi sinh vật chết nếu môi trường chưa hạ xuống
nhiệt độ 450C. Không xác định được hình dạng khuẩn lạc nhất định 36
BÀI 15: ĐỊNH LƯỢNG COLIFORMS BẰNG PHƯƠNG PHÁP MPN
Báo cáo thực tập
1. Đặc điểm của nhóm vi khuẩn Coliform và tác hại của chúng
Coliform là những trực khuẩn, Gram (-), không sinh bào tử, kỵ khí tùy tiện, có khả
năng lên men lactose sinh acid và sinh hơi ở 370C trong 24-48h. Phát triển ở pH từ
4,4-9,0, nhiệt độ rất rộng -2:500C,
Nhóm Coliform hiện diện rộng rãi trong tự nhiên, trong ruột người, động vật. Số
lượng coliform trong mẫu được dùng để chỉ thị khả năng của các vi sinh vật gây bệnh
khác, chỉ thị cho mức độ vệ sinh của môi trường hay một sản phẩm. Nhóm coliform
gồm 4 giống là : E.coli, Citrobacter, Klebsiella và Enterobactor
Tác hại: vi khuẩn được đưa vào thực phẩm từ nước có nhiễm phân hay từ nguyên
liệu thực phẩm nhiễm phân.
Triệu chứng ngộ độc: thời gian ủ bệnh từ 2-20h. Bệnh phát đột ngột, đau bụng dữ
dội, ít nôn mửa, đi phân lỏng, thân nhiệt bình thường hoặc sốt nhẹ, có trường hợp sốt
cao, chân co quắp. Bình thường sau 2-3 ngày sẽ khỏi, bị nặng sẽ lâu hơn.
2. Trình bày nguyên tắc và phương pháp định lượng coliform trong thực phẩm theo
phương pháp MPN. a. Nguyên tắc
Dùng phương pháp MPN để xác định copliform trong thực phẩm.
Phương pháp MPN( phương pháp có xác suất cao nhất, số tối khả) còn được gọi là
phương pháp pha loãng tới hạn hay phương pháp chuẩn độ. Đây là phương pháp dùng
để đánh giá số lượng VSV theo số lượng VSV có xác suất lớn nhất có mặt trong 1 đơn
vị thể tích mẫu hay nói cách khác MPN dựa trên nguyên tắc xác suất thống kê sự phân
bố VSV trong các độ pha loãng khác nhau của mẫu. Đây là phương pháp định lượng
dựa trên kết quả định tính của 1 loạt các thí nghiệm được lặp lại ở 1 số độ pha loãng
khác nhau. Thông thường việc định lượng này được lặp lại 3 lần ở 3 độ pha loãng bậc
10 liên tiếp, tổng cộng 9 ống nghiệm. các độ pha loãng được lựa chọn sao cho các lần
lặp lại có 1 lần dương tính và 1 âm tính. 37
Từ các kết quả của thí nghiệm định tính, dựa vào bảng Mac Crady để suy ra mật
độ ước đoán số lượng VSV có trong mẫu, được trình bày dưới dạng số MPN/100ml
hay số MPN/g mẫu. Độ chính xác của phương pháo MPN phụ thuộc vào số lượng ống
nghiệm lặp lại trong mỗi độ pha loãng: số lượng ống nghiệm lặp lại càng cao thì độ
chính xác của trị số MPN càng lớn
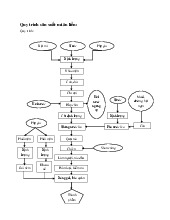
b. Phương pháp định lượng Mẫu
Đồng nhất mẫu ( hút 1ml mẫu trong 9 ml nước muối sinh lý)
Pha loãng mẫu ( pha loãng thành 10-2, 10-3, 10-4…)
Tăng sinh ( chọn 3 nồng độ liện tiếp thích hợp cấy 1 ml mẫu vào 10ml BGBL, mỗi nồng độ cấy 3 ống, ủ 370C/48h)
Ghi nhận số ống dương ởmỗi nồng độ pha loãng
Chọn ống (+) cấy sang môi trường nước tryptone ủ 440C/24h Tra bảng MPN
Thử phản ứng Indole bằng thuốc thử Kowac’s
Tra bảng MPN, tính mật độ E.coli 38
BÀI 19: PHƯƠNG PHÁP PHÂN TÍCH ĐỊNH LƯỢNG ESCHERICHIA
COLI TRONG THỰC PHẨM Báo cáo thực tập
1. Trình bày đặc điểm của E.coli
Là trực khuẩn, gram(-), không tạo bào tử. Phát triển ở nhiệt độ từ 7-500C, t0opt là 370C,pHopt là 4,4.
E.coli sống trong ruột già của người và của động vật. E.coli theo phân người và
phân gia súc ra thiên nhiên
2. Trình bày quy trình phân tích định lượng
Lấy 1ml mẫu nước mía cho vào 9ml nước muối sinh lý, được 10-1
Pha loãng mẫu 10-2, 10-3,10-4….
Chuyển 1ml dung dịch 10-2, 10-3, 10-4 vào 10ml canh BGBL, nồng độ 3 ống lặp lại, ủ 370C, 36h
Chọn ống (+), cấy sang EC, ủ 440C trong 24-48h
Xác định ống (+) ở mỗi nồng độ, cấy sinh khối VSV từ các ống (+) sang đĩa môi trường EMB để phân lập E.coli
a. Cơ chế của các thử nghiệm sinh hóa - Phản ứng Indol
• Trong môi trường NB/ tryptone sẽ có Tryptophan
• Nếu trong môi trường đó có vi khuẩn E.Coli thì sẽ sản sinh ra Emzyme Tryptophanase
• Tryptophanase sẽ khử Tryptophan thì Indol
• Để nhận biết có Indol trong môi trường hay không thì chúng ta sẽ nhỏ
thuốc thử kowac’s vào. Nếu sinh ra hợp chất có màu hồng cánh sen thì có mặt của Indol
Suy ra phản ứng Indol (+) 39 - Thử nghiệm MR
• Nguyên tắc: phát hiện các vi khuẩn lên men glucose tạo sản phẩm acid hữu cơ
• Trong môi trường có hệ đệm phosphat ( K2HPO4) nhằm ổn định pH
(6,9)môi trường. E.coli có khả năng lên men glucose tạo ra acid hữu cơ
bền thì nó sẽ phá vỡ hệ đệm làm pH giảm mạnh xuống khoảng 4 – 4,3.
• Nhỏ MR nếu pH <4,3 thì môi trường có màu đỏ thì (+) còn màu vàng thì (-) Kết quả MR(+) - Thử nghiệm VP
• Nguyên tắc: cũng giống như với MR nhưng nó sẽ không tạo ra acid hữu cơ mà tạo thành acetoin
• Sau đó nhỏ thêm KOH 10% và napthol. Để yên đợi trong vòng 30s cho đến 10 phút
• Phản ứng (+): có màu đỏ hồng
• Phản ứng (-): môi trường có màu vàng hoặc màu nâu đất
=>E.coli không có khả năng sinh acetoin nên phản ứng cho kết quả âm tính. 40
BÀI 20: PHƯƠNG PHÁP PHÂN TÍCH SAMONELLA SPP TRONG THỰC PHẨM Nguyên tắc
Quá trình phân tích Samonella gồm 4 bước: tăng sinh, tăng sinh chọn lọc, phân
lập, và khẳng định. Bước tăng sinh chọn lọc thường dùng các loại môi trường chuyên
biệt tùy vào nguồn mẫu thu nhận. Bước khẳng định nhằm xác nhận các khuẩn lạc đặc
trưng cho Samonella xuất hiện trên môi trường phân lập. Bước này dựa trên việc sử
dụng các thử nghiệm sinh hóa và thử nghiệm huyết thanh đặc trưng cho Samonella Báo cáo thực tập
1. Trình bày quy trình phân tích Samonella trong thực phẩm 41 Mẫu
Tiền tăng sinh( đồng nhất 25ml mẫu trong 225ml canh BPW ủ 370C trong 16-24h) Tăng sinh chọn lọc ± h 3 ± h 3 Phân lập ± h 3 42
2. Tại sao khi phân tích Samonella chỉ cần phân tích định tính
Chỉ tiêu Samonella là 1 trong những chỉ tiêu rất quan trọng trong kiểm định các
loại hải sản như cá, mực, tôm…theo những tiêu chuẩn VN quy định về sự có mặt của
Samonella trong 25gam các loại này là 0, nghĩa là không cho phép sự có mặt của nó
trong thực phẩm này. Nên chúng ta chỉ cần phát hiện sự có mặt của Samonella không
cần phân tích định lượng
a. Giải thích cơ chế các phản ứng sinh hóa xác định Samonella
Đối với phản ứng MR-VP đã được trình bày trong bài phân tích định lượng E.coli.
Chỉ giải thích phản ứng sinh hóa LDC và MIU • LDC
Trong môi trường LDC cũng có glucose nên vi sinh vật sẽ phân giải glucose tạo
thành các acid hữu cơ làm giảm pH môi trường, do đó môi trường sẽ có màu vàng
Khi nguồn glucose cạn kiệt thì vi sinh vật sẽ sử dụng Lysine
Cơ chế: vi sinh vật có khả năng tạo ra enzyme lysine decarboxylase phân cắt phân
tử lyzine tạo thành diamine
Trong diamine có 2 nhóm amoni làm pH môi trường tăng tạo màu tím đỏ (+) • MIU
M: thì chúng ta sẽ dùng que cấy thẳng vào môi trường, nếu vi khuẩn mọc lan
khỏi đường cấy thẳng thì VSV có tính di động
I: Indol đã được trình bày như trên bài E.coli
Ure: vi sinh vật có khả năng tạo enzyme urease phân giải ure tạo thành NH3
làm pH thay đổi, dùng thuốc thử phenol red nếu có màu hồng cánh sen thì phản ứng dương tính, màu vàng (-) 43
BÀI 21: PHƯƠNG PHÁP PHÂN TÍCH ĐỊNH LƯỢNG BACILLUS CEREUS TRONG THỰC PHẨM Nguyên tắc
Quá trình phân tích định lượng Bacillus cereus trong thực phẩm có thể được thực
hiện theo phương pháp MPN hoặc phương pháp đếm khuẩn lạc. Khuẩn lạc của
Bacillus cereus trên môi trường phân lập MYP được xác định bằng các phản ứng sinh hóa đặc trưng Báo cáo thực tập
1. Quy trình phân tích Bacillus cereus trong thực phẩm Mẫu Đồng nhất mẫu
Phân lập ( dàn đều 0,1ml dung dịch mẫu lên 2 đĩa môi trường MYP ủ 300C trong 24h
Đếm số khuẩn lạc điển hình Khẳng định
Chọn 5 khuẩn lạc điển hình trên mỗi đĩa thạch cấy vào môi trường thạch máu cừu Tính kết quả
2. Giải thích cơ chế của các phản ứng sinh hóa xác định Bacillus cereus 44
Thử nghiệm MR-VP, đã được trình bày. Thử nghiệm Tyrosin và Lysozyme không
được tiến hành. Trong bài này chỉ giải thích khả năng chuyển nitrat thành nitric NO -3 NO-2
• Cơ chế: vi khuẩn tạo enzyme reductase sẽ khử NO3- thành NO2-
• Khi cho thêm Gress A và Gress B, nếu tạo ra các hợp chất màu đỏ hồng
là (+), hoặc khi thêm 2 chất đó vào, nếu khử NO2- thành N2 và thêm vào
đó CH3COOH và Zn mà tạo ra khí H2 thì cũng là (+). Nếu không màu là (-)
3. Tại sao khi phân tích Bacillus aureus chỉ cần phân tích định tính
Vì trong 1 số tiêu chuẩn VN có quy định số vi khuẩn Bacillus aureus tối đa có mặt
trong thực phẩm là 102. Số lượng rất nhỏ nên chỉ cần kiểm nghiệm định tính mà không
cần kiểm tra định lượng. 45
BÀI 22: PHƯƠNG PHÁP PHÂN TÍCH ĐỊNH LƯỢNG STAPHYLOCOCCUS
AUREUS TRONG THỰC PHẨM Nguyên tắc
Nguyên tắc xác định sự có mặt và định lượng số lượng của Staphylococcus Aureus
trong thực phẩm dựa vào sự xuất hiện của khuẩn lạc điển hình ( chỉ định bởi sự khử
của kali tellurite leicithin lòng đỏ trứng ) trên môi trường phân lập Baird – Parker và
phản ứng dương tính coagulase trong dịch huyết tương đỏ.
Báo cáo thực tập
1. Đặc tính và độc tố của Staphylococcus aureus Đặc tính:
• Là tụ cầu khuẩn, gram (+), không di động và không sinh bào tử Mẫu
• Phát triển ở pH môi trường trung tính, nhiệt độ 370C
Độc tố: Chúng gây ra nhiều bệnh nguy Đồng hiểm nh trênấ t dmẫ a, u
trong cơ thể bằng cách tiết ra độc
tố như hyaluronidase, hemolysine, leukocidine, exfoloatine, 5 độc tố ruột enterotocxine A, B, C, D, E. Pha loãng
2. Quy trình phân tích định lượng Sp.aureus
Trong bài thực hành này, chỉ được thực hành đến giai đoạn đếm khuẩn lạc điển
Phân lập (Dàn đều 0,1ml dd mẫu lên 2 đĩa môi trường BP, ủ 370C, 24h-48h) hình.
Đếm số khuẩn lạc điển hình
Khẳng định ( chọn 5 khuẩn lạc điển hình cấy vào môi trường)
Coagulase test( cho 0,1ml BHI vào 0,3 ml huyết tương thỏ ủ 370C/4-6h)
Đông huyết tương. Mức độ đông ¾ trở lên được xe Không m hì là nh dươ thà ng nh tính
khối đông huyết tương( hỗn hợ 46 p đồng nhất 47
BÀI 24: PHƯƠNG PHÁP PHÂN TÍCH CLOSTRIDIUM PERFRINGENS TRONG THỰC PHẨM Nguyên tắc
Clostridium perfringens được phân tích bằng cách sử dụng môi trường có chứa sắt
và sulphite. Khuẩn lạc mọc trên môi trường có màu đen do phản ứng giữa S2- và Fe2+
Trả lời câu hỏi
1. Đặc tính sinh lý và gây bệnh của Clostridium perfringen
Vi khuẩn Clostridium perfingen là vi khuẩn tạo bào tử, gram (+), không chuyển
động. Đa số sống kị khí, ưa nhiệt. Thủy phân mạnh protein và chuyển hóa acidmin tạo
mùi khó chịu. Sinh độc tố trong thực phẩm và gây bệnh hoại tử vết thương
Triệu chứng ngộ độc: viêm ruột và dạ dày, đau bụng đi ngoài, phân lỏng hoặc toàn
nước lẫn máu, thỉnh thoảng có nôn mửa. Thời gian ủ bệnh 12-24h
2. Quy trình phân tích Clostridium perfringens 48 Mẫu Đồng nhất mẫu Pha loãng mẫu
Cấy mẫu: chọn nồng độ thích hợp cấy 10ml mẫu vào 2 ống môi trường thạch Wilson Blair bổ sung thêm 0,5 ml Na2SO3 5% và 0,25ml FeSO4 5%. Trộn đều Đun cách thủy 750C/15p Làm đông thạch nhanh
Cho 1 ml parafin lỏng vào ống thạch. ủ ở 370C/18-24h
Khẳng định: chọn khuẩn lạc điển hình, tròn,bờ lồi, đen nhẵn
Chọn khuẩn lạc điển hình cấy vào môi trường Motilit Chọn khuẩ y Nitrate. Ủ t n lạc đi rong đi ể ề n hì u ki nh c ện kịấy và khí o môi 370C/ trường L 18-24h
actose gelatine. Ủ trong điều kiện kị khí 370C/18-24h Motility Nitrate Lactose Gelatine 49
Document Outline
- 1. Phản ứng tạo indol
- 2. Phản ứng MR (methyl red)
- 3. Phản ứng VP
- 4. Thử nghiệm Citrate
- 5. Thử nghiệm KIA/TSI
- 6. Phản ứng LDC
- 7. Phản ứng di động
- 8. Phản ứng Coagulase test
- 9. Phản ứng sinh H2S
- 10. Phản ứng phân huỷ Nitrate thành Nitrit.