

















Preview text:
PHIẾU BÀI TẬP ÔN HÈ KHOA HỌC TỰ NHIÊN 7
NỘI DUNG 1: NGUYÊN TỬ - SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
PHIẾU ÔN TẬP SỐ 1
Câu 1. Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là
A. electron và neutron. B. proton và neutron.
C. neutron và electron.
D. electron, proton và neutron
Câu 2. Nguyên tử luôn trung hoà về điện nên
A. số hạt proton = số hạt neutron.
B. số hạt electron = số hạt neutron.
C. số hạt electron = số hạt proton.
D. số hạt proton = số hạt electron = số hạt neutron.
Câu 3. Nguyên tử X có 11 proton và 12 neutron. Tổng số hạt trong nguyên tử X là A. 23. B. 34. C. 35. D. 46.
Câu 4. Số electron tối đa ở lớp electron thứ nhất là A. 1. B. 2. C. 3. D. 8.
Câu 5. Nguyên tố phi kim nào tồn tại ở dạng lỏng ở nhiệt độ phòng? A. Nitrogen. B. Bromine. C. Argon. D. Mercury.
Câu 6. Cho thành phần các nguyên tử sau: A (17p,17e, 16 n), B (20p, 20e, 20n), C
(17p,17e, 18n), D (19p,19e, 20n), E (8p, 8e, 9n). Có bao nhiêu nguyên tố hóa học? A. 1. B. 2. C. 3. D. 4.
Câu 7. Tổng số hạt trong nguyên tử X là 28 và số hạt không mang điện chiếm 35,7% thì nguyên tử X là A. Nitrogen. B. Oxygen. C. Fluorine. D. Neon
Câu 8. Nguyên tố Mg thuộc chu kì 3, nhóm IIA. Nguyên tử của nguyên tố Mg có bao nhiêu lớp electron? A. 2. B. 3. C. 4. D. 1.
Câu 9. Dãy gồm các nguyên tố kim loại? A. F, O, Na, N. B. O, Cl, Br, C.
C. K, Na, Mg, Al. D. K, N, H, O.
Câu 10. Mỗi phát biểu sau là đúng hay sai? Phát biểu Đúng Sai
a) Các hạt electron được tìm thấy ở hạt nhân của nguyên tử
b) Các hạt neutron và electron hút nhau.
c) Trong nguyên tử, số electron tối đa ở lớp electron thứ hai là 8.
d) Phần lớn khối lượng của nguyên tử tập trung ở hạt nhân nên
kích thước của hạt nhân gần bằng kích thước của nguyên tử.
Câu 11. Phát biểu nào sau đây đúng, phát biểu nào sau đây sai? Phát biểu Đúng Sai
a) Tất cả nguyên tử của các nguyên tố ở chu kì II đều có 2
electron ở lớp ngoài cùng.
b) Số thứ tự của chu kì bằng số lớp electron trong nguyên tử của
các nguyên tố thuộc chu kì đó.
c) Các nguyên tố kim loại có mặt ở tất cả các nhóm trong bảng tuần hoàn.
d) Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều
tăng dần khối lượng nguyên tử.
Câu 12. Số hiệu nguyên tử của carbon là 6. Tìm số hạt electron trong nguyên tử carbon
Trả lời: . . . . . . . .
Câu 13. Hiện nay có bao nhiêu chu kì trong bảng tuần hoàn các nguyên tố hóa học?
Trả lời: . . . . . . . .
Câu 14. Mặt trời chứa hydrogen, 25% helium và 2% các nguyên tố hóa học khác.
Tính phần trăm nguyên tố hydrogen có trong Mặt Trời.
Trả lời: . . . . . . . .
Câu 15. Bổ sung các thông tin để hoàn thành bảng sau Khối lượng Kí hiệu hóa
Cấu tạo nguyên tử của nguyên tố Nguyên tố nguyên tử học
Số proton Số neutron Calcium 20 20 Ne 10 10 P 15 31 Aluminium 13 14
Câu 16. Hãy cho biết vị trí của nguyên tố Y trong bảng tuần hoàn, biết vỏ nguyên tử
của nguyên tố Y có 2 lớp electron, trong đó lớp ngoài cùng có 4 electron. Từ đó cho
biết Y là kim loại, phi kim hay khí hiếm?
Câu 17. Biết nguyên tử của nguyên tố M có 3 lớp electron và có 2 electron ở lớp ngoài cùng.
a) Hãy xác định vị trí của M trong bảng tuần hoàn (ô, chu kì, nhóm) và cho biết M là
kim loại, phi kim hay khí hiếm.
b) Vẽ mô hình nguyên tử M.
Câu 18*. Tổng số proton, neutron và electron của nguyên tử X là 10.
a) Xác định số proton, số neutron, số electron của nguyên tử X. Biết trong nguyên tử X,
số neutron lớn hơn số electron và nhỏ hơn 1,5 lần số electron.
b) Xác định số đơn vị điện tích hạt nhân của X.
c) Tính khối lượng nguyên tử X.
d) Cho biết nguyên tử X có bao nhiêu lớp electron và xác định số electron lớp ngoài cùng của X.
ĐÁP ÁN HƯỚNG DẪN GIẢI CHI TIẾT PHIẾU SỐ 1 Câu 1 2 3 4 5 6 7 8 9 Đáp án B C B B B D C B C Câu 6.
Nguyên tố hóa học là tập hợp những nguyên tử cùng loại, có cùng số proton trong hạt nhân.
A, C đều thuộc cùng một nguyên tố vì có cùng số proton là 17.
Các nguyên tố hóa học khác: B, D, E.
Câu 7. Trong nguyên tử của nguyên tố X có: p n e 28 n 10 n 35,7% p ( n ) e p 9
Vậy nguyên tử X cần tìm là Fluorine (p = 9)
Câu 8. Nguyên tố Mg thuộc chu kì 3 nên có 3 lớp electron. Câu 10.
a) sai vì các hạt electron được tìm thấy ở vỏ nguyên tử.
b) sai vì hạt neutron không mang điện nên không hút được electron. c) đúng.
d) sai vì phần lớn khối lượng của nguyên tử tập trung ở hạt nhân nên khối lượng của
hạt nhân gần bằng khối lượng của nguyên tử. Câu 11.
a) sai vì số thứ tự của chu kì được đánh số từ 1 đến 7, không dùng số La mã. b) Đúng
c) Đúng vì Các nguyên tố kim loại gồm:
+ Hầu hết các nguyên tố thuộc nhóm IA, IIA, IIIA và một số nguyên tố nhóm IVA, VA, VIA.
+ Các nguyên tố thuộc nhóm IB đến VIIIB, các nguyên tố lanthanide và các nguyên tố
actinide được xếp riêng thành 2 hàng ở cuối bảng.
d) sai vì hiện tại các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần
điện tích hạt nhân nguyên tử. Câu 12. Trả lời: 6
Số hiệu nguyên tử bằng số hạt proton mà số hạt proton bằng số hạt electron trong nguyên tử. Câu 13. Trả lời: 7 Câu 14.
Phần trăm của các nguyên tố hóa học ngoài hydrogen và helium có trong Mặt Trời là: 100% - 25% - 2% = 73%. Trả lời: 73% Câu 15 Khối lượng Kí hiệu hóa
Cấu tạo nguyên tử của nguyên tố Nguyên tố nguyên tử học
Số proton Số neutron Số electron Calcium Ca 20 20 20 40 Neon Ne 10 10 10 20 Phosphorus P 15 16 15 31 Aluminium Al 13 14 13 27 Câu 16.
Y có số electron = 2 + 4 = 6 electron.
Vậy số hiệu nguyên tử Y là 6, Y thuộc ô thứ 6 trong bảng tuần hoàn.
Y có 2 lớp electron nên thuộc chu kì 2; lớp ngoài cùng có 4 electron nên thuộc nhóm IVA.
Vì Y thuộc nhóm IVA, chu kì 2 nên Y là phi kim. Câu 17.
Nguyên tử của nguyên tố M có 2 electron ở lớp ngoài cùng ⇒ thuộc nhóm IIA.
- Có 3 lớp electron ⇒ thuộc chu kì 3.
+ Lớp thứ nhất có 2 electron.
+ Lớp thứ hai có 8 electron.
+ Lớp thứ ba (lớp ngoài cùng) có 2 electron.
⇒ Nguyên tử của nguyên tố M có 12 electron
⇒ Thuộc ô số 12 trong bảng tuần hoàn. M là kim loại. b)
Câu 18. Gọi số proton, electron và neutron trong X lần lượt là P, E, N.
Nguyên tử trung hòa về điện nên E = P.
Tổng số proton, neutron và electron của nguyên tử X là 10 nên:
P + N + E = 10 hay 2E + N = 10 hay N = 10 – 2E.
Trong nguyên tử X, số neutron lớn hơn số electron và nhỏ hơn 1,5 lần số electron nên: E < N < 1,5E (1)
Thay N = 10 – 2E vào (1) ta được: E < 10 – 2E < 1,5E ⇒ 3E < 10 < 3,5E 10 E 3,33 3E 10 3 3,5E 10 10 E 2,86 3,5
Do số electron là số nguyên dương nên E = 3 ( = P) thỏa mãn. Vậy N = 4.
Số proton, neutron và electron của nguyên tử X lần lượt là 3, 4, 3.
b) Số đơn vị điện tích hạt nhân của X = số proton = 3.
c) Khối lượng nguyên tử X: 3.1 + 4.1 = 7 (amu).
d) Nguyên tử X có 3 electron được phân bố vào hai lớp:
- Lớp thứ nhất (gần hạt nhân nhất) có 2 electron.
- Lớp thứ hai (lớp ngoài cùng) có 1 electron.
PHIẾU ÔN TẬP SỐ 2
Câu 1. Các hạt cấu tạo nên hầu hết các nguyên tử là
A. Electron và neutron. B. Proton và neutron
C. Neutron và electron.
D. Electron, proton và neutron
Câu 2. Dãy nào sau đây gồm các nguyên tố là kim loại khí hiếm? A. F, Cl, Br, I. B. Mg, Ca, Sr, Ba. C. He, Ne, Ar, Kr. D. Li, Na, K, Rb.
Câu 3. Trong ô nguyên tố sau, con số 23 cho biết điều gì?
A. Khối lượng nguyên tử của nguyên tố. B. Chu kì của nó.
C. Số nguyên tử của nguyên tố.
D. Số thứ tự của nguyên tố.
Câu 4. Nguyên tử X có 11 proton và 12 neutron. Tổng số hạt trong nguyên tử X là A. 23. B. 34. C. 35. D. 46.
Câu 5. Nguyên tử X có 9 electron, lớp ngoài cùng nguyên tử X có số electron là A. 1. B. 2. C. 7. D. 8
Câu 6. Khối lượng của các hạt dưới nguyên tử (proton, neutron) được đo bằng đơn vị A. gam. B. amu. C. mL. D. kg.
Câu 7. Trong hạt nhân nguyên tử lưu huỳnh (sulfur) có 16 proton. Số electron trong
các lớp của vỏ nguyên tử sulfur, viết từ lớp trong ra lớp ngoài, lần lượt là A. 2, 10, 6. B. 2, 6, 8. C. 2, 8, 6. D. 2, 9, 5.
Câu 8. Kí hiệu nào sau đây là kí hiệu hóa học của nguyên tố magnesium? A. MG. B. Mg. C. mg. D. Mg
Câu 9. Các nguyên tố phi kim không thuộc nhóm nào sau đây trong bảng tuần hoàn các nguyên tố hóa học? A. Nhóm IA. B. Nhóm IVA. C. Nhóm IIA. D. Nhóm VIIA.
Câu 10. Phát biểu nào sau đây đúng, phát biểu nào sau đây sai? Phát biểu Đúng Sai
a) Khối lượng của một nguyên tử bằng tổng số proton của nguyên tử đó.
b) Tất cả nguyên tử của các nguyên tố nhóm VA đều có 5
electron ở lớp ngoài cùng.
d) Số thứ tự của nhóm bằng số lớp electron trong nguyên tử của
các nguyên tố thuộc nhóm đó.
d) Trong nguyên tử, các electron được xếp theo từng lớp. Các
electron được sắp xếp lần lượt vào các lớp theo chiều từ gần hạt
nhân ra ngoài. Mỗi lớp electron có một số electron nhất định.
Câu 11. Phát biểu nào sau đây đúng, phát biểu nào sau đây sai? Phát biểu Đúng Sai
a) Nguyên tử trung hòa về điện.
b) Khối lượng nguyên tử tập trung chủ yếu ở hạt nhân.
c) Trong nguyên tử, số hạt mang điện tích dương bằng số hạt
mang điện tích âm nên số hạt electron bằng số hạt neutron.
d) Vỏ nguyên tử, gồm các lớp electron có khoảng cách khác nhau đối với hạt nhân.
Câu 12. Cho các nguyên tố hóa học sau: H; Mg; B; Na; S; O; P; Ne; He; Al. Số
nguyên tố nào thuộc cùng một chu kì 3 là?
Trả lời: . . . . .
Câu 13. Biết rằng 4 nguyên tử magnesium nặng bằng 3 nguyên tử nguyên tố X. Kí
hiệu hóa học của nguyên tố X là? Trả lời: . . . . .
Câu 14. Thêm 5 amu cho khối lượng nguyên tử của nguyên tố X để nguyên tử khối
của nó bằng 2 lần nguyên tử khối của oxygen. X là? Trả lời: . . . . .
Câu 15. Điền từ thích hợp vào chỗ trống:
nguyên tử; neutron; electron; proton; lớp vỏ electron; hạt nhân.
a) Thành phần chính tạo nên mọi vật chất được gọi là (1) ……. Nguyên tử được tạo
nên từ (2) ……….và (3) ………….
b) (4) …………. nằm ở trung tâm nguyên tử. Hạt nhân được tạo bởi (5) …………. và (6) …………
c) Các hạt mang điện tích dương trong hạt nhân nguyên tử được gọi là (7) ………. và
các hạt không mang điện tích được gọi là (8) ………….
d) (9) ………… chuyển động quanh hạt nhân nguyên tử.
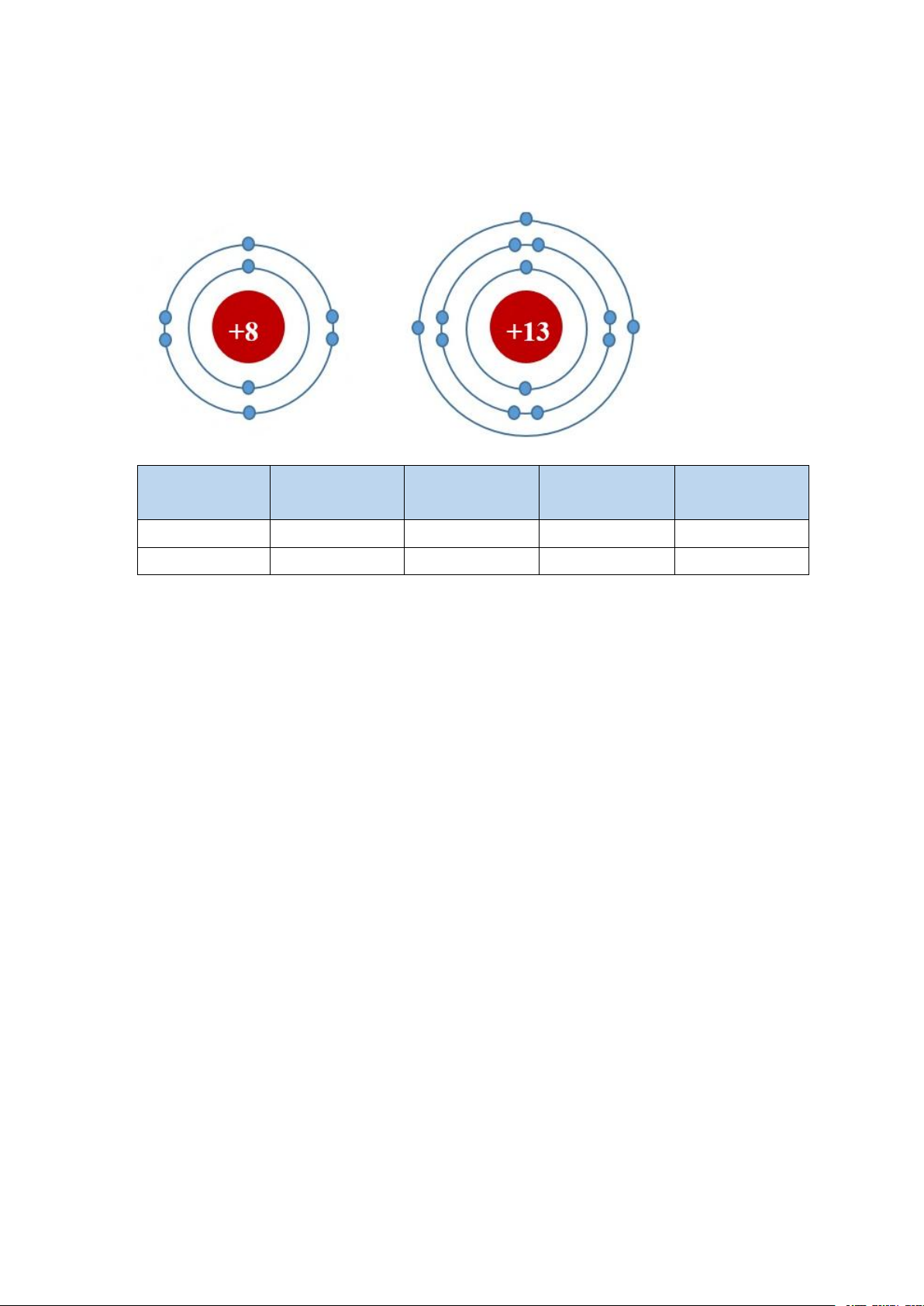
Câu 16. Vẽ sơ đồ cấu tạo các nguyên tử có số hạt mang điện tích dương trong hạt nhân
là 8, 13. Từ những sơ đồ đó có thể cho ta biết những thông tin gì về các nguyên tử đó?
Câu 17. Trong tự nhiên có hai loại nguyên tử đều thuộc cùng một nguyên tố hoá học
là Ne (Z = 10). Một loại là các nguyên tử Ne có khối lượng nguyên tử là 20 amu và
loại còn lại là các nguyên tử Ne có khối lượng nguyên tử là 22 amu.
a) Hạt nhân của nguyên tử Ne có khối lượng 22 amu có bao nhiêu hạt proton và neutron?
b) Hãy giải thích vì sao hai loại nguyên tử đó đều thuộc cùng một nguyên tố hoá học Ne?
Câu 18. Tổng số proton, neutron và electron của nguyên tử X là 46. Trong đó số hạt
mang điện nhiều hơn số hạt không mang điện là 14.
a) Tính số proton, số neutron, số electron của nguyên tử X.
b) Tính khối lượng nguyên tử X.
c) Cho biết nguyên tử X có bao nhiêu lớp electron và chỉ ra số electron trên mỗi lớp.
ĐÁP ÁN HƯỚNG DẪN TRẢ LỜI PHIẾU SỐ 2 Câu 1 2 3 4 5 6 7 8 9 Đáp án D C A B C B C B C Câu 4.
Vì p = e nên số electron = 11
Tổng số hạt trong nguyên tử X là: 11 + 11 + 12 = 34. Câu 5. Nguyên tử X có 9 electron
Lớp thứ nhất có tối đa 2 e
Lớp thứ hai có tối đa 8 e
Vậy thì lớp ngoài cùng có: 9 – 2 = 7 electron Câu 10.
a) sai vì khối lượng nguyên tử được coi bằng tổng khối lượng của proton và
neutron có trong nguyên tử. b) Đúng
c) sai vì số thứ tự của nhóm A bằng số electron lớp ngoài cùng trong nguyên tử của
nguyên tố thuộc nhóm đó. d) Đúng Câu 11.
Các phát biểu đúng là: a); b); d).
Phát biểu (c) sai vì số hạt proton bằng số hạt electron. Câu 12. Trả lời: 3 Câu 13. Trả lời: S Theo bài ra ta có: (NTK Mg). 4 = (NTK X).3
⇔ 24 . 4 = (NTK X).3 ⇔ NTK X = 32 (amu).
Vậy nguyên tố X là lưu huỳnh (sulfur), kí hiệu là S. Câu 14. Trả lời: Al
Nguyên tử oxygen có khối lượng nguyên tử là 16 amu
Nguyên tử X có khối lượng nguyên tử 16.2 – 5 = 27 amu. Nguyên tử X là Al Câu 15
a) Thành phần chính tạo nên mọi vật chất được gọi là (1) nguyên tử. Nguyên tử được
tạo nên từ (2) hạt nhân và (3) lớp vỏ electron.
b) (4) Hạt nhân nằm ở trung tâm nguyên tử. Hạt nhân được tạo bởi (5) proton và (6) neutron.
c) Các hạt mang điện tích dương trong hạt nhân nguyên tử được gọi là (7) proton và
các hạt không mang điện tích được gọi là (8) neutron.
d) (9) Electron chuyển động quanh hạt nhân nguyên tử. Câu 16.
Sơ đồ cấu tạo các nguyên tử X và Y có số hạt mang điện tích dương trong hạt nhân lần lượt là 8, 13 Số p trong hạt số e trong số lớp số e lớp ngoài nhân nguyên tử electron cùng X 8 8 2 6 Y 13 13 3 3 Câu 17. Hướng dẫn
a) Hạt nhân của nguyên tử Ne khối lượng 22 amu có 10 proton và 12 neutron. Giải thích:
+ Số proton = số hiệu nguyên tử = 10.
+ Số neutron = 22 – 10 = 12.
b) Hai loại nguyên tử đó đều có cùng số proton trong hạt nhân là 10, nên thuộc cùng
một nguyên tố hóa học là Ne. Câu 18.
a) Gọi số hạt proton, neutron và electron trong nguyên tử X lần lượt là P, N và E.
Nguyên tử trung hòa về điện nên E = P (1)
Tổng số proton, neutron và electron của nguyên tử X là 46 nên P + N + E = 46 (2
Thay E = P vào (2) ta được 2P + N = 46 hay N = 46 – 2P (3)
Trong X số hạt mang điện nhiều hơn số hạt không mang điện là 14 nên: (P + E) – N = 14 (4)
Thay E = P; N = 46 – 2P vào (4) ta được:
2P – (46 – 2P) = 14 ⇒ P = 15 (= E) Vậy N = 46 – 2.15 = 16.
Số hạt proton, electron và neutron của X lần lượt là 15, 15, 16.
b) Khối lượng nguyên tử X là: 15 . 1 + 16 . 1 = 31 (amu)
c) Nguyên tử X có 15 electron được sắp xếp vào 3 lớp.
- Lớp thứ nhất (gần hạt nhân nhất) có 2 electron.
- Lớp thứ hai có 8 electron.
- Lớp thứ ba (lớp ngoài cùng) có 5 electron.
NỘI DUNG 2: PHÂN TỬ - LIÊN KẾT HÓA HỌC
PHIẾU ÔN TẬP SỐ 1
Câu 1. Lõi dây điện bằng đồng chứa A. các phân tử Cu2.
B. các nguyên tử Cu riêng rẽ không liên kết với nhau.
C. rất nhiều nguyên tử Cu liên kết với nhau.
D. một nguyên tử Cu.
Câu 2. Trong số các chất dưới đây, chất nào thuộc loại đơn chất A. Nước. B. Muối ăn. C. Thủy ngân. D. Khí cacbonic.
Câu 3. Cho các chất sau: Ca, O2, P2O5, HCl, Na, NH3, Al đâu là đơn chất A. Ca, O2, Na, Al. B. Ca, O, HCl, NH3. C. HCl, P2O5, Na, Al. D. NH3, HCl, Na, Al.
Câu 4. Nguyên tố X có nguyên tử khối bằng 3,5 lần nguyên tử khối của oxi. X là nguyên tố nào sau đây? A. Ca B. Na C. K D. Fe
Câu 5. Liên kết giữa các nguyên tử trong phân tử muối ăn là liên kết A. cộng hóa trị. B. ion. C. phi kim. D. kim loại
Câu 6. Cho biết phân tử Calcium chloride được tạo thành 1 nguyên tử Ca và 2 nguyên
tử Cl. Liên kết ion trong phân tử hình thành từ 2 ion sau: A. Ca+ và Cl2- B. Ca+ và Cl- C. Ca2+ và Cl- D. Ca2+ và Cl2
Câu 7. Hóa trị của các nguyên tố sau: O, Na, Al trong hợp chất lần lượt là: A. I, II, III B. III, II, I C. II, I, III D. II, III, I.
Câu 8. Muối ăn (sodium chloride) được tạo nên từ 2 nguyên tố hóa học là Na ( Sodium)
và Cl (Chlorine). Biết Na hóa trị I, Cl: hóa trị I. Vậy công thức hóa học của muối ăn là: A. NaCl. B. Na2Cl. C.Na2Cl2 D. NCl
Câu 9. Biết N có hoá trị IV, hãy chọn công thức hoá học phù hợp với qui tác hoá trị
trong đó có các công thức sau: A. NO B. N2O C. N2O3 D. NO2
Câu 10. Mỗi phát biểu sau là đúng hay sai? Phát biểu Đúng Sai
a) Cách biểu diễn công thức hóa học của kim loại và khí hiếm giống nhau
b) Công thức hóa học của các đơn chất phi kim trùng với kí hiệu nguyên tố hóa học.
c) Dựa vào công thức hóa học, ta luôn xác định được hóa trị của các nguyên tố.
d) Các chất có cùng khối lượng phân tử thì có cùng công thức hóa học.
Câu 11. Phát biểu nào sau đây đúng, phát biểu nào sau đây sai? Phát biểu Đúng Sai
a) Trong hợp chất, kim loại luôn nhường electron, phi kim luôn nhận electron.
b) Trong phân tử, hợp chất gồm các nguyên tố C, H, O chỉ có liên kết cộng hóa trị.
c) Hợp chất của kim loại khó bay hơi, khó nóng chảy, dễ tan
trong nước tạo thành dung dịch dẫn được điện.
d) Đường tinh luyện và muối ăn đều là chất rắn tan được trong
nước tạo dung dịch dẫn điện.
Câu 12. Silicon dioxide có công thức hóa học là SiO2 là thành phần chính của cát
thạch anh. Hóa trị của Si trong silicon dioxide là (biết trong silicon dioxide O có hóa trị II)
Trả lời: . . . . . . . .
Câu 13. Trong các chất sau đây: khí oxygen, carbon dioxide, khí nitrogen, nước, muối
ăn, đồng, nhôm. Số chất là hợp chất là?
Trả lời: . . . . . . . .
Câu 14. Phân tử glycerol chứa ba nguyên tử carbon, tám nguyên tử hydrogen và ba
nguyên tử oxygen. Khối lượng phân tử của glycerol là bao nhiêu amu?
Trả lời: . . . . . . . .
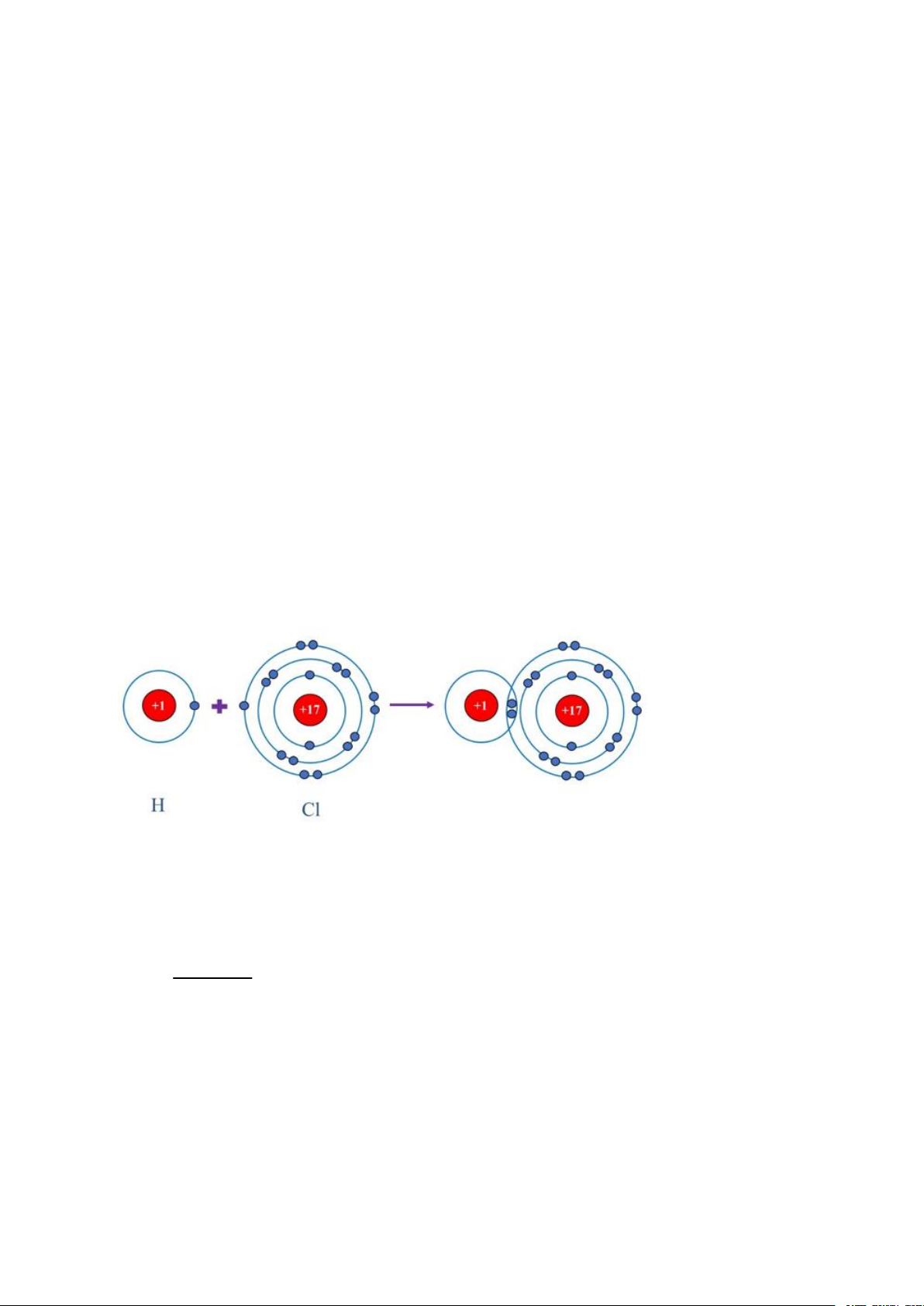
Câu 15. Vẽ sơ đồ mô tả sự hình thành liên kết cộng hóa trị trong phân tử hydrogen chloride (HCl).
Câu 16. Một oxide có công thức XOn, trong đó X chiếm 30,43% (khối lượng); Biết
khối lượng phân tử của oxide bằng 46 amu. Xác định công thức hóa học của oxide trên.
Câu 17. Lập công thức hóa học của hợp chất tạo bởi sulfur và oxygen, trong đó sulfur
chiếm 40% về khối lượng còn lại là oxi, biết khối lượng phân tử của hợp chất là 80 amu.
Câu 18*. Để pháo hoa có nhiều màu sắc khác nhau, người ta sẽ cho vào thuốc pháo
các chất phụ gia tạo màu. Các chất phụ gia này thường là các muối của một số kim loại,
trong đó có muối (D) gồm 1 nguyên tử kim loại M và 2 nguyên tử Cl; biết (D) có khối
lượng phân tử là 135 amu. Tra bảng tuần hoàn, hãy xác định kim loại M. Trong phân
tử muối (D) có loại liên kết gì? Giải thích. .
ĐÁP ÁN HƯỚNG DẪN GIẢI CHI TIẾT PHIẾU SỐ 1 Câu 1 2 3 4 5 6 7 8 9 Đáp án C C A D B C C A D Câu 10. a) Đúng
b) Sai, ví dụ đơn chất oxygen: O2 còn kí hiệu nguyên tố oxygen là O. c) Đúng
d) Sai, vì có nhiều chất trùng khối lượng phân tử nhưng công thức hóa học khác nhau,
ví dụ: carbon dioxide (CO2) và dinitrogen oxide (N2O) đều có cùng khối lượng phân tử là 44 amu. Câu 11.
a) sai vì trường hợp 2 nguyên tử của 2 nguyên tố phi kim góp chung electron tạo liên kết cộng hóa trị b) Đúng c) Đúng
d) sai vì dung dịch nước đường không dẫn điện. Câu 12. Trả lời: IV
Gọi hóa trị của Si trong hợp chất SiO2 là a.
Áp dụng quy tắc hóa trị ta có: 1.a = 2.II → a = IV
Vậy trong phân tử silicon dioxide, Si có hóa trị IV. Câu 13. Trả lời: 3
Hợp chất là những chất do hai hoặc nhiều nguyên tố hóa học tạo thành.
Các hợp chất là: carbon dioxide, nước, muối ăn. Câu 14. Trả lời: 92
Khối lượng phân tử glycerol là:
3 × 12 + 1 × 8 + 3 × 16 = 92 amu Câu 15. Câu 16. Theo đề bài ta có:
KLPT (XOn) = KLNT (X) + 16 × n = 46 amu (1) Mặt khác trong XOn có: KLNT(X %X ) .100% 30,43% KLNT X ( )14 46
Thay KLNT (X) vào (1) được n = 2.
Vậy công thức của oxide là NO2. Câu 17.
Gọi công thức hóa học của hợp chất tạo bởi lưu huỳnh và oxygen là SxOy.
Khối lượng phân tử của hợp chất là: x.32 + y.16 = 80 (amu)
Phần trăm khối lượng của các nguyên tố trong hợp chất là: . x 32.100% %S 40% x 1 80 . y 16.100% %O 60% y 3 80
Vậy công thức hóa học của hợp chất tạo bởi lưu huỳnh và oxygen là SO3.
Câu 18. Khối lượng phân tử (D) = khối lượng nguyên tử (M) + x. khối lượng nguyên tử (Cl)
Với x là số nguyên tử Cl.
Thay số vào ta được: 135 = khối lượng nguyên tử (M) + x . 35,5
+ Với x = 1, khối lượng nguyên tử (M) = 99,5 amu (loại)
+ Với x = 2, khối lượng nguyên tử (M) = 64 amu (thỏa mãn). Vậy M là Cu.
Vì phân tử (D) chứa Cu và Cl nên trong phân tử (D) có liên kết ion.
PHIẾU ÔN TẬP SỐ 2
Câu 1. Cho các chất sau:
1) Khí nitrogen do nguyên tố N tạo nên;
2) Khí carbon dioxide do 2 nguyên tố C và O tạo nên;
3) Sodium hydroxide được tạo thành từ 3 nguyên tố Na, O và H.
4) Sulfur được tạo thành từ nguyên tố S.
Trong những chất trên, chất nào là đơn chất? A. (1), (2). B. (2), (3). C. (3), (4). D. (1), (4)
Câu 2. Phân tử nước chứa hai nguyên tử hydrogen và một oxygen. Nước là. A. một hợp chất. B. một đơn chất. C. một hỗn hợp.
D. một nguyên tố hóa học.
Câu 3. Phân tử khối của Cu gấp bao nhiêu lần phân tử khối của oxygen? A. 4 lần. B. 32 lần. C. 2 lần. D. 64 lần
Câu 4. Ở điều kiện thường, phát biểu nào sau đây là đúng?
A. Tất cả các hợp chất ở thể rắn đều là chất ion.
B. Chất cộng hóa trị luôn ở thể rắn.
C. Chất chỉ có liên kết cộng hóa trị là chất cộng hóa trị và luôn ở thể khí.
D. Hợp chất có chứa kim loại thường là chất ion.
Câu 5. Nguyên tử các nguyên tố có xu hướng tham gia liên kết hóa học để đạt được electron ngoài cùng giống A. Kim loại. B. Khí hiếm. C. Đơn chất. D. Phi kim
Câu 6. Chất nào sau đây là chất cộng hóa trị A. Potassium chloride. B. Calcium chloride. C. Nitrogen. D. Sodium oxide
Câu 7. Khi hình thành phân tử calcium chloride, nguyên tử Ca (calcium)
A. nhường 2 electron cho nguyên tử chlorine.
B. nhận 1 electron từ nguyên tử chlorine.
C. nhường 1 electron cho nguyên tử chlorine.
D. nhận 2 electron từ nguyên tử chlorine.
Câu 8. Nguyên tố X có hoá trị III, công thức của muối sunfat là: A. XSO4 B. X(SO4)3 C. X2(SO4)3 D. X3SO4
Câu 9. Nguyên tố N chiếm 46.66% trong công thức hóa học nào sau đây? A. N2O5 B. NO2 C. NO D. N2O3.
Câu 10. Phát biểu nào sau đây đúng, phát biểu nào sau đây sai? Phát biểu Đúng Sai
a) Trong hợp chất gồm các nguyên tố C, H, O thì O luôn có hóa trị bằng II.
b) Tùy thuộc vào nguyên tử liên kết với nguyên tố P mà hóa trị
của P có thể bằng III và bằng V
c) Trong các hợp chất gồm nguyên tố S và nguyên tố O thì S luôn có 1 hóa trị.
d) Nguyên tố H và nguyên tố Cl đều có hóa trị bằng I trong các hợp chất.
Câu 11. Phát biểu nào sau đây đúng, phát biểu nào sau đây sai? Phát biểu Đúng Sai
a) Hợp chất ion và chất cộng hóa trị đều bền với nhiệt.
b) Tất cả các chất ion đều tan trong nước và tạo thành dung dịch có khả năng dẫn điện.
c) Khi đun sodium chloride rắn ở nhiệt độ cao sẽ được sodium
chloride lỏng, dẫn điện.
d) Để tạo ion dương thì nguyên tử của nguyên tố phi kim sẽ nhận
thêm electron để có đủ 8 electron ở lớp electron ngoài cùng.
Câu 12. Trong các chất hóa học: Li, N2, CO, Cl2, S8, NaCl, số chất là đơn chất là?
Trả lời: . . . . .
Câu 13. Trong mật ong có nhiều fructose. Phân tử frutose gồm 6 nguyên tử C, 12
nguyên tử H và 6 nguyên tử O. Khối lượng phân tử frutose là: Trả lời: . . . . .
Câu 14. : Cho biết công thức hóa học của hợp chất được tạo bởi hai nguyên tố X và O
(oxygen); Y và H (hydrogen) lần lượt là XO và YH3. Công thức hóa học của hợp chất
giữa X với Y, biết X và Y có hóa trị bằng hóa trị của chúng trong các chất XO và YH3. Trả lời: . . . . .
Câu 15. Một oxide có công thức XOn, trong đó X chiếm 30,43% (khối lượng); Biết
khối lượng phân tử của oxide bằng 46 amu. Xác định công thức hóa học của oxide trên.
Câu 16. . Hãy vẽ sơ đồ hình thành liên kết ion trong các phân tử sau, sử dụng các dấu
chấm để biểu diễn các electron a) Lithium fluoride (LiF). b) Calcium oxide (CaO). c) Potassium oxide (K2O).
Câu 17. Hợp chất (E) là oxide của nguyên tố M có hóa trị VI. Biết (E) có khối lượng
phân tử bằng 80 amu và có 60% oxygen. Hãy xác định công thức hóa học của hợp chất E.
Câu 18. Trong khí thải nhà máy (hình bên) có các oxide của carbon và sulfur (cùng hoá trị).
a) Hãy xác định công thức hoá học của các hợp chất này và tính khối lượng phân tử của chúng.
b) Trong phân tử của các hợp chất trên có chứa loại liên kết hoá học gì?
ĐÁP ÁN HƯỚNG DẪN TRẢ LỜI PHIẾU SỐ 2 Câu 1 2 3 4 5 6 7 8 9




