

















Preview text:
lO M oARcPSD| 47669111
Ngô Phước Long A2K73 MK73 HUP
CHƯƠNG I ĐẠI CƯƠNG VỀ ĐỘC CHẤT HỌC Mục tiêu:
1. Trình bày nội dung, nhiệm vụ của Độc chất học.
2. Trình bày các nguyên nhân gây ngộ ộc, tác ộng của chất ộc lên cơ quan của cơ thể, các
yếu tố ảnh hưởng ến ộc tính của các chất ộc.
3. Mô tả các yếu tố ảnh hưởng ến sự phân bố, chuyển hó a, thải trừ của chất ộc khỏi cơ thể.
4. Giải thích các nguyên tắc cơ bản trong xử trí ngộ ộc.
I. ĐỘC CHẤT VÀ NHIỆM VỤ CỦA ĐỘC CHẤT HỌC
Nội dung và nhiệm vụ của Độc chất học
- Phục vụ cho công tác phòng bệnh và phòng chống ô nhiễm môi trường:
+ Xây dựng tiêu chuẩn vệ sinh môi trường ề phòng nhiễm ộc cho người.
+ Kiểm tra, giám sát việc thực hiện các tiêu chuẩn vệ sinh ã xây dựng.
+ Hoàn thiện các phương pháp phân tích ã có, ề xuất các phương pháp mới ể phát hiện và
xác ịnh hàm lượng các chất ộc..
+ Đề xuất các phương pháp khử ộc tránh ô nhiễm môi trường.
- Phục vụ công tác iều trị và cấp cứu ngộ ộc:
+ Khi bị ngộ ộc, phân tích chất ộc giúp cho việc chuẩn oán, phát hiện nhanh nguyên nhân
ngộ ộc ể có biện pháp cấp cứu iều trị chính xác kịp thời, nâng cao hiệu quả cứu chữa người bệnh.
+ Phân tích ộc chất giúp phòng ngộ ộc thuốc trong quá trình iều trị, xác ịnh loại và nồng ộ
chất ộc trong dịch sinh học như máu, nước tiểu...
- Phục vụ công tác tư pháp: trường hợp nghi nạn nhân bị ầu ộc ến tử vong (hay bị ngộ ộc nặng).
II. CHẤT ĐỘC VÀ SỰ NGỘ ĐỘC
1. Khái niệm chất ộc
- Chất ộc: khi ưa và cơ thể một lượng nhỏ trong iều kiện nhất ịnh sẽ gây ngộ ộc hoặc dẫn ến
tử vong. Ngộ ộc: sự rối loạn hoạt ộng sinh lý của cơ thể dưới tác dụng của chất ộc.
2. Các yếu tố ảnh hưởng ến ộc tính 2.1. Độc tính
- Độc tính: liều lượng mô tả tính chất gây ộc của một chất với cơ thể.
- Độc lực: mối quan hệ giữa liều lượng chất gây ộc và áp ứng của cơ thể bị ngộ ộc.
+ ED50: liều có tác dụng với 50% ĐVTN.
+ Liều tối a không gây ộc: liều lớn nhất không gây biến ổi cho cơ thể về mặt huyết học, hóa
học lâm sàng hoặc bệnh lý. lO M oARcPSD| 47669111
Ngô Phước Long A2K73 MK73 HUP
+ Liều thấp nhất có thể gây ộc: gấp ôi liều không gây chết ĐVTN.
+ Liều giới hạn: cơ thể vẫn chịu ựng ược và không gây ra những tổn thương thực thể.
+ Liều gây ộc: liều tạo biến ổi bệnh lý (gấp ôi liều gây chết ĐVTN).
+ Liều gây chết (LD) – liều ộc cấp tính (LD50): liều gây chết 50% ĐVTN.
+ Nồng ộ gây chết (chất ộc thể khi, hơi), ơn vị mg/l, hay mg/m3
2.2. Các yếu tố ảnh hưởng ến ộc tính - Yếu tố chủ quan:
+ Loài: mỗi loài có một liều ộc riêng, không thể suy từ loài này sang loài khác.
+ Tuổi, giới tính, cân nặng: non ít ảnh hưởng hơn già về ường chuyển hóa, nhưng nặng hơn về mặt TKTW.
+ Độ nhạy cảm của từng cá thể.
+ Trạng thái cơ thể: no, ói, mệt, có thai, bệnh tật. - Yếu tố khách quan:
+ Đường dùng, cách dùng: tiêm vào máu, hít vào phổi tác ộng nhanh hơn. + Dạng dùng.
+ Tốc ộ ưa thuốc vào cơ thể.
+ Việc sử dụng ồng thời: gây tác dụng hiệp ồng hay ối kháng.
+ Sự quen thuốc: dùng nhiều lần có thể chịu ựng ược liều ộc nhất ịnh.
2.3. Phân loại chất ộc
- Theo nguồn gốc: thiên nhiên, bán tổng hợp, tổng hợp. - Theo tính chất lý hóa:
+ Trạng thái: rắn, lỏng, khí. + Vô cơ. + Hữu cơ. - Theo ộc tính.
- Theo phương pháp phân lập mẫu và phát thải chất ộc:
+ Theo phương pháp phân lập mẫu: cất kéo hơi nước, cồn acid, chiết với dung môi hữu cơ,
vô cơ hóa mẫu thử, thẩm tích, ặc biệt,… + Theo phát thải chất ộc:
- Theo cơ quan chịu tác ộng.
- Theo tác ộng của chất ộc: gây ung thư, biến ổi gen, quái thai,…
- Theo mục ích sử dụng chất ộc: dung môi, thuốc trừ sâu, chất phụ gia thực phẩm,…
2.4. Ngộ ộc và nguyên nhân gây ngộ ộc
2.4.1. Khái niệm ngộ ộc
- Ngộ ộc: là sự rối loạn hoạt ộng sinh lý của cơ thể dưới tác dụng của c hất ộc. - Phân loại:
theo thời gian xảy ra ngộ ộc: lO M oARcPSD| 47669111
Ngô Phước Long A2K73 MK73 HUP
+ Ngộ ộc cấp tính: biểu hiện ngộ ộc xảy ra rất sớm (< 24h).
+ Ngộ ộc bán cấp: xảy ra sau nhiều ngày, có khi sau 1-2 tuần. Sau khi iều trị, khỏi nhanh
nhưng thường ể lại di chứng.
+ Ngộ ộc mạn tính: chỉ xuất hiện sau nhiều lần phơi nhiễm với chất ộc (hàng tháng, hàng
năm) khó iề u tr ị .
Tùy theo liều và ườ ng nhi ễm ộc mà các chất ộc có thể gây ra ngộ ộ c v ới các cấp ộ c khác nhau.
2.4.2 . Nguy ên nhân gây ngộ ộ c - Do nh ầ m l ẫ n. - Do ngh ệ nghi ệ p.
- Do ô nhiễm môi trườ ng. - Do th ự c ph ẩ m.
- Do c ố tình tự sát hay bị ầu ộ c.
III. ĐỘC ĐỘ NG H ỌC VÀ ĐỘ C L Ự C H Ọ C
Độc ộ ng h ọc: nghiên cứu quá trình xâm nhậ p, h ấp thu, phân bố , chuy ển hóa, thả i tr ừ c ủ a ch ấ t ộ c.
Độ c l ự c h ọc: nghiên cứ u:
- Tương tác của chát ộ c v ớ i v ị trí tấn công ặ c hi ệ u.
- Xác ị nh v ị trí ặ c hi ệ u c ủ a m ỗ i ch ất ộc, ái lự hóa họ c gi ữa 2 thành phần ó.
- M ối liên quan củ a n ồng ộ ch ất ộ c t ạ i ch ỗ .
Tìm thuố c ch ống ộc ặ c hi ệ u.
1 . H ấ p thu - Qua da và niêm mạ c. - Qua ường tiêu hóa . - Qua ường hô hấ p. - Qua ường tiêm .
biện pháp thích hợp ể ngăn cản hoặc hạn chế lượng chất ộc hấp thu vào máu. 2. Phân bố
- Sau khi vào cơ thể, chất ộc ược máu (kết hợp với protein) ưa ến các tổ chức và gây ộc.
- Hiểu biết phân bố chất ộc trong cơ thể giúp:
+ Giải thích triệu chứng ngộ ộc.
+ Chọn mẫu thử thích hợp ể phân tích chất ộc.
- Sự phân bố chất ộc ến các tổ chức tùy thuộc:
+ Tính chất của chất ộc: tan trong nước/lipid. lO M oARcPSD| 47669111
Ngô Phước Long A2K73 MK73 HUP
+ Ái lực của chất ộc với các loại mô: fluor, kim loại nặng.
+ Khả năng tích lũy của tổ chức với chất ộc. + Cấp ộ ngộ ộc. 3. Chuyển hóa
Phần lớn tạo thành sản phẩm không ộc hoặc ít ộc hơn và dễ ào thải hơn ra khỏi cơ thể. 3.1. Oxy hóa khử
- Oxy hóa: nitrit nitrat; CH3OH, C2H5OH oxy hóa thành CO2, H2O; toluen acid benzoic,…
- Khử: cloralhydrat tricloroethanol; dẫn xuất nitro amin,… 3.2. Thủy phân
- Với ester, amid, carbamate.
3.3. Các phản ứng liên hợp - Với sulfat.
- Với acid glucuronic: phản ứng với các -OH như alcol, phenol tạo thành các glucuronic bền trong kiềm. - Với glutathion
- Với nhóm thiol: một số chất ộc liên kết với nhóm -SH như As, Hg, benzen,… - Với acid amin 3.4. Thải trừ
- Qua thận: ường thải trừ quan trọng nhất của chất ộc tan/nước.
- Qua gan/mật: hay gặp ở chất ộc có kích thước phân tử của sản phẩm chuyển hóa lớn.
- Qua ường hô hấp: các chất khí như CO2, H2S, HCN, alcol, thuốc mê,… - Qua ường khác:
sữa mẹ, mồ hôi, nước bọt, lông, tóc, móng tay,…
IV. TÁC ĐỘNG CỦA CHẤT ĐỘC TRÊN CÁC CƠ QUAN
1. Tác ộng vào máu
- Huyết tương: các thuốc mê (ether, cloroform) làm giảm pH và dự trữ kiềm, tăng K+ huyết
tương. Nọc rắn loại viperide (họ Rắn lục) làm tăng khả năng ông máu, loại colubride (họ
Rắn nước) làm giảm/mất khả năng ông máu.
- Hồng cầu: bị phá hủy khi ngộ ộc Pb, nhiễm tia X, benzen, các dẫn xuất của amin thơm,…
- Bạch cầu: giảm/ngộ ộc benzen, tăng/ngộ ộc KL nặng.
- Tiểu cầu: giảm/ngộ ộc benzen.
2. Tác ộng trên hệ tiêu hóa
- Gây nôn: Fe, Hg, As, bột giặt, nấm ộc, opioid, P hữu cơ,…
- Đau, loét, kích ứng: NSAIDs, HgCl2, benzoat, acid, kiềm,…
- Chảy máu tiêu hóa: dẫn xuất salicylat, thuốc chống ông máu,… lO M oARcPSD| 47669111
Ngô Phước Long A2K73 MK73 HUP
- Tiết nước bọt nhiều: P hữu cơ, Pb, Hg,…
- Gây khô miệng: Atropin, Li, Colchicin,…
- Ỉa chảy: nhiễm ộc do vi khuẩn, nấm ộc,…
3. Tác ộng trên gan
- Hầu như các chất ộc ều ảnh hưởng ến gan.
- Gây ngộ ộc cấp: As, Fe, acetaminophen (paracetamol), P vàng, …
- Gây ngộ ộc mạn: Isoniazid, Methyldopa,…
4. Tác dụng trên tim mạch
- Làm tăng nhịp tim: Adrenalin, Amphetamin,…
- Làm giảm nhịp tim: Digitalin, Eserin,…
- Mạch không ều: ngộ ộc gan cóc, nhựa da cóc,… - Gây ngừng tim: Quinidin, Imipramin,…
- Giãn mạch: Acetylcholin,…
- Co mạch: Cựa lõa mạch,…
4. Tác dụng trên thận
- Tăng ure, albumin trong nước tiểu: Hg,, Pb, Cd,…
- Đi tiểu ra máu: acid oxalic, thuốc chống ông,…
- Gây viêm thận: CHCl3, CH2Cl2,…
- Gây vô niệu: Hg, sulfamid, mật cá trắm,…
6. Tác dụng trên hệ thần kinh
- Một số thuốc mê như CHCl3 tác dụng lên não và tủy sống gây mất phản xạ.
- Hôn mê: thuốc ngủ, opioid, rượu,…
- Gây co cứng: Mã tiền,…
- Kích thích vật vã: Atropin, Amphetamin, Cl hữu cơ,… - Gây rối loạn chức năng.
- Tác dụng lên hệ giao cảm gây giãn ồng tử: Adrenalin, Ephedrin,…
- Tác dụng lên hệ phó giao cảm, gây co ồng tử: Acetylcholin,…
7. Tác dụng lên bộ máy hô hấp
- Có thể gây tác dụng tại chỗ hoặc toàn thân.
- Gây ho, chảy nước mũi: Hơi ộc, hơi ngạt,…
- Tím tái: CO, lá Trúc ào,…
- Ức chế gây ngạt thở: Thuốc phiện, Cyanid, thuốc ngủ,…
- Gây phù phổi: H2S, P hữu cơ,…
8. Tác dụng lên hệ sinh sản
Gây rối loạn chức năng của hệ sinh sản của cả nam và nữ.
- Pb: ngăn cản rụng trứng. lO M oARcPSD| 47669111
Ngô Phước Long A2K73 MK73 HUP
- Thuốc chống ung thư: ức chế sinh tinh.
V. XỬ TRÍ NGỘ ĐỘC
Khi có dấu hiệu nạn nhân bị ngộ ộc ảnh hưởng ến các cơ quan sống của cơ thể thì việc iều
trị triệu chứng ể duy trì sự sống, nâng cao sức ề kháng là quan trọng nhất, phải ược tiến
hành trước khi tiến hành các biện pháp loại trừ chất ộc hoặc làm giảm tác ộng của chất ộc
và iều trị các rối loạn, triệu chứng khác. Các phương pháp xử trí ngộ ộc:
(1) Loại chất ộc khỏi cơ thể: nhằm giảm sự hấp thu vào máu -
Trực tiếp: trên da, mắt, ường tiêu hóa.
- Gián tiếp: qua hô hấp, qua thận, thẩm tách máu/chích máu.
(2) Làm giảm ộc tính của chất ộc
- Hấp phụ bởi chất ộc trong dạ dày, ruột.
- Trung hòa hoặc phá hủy chất ộc bằng các kháng ộc ặc hiệu.
(3) Điều trị các hậu quả do chất ộc gây ra - Điều trị ối kháng.
- Điều trị triệu chứng.
1. Loại chất ộc ra khỏi cơ thể
1.1. Loại trực tiếp (khi nạn nhân ngộ ộc < 6h) - Trên da, mắt:
+ Cởi bỏ quần áo chỗ nhiễm ộc, rửa nhiều lần (không chà xát) bằng nước ấm, xà phòng.
+ Nếu chất ộc không tan trong nước, dùng dung môi hữu cơ.
+ Nếu ở mắt có thể rửa sạch bằng nước, NaCl 0,9% từ 10-15 phút, nhỏ thuốc giảm au,… - Qua ường tiêu hóa:
(1) Gây nôn: xử lý càng sớm càng tốt ngay sau khi ăn hoặc uống phải chất ộc.
+ Bằng kích thích vật lý (móc họng, ngoáy họng bằng lông gà) hoặc bằng các chất gây nôn (Ipeca, Apomorphin)
+ Chú ý: không nên gây nôn khi ngộ ộc > 4h, bị hôn mê, ộng kinh co giật, bị ngộ ộc
acid/kiềm mạnh, hóa chất gây bỏng, ngộ ộc xăng dầu hay các chất ộc dễ hay hơi.
(2) Rửa dạ dày: nếu không gây nôn ược, từ 3-8h sau ngộ ộc. Rửa dạ dày nhiều lần cho ến
khi nước rửa trong hẳn, chú ý giữ lại 200-300ml dịch rửa ầu ể xác ịnh chất ộc. + Dung dịch rửa: KMnO4 0m1%.
+ Dung dịch NaHCO3 0,5% (không dùng khi ngộ ộc acid). + Dung dịch NaCl 0,9%.
+ Chú ý: BN bị ngộ ộc strychnine, acid hoặc base mạnh, ngộ ộc dầu, hôn mê sâu thì không ược rửa dạ dày. (3) Tẩy xổ: lO M oARcPSD| 47669111
Ngô Phước Long A2K73 MK73 HUP
+ Dùng thuốc Na2SO4, MgSO4 ể kích thích nhu ộng ruột thải bớt chất ộc, giảm hấp thu chất
ộc ở ruột, giảm táo bón do dùng than hoạt.
+ Không dùng thuốc tẩy dầu khi ngộ ộc các chất ộc tan/dầu, P hữu cơ,
(4) Thụt tháo: ể rửa ruột, thường dùng dung dịch NaCl 0,9%.
1.2. Loại gián tiếp
- Đường hô hấp: các chất ộc dễ bay hơi có thể loại bằng ường hô hấp.
+ Để BN nằm nơi thoáng, hô hấp nhân tạo (không dùng khi ngộ ộc các chất gây phù phổi:
Phosgen, Cl2, SO2,…). Có thể dùng máy thở nồng ộ oxy 50%. - Đường tiết niệu:
+ Truyền nhiều dịch (Glucose ưu trương 10-30%, dung dịch Ringer,…), có thể kết hợp với
thuốc lợi tiểu thẩm thấu (Manitol 10-25%). Không dùng khi có suy thận, suy tim, phù phổi
cấp, trụy tim mạch nặng. Chú ý bù ắp các chất iện giải.
+ Trong môi trường kiềm, một số chất ộc có tính acid yếu có thể tăng ào thải (barbituric)
hoặc giảm tác dụng (P hữu cơ). Có thể ưa dung dịch kiềm vào cơ thể (truyền
THAM/NaHCO3 1-5%) nhưng phải theo dõi pH máu không > 7,6.
+ Trong trường hợp nặng, có thể dùng phương pháp chạy thận nhân tạo (nhanh, tốn kém). -
Bằng thẩm tách hoặc chích máu: khi chất ộc vào máu nhiều thì phải chích máu.
VD: ngộ ộc barbiturate, CO, As,…
- Sau khi chích máu cần phải truyền máu ngay.
2. Làm giảm ộc tính
2.1. Hấp phụ bớt chất ộc trong dạ dày, ruột
- Dùng các chất có khả năng hấp phụ chất ộc như: than hoạt, lòng trắng trứng, sữa, kaolin,…
- Chất hấp phụ hay dùng là than hoạt vì than hoạt có thể hấp phụ nhiều chất ộc nếu ược
dùng trong 4h ầu sau ngộ ộc.
- Có thể dùng than hoạt sau khi gây nôn hoặc rửa dạ dày, không dùng khi chưa dứt nôn.
2.2. Trung hòa, phá hủy chất ộc bằng các chất kháng ộc ặc hiệu (antidote)
- Dùng các chất tương kị ể ngăn cản hấp thu chất ộc hoặc làm mất hoạt tính hoặc có tính ối
kháng tác dụng với chất ộc.
VD: nước lòng trắng trứng tạo với KL nặng ra albuminat không tan, dùng tanin ể tủa KL nặng, alkaloid. - Một số antidote:
+ Dimercaprol (BAL) trong ngộ ộc As, Hg,…
+ DMSA với As, Pb,… + EDTA với KL nặng.
+ Atropin sulfat với chất ức chế cholinesterase (P hữu cơ). + EtOH với ethylene glycol.
+ Dung dịch ường vôi với acid oxalic/phenol.
+ Dung dịch natri sulfide + Mg với Pb, Ba. lO M oARcPSD| 47669111
Ngô Phước Long A2K73 MK73 HUP
+ Dung dịch nước chanh, acid boric/trtric/sulfuric với kiề.
+ NaNO2, Na2S2O3 iều trị ngộ ộc CN–,…
3. Điều trị hậu quả
3.1. Điều trị ối kháng: dùng các chất có tác dụng dược lý ối lập nhau VD:
barbiturat – strychnin, atropine – P hữu cơ, neostigmin – curain,… Tác dụng
trung hòa hoặc ối lập với tác dụng của chất ộc thông qua các cơ chế:
- Ngăn chặn quá trình chuyển hóa thành sản phẩm ộc hơn.
- Làm tăng ào thải chất ộc: thay ổi tính chất hóa lý của chất ộc, giúp tăng lọc qua cầu thận,
giảm tái hấp thu ở ống thận.
- Cạnh tranh thụ thể hoặc phong bế các thụ thể này.
- Giúp hồi phục các chức năng của cơ thể bị ngộ ộc:
VD: khử Fe3+ của met-Hem thành He2+ của Hem ể tiếp tục tham gia vận chuyển oxy.
3.2. Điều trị triệu chứng
- Bệnh nhân bị ngạt: ặt nội khí quản, làm hô hấp nhân tạo, cho thở oxy hoặc carbogen. Sau
khi hô hấp nhân tạo, có thể dùng các thuốc kích thích TKTW: Ephedrin, Amphetamin, Theophyllin,…
- BN bị trụy tim mạch: dùng các chất trợ tim như dẫn xuất của Camphor, Niketamid,…
- Chống sốc (do nôn, tiêu chảy, xuất huyết dẫn ến giảm thể tích máu, giảm cung lượng tim
ột ngột do RL nhịp tim): truyền dung dịch Ringer lactat hoặc chất thay thế huyết tương.
- Điều trị các triệu chứng thần kinh: giảm co giật, khắc phục hôn mê, ức chế thần kinh.
- Chống mất nước, iện giải: truyền dung dịch glucose 5% và dung dịch NaCl 0,9%.
- Điều chỉnh toan kiềm: nếu thừa kiềm dùng thuốc lợi niệu như Acetazolamid, bù toan bằng
cách truyền dung dịch NH4Cl 0,83%. Nếu toan huyết có thể truyền dung dịch NaHCO3 1,5%.
- Chống biến chứng máu:
+ Tạo met-Hem, làm máu chậm ông, tan huyết bằng tiêm dung dịch xanh methylen 1% 540ml.
+ Trường hợp ngộ ộc làm máu chậm ộng: truyền tiểu cầu hoặc máu tươi, có thể dùng thêm nhóm corticoid.
+ Trường hợp tan huyết: truyền máu. CHƯƠNG II
PHƯƠNG PHÁP PHÂN LẬP CÁC CHẤT ĐỘC Mục tiêu:
1. Trình bày nguyên tắc chung trong phân tích các chất ộc.
2. Trình bày nguyên tắc của các phương pháp vô cơ hóa mẫu, ưu nhược iểm và ứng dụng
của chúng trong phân tích các kim loại và nguyên tố ộc. lO M oARcPSD| 47669111
Ngô Phước Long A2K73 MK73 HUP
3. Trình bày nguyên tắc, cách tiến hành và ứng dụng của phương pháp cất kéo hơi nước
trong phân trích chất ộc.
4. Trình bày nguyên tắc của các phương pháp phân lập các chất ộc hữu cơ từ dung dịch
nước hay cồn ở các pH thích hợp.
I. NGUYÊN TẮC CHUNG TRONG PHÂN TÍCH CÁC CHẤT ĐỘC
- Nhằm xác ịnh loại và nồng ộ chất ộc trong dịch sinh học: máu, nước tiểu, dịch rửa dạ dày,…
- Mẫu rất phức tạp, hàm lượng chất ộc thấp phải:
+ Tiến hành lấy mẫu phù hợp.
+ Có biện pháp phân lập chất ộc, làm sạch.
+ Phương pháp phân tích thích hợp kết quả nhanh, chính xác nhất.
- Quá trình phân tích các chất ộc thường qua các giai oạn trên. *Quá trình phân tích chất
ộc gồm 4 bước chính:
(1) Cách lẫy mẫu và bảo quản cho quá trình phân tích -
Nước tiểu: thể tích ủ lớn khoảng 50mL, lấy càng sớm càng tốt, không thêm chất bảo quản. -
Dịch dạ dày: lọc hay ly tâm, lấy sớm ể không có chất chuyển hóa, thể tích khoảng
20mL. - Máu: thể tích khoảng 10mL, có heparin ể chống ông.
(2) Chiết chất ộc từ mẫu: chọn dung môi thích hợp, thể tích gấp 5-25 lần thể tích mẫu. - Xay với dung môi. - Lắc với dung môi.
- Chiết liên tục bằng dung môi hay chiết siêu tới hạn.
(3) Phân lập các chất ộc: chọn phương pháp phân lập dựa vào ặc iểm lý hóa của chất ộc. - Vô cơ hóa.
- Phương pháp cất và phương pháp cất kéo hơi nước.
- Chiết bằng dung môi hữu cơ ối với các chất ộc không bay hơi trong nước.
(4) Phân tích các chất ộc:
- Phản ứng ịnh tính ể xác ịnh chất ộc.
- Hàm lượng chất ộc ược ịnh lượng bằng phương pháp thích hợp:
+ Với chất ộc vô cơ: AAS, ICP, cực phổ,…
+ Với chất ộc hữu cơ: LC, GC, TLC, CE, LC/MS,…
II. VÔ CƠ HÓA VÀ PHƯƠNG PHÁP PHÂN LẬP CÁC KIM LOẠI
- Vô cơ hóa là quá trình oxy hóa ốt cháy chất hữu cơ ể giải phóng kim loại dưới dạng ion.
- Phương pháp vô cơ hóa phổ biến: lO M oARcPSD| 47669111
Ngô Phước Long A2K73 MK73 HUP + Vô cơ hóa khô ( ốt).
+ Vô cơ hóa ướt (dùng acid với tác nhân oxy hóa).
+ Phân lập một số kim loại (Hg, As) sử dụng phản ứng tạo sản phẩm dễ bay hơi ở nhiệt ộ
thường (Hg0, AsH3) – kỹ thuật hóa hơi lạnh hoặc kỹ thuật hydrid.
- Nếu mẫu thử là máu, nước tiểu thì phải ong trước, có thể cho thêm một ít Na2CO3 rồi cô cách thủy ến khô.
- Nếu mẫu thử rắn (thức ăn, phủ tạng,…) thì phải nghiền nhỏ.
- Mẫu thử có cồn thì phải loại cồn bằng un cách thủy ở nhiệt ộ thấp (40-50OC) ể tránh gây
nỏ khi vô cơ hóa bằng hỗn hợp HCl và KClO3.
1. Phương pháp vô cơ hóa ướt
1.1. Vô cơ hóa bằng clor mới sinh
KClO3 + 6HCl KCl + 3Cl2 + 3H2O Cl2 + H2O 2HCl + O -
KL ược giải phóng dưới dạng muối clorid. - Nhược iểm:
+ Thời gian vô cơ hóa dài, không hoàn toàn. + Phải uổi clor dư.
+ Có thể gây mất As, Hg, Pb, Cu,…
1.2. Vô cơ hóa bằng chất oxy hóa mạnh trong acid sulfuric
(1) Phương pháp sulfonitric: phương pháp phổ biến nhất ể vô cơ hóa a số kim loại ộc. H2SO4 H2SO3 + O H2SO3 SO2 + H2O 2HNO3 H2O + 2NO + 3O 2NO N2 + 2O - Ưu iểm:
+ Thời gian phá mẫu ngắn.
+ Độ nhạy cao với nhiều cation.
+ Thể tích dịch vô cơ hóa nhỏ.
- Nhược iểm: có thể mất mẫu dễ bay hơi Hg,…
(2) Vô cơ hóa bằng hỗn hợp acid sulfuric, acid nitric và acid percloric: phương pháp phổ
biến nhất ể vô cơ hóa a số kim loại ộc. 2HNO3 2NO2 + H2O2 H2SO4 SO2 + H2O2 2HClO4 Cl2O6 + H2O2 lO M oARcPSD| 47669111
Ngô Phước Long A2K73 MK73 HUP
- Ưu iểm: oxy hóa ược gần hoàn toàn các chất hữu cơ (99%), ến hóa trị cao nhất, rút
ngắn 2,5-3 lần so với phương pháp (1), thể tích vô cơ hóa nhỏ. - Nhược iểm: có thể mất mẫu dễ bay hơi Hg,…
(3) Vô cơ hóa bằng hỗn hợp NH
: cơ chế tương tự phương pháo (1). 4NO3 và H2SO4
- Ưu iểm: ỡ nguy hiểm cho người làm việc.
(4) Vô cơ hóa bằng hỗn hợp H2O2 và H2SO4: H2O2
H2O + O H2SO4 SO2 + H2O2 - Ưu iểm: ít tỏa khí ộc.
- Nhược iểm: giá thành cao.
2. Phương pháp vô cơ hóa khô
2.1. Đốt với hỗn hợp Na2CO3 và NaNO3
- Ít ược dùng, lượng mẫu thử nhỏ (5-10g). Mất một số KL khi ốt ở nhiệt ộ cao.
- Có thể tìm một số chất ộc trong một khối lượng nhỏ mẫu thử như tìm As trong nước tiểu, tóc, móng tay,…
- Phương pháp này thường ược dùng ể bổ sung cho phương pháp vô cơ hóa bằng clor mới sinh.
2.2. Đốt ơn giản - Ít dùng.
- Có thể dùng ể xác ịnh sự có mặt của các muốt: bismuth, Zn, Cu, Mn, acid fluosillicic, các iodid.
3. Phương pháp loại chất oxy hóa khỏi dịch vô cơ hóa -
Sau khi vô cơ hóa, chất lỏng thu ược ều chứa một lượng chất oxy hóa thừa như
nitrogen oxyd hay vết acid nitric. -
Cần loại chất oxy hóa khỏi dung dịch vô cơ hóa. Các cách như dùng formaldehyd, ure, natri sulfit,…
III. PHÂN LẬP CÁC CHẤT ĐỘC HỮU CƠ BẰNG CẤT KÉO HƠI NƯỚC
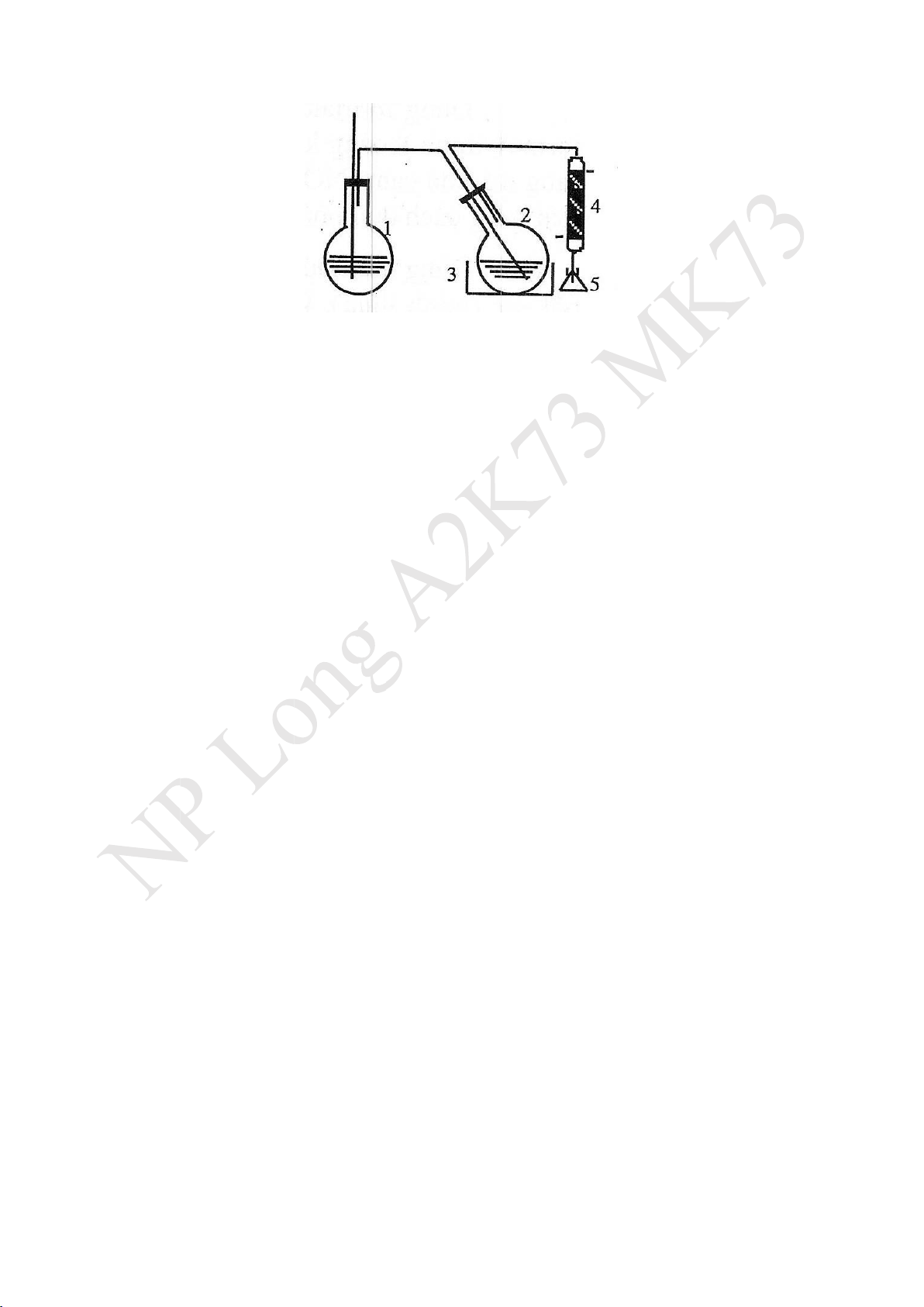
1. Cơ sở của phương pháp -
Đun hỗn hợp 2 chất A và B không hòa tan vào nhau thì áp suất hơi riêng phần của
chúng tăng lên và không phụ thuộc vào nhau. -
Khi tổng áp suất hơi riêng phần (P = PA + PB) bằng áp suất khí quyển trên bề mặt thì hỗn hợp ó sôi.
Mỗi chất/hỗn hợp sẽ sôi ở nhiệt ộ thấp hơn nhiệt ộ sôi của nó.
- Bình sinh hơi làm bằng ồng hoặc thép không gỉ.
- Bình ựng mẫu thử (2) ặt trong nồi cách thủy (3).
- Ống sinh hàn (4) ngưng tụ pha hơi ưa vào bình chứa mẫu (5). lO M oARcPSD| 47669111
Ngô Phước Long A2K73 MK73 HUP .
2 Cách lấ y m ẫu ể phân tích các chất ộ c t ừ d ị ch c ất ượ c
2.1 . Theo Svaicova
- D ị ch c ất ượ c h ứng vào 4 bình.
- Bình 1 (có 2mL dung dị ch NaOH 5%), c ấ t l ấ y 15mL.
- C ắ t ti ếp vào 3 bình khác, mỗi bình lấ y 25-50mL.
- N ếu dương tính chất nào thì cất cho ến khi không còn phả n ứ ng ch ất ó trong dị ch c ấ t.
- Bình 1 ể xác ịnh cyanid và dẫ n xu ấ t halogen m ạ ch th ẳng, methanol, ethanol,…
- Các dị ch c ấ t ở các bình sau dùng ể ki ể m tra l ạ i khi c ầ n.
2.2 . Theo Kohn-Abrest
- Ti ến hành vớ i 300g m ẫ u th ử ể l ấ y 300mL d ị ch c ấ t.
- Nh ận xét màu, mùi dị ch c ấ t.
- L ấ y kho ả ng 50mL (1/6) d ị ch c ất ể tìm dẫ n xu ấ t halogen m ạ ch th ẳ ng, cloral hydrat, cresol,…
- Ph ần còn lạ i c ấ t l ầ n th ứ 2 l ấ y 100mL. Sau ó cắt thêm lầ n th ứ 3 l ấ y 35mL.
- L ấ y n ử a d ị ch c ấ t l ầ n cu ối ể xác ịnh cyanid, phenol, chloroform,… và nửa còn lại xác ịnh rượ u.
IV. PHƯƠNG PHÁP CHIẾ T B ẰNG DUNG MÔI HỮ U C Ơ
1 . Nguyên tắ c chung chi ế t xu ấ t ch ất ộ c h ữu cơ
- Chiết là một quá trình ặc biệt, phân bố một chất giữa 2 pha lỏng không trộn lẫn vào nhau,
thường là giữa các dung môi hữu cơ và nước.
- Lắc ể tăng tốc ộ phân bố chất tan giữa 2 chất lỏng.
- Quá trình lắc ở mức ộ thích hợp.
- Đạt tới trạng thái cân bằng, ngừng lắc và tách riêng dung môi chiết.
- Hiệu suất chiết chất ộc từ một mẫu thử phụ thuộc vào nhiều yếu tố.
*Quá trình chiết gồm các giai oạn sau:
(1) Xử lý sơ bộ mẫu thử:
- Có nhiều mẫu thử không phải qua giai oạn này. lO M oARcPSD| 47669111
Ngô Phước Long A2K73 MK73 HUP
- Tạo iều kiện cho chất ộc dễ dàng chuyển sang dung môi hữu cơ như: cắt liên kết protein
(chiết morphin trong nước tiểu cần thủy phân trong HCl,…). - Nhằm làm giàu chất phân
tích như: cồn – acid, nước – acid,…
(2) Chọn iều kiện cho quá tình chiết xuất:
- Quá trình chiết ể xác ịnh chất ộc thường ược tiến hành ở cả môi trường acid và môi trường kiềm.
+ MT acid (acid hữu cơ) thu ược các acid yếu.
+ MT kiềm (NH3 hoặc NaHCO3) thu ược các alkaloid và base tổng hợp. -
Dung môi thường dùng: Ether/CHCl3.
- Việc chiết xuất ở môi trường acid có thể sẽ có nhiều tạp chất.
- Nếu chất phân tích không chiết ở môi trường này thì vẫn nên loại bỏ bớt tạp chất bằng
chiết qua pH acid trước khi chiết ở môi trường kiềm.
(3) Loại bỏ tạp trong dịch chiết: Dịch chiết ether/cloroform thường có nhiều tạp chất nên
việc loại bớt tạp chất có trong dịch chiết là cần thiết. Có nhiều cách ể thực hiện quá trình này như:
- Cho qua cột than hoạt tính hoặc cột ionit.
- Thăng hoa ể lất chất ộc (barbiturat).
- Chiết lặp lại nhiều lần ở 2 môi trường acid ( ể lấy base yếu) hoặc dung dịc h nước kiềm ( ể lấy acid yếu).
(+) Với phương pháp chiết lại:
+ Các chất ộc có tính acid tan trong dung môi, khi chiết ở môi trường acid thì chuyển thành
muối tan trong nước bằng cách lắc dịch chiết với dung dịch NaOH. Lấy lớp nước, acid hóa
và chiết lại bằng ether vài lần.
+ Dịch chiết ở môi trường kiềm thì lắc vài lần với dung dịch acid nước. Lấy phần nước gộp
lại và kiềm hóa rồi chiết bằng dung môi vài lần. Có thể làm nhiều lần như vật ể loại tạp trong dịch chiết.
(+) Với phương pháp trao ổi ion:
+ Trước khi ịnh lượng alkaloid có thể tinh khiết hóa bằng cách cho dung dịch nước của
muối alkaloid qua cột cationid, alkaloid ược giữ lại ở cột.
+ Rửa cột bằng nước cất ến phản ứng trung tính.
+ Đẩy alkaloid khỏi cột bằng 50mL dung dịch acid với tốc ộ 2mL/phút.
+ Thường dùng cellulose ã oxy hóa làm chất trao ổi có ưu iểm là liên kết của nó với alkaloid
rất yếu nên có thể dùng acid ẩy nhanh ra và hoàn toàn.
(4) Chiết bằng dung môi:
- Là kỹ thuật dùng dung môi hữu cơ ể chiết chất phân tích từ mẫu ã làm khô.
- Có thể dùng một số tác nhân vật lý hỗ trợ như: lắc, khuấy trộn, vi sóng,… - Chiết Soxhlet. lO M oARcPSD| 47669111
Ngô Phước Long A2K73 MK73 HUP
2. Một số phương pháp chiết chất ộc
2.1. Chiết Soxhlet (chiết gián oạn) – chiết bằng dung môi
- Dùng một lượng dung môi (cồn) nhất ịnh qua hệ thống hồi lưu và i qua mẫu thử.
- Sau ó cất thu hồi cồn và chiết bằng dung môi như các phương pháp ở dưới.
2.2. Chiết siêu tới hạn
- Chiết bằng DM ở trạng thái siêu tới hạn (không còn ở thể lỏng, chưa thành thể khí).
- CO2 thường ược sử dụng do:
+ Dễ ạt nhiệt ộ và áp suất tới hạn (31oC và 73atm).
+ Tinh khiết, giá rẻ, bền, không ộc, không cháy.
+ Độ nhớt thấp, khuếch tán tốt.
+ Có thể pha vào các dung môi khác.
+ Dễ loại khỏi dịch chiết.
- Chỉ chiết ược các chất ít và không phân cực.
2.3. Chiết pha rắn
- Dựa vào sự phân tán của chất phân tích giữa 2 pha lỏng và rắn (hạt nhỏ, xếp óng và các ống nhỏ).
- Pha lỏng chảy qua ống, chất phân tích tương tác với pha rắn và ược giữ trên ống. - Rửa tạp chất.
- CPT ược rửa giải khỏi pha rắn bằng DM phù hợp hoặc luồng khí nóng (SK khí).
- Thể tích DM rửa giải thường nhỏ hơn thể tích mẫu SPE có tác dụng làm sạch, làm giàu mẫu. - Pha rắn trong SPE:
+ Pha rắn nền silica: phân cực mạnh.
+ Pha rắn florisil (Mg silicat): ít phân cực.
+ Pha rắn than chì: kỵ nước.
+ Pha rắn nền polymer hữu cơ tổng hợp: (diện tích bề mặt lớn, hấp thu tốt, pH làm việc
rộng) gồm PS-DVB (dùng cho các chất kém phân cực, không phân cực có KLPT lớn) và
Oasis HLB (có vùng thân nước, vùng thân dầu).
+ Mix mode: nhiều cơ chế lưu giữ.
+ Ái lực miễn dịch (IAC): dựa trên liên kết KN-KT.
2.4. Chiết với hệ phân tán pha rắn -
Trộn cơ học mẫu thử với pha rắn. - Nhồi vào cột chiết.
- Dùng dung môi rửa giải chất phân tích.
2.5. Vi chiết pha rắn lO M oARcPSD| 47669111
Ngô Phước Long A2K73 MK73 HUP
- Chất phân tích ược hấp phụ vào một pha rắn.
- Pha rắn chế tạo từ vật liệu hấp phụ rắn, xốp trên bề mặt sợi silica hoặc sợi kim loại. - Chất
phân tích ược rửa giải ưa vào GC hoặc LC. - Có 2 cách lấy mẫu:
+ Immersion SPME: sợi nhúng vào mẫu lỏng.
+ Headspace SPME: sợi chiết ưa vào không gian hơi của chất phân tích.
2.6. Vi chiết pha lỏng
- Đưa một lượng nhỏ (vài µg) dung môi vào dung dịch pha nước của mẫu chứa chất phân tích.
- Vi chiết giọt ơn: 2 kỹ thuật Immersion và Headspace.
- Vi chiết lỏng – lỏng phân tán. - Vi chiết sợi rỗng.
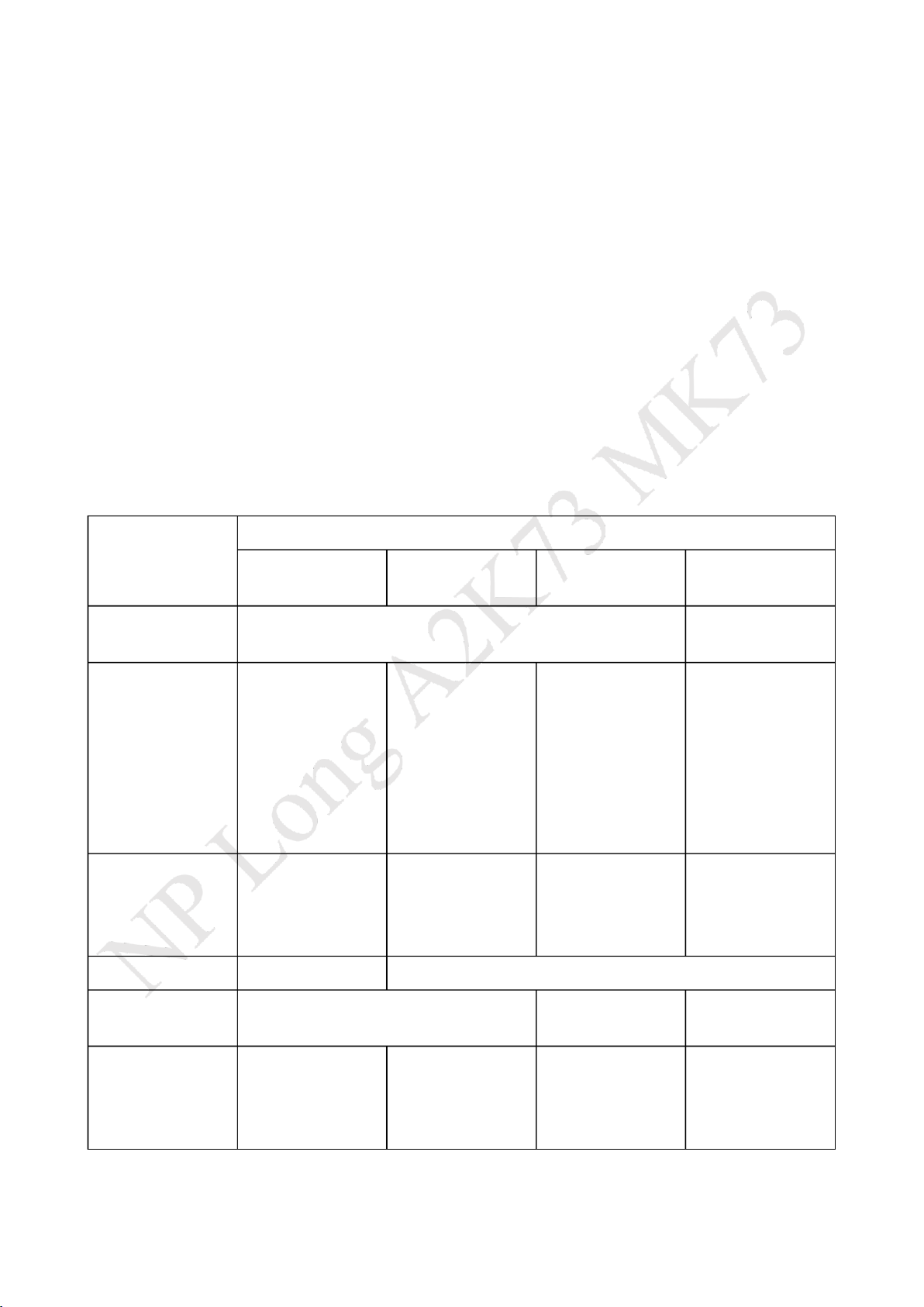
3. Một số ví dụ về phương pháp xử lý mẫu qua từng giai oạn Giai oạn Phương pháp xử lý mẫu Stass-Otto Svaicova Kohn-Abrest Làm khô mẫu thử Xử lý sơ bộ Xay mẫu Xay mẫu với Na2SO4 Cồn acid Acid hóa dùng - Cồn 95/acid - Cồn 95/acid - Cồn
95/acid acid oxalic hoặc hóa dùng acid hóa dùng acid hóa dùng acid acid tartric oxalic hoặc acid tartric 1% tartric 1% tartric 10% - Ngâm 50- - Ngâm 50- - Ngâm 25- 60’/12h. 60’/4h. 30’/24h. - Làm 3-4 lần Loại ạm Bốc hơi cồn ở Cồn 95 Cồn 95 hoặc Bốc hơi cồn ở (albumin) nhiệt ộ thấp tuyệt ối nhiệt ộ thấp trong chân trong chân không không Loại mỡ Không Ether dầu hỏa Chiết bằng Dùng Ether/CHCl3 MT acid: dùng Dùng DMHC ở 2 MT Ether Ether/CHCl3
Kiềm hóa: dùng Kiềm hóa: dùng MT kiềm Kiềm hóa: dùng NH3 NH3/NaHCO3 (NaHCO3) dùng NH3/NaHCO3 Ether sau ó dùng CHCl3 lO M oARcPSD| 47669111
Ngô Phước Long A2K73 MK73 HUP CHƯƠNG III CÁC CHẤT ĐỘC VÔ CƠ Mục tiêu:
1. Trình bày nguyên nhân gây ngộ ộc và ộc tính của một số kim loại và nguyên tố ộc (Hg,
Ph, As, Ba, Cd, Cr, Cu, Zn, Sn), khí ộc, acid vô cơ và kiềm mạnh.
2. Nêu triệu chứng ngộ ộc, cách xử trí ngộ ộc và các biện pháp ề phòng nhiễm ộc các hợp
chất vô cơ kể trên.
3. Trình bày nguyên tắc của những phương pháp có thể phân tích các chất ộc ã nêu trên.
I. CÁC KIM LOẠI VÀ NGUYÊN TỐ ĐỘC 1. Chì (Pb)
1.1. Dẫn chất của chì
- PbO, Pb(OH)2: bột trắng ít tan/nước, tan/kiềm.
- Minium Pb3O4 (2PbO.PbO2): bột ỏ, không tan/nước, dùng ể pha sơn, trong kỹ nghệ thủy
tinh, làm chất màu cho ồ gốm,… - PbCO3: dùng pha màu sơn.
- PbCrO4: màu vàng ẹp, dùng pha sơn màu.
- PbS: dùng tạo lớp màu trên mặt ồ gốm.
- Pb(CH3COO)2.3H2O; dùng trong phòng thí nghiệm, y học.
1.2. Nguyên nhân ngộ ộc
1.2.1. Ngộ ộc cấp tính
- Ít, mùi vị rất khó chịu nên khó uống. Nhưng có thể xảy ra khi:
+ Đựng dung dịch NaCl ẳng trương vào chai thủy tinh có pha chì,… +
Trẻ em ngậm ồ chơi có pha chì.
1.2.2. Ngộ ộc trường diễn
- Ăn ồ hộp hàn thiếc lẫn chì, nước dẫn qua ường ống pha chì,…
- Hít phải bụi chì hay hợp chất của nó trong các nhà máy sản xuất sơn, acqui, mạ, khai thác chì và úc chữ.
- Trước ây: công nhân tiếp xúc với xăng dầu chứa Pb(C2H5)4, công nhân trong các nhà máy in,..
1.3. Cơ chế gây ộc
1.4. Triệu chứng ngộ ộc
1.4.1. Ngộ ộc (bán) cấp tính
- Mệt mỏi, kích ứng, biếng ăn, mất ngủ, sút cân.
- Rối loạn tiêu hóa, au thượng vị từng cơn, buồn nôn và nôn ra chất trắng, tiêu chảy phân en rồi táo bón.
- Nhức ầu, kích ứng mạnh hệ TKTW. Trẻ em bị ảnh hưởng nhiều hơn vị hệ TKTW ang phát triển. lO M oARcPSD| 47669111
Ngô Phước Long A2K73 MK73 HUP
- Hủy hoại mao mạch và ộng mạch dẫn ến phù não, thoái hóa thần kinh: ngớ ngẩn, mê sảng, co giật, hôn mê.
- Rối loạn phối hợp vận ộng cơ, gây yếu cơ, au cơ, viêm khớp.
- Rối loạn chức năng ống thận, viêm thận, có thể gây vô niệu, tăng ure máu. - Gây thiếu máu.
- Ảnh hưởng ến hệ sinh sản: thoái hóa tinh hoàn, sảy thai hay sinh non, trẻ sinh ra nhẹ cân.
- Thường tìm thấy lượng chì lớn trong ường tiêu hóa.
1.4.2. Ngộ ộc trường diễn
- Đầu tiên: xuất hiện viền xanh ở lợi, hơi thở thối, au bụng, thiếu máu, mệt mỏi, suy nhược, da xanh tái.
- Nếu không iều trị sẽ gây viêm thận mạn, rối loạn thần kinh, co giật, tê liệt các chi.
- Hồng cầu giảm, xuất hiện hồng cầu hạt trong máu và porphyrin trong nước tiểu.
Chẩn oán: kết quả ịnh lượng chì trong máu và nước tiểu hoặc thử nghiệm δ-ALA.
1.5. Điều trị ngộ ộc
1.5.1. Ngộ ộc cấp
- Loại chất ộc ra khỏi cơ thể: gây nôn, rửa dạ dày bằng dung dịch Na2SO4, MgSO4, uống than hoạt, thụt tháo,…
- Dùng các chất tạo phức ể giảm nồng ộ chì trong máu và tăng bài tiết qua nước tiểu:
+ Tiêm TM chậm hay tiêm truyền CaNa2EDTA.
+ Tiền dimercaprol (BAL) ở người có tổn thưởng não hoặc uống DMSA kết hợp
CaNa2EDTA ở người chưa có tổn thương não.
- Điều trị triệu chứng: ộng kinh, hôn mê (nếu có), nếu tăng áp lực nội sọ có thể tiêm
dexamethason hay mannitol. *Để tránh nhiễm ộc chì:
- Cải thiện iều kiện làm việc, giảm thiểu lượng bụi chì và các hợp chất của nó xâm nhập vào cơ thể.
- Kiểm tra sức khỏe ịnh kỳ 6 tháng/lần.
- Định lượng chì trong máu và nước tiểu.
- Xét nghiệm ure huyết, tìm hồng cầu có chấm.
1.6. Phương pháp phân tích
1.6.1. Xử lý mẫu thử - Trong không khí:
+ Hút không khí có bụi chì vào HNO3.
+ Dùng phản ứng của chì ĐT, ĐL.
- Trong phủ tạng, máu, nước tiểu:
+ Vô cơ hóa bằng hỗn hợp sulfonitric tạo tủa PbSO4.
+ Hòa tan PbSO4 trong amoni acetat nóng, sau ó tiến hành ĐT, ĐL. lO M oARcPSD| 47669111
Ngô Phước Long A2K73 MK73 HUP
1.6.2. Định tính Pb2+
- Phản ứng với dithizone tạo dithizonat chì màu ỏ tía trong CCl4. Phản ứng có ộ nhạy cao
(0,05µgPb/mL) và có tính ặc hiệu tuyệt ối vì Pb2+ từ PbSO4 tức là tách riêng khỏi a số các nguyên tố khác.
- Phản ứng với KI tạo tủa PbI2 vàng. Thêm nước, un nóng tan, ể nguội, kết tinh trở lại cho
những tinh thể vàng óng ánh: phản ứng “mưa vàng”.
- Phản ứng tạo kali chì ồng hexanitrit: K2CuPb(NO2)6 hình lập phương màu en.
- Phản ứng tạo PbS: tan trong acid nitrit loãng.
3PbS + 8HNO3 3Pb(NO3)2 + 2NO + 3S + 4H2O
- Tạo kết tủa PbCrO4 vàng không tan trong acid acetic, tan trong acid vô cơ và trong kiềm ăn da.
1.6.3. Định lượng Pb2+
Sau khi vô cơ hóa, Pb ở dạng PbSO4 ược hòa tan trong amino acetat chuyển thành Pb2+.
- Phương pháp AAS/ICP: ứng dụng phổ biến ể phân tích chì trong dịch sinh học, dược liệu,
mỹ phẩm. Đo ở 283,3nm; LOD = 0,8mg/mL và LOQ = 2,6mg/mL.
- Phương pháp cực phổ: khử ion chì trên catod giọt Hg với nền amoni acetat 3%. Thế bán
sóng của chì 0,55V. Độ nhạy 5 µg/mL.
- Phương pháp dicromat-iod:
+ Cho Pb2+ tác dụng với lượng thừa K2Cr2O7 chuẩn.
+ ĐL K2Cr2O7 dư bằng phương pháp o iod.
+ Cho kết quả tốt khi hàm lượng khá lớn (2-100mg/ 100g).
- Phương pháp chiết o quang với dithizon:
+ Tạo dithizonat chì ở pH = 7-10.
+ Chiết dithizonat bằng CHCl3 ở pH > 7,0.
+ Rửa dịch chiết bằng dung dịch KCN có thêm NH4OH.
+ Đo mật ộ quang của dịch chiết ở 520nm.
+ Độ nhạy của phương pháp là 10mg/g. - Phương pháp complexon:
+ ĐL Pb2+ bằng cách cho dư complexon (III) 0,01N trong dung dịch ệm amoniac. +
Chuẩn ộ complexon thừa bằng ZnCl3 với chỉ thị en ericrom T. 2. Arsen (As)
2.1. Dẫn chất của Arsen
- Là một chất ộc nguy hiểm và gây ÔNMT. Nhiều hợp chất ược dùng:
+ Y học: thuốc cổ truyền, thuốc bổ, thuốc thú y,… lO M oARcPSD| 47669111
Ngô Phước Long A2K73 MK73 HUP
+ Khác: bảo quản gỗ, thuốc trừ sâu, diệt côn trùng, diệt cỏ, sản xuất thủy tinh, chất bán dẫn,…
- As có màu xám, dễ bị oxy hóa thành As2O3 cháy mùi tỏi.
- As2O3 (thạch tín, Arsen trắng): quan trọng nhất, rất ộc. - Arsenid:
+ Muối Na, K của acid arsenơ.
+ Muối ồng arsenid, ồng aceto arsenid.
+ Đều có màu xanh lục, dùng trong công nghệ nhuộm giấy.
- Arsenat: muối của acid arsenic :
+ Natri arsenat: thuốc súng.
+ Đồng arsenat: xanh lục, dùng làm phẩm màu.
+ Chì/calci arsenat: thuốc trừ sâu.
- Arsen sulfide: dùng trong công nghệ sơn, in, thuốc nhuộm.
- Arsin (AsH3): chất khí rất ộc, mùi tỏi, sinh ra trong sản xuất công nghiệp.
- As còn có trong nước ngầm.
- Hợp chất As hữu cơ ược sử dụng: làm chất ộc hóa học, thuốc trừ sâu (MSMA, DSMA),
thuốc trị giang mai (Stovarsol, Sulfarseno). 2.2. Nguyên nhân ngộ ộc - Bị ầu ộc. - Do tự tử. - Do ăn uống.
- Do nước sinh hoạt nhiễm As.
2.3. Độc tính. Cơ chế gây ộc
- Độc tính của các hợp chất As phụ thuộc: hóa trị, trạng thái vật lý, ộ tan và loại ộng vật bị nhiễm.
- As3+ ộc hơn As5+, hợp chất hữu cơ ít ộc hơn hợp chất vô cơ.
- As và các hợp chất ức chế enzym qua tương tác với nhóm -SH (các As3+) hay thay thế nhóm phosphat (các As5+).
- Liều ộc của As khó xác ịnh vì phần lớn chất ộc bị nôn ra ngoài. LD của As 2O3 ⁓ 2mg/kg.
- Lặp lại hằng ngày 20-60 µg/kg có thể gây ngộ ộc mạn tính.
- Liều ộc các hợp chất hữu cơ thường cao hơn, liều ộc thay ổi theo từng cá thể.
2.4. Triệu chứng ngộ ộc
2.4.1. Ngộ ộc cấp
- Triệu chứng nghiêm trọng xảy ra trên tiêu hóa (30’-2h):
+ Bỏng rát thực quản, buồn nôn, nôn.
+ Đau bụng dữ dội, tiểu máu, xuất huyết tiêu hóa, phân lổn nhổn hạt trắng.
+ Quá nặng: viêm dạ dày, hạ HA, sốc và chết. lO M oARcPSD| 47669111
Ngô Phước Long A2K73 MK73 HUP
- Tim phổi: cơ tim xung huyết, nhịp nhanh, phù phổi, chết do trụy tim mạch sau 24h. - Hệ
thần kinh: mê sảng, co giật, hôn mê, suy nhược, tê liệt, phù não.
- Tiết niệu: suy thận, bí tiểu,…
2.4.2. Ngộ ộc mạn
- RLTH liên tục, au bụng, mệt mỏi, khó chịu, viêm dạ dày, suy nhược.
- Giảm bạch cầy, thiếu máu, suy thận.
- Viêm thần kinh ngoại, liệt các ầu chi, rụng tóc.
- Rối loạn sắc tố da, en da, xuất hiện các mảng dày sừng, viêm da kiểu eczema, hoại tử chân,…
- Có thể gây ung thư phổi, gan, thận, bàng quang, hạch bạch huyết,… sau nhiều năm phơi nhiễm.
2.5. Xử trí ngộ ộc
2.5.1. Ngộ ộc cấp
- Loại trừ chất ộc ra khỏi cơ thể càng nhanh càng tốt bằng cách gây nôn và rửa dạ dày với
nước lòng trắng trứng.
- Trung hòa chất ộc bằng các chất chống ộc như:
+ Dung dịch có sulfid, muối Fe3+, MgO,…
+ Tiêm thuốc ặc trị BAL với liều 5mg/kg cách nhau 4-6h.
+ Sau khi nạn nhân ã ổn ịnh hoặc nhiễm ộc mạn tính: uống Succimer (DMSA).
+ Truyền huyết thanh mặn, ngọt, dùng thuốc trợ tim, lợi tiểu.
+ Thẩm tích máu nếu cần.
2.5.2. Ngộ ộc mạn
- Chủ yếu chứa triệu chứng: trợ tim, lợi tiểu, kết hợp vật lý trị liệu.
2.6. Phương pháp kiểm nghiệm
2.6.1. Xử lý mẫu thử
- Vô cơ hóa mẫu thử bằng hỗn hợp sulfonitric. 2.6.2. Định tính a) Phương pháp Marsh:
- Nguyên tắc: khử arsenic hóa trị cao bằng H mới sinh (H2SO4 loãng và Zn kim loại) thành AsH3 bay lên. H2SO4 + Zn 2H + ZnSO4
H3AsO4 + 8H AsH3 + 4H2O - Phát hiện khí AsH3:
+ Đốt lên tới nhiệt ộ 600oC, AsH3 sẽ phân hủy thành As và H2.
+ As sẽ ọng lại trên thành ống một vòng en ánh kim.
+ Đốt nhẹ ống có vòng xám en ra, sẽ thấy các hạt trắng bám trên thành, soi dưới kính hiển
vi: hình ặc biệt của As2O3.




