







Preview text:
lOMoAR cPSD| 59416725
UV-VIS: phương pháp quang phổ hấp thụ tử ngoại khả kiến UV-VIS I. Nguyên tắc:
Phương pháp quang phổ hấp thụ tử ngoại khả kiến UV-VIS là phương pháp phân
tích dựa vào hiệu ứng hấp thụ xảy ra khi phân tử vật chất tương tác với bức xạ điện
từ ở vùng bước sóng UV-VIS 200-760nm.
Ứng dụng định tính: là xác định trong mẫu thử có dược chất cần nghiên cứu hay không.
• Định tính một dược chất bằng cách so sánh phổ UV-VIS của mẫu thử và mẫu
dược chất chuẩn. Dựa vào hệ số tương thích (match) để xác định mẫu thử có
dược chất đang nghiên cứu hay không. Nếu phổ UV-VIS của mẫu thử giống
với phổ UV-VIS của mẫu dược chất chuẩn thì khẳng định mẫu thử có dược chất đó
• Ngoài ra, khi không có dược chất chuẩn, có thể định tính dược chất trong mẫu
thử bằng cách xác định vị trí các cực đại hấp thụ thu được của mẫu thử với tài
liệu, từ đó khẳng định trong mẫu thử có dược chất cần nghiên cứu hay không
Ứng dụng định lượng: dựa vào
• Định luật Lambert-Beer
• Định lượng bằng phương pháp UV-VIS sử dụng kỹ thuật đường chuẩn
• Định lượng bằng phương pháp UV-VIS khi biết hệ số hấp thụ riêng
• Định lượng bằng phương pháp UV-VIS sử dụng kỹ thuật đo so sánh II.
Biểu thức định luật Lambert-Beer
Định luật Lambert-beer: Độ hấp thụ quang của một dung dịch đối với một chùm
sáng đơn sắc tỉ lệ thuận với độ dày truyền quang và nồng độ chất tan trong dung dịch A=ε×l×C
A: mật độ quang hay độ hấp thụ quang l: bề dày dung dịch (cm)
C: Nồng độ dung dịch (mol/lít) lOMoAR cPSD| 59416725
ε : hệ số hấp thụ mol (lit. mol−1.cm−1) phụ thuộc vào bản chất dung dịch và bước sóng của chùm tia đơn sắc
III. Điều kiện áp dụng định luật Lambert-Beer
- Thiết bị phải có khả năng tạo ra chùm tia sáng đơn sắc, độ đơn sắc càng cao càng tốt
- Chất thử phải bền trong dung dịch và tác dụng của tia UV-VIS
- Dung dịch phải nằm trong khoảng nồng độ thích hợp
- Dung dịch phải trong suốt để hạn chế tối đa hiện tượng tán xạ, phản xạ ánh sáng IV. Ưu nhược điểm Ưu điểm: - Thời gian phân tích nhanh -
Kết quả chính xác Nhược điểm: -
Không thể phân tích các mẫu có thành phần phức tạp V.
Các bài tập (các bài 1,2,4,5)
Bài 1: Cân chính xác 0,15g chất Y tinh khiết pha thành 100ml dung dịch A. Lấy
chính xác 5ml dung dịch A pha thành 100ml (dung dịch B). Đem đo mật độ quang
của dung dịch B trên máy đo quang phổ với cuvet dày 1cm tại bước sóng 270nm thu
được giá trị A là 0,42
Tính hệ số hấp thụ riêng E và hệ số hấp thụ mol ε của chất Y tại bước sóng 270nm.
Biết rằng khối lượng mol của Y là 200
Bài 2: Mẫu thử dạng chất rắn
Cân chính xác 0,1g mẫu thử có chứa berberin clorid cho vào bình định mức 1000ml,
thêm nước tới vạch để thu được dung dịch A. Hút chính xác 5ml dung dịch A cho
vào bình định mức 100ml và thêm nước tới vạch để thu được dung dịch
B. Đo độ hấp thụ của dung dịch B ở bước sóng cực đại 263nm với cốc đo dày 1cm
Giá trị độ hấp thụ quang trung bình của dung dịch B là 0,359
Tính hàm lượng % berberin clorid trong mẫu thử biết A(1%,1cm) của berberin clorid
ở bước sóng 263nm là 724 lOMoAR cPSD| 59416725
Bài 4: Một chất X có 02 cực đại hấp thụ tại 280 và 420nm. Cân chính xác 0,025g
chất X tinh khiết, hòa tan với nước và pha thành 100ml (dung dịch A). Lấy 10ml
dung dịch A pha loãng với nước thành 100ml để thu được dung dịch B. Đem đo độ
hấp thụ quang của dung dịch B với bước sóng 280nm với cuvet dày 1cm thu được giá trị A là 0,42
Lấy 5ml dung dịch A pha loãng với nước thành 100ml để thu được dung dịch C.
Đem đo độ hấp thị quang của dung dịch C ở bước sóng 420nm với cuvet trên thu
được giá trị A là 0,33
a. Tính hệ số hấp thụ riêng E(1%,1cm) của chất X tại 2 bước sóng 280 và 420nm
b. Nếu ứng dụng phương pháp UV-VIS để định lượng chất X này thì nên tiến hành
tại bước sóng nào và tại sao
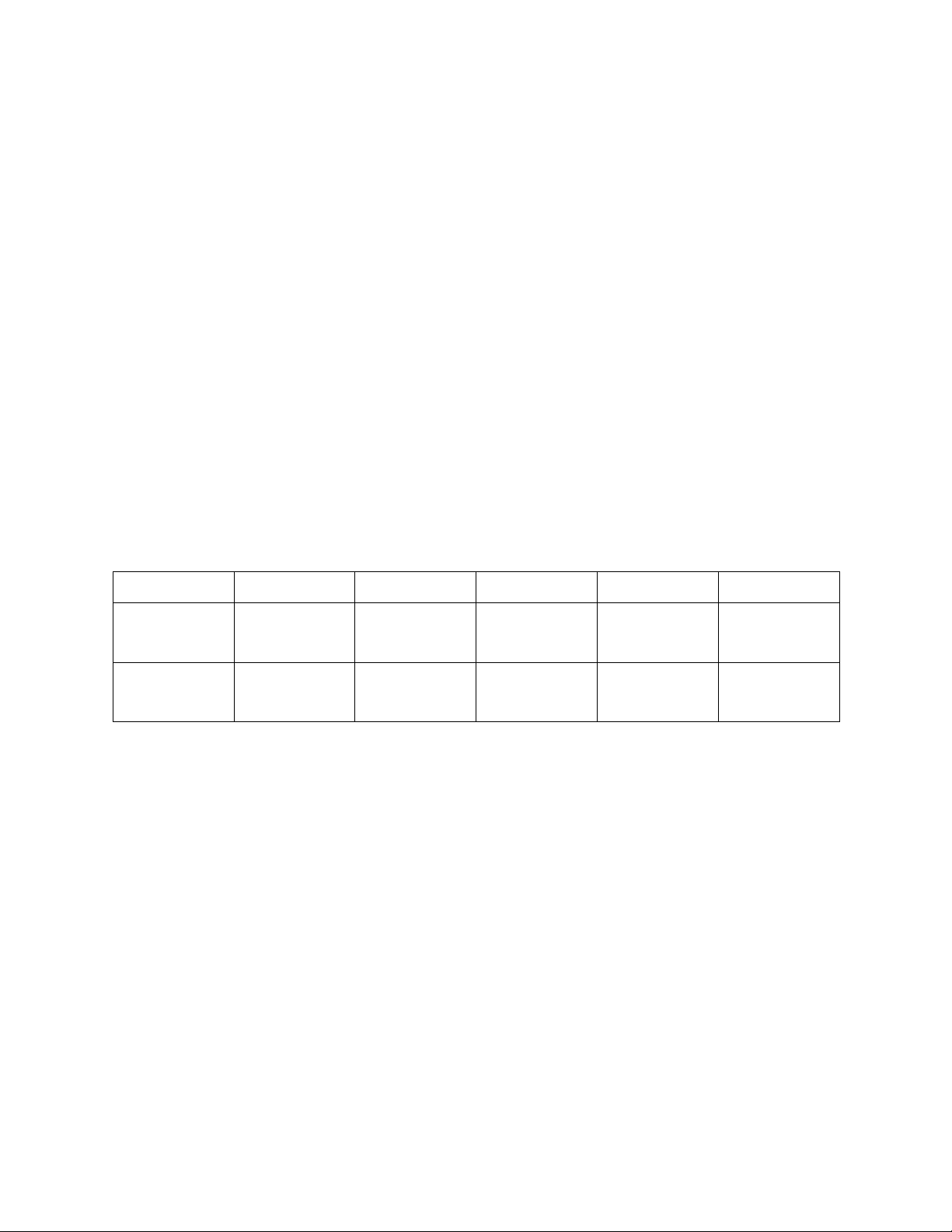
Bài 5: Một chất M có cực đại hấp thụ tại 350nm. Đo độ hấp thụ quang của 05 dung
dịch chuẩn M với các nồng độ khác nhau ở 350nm với cuvet dày 1cm thu được kết quả như sau: Dung dịch A B C D E Nồng độ 2×10−2 4×10−2 6×10−2 8×10−2 10×10−2 (%; kl/tt) Độ hấp thụ 0,21 0,335 0,45 0,58 0,7 quang
Đo độ hấp thụ quang của dung dịch X có chứa chất M ở bước sóng 350nm với cuvet
dày 1cm thu được giá trị A là 0,5
a. Xác định nồng độ % (kl/tt) của chất M trong dung dịch X bằng kỹ thuật đường chuẩn ở trên
b. Nếu sử dụng kỹ thuật đo so sánh sẽ dùng dung dịch nào làm dung dịch chuẩn.
Xác định nồng độ % (kl/tt) của M trong dung dịch X bằng kỹ thuật đo so sánh
So sánh kết quả nồng độ của chất M trong dung dịch X khi sử dụng hai kỹ thuật trên lOMoAR cPSD| 59416725 Đại cương sắc ký I.
Một số khái niệm chung về sắc ký
Sắc ký là một quá trình phân tách các chất trong một mẫu dựa vào sự phân bố của
các chất trong 02 pha, một pha đứng yên là pha tĩnh và một pha di chuyển là pha động.
Pha tĩnh được cố định trên một cột hoặc là một bề mặt chất rắn. Các chất trong mẫu
phân tích có lực liên kết với pha tĩnh khác nhau sẽ di chuyển qua pha tĩnh với tốc độ
khác nhau và tách ra khỏi nhau từ đó làm cơ sở cho phân tích định tính, định lượng.
Pha tĩnh: Stationary Phase (SP) được cố định trong cột hoặc trên bề mặt chất rắn.
Pha động: Mobile Phase (MP) có thể là chất khí, chất lỏng hoặc chất lỏng siêu tới hạn.
- Chất phân tích được hòa tan trong một dung môi thích hợp và đưa lên
SPII. Một số công thức tính toán t2 R t2R
Số đĩa lý thuyết: N=16 W2=5,54 W2 L
Chiều cao đĩa lý thuyết: H= N
Hệ số phân giải: RS=
2(WtR,BB+−Wt RA, A)=1,18W (t. BR+,BW−t R. A, A ) t 'R, B t B−t M
Hệ số chọn lọc: α=
t' R, A =t A−t M
Hệ số đối xứng pic trong sắc ký rửa giải: 1 nửachiềurộng phíasaupicở chiềucao pic b 10 lOMoAR cPSD| 59416725 AF=a= 1
nửachiềurộng phíatrước picở chiềucao pic 10
(AF càng gần 1, pic càng đối xứng 0,9 ≤ AF≤ 1,5) III.Các bài tập
Bài 1: Dữ liệu thực nghiệm cho sắc ký lỏng: - Chiều dài cột 24,7cm
- Tốc độ dòng 0,313 ml/phút - Vm = 1,37ml ; Vs = 0,164ml Hợp chất Thời gian lưu (phút) Bề rộng pic W (phút) Không lưu giữ 3,1 A 5,4 0,41 B 13,3 1,07 C 14,1 1,16 D 21,6 1,72 Hãy tính:
a. Số đĩa lý thuyết theo mỗi pic
b. Số đĩa lý thuyết trung bình, chiều cao đĩa cho cột
c. Tính độ phân giải của 02 chất B và C
d. Tính hệ số chọn lọc α cho chất 02 chất B và C
Bài 2: Dữ liệu thu được từ thực nghiệm cho sắc ký khí dùng cột nhồi 40cm như sau: Hợp chất t R (phút) W1/2 (phút) Không khí 1,9 Metyl cyclohexan 10,0 0,76 Metyl cyclohexen 10,9 0,82 Toluen 13,4 1,06 Hãy xác định:
a. Số đĩa lý thuyết trung bình
b. Chiều cao đĩa lý thuyết cho cột
c. Tính độ phân giải của 02 chất metyl cyclohexan và metyl cyclohexen
d. Tính độ phân giải của 02 chất metyl cyclohexen và toluen
e. Tính độ phân giải của 02 chất metyl cyclohexan và toluen lOMoAR cPSD| 59416725
Sắc ký lớp mỏng – TLC I.
Nguyên tắc của phương pháp sắc ký lớp mỏng
Phương pháp TLC (thin layer chromatography; sắc ký lớp mỏng) là phương pháp
phân tách các chất được thực hiện trên một lớp mỏng gồm các hạt có kích thước
đồng nhất kết dính trên một giá đỡ bằng thủy tinh, nhôm hoặc chất dẻo. Lớp mỏng
kết dính đóng vai trò là pha tĩnh, pha động là các dung môi.
Lực liên kết giữa các chất trong mẫu phân tích với pha tĩnh, pha động khác nhau,
do đó khi tiến hành sắc ký chúng sẽ tách ra khỏi nhau. II. Tính hệ số lưu giữ Rf
Hệ số lưu giữ Rf là một đại lượng đặc trưng cho mức độ di chuyển của các chất phân tích Rf= dd MR
dR: khoảng cách từ điểm xuất phát đến tâm vết phân tích dM:
khoảng cách từ điểm xuất phát tới mức dung môi pha động Rf nằm trong khoảng 0 - 1 III. Các loại pha tĩnh
Pha tĩnh của TLC là các hạt có kích thước 10-30 μm được rải đều và kết dính thành
lớp mỏng đồng nhất dày khoảng 250 μm trên giá đỡ hình vuông. Phân loại:
- Bản mỏng pha thường (pha thuận – được sử dụng chủ yếu): Đối với bản mỏng
pha thường chất càng phân cực có hệ số Rf càng nhỏ
- Bản mỏng pha đảo: Đối với bản mỏng pha đảo chất càng phân cực có hệ số Rf càng lớn
IV. Yêu cầu pha động trong phương pháp TLC
Pha động trong phương pháp TLC là các dung môi. Để tăng khả năng phân tách
người ta hay sử dụng kết hợp 02 hoặc nhiều dung môi
• Dung môi phân cực: có các liên kết giữa các nguyên tử có độ âm điện rất khác
nhau (vd: O và H hoặc Cl và H) lOMoAR cPSD| 59416725
• Dung môi kém phân cực: có các liên kết giữa các nguyên tử có độ âm điện
tương tự nhau (vd: C và H)
n-hexan < chloroform < ethyl acetate < aceton < n-butanol < ethanol < methanol < n ớcƣ
- Dung môi pha động cần độ tinh khiết cao
- Cần điều chỉnh dung môi pha động để chất cần phân tích có hệ số lưu giữ
Rfnằm trong khoảng 0,2 – 0,8.
Đối với sắc ký lớp mỏng pha thường dung môi càng phân cực giá trị Rf của
chất phân tích càng lớn.
Đối với sắc ký lớp mỏng pha đảo dung môi càng phân cực giá trị Rf của chất phân tích càng nhỏ. V.
Các bước thực hiện kỹ thuật TLC
1. Đưa chất phân tích lên bản mỏng - Chuẩn bị bản mỏng
- Chất phân tích được pha trong dung môi với nồng độ thích hợp trước khi đưa lên bản mỏng.
- Lượng mẫu đưa lên bản mỏng ảnh hưởng lớn đến quá trình tách sắc ký 2. Khai triển sắc ký
3. Phát hện vết trên sắc ký đồ
- Soi dưới đèn tử ngoại (UV)
- Phun thuốc thử hiện màu
- Dùng máy đo mật độ quang
4. Thu nhận và xử lý số liệu thực nghiệm
VI. Ưu nhược điểm của phương pháp TLC
Ưu điểm so với GC và HPLC
Thiết bị đơn giản, chi phí thấp
Thời gian phân tích nhanh
Có thể thực hiện đồng thời nhiều mẫu, so sánh trực tiếp mẫu thử và mẫu chuẩn Nhược điểm
Độ lặp lại thấp hơn so với GC và HPLC lOMoAR cPSD| 59416725
Sắc ký lỏng hiệu năng cao – HPLC I.
Nguyên tắc của phương pháp HPLC
- Sắc ký lỏng hiệu năng cao là một phương pháp sắc ký lỏng (pha động là chất lỏng)
- Là quá trình phân tách các chất trong hai pha dưới áp suất cao: pha động và
pha tĩnh. Dưới áp suất cao, pha động được dịch chuyển qua pha tĩnh (hạt pha
tĩnh nhồi trong một cái cột, có kích thước nhỏ cỡ μm) và mang theo các thành
phần hỗn hợp cần phân tách.
- Lực liên kết của các chất phân tích với pha tĩnh và pha động khác nhau do đó
chúng sẽ tách ra khỏi nhau.
II. Ưu và nhược điểm của phương pháp HPLC Ưu điểm: -
Có thể phân tích nhiều loại mẫu khác nhau - Độ chính xác cao - Độ nhạy cao Nhược điểm: -
Chi phí đầu tư tương đối tốn kém -
Thời gian phân tích tương đối lâu -
Đòi hỏi khắt khe về độ tinh khiết của pha động trong quá trình vận hành III. Các bài tập Bài 1:
Định lượng ibuprofen trong thuốc viên nén bằng phương pháp HPLC.
Mẫu chuẩn: Chất chuẩn ibuprofen được pha thành một dãy các dung dịch chuẩn
bằng MeOH. Tiến hành sắc ký HPLC các dung dịch chuẩn thu được phương trình
đường chuẩn biểu diễn sự phụ thuộc của diện tích pic S vào nồng độ C (mg/ml)
là S = 467770,2×C – 541,7.
Mẫu thử: Viên nén ibuprofen được nghiền nhỏ, cân 0,6 g bột mẫu thử cho vào
bình nón 250 ml, thêm khoảng 150 ml MeOH, siêu âm trong 30 phút, lọc cho vào
bình định mức 200 ml, thêm methanol đến vạch thu được dung dịch A. Hút chính
xác 1 ml dung dịch A cho vào bình định mức 200 ml, thêm MeOH đến vạch để
thu được dung dịch B. Tiến hành sắc ký HPLC dung dịch B với cùng điều kiện
như dung dịch chuẩn thu được diện tích pic của ibuprofen trong mẫu thử là 3671,9.
a. Xác định nồng độ % (kl/tt) của ibuprofen trong dung dịch A và dung dịch B lOMoAR cPSD| 59416725
b. Xác định hàm lượng % của ibuprofen trong mẫu thử viên nén ibuprofenBài 2:
Kết quả khi tiến hành phân tích định lượng 02 dược chất tanshinon I và tanshinon
IIA trong dược liệu Đan sâm bằng phương pháp HPLC như sau:
Mẫu thử: 0,6589 g bột dược liệu Đan sâm (độ ẩm dược liệu 7,99%) được cho vào
bình nón dung tích 100 mL. Thêm khoảng 40 mL methanol, chiết siêu âm trong 30
phút ở 300C. Lọc vào bình định mức 50 mL, bổ sung dung môi methanol đến vạch
để thu được dung dịch A. Hút chính xác 10 mL dung dịch A cho vào bình định mức
50 mL, thêm methanol đến vạch để thu được dung dịch B. Dung dịch B được lọc
qua màng lọc 0,45 μM để tiến hành sắc ký.
Mẫu chuẩn tanshinon I: Hòa tan chất chuẩn tanshinon I trong methanol thu được
dung dịch chuẩn có nồng độ C% là 0,0016% (kl/tt) để tiến hành sắc ký.
Mẫu chuẩn tanshinon IIA: Hòa tan chất chuẩn tanshinon IIA trong methanol thu
được dung dịch chuẩn có nồng độ C% 0,0020% (kl/tt) để tiến hành sắc ký.
Cách tiến hành: Tiến hành sắc ký dung dịch thử và các dung dịch chuẩn ở cùng điều kiện
Kết quả thực nghiệm:
Diện tích pic của dung dịch chuẩn tanshinon I: 4699,2
Diện tích pic của dung dịch chuẩn tanshinon IIA: 5641,2
Diện tích pic của tanshinon I trong mẫu thử dung dịch B: 4877,9
Diện tích pic của tanshinon IIA trong mẫu thử dung dịch B: 5589,9 a.
Hãy xác định hàm lượng % của tanshinon I dược liệu Đan sâm tính theo dượcliệu khô kiệt. b.
Hãy xác định hàm lượng % của tanshinon IIA trong dược liệu Đan sâm tính
theodược liệu khô kiệt.




