









Preview text:
MA TRẬN ĐỀ THI HỌC KÌ 2
MÔN: HÓA HỌC 10 – CÁNH DIỀU
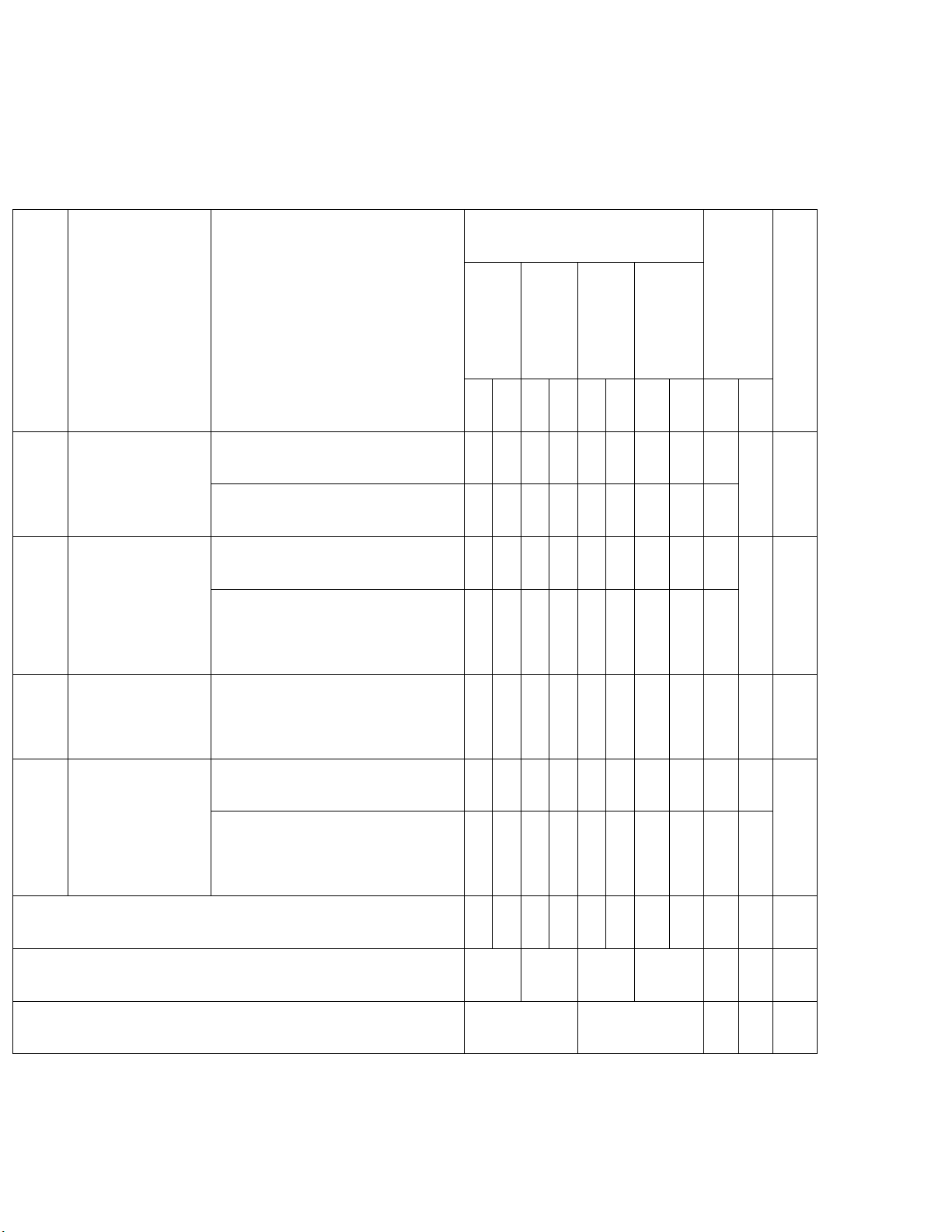
Mức độ nhận thức Tổng số Vận Tổng Nội dung kiến Nhận Thông Vận câu Số TT
Đơn vị kiến thức dụng % thức biết hiểu dụng cao điểm
TN TL TN TL TN TL TN TL TN TL Số oxi hóa
1 0 1 0 0 0 0 0 2 Phản ứng oxi hóa 1 1 20% khử
Phản ứng oxi hóa – khử 1 0 1 0 0 1 0 0 2
Phản ứng hóa học và enthalpy 2 0 1 0 0 0 0 0 3 Năng lượng hóa 2
Ý nghĩa và cách tính biến thiên 0 15% học 2 0 1 0 0 0 0 0 3
enthalpy phản ứng hóa học
Tốc độ phản ứng 3
Tốc độ phản ứng hóa học 4 0 4 0 0 0 0 0 8 0 20% hóa học
Nguyên tố và đơn chất halogen 3 0 2 0 0 1 0 0 5 1 Nguyên tố nhóm 4
Hydrogen halide và hydrohalic 45% VIIA 3 0 2 0 0 0 0 1 5 1 acid
Tổng số câu 16 0 12 0 0 2 0 1 28 3 Tỉ lệ % 40% 30% 20% 10% Tỉ lệ chung 70% 30%
BẢNG ĐẶC TẢ KĨ THUẬT ĐỀ THI HỌC KÌ 2
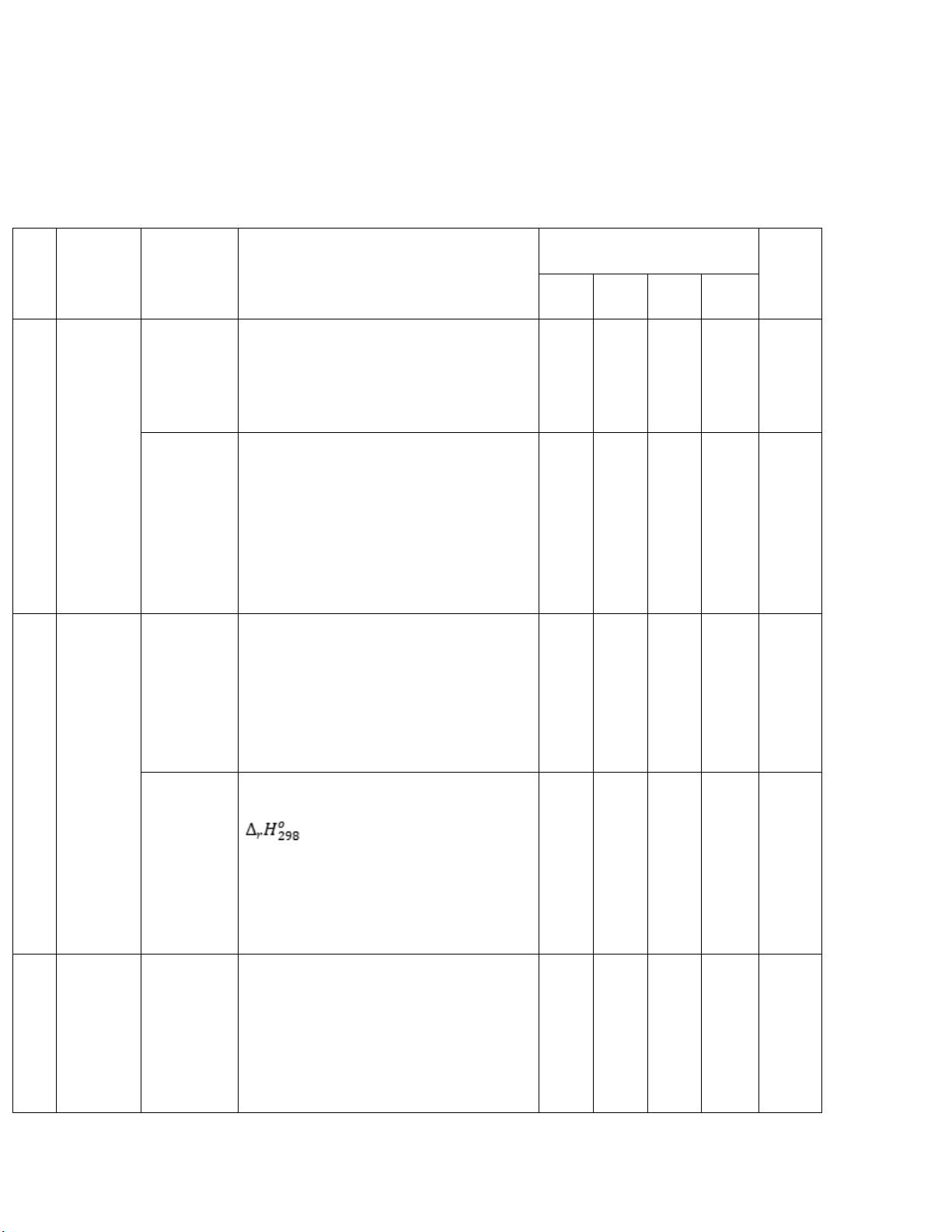
MÔN: HÓA HỌC 10 – CÁNH DIỀU TT Nội Đơn vị
Mức độ kiến thức, kĩ năng cần
Số câu hỏi theo các mức Tổng dung kiến thức
kiểm tra, đánh giá độ nhận thức kiến NB TH VD VCD thức 1 Phản
Số oxi hóa Nhận biết: Số oxi hóa của nguyên tố ứng oxi
trong đơn chất, hợp chất hóa –
Thông hiểu: Xác định được số oxi 1 1 2 khử
hóa của nguyên tố trong một số hợp chất cụ thể Phản ứng
Nhận biết: Khái niệm chất oxi hóa, oxi hóa –
chất khử, sự oxi hóa, sự khử khử
Thông hiểu: Xác định được chất oxi
hóa, chất khử, quá trình oxi hóa, quá 1 1 1 3
trình khử trong phản ứng oxi hóa khử
Vận dụng: Lập được phương trình
hóa học của một số phản ứng oxi hóa – khử 2 Năng Phản ứng Nhận biết: lượng hóa học
- Dự đoán các phản ứng hóa học là hóa học và
phản ứng tỏa nhiệt hay thu nhiệt enthalpy
- Trình bày được khái niệm phản ứng
tỏa nhiệt, thu nhiệt, điều kiện chuẩn 2 1 3
Thông hiểu: Đếm số phát biểu đúng
sai liên quan đến biến thiên enthalpy Ý nghĩa Nhận biết: và cách
- Nêu được ý nghĩa của dấu và giá trị tính biến thiên
- Dựa vào nhiệt phản ứng xác định enthalpy
phản ứng là tỏa nhiệt hay thu nhiệt. 2 1 3 phản ứng
Thông hiểu: Đếm số phát biểu đúng hóa học
sai liên quan đến ý nghĩa biến thiên enthalpy 3 Tốc độ Tốc độ Nhận biết: phản phản ứng
- Trình bày được khái niệm tốc độ ứng hóa hóa học
phản ứng hóa học và cách tính tốc độ học
trung bình của phản ứng.
- Viết được biểu thức tốc độ phản
ứng theo hằng số tốc độ phản ứng và nồng độ.
- Nêu được ý nghĩa của hệ số nhiệt đới Van’t Hoff ( ) Thông hiểu: 4 4 8
- Giải thích được các yếu tố ảnh
hưởng tới tốc độ phản ứng như: nồng
độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác.
- Tính được tốc độ trung bình của một phản ứng hóa học
- Vận dụng được kiến thức tốc độ
phản ứng hóa học vào việc giải thích
một số vấn đề trong cuộc sống và sản xuất. 4 Nguyên
Nguyên tố Nhận biết: tố nhóm và đơn
- Phát biểu được trạng thái tự nhiên VIIA chất
của các nguyên tố halogen halogen
- Chỉ ra được trạng thái, màu sắc,
nhiệt độ nóng chảy, nhiệt độ sôi của các đơn chất halogen.
- Chỉ ra được hiện tượng của các thí
nghiệm so sánh tính oxi hóa của các halogen Thông hiểu 3 2 1 6
- Viết sản phẩm phản ứng thể hiện
tính chất của đơn chất halogen
- Tính thể tích khí chlorine (ở đktc)
tạo thành trong phản ứng đơn giản
- So sánh được tính oxi hóa giữa các halogen
Vận dụng: Bài tập liên quan đến tính
chất hóa học của các đơn chất halogen
Hydrogen Nhận biết: halide và
- Trình bày được xu hướng biến đổi
hydrohalic tính acid của dãy hydrohalic acid. acid
- Chỉ ra được hiện tượng của phản
ứng khi cho dung dịch AgNO3 tác dụng với ion X-
- Nêu được ứng dụng của một số hydrogen halide 3 2 1 6 Thông hiểu:
- Tính được khối lượng kim loại
trong phản ứng đơn giản có HCl tham gia
- Viết được PTHH thể hiện tính chất
hóa học của các acid HX.
Vận dụng cao: Vận dụng giải bài tập
liên quan đến hydrohalic acid, ion halide X Tổng 16 12 2 1 31
Tỉ lệ % từng mức độ 40% 30% 20% 10% 100% nhận thức Tỉ lệ chung 70% 30%
ĐỀ KIỂM TRA HỌC KÌ 2
MÔN: HÓA HỌC 10 – CÁNH DIỀU
Phần I: Trắc nghiệm (7 điểm)
Câu 1. Phát biểu nào sau đây là đúng?
A. Trong tất cả hợp chất, hydrogen luôn có số oxi hóa là +1
B. Trong tất cả các hợp chất, oxygen luôn có số oxi hóa là -2
C. Số oxi hóa của nguyên tử trong bất kì một đơn chất hóa học nào đều bằng 0
D. Tổng số oxi hóa của tất cả các nguyên tử trong một phân tử và trong một ion đa nguyên tử bằng 0.
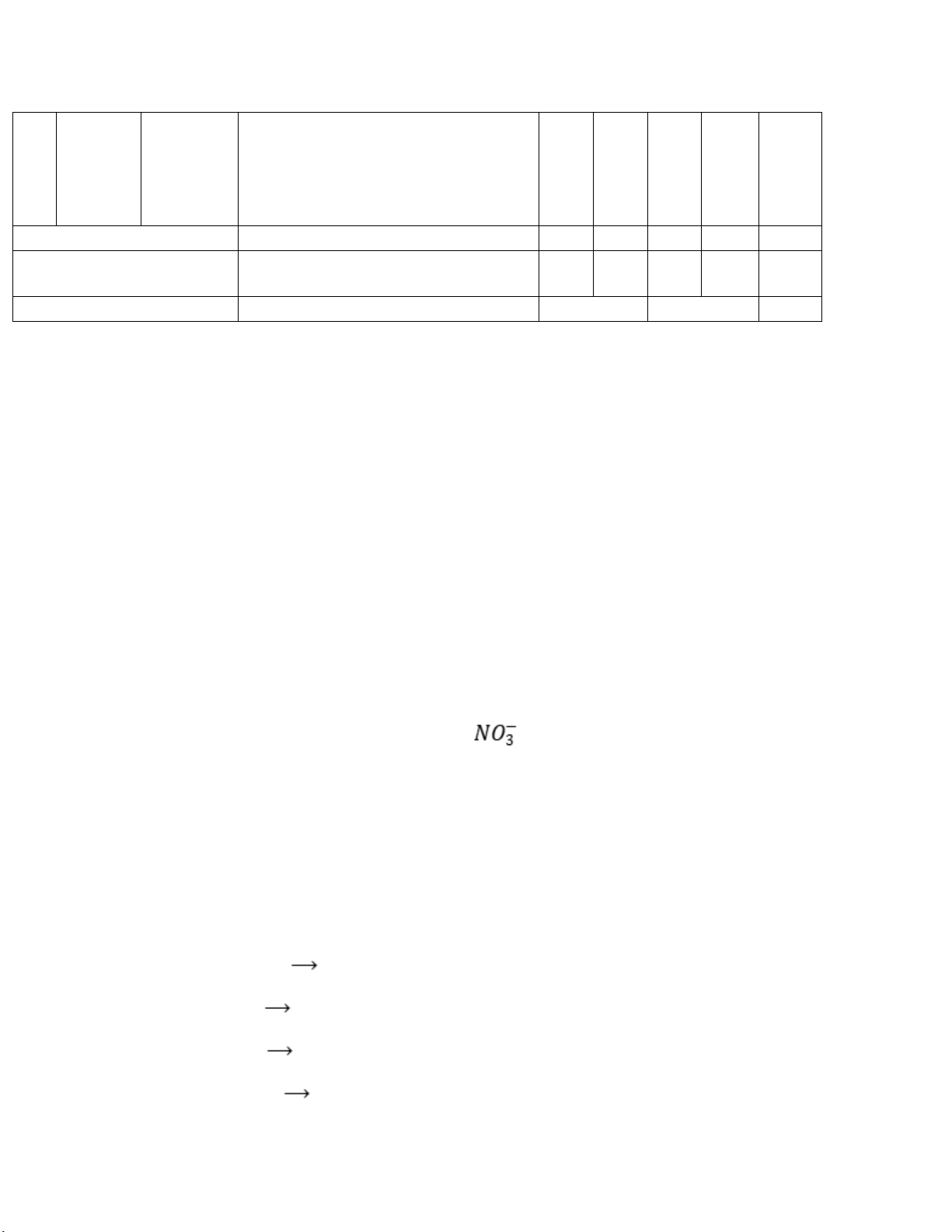
Câu 2. Số oxi hóa của nitrogen trong ion là A. +3 B. +5 C. -3 d. -5
Câu 3. Trong các phản ứng hóa học sau, phản ứng oxi hóa – khử là A. Ba(OH)2 + 2HCl BaCl2 + 2H2O B. Fe3O4 + 8HCl FeCl2 + 2FeCl3 + 4H2O C. Cu + 2AgNO3 Cu(NO3)2 + 2Ag D. FeCl2 + 2NaOH Fe(OH)2 + 2NaCl
Câu 4. Dẫn khí chlorine vào dung dịch KBr xảy ra phản ứng hóa học: Cl2 + 2KBr 2KCl + Br2
Trong phản ứng hóa học trên, xảy ra quá trình oxi hóa chất nào? A. KCl B. Br2 C. Cl2 D. KBr
Câu 5. Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường? A. Phản ứng nung vôi
B. Phản ứng giữa H2 và O2 trong không khí
C. Phản ứng giữa Fe và dung dịch H2SO4 loãng
D. Phản ứng nhiệt phân thuốc tím
Câu 6. Phản ứng thu nhiệt là
A. phản ứng giải phóng năng lượng dưới dạng nhiệt
B. phản ứng hấp thụ năng lượng dưới dạng nhiệt
C. phản ứng giải phóng ion dưới dạng nhiệt
D. phản ứng hấp thụ ion dưới dạng nhiệt
Câu 7. Cho các phát biểu sau:
(a) Trong phòng thí nghiệm, có thể nhận biết một phản ứng thu nhiệt hoặc tỏa nhiệt
bằng cách đo nhiệt độ của phản ứng bằng một nhiệt kế
(b) Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng thu nhiệt
(c) Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng tỏa nhiệt
(d) Nhiệt độ của hệ phản ứng sẽ giảm đi nếu phản ứng tỏa nhiệt
(e) Nhiệt độ của hệ phản ứng sẽ giảm đi nếu phản ứng thu nhiệt Số phát biểu đúng là A. 2 B. 3 C. 4 D. 5
Câu 8. Cho các phương trình nhiệt hóa học sau: (1) 2NaHCO3(s) Na2CO3(s) + H2O(l) + CO2(g) (2) 4NH3(g) + 3O2(g) 2N2(g) + 6H2O(l) Nhận xét đúng là
A. Phản ứng (1) tỏa nhiệt, phản ứng (2) thu nhiệt
B. Cả hai phản ứng đều thu nhiệt
C. Phản ứng (1) thu nhiệt, phản ứng (2) tỏa nhiệt
D. Cả hai phản ứng đều tỏa nhiệt
Câu 9. Cho phản ứng sau: SO2(g) + O2(g) SO3(l)
Biến thiên enthalpy chuẩn của phản ứng tính theo nhiệt tạo thành là A. B. C. D.
Câu 10. Cho phản ứng tạo thành propene từ propyne: CH3 – C CH(g) + H2(g) CH3 – CH = CH2(g)
Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn Liên kết C – H C – C C = C C C H – H Eb(kJ/mol) 413 347 614 839 432
Biến thiên enthalpy chuẩn của phản ứng là A. -169 kJ B. +169 kJ C. -196 kJ D. +196 kJ
Câu 11. Với phản ứng đơn giản: aA + bB
sản phẩm, tốc độ phản ứng được tính theo công thức A. v = k B. v = k.CA.CB C. v = D. v = abCACB
Câu 12. Cho các phản ứng sau:
(1) Phản ứng than cháy trong không khí
(2) Phản ứng tạo gỉ sắt
(3) Phản ứng nổ của khí bình gas
(4) Phản ứng lên men rượu
Phản ứng xảy ra với tốc độ nhanh nhất là A. (1) B. (2) C. (3) D. (4)
Câu 13. Cho các phát biểu sau:
(a) Phản ứng đơn giản là phản ứng xảy ra theo một bước
(b) Phản ứng đơn giản là phản ứng có các hệ số tỉ lượng trong phương trình hóa
học bằng nhau và bằng 1
(c) Tốc độ của một phản ứng đơn giản tuân theo định luật tác dụng khối lượng
(d) Tốc độ của mọi phản ứng hóa học đều tuân theo định luật tác dụng khối lượng Số phát biểu đúng là A. 4 B. 3 C. 2 D. 1
Câu 14. Cho phản ứng: Br2(l) + HCOOH(aq) 2HBr(aq) + CO2(s)
Nồng độ ban đầu của Br2 là aM, sau 50 giây nồng độ Br2 còn lại là 0,02M. Tốc độ
trung bình của phản ứng trên là 4.10-5 M/s. Giá trị của a là A. 0,02M B. 0,07M C. 0,02M D. 0,022M
Câu 15. Việc làm nào dưới đây thể hiện sự ảnh hưởng của diện tích bề mặt đến tốc
độ phản ứng: CaCO3((s) + 2HCl(aq) CaCl2(aq) + CO2(g) + H2O(l)? A. Pha loãng dung dịch HCl
B. Nghiền nhỏ đá vôi CaCO3
C. Sử dụng chất xúc tác
D. Tăng nhiệt độ của phản ứng
Câu 16. Cho các phát biểu sau:
(a) Khi đốt củi, nếu thêm một ít dầu hỏa lửa sẽ cháy to hơn. Như vậy, dầu hỏa
đóng vai trò chất xúc tác cho quá trình này.
(b) Để thực phẩm tươi lâu, người ta dùng phương pháp bảo quản lạnh. Ở nhiệt độ
thấp, quá trình phân hủy các chất diễn ra chậm hơn
(c) Trong quá trình làm sữa chua, lúc đầu người ta phải pha sữa trong nước ấm và
thêm men là để tăng tốc độ quá trình gây chua. Sau đó làm lạnh để kìm hãm quá trình này
(d) Tùy theo phản ứng mà có thể dùng một, một số hoặc tất cả yếu tố để tăng tốc độ phản ứng Số phát biểu sai là A. 1 B. 2 C. 3 D. 4
Câu 17. Hệ số nhiệt độ Van’t Hoff được kí hiệu là A. B. C. D.
Câu 18. Cho phản ứng đơn giản xảy ra trong bình kín: H2(g) + Cl2(g) 2HCl(g)
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 giảm 4 lần và nồng độ Cl2 tăng 2 lần A. tăng 4 lần B. giảm 4 lần C. giảm 2 lần D. tăng 8 lần
Câu 19. Phản ứng giữa đơn chất halogen nào sau đây với hydrogen diễn ra mãnh
liệt, nổ ngay cả trong bóng tối hoặc ở nhiệt độ thấp? A. I2 B. Br2 C. Cl2 D. F2
Câu 20. Dung dịch Br2 có thể phản ứng được với dung dịch nào sau đây? A. NaF B. NaCl C. NaBr D. NaI
Câu 21. Trong công nghiệp, người ta sử dụng phản ứng giữa chlorine với dung
dịch nào sau đây để tạo ra nước Javel có tính oxi hóa mạnh phục vụ cho mục đích
sát khuẩn, vệ sinh gia dụng? A. NaBr B. NaOH C. NaCl D. MgCl2
Câu 22. Cấu hình electron lớp ngoài cùng của nguyên tố halogen là A. ns2np3 B. ns2np4 C. ns2np5 D. ns2np6
Câu 23. Ở điều kiện thường, đơn chất chlorine có màu A. lục nhạt B. vàng lục C. nâu đỏ D. tím đen
Câu 24. Dung dịch chất nào sau đây được dùng để trung hòa môi trường base,
hoặc thủy phân các chất trong quá trình sản xuất, tẩy rửa gỉ sắt (thành phần chính
là các iron oxide) bám trên bề mặt của các loại thép? A. H2SO4 B. HCl C. NaOH D. NaCl
Câu 25. Để phân biệt các dung dịch: NaF, NaCl, NaBr, NaI ta dùng A. dung dịch HCl B. quỳ tím C. dung dịch BaCl2 D. dung dịch AgNO3
Câu 26. Hydrohalic acid có tính acid mạnh nhất là A. Hydrochloric acid B. Hydrofluoric acid C. Hydrobromic acid D. Hydroiodic acid
Câu 27. Phản ứng giữa chất nào sau đây với dung dịch H2SO4 đặc, nóng không
phải là phản ứng oxi hóa – khử? A. KBr(s) B. KI(s) C. NaCl(s) D. NaBr(s)
Câu 28. Phản ứng hóa học nào sau đây là sai? A. 2HCl + Fe FeCl2 + H2 B. SiO2 + 4HF SiF4 + 2H2O C. Cl2 + 2NaBr 2NaCl + Br2 D. AgNO3 + HF HNO3 + AgF
Phần II. Tự luận (3 điểm)
Câu 1 (1 điểm): Cho m gam KClO3 tác dụng với HCl đến khi phản ứng xảy ra
hoàn toàn thấy thoát ra V lít khí Cl2 ở đktc. Biết lượng Cl2 sinh ra phản ứng vừa đủ với 0,56 gam Fe.
a) Viết các phương trình hóa học xảy ra, chỉ rõ chất khử, chất oxi hóa b) Xác định m và V
Câu 2 (1 điểm): Viết các phương trình hóa học chứng minh tính oxi hóa giảm dần
theo chiều: F2 > Cl2 > Br2 > I2
Câu 3 (1 điểm): Cho 2,24 gam hỗn hợp gồm: CaCO3 và Mg vào một lượng dung
dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn thấy thoát ra 0,7437 lít hỗn hợp
khí ở đkc. Xác định phần trăm khối lượng của các chất trong hỗn hợp ban đầu.
ĐÁP ÁN ĐỀ THI HỌC KÌ 2
MÔN: HÓA HỌC 10 – CÁNH DIỀU
Phần I: Trắc nghiệm 1 - C 2 - B 3 - C 4 - D 5 - C 6 - B 7 - B 8 – C 9 - C 10 - A
11 - A 12 - C 13 - C 14 - D 15 - B 16 - A 17 - B 18 - C 19 - D 20 - D
21 - B 22 - C 23 - B 24 - B 25 - D 26 - D 27 - C 28 - D Phần II; Tự luận Câu 1:
a) Các phương trình hóa học xảy ra: KClO3 + 6HCl 3Cl2 + KCl + 3H2O
Chất khử: HCl; chất oxi hóa: KClO3 3Cl2 + 2Fe 2FeCl3
Chất khử: Fe; chất oxi hóa: Cl2 b) nFe = = 0,01 mol KClO3 + 6HCl 3Cl2 + KCl + 3H2O 0,005 0,015 3Cl2 + 2Fe 2FeCl3 0,015 0,01
Vậy m = 0,005.122,5 = 0,6125 gam
V = 0,015.24,79 = 0,37185 lít Câu 2:
Các phương trình hóa học chứng minh H2 + F2 2HF H2 + Cl2 2HCl H2 + Br2 2HBr to, xt H2 + I2 2HI Câu 3: nkhí = = 0,3 mol
Gọi số mol CaCO3 là x (mol); số mol Mg là y (mol) CaCO3 + 2HCl CaCl2 + CO2 + H2O (1) x x mol Mg + 2HCl MgCl2 + H2 (2) y y mol Ta có hệ phương trình %
%mMg = 100% - 89,286% = 10,714%
Document Outline
- MA TRẬN ĐỀ THI HỌC KÌ 2
- MÔN: HÓA HỌC 10 – CÁNH DIỀU
- BẢNG ĐẶC TẢ KĨ THUẬT ĐỀ THI HỌC KÌ 2
- MÔN: HÓA HỌC 10 – CÁNH DIỀU (1)
- ĐỀ KIỂM TRA HỌC KÌ 2
- MÔN: HÓA HỌC 10 – CÁNH DIỀU (2)




