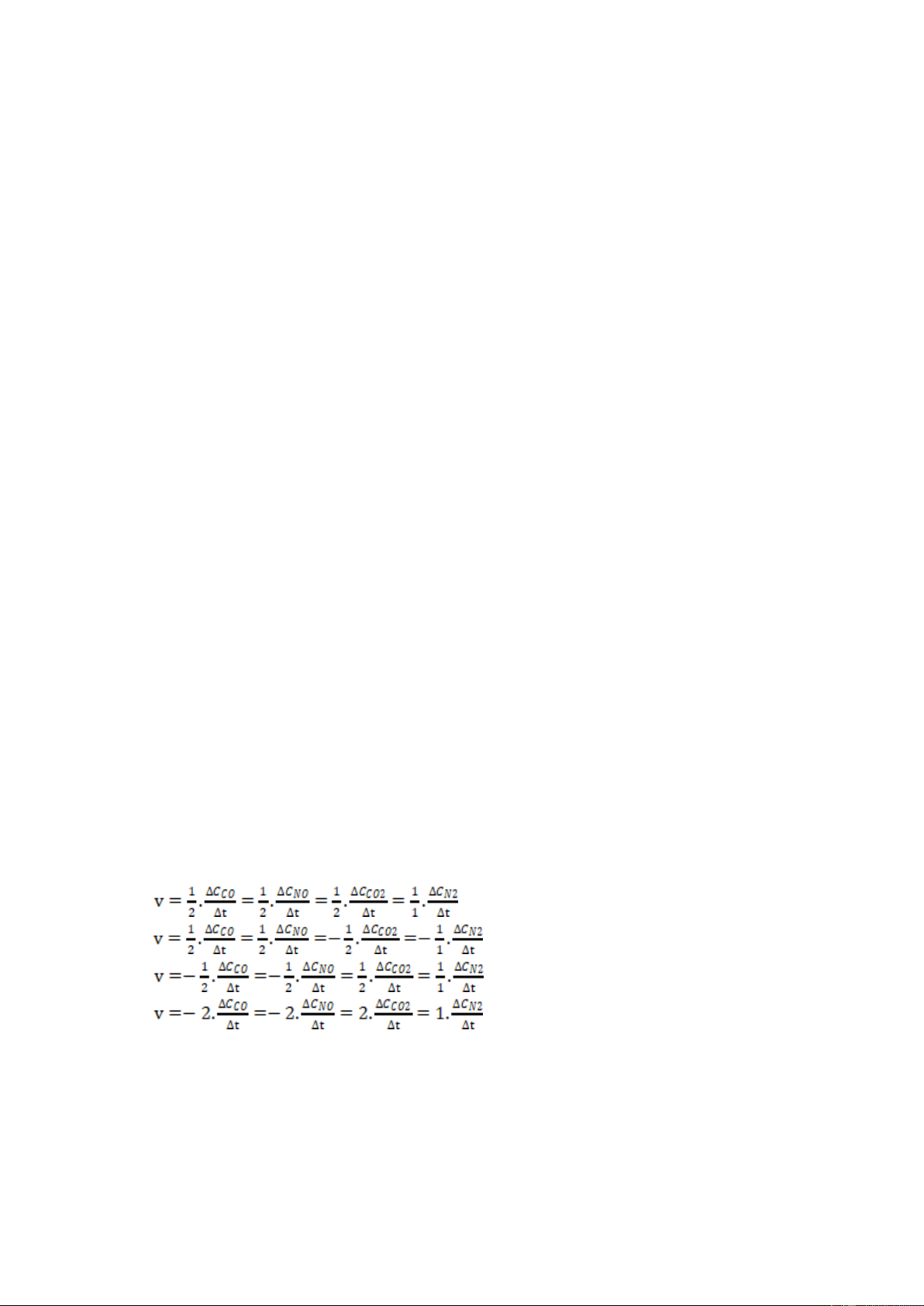



Preview text:
ÔN TẬP HỌC KÌ 2 – HÓA 10 – ĐỀ 8 I. TRẮC NGHIỆM:
Câu 1: Cho các nhận định sau:
1. Quá trình khử là qúa trình nhường e.
2. Quá trình oxi hóa là quá trình nhường e.
3. Chất bị khử là chất nhường e, có số oxi hóa tăng sau phản ứng
4. Chất bị oxi hóa là chất nhường e, có số oxi hóa tăng sau phản ứng
Nhận định đúng là A. 1, 2, 4. B. 2, 4. C. 2, 3, 4. D. 1, 2, 3, 4.
Câu 2: Cho phản ứng sau: SO2 + Br2 + H2O → H2SO4 + HBr . Trong phản ứng trên xảy ra
A. Sự khử Br2 và sự oxi hóa SO2.
B. Sự oxi hóa H2SO4 và sự khử Br2.
C. Sự khử SO2 và sự oxi hóa Br-1.
D. Sự khử SO2 và sự oxi hóa Br2.
Câu 3: Cho các phản ứng hoá học sau:
1. 3HNO3 + Fe(OH)3 → Fe(NO3)3 + 3H2O. 2. 2Fe + 3Cl2 → 2FeCl3.
3. H2SO4 + BaSO3 → BaSO4 + SO2 + H2O.
4. 2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2 + 8H2O.
Phản ứng oxi hoá – khử là A. 1, 2, 4. B. 2, 3, 4. C. 1, 2, 3, 4. D. 2, 4.
Câu 4: Cho phản ứng ở dạng đơn giản: aA + bB → cC + dD. Nhận xét nào về tốc độ phản ứng tức thời là đúng ?
A. Biểu thức tốc độ tức thời theo định luật tác dụng khối lượng là v = k.a.CA.b.CB.
B. Hằng số tốc độ phản ứng k chỉ phụ thuộc vào bản chất phản ứng và áp suất.
C. Định luật phản ứng đúng cho tất cả các loại phản ứng.
D. Khi nồng độ CA và CB bằng 1, thì k được gọi là tốc độ riêng.
Câu 5: Cho phản ứng sau: 2CO(g) + 2NO(g)
2CO2(g) + 1N2(g) . Biểu thức tốc độ trung bình của phản ứng là A. B. C. D.
Câu 6: Cho các phản ứng sau: 0 1. Cl t , xt 2(g) + H2(g) 2HCl(g) 2. SiO2(s) + 4HF(l) SiF4(aq) + 2H2O(l) 3. SO2(g) + Ca(OH)2(aq) CaSO3(s) + H2O (l)
4. KCl (aq) + AgNO3 (aq) AgCl(s) + HNO3(aq) 5. 2H2S(g) + 3O2(g) 2SO2(g) + 2H2O(l)
Yếu tố áp suất ảnh hưởng đến tốc độ phản ứng nào ? A. 1, 3, 5. B. 1, 2, 3, 5. C. 1, 3, 4, 5. D. 1, 2, 3, 4.
Câu 7: Khi sản xuất rượu, người ta cho nước vào củ khoai, củ sắn rồi nấu chín. Sau đó cho men vào ủ một thời
gian rồi nấu thành rượu. Các yếu tố làm cho phản ứng xảy ra nhanh hơn là
A. Nhiệt độ, xúc tác, áp suất.
B. Nhiệt độ, xúc tác.
C. Nhiệt độ, xúc tác, kích thước củ.
D. Nhiệt độ, xúc tác, khối lượng củ.
Câu 8: Cho a gam kim loại Mg dạng hạt vào lượng dư dung dịch HCl 2M, phương trình hóa học xảy ra như
sau: Mg(s) + 2HCl (aq) → MgCl2 (aq) + H2 (g). Khi thay đổi các yếu tố nào dưới đây thì tốc độ khí H2 thoát ra nhanh hơn
A. Thay a g Mg bột bằng a g hạt Mg.
B. Thay dung dịch HCl 2M bằng dung dịch HCl 1M.
C. Thực hiện phản ứng ở nhiệt độ cao hơn bằng cách đun nóng nhẹ dung dịch HCl.
D. Thêm vào 2 lít dụng dịch HCl 2M.
Câu 9: Cho các nhận xét sau về “tính chất chung của các nguyên tử hoặc đơn chất halogen” là
1. Các nguyên tố halogen thuộc nhóm VIIA.
2. Đều có 7 e lớp ngoài cùng thuộc phân lớp ns2np5.
3. Có tính chất hóa học đặc trưng là tính oxi hóa mạnh.
4. Vừa có tính oxi hóa, vừa có tính khử.
5. Tính oxi hóa giảm dần từ F2 đến I2. Nhận xét nào đúng ? A. 1, 2, 3, 4, 5. B. 1, 2, 3, 5. C. 1, 2, 3, 4. D. 1, 3, 4, 5.
Câu 10: Ở điều kiện thường, đơn chất halogen ở trạng thái rắn, có màu đen tím là A. Cl2. B. I2. C. Br2 . D. F2.
Câu 11: Trong tự nhiên, Ion Chloride có nhiều trong nước biển, trong quặng halite thường gọi là muối mỏ,
công thức quặng halite là A. KCl. B. CaCl2. C. NaCl. D. BaCl2.
Câu 12: Trong các đơn chất halogen, halogen có nhiệt độ sôi thấp nhất là A. Cl2. B. I2. C. Bjr2 . D. F2.
Câu 13: Nguyên nhân dẫn tới nhiệt độ nóng chảy, nhiệt độ sôi của các đơn chất halogen tăng từ fluorine đến
iodine là do từ fluorine đến iodine,
A. khối lượng phân tử và tương tác van der Waals đều tăng.
B. tính phi kim giảm và tương tác van der Waals tăng.
C. khối lượng phân tử tăng và tương tác van der Waals giảm.
D. độ âm điện và tương tác van der Waals đều giảm.
Câu 14: Halogen X được sử dụng trong sản xuất chất dẻo ma sát thấp dùng cho thiết bị nhà bếp, dụng cụ thí
nghiệm,... Một số hợp chất khác của X dùng trong sản xuất nhôm; sản xuất thuốc trừ sâu, chống gián; một số
muối X khác được thêm vào thuốc đánh răng, tạo men răng,... Chất X là A. Flourine. B. Chlorine. C. Iodine. D. Bromine.
Câu 15: Cho các phát biểu sau:
(1) Nước Javen có khả năng tẩy màu và sát khuẩn.
(2) Cho giấy quì tím vào dung dịch nước chlorine thì quì tím chuyển màu hồng sau đó lại mất màu.
(3) Trong phản ứng của HCl với MnO2 thì HCl đóng vai trò là chất bị khử.
(4) Dung dịch muối ăn NaCl có lẫn một ít NaBr và NaI. Để tinh chế muối ăn, ta sục khí Cl2 đến dư vào dung dịch trên.
Số phát biểu đúng là A. 3. B. 4. C. 2. D. 1. II. TỰ LUẬN:
Câu 1: Viết các phản ứng sau (ghi rõ điều kiện, nếu có)
a. Cho Na tác dụng với Br2.
..................................................................................................................................................................
b. Sục khí Chlorine vào bình chứa dung dịch NaOH , sau đó đun nóng.
.................................................................................................................................................................. c. Cho Iodine vào nước.
..................................................................................................................................................................
d. Cho Hydrogen tác dụng với iodine.
..................................................................................................................................................................
Câu 2: Cho phản ứng sau: 2H2S(g) + 3O2(g) 2SO2(g) + 2H2O(l)
a. Viết biểu thức tốc độ tức thời của phản ứng ?
...................................................................................................................................................................................
b. Ở nhiệt độ không đổi, tốc độ phản ứng thay đổi như thế nào khi:
- Nồng độ H2S tăng lên 2 lần và nồng độ O2 không đổi.
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
- Nồng độ H2S không đổi và nồng độ O2 giảm đi 3 lần.
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
- Nồng độ H2S và nồng độ O2 tăng lên 2 lần.
..................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
Câu 3: Nhỏ từ từ đến hết 16 lít dung dịch HCl 0,2M vào 79 gam KMnO4 thu được khí X2 (đkc). Sục toàn bộ
khí Cl2 thu được vào nước biển có chứa muối NaX thu được 160 gam halogen X2. Xác định X ?
Câu 4: Chlorine B (C6H5ClNNaO2S) là chất thường được sử dụng để sát khuẩn trên các bề mặt, vật dụng hoặc
dùng để khử trùng, sát khuẩn, xử lý nước sinh hoạt. Ở nồng độ cao, chloramine B có tác dụng diệt nấm mốc, vi
khuẩn, virus gây bệnh cho người. Chloramine B có dạng viên nén (mỗi viên có khối lượng 0,3 – 2,0 gam) và
dạng bột. Chloramine B 25% (250mg chlorine hoạt tính trong một viên nén như hình bên) được dùng phổ biến,
vì tiện dụng khi pha chế và bảo quản.
a. Nồng độ chloramine B khi hòa tan vào nước đạt 0,001% có tác dụng sát khuẩn dùng trong xử lí nước sinh
hoạt. Cần dùng bao nhiêu viên nén chloramine B 25% (loại viên 1 gam) để xử lí bình chứa 200 lít nước? Đ.A: 2 viên.
b. Chloramine B nồng độ 2% dùng để xịt trên các bề mặt vật dụng nhằm sát khuẩn, virus gây bệnh. Để pha chế
dung dịch này, sử dụng chloramine B 25% dạng bột, vật cần bao nhiêu gam bột chloramine B 25% pha với 1 lít
nước để dung dịch sát khuẩn 2%. Đ.A: 20g.
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................
...................................................................................................................................................................................




