


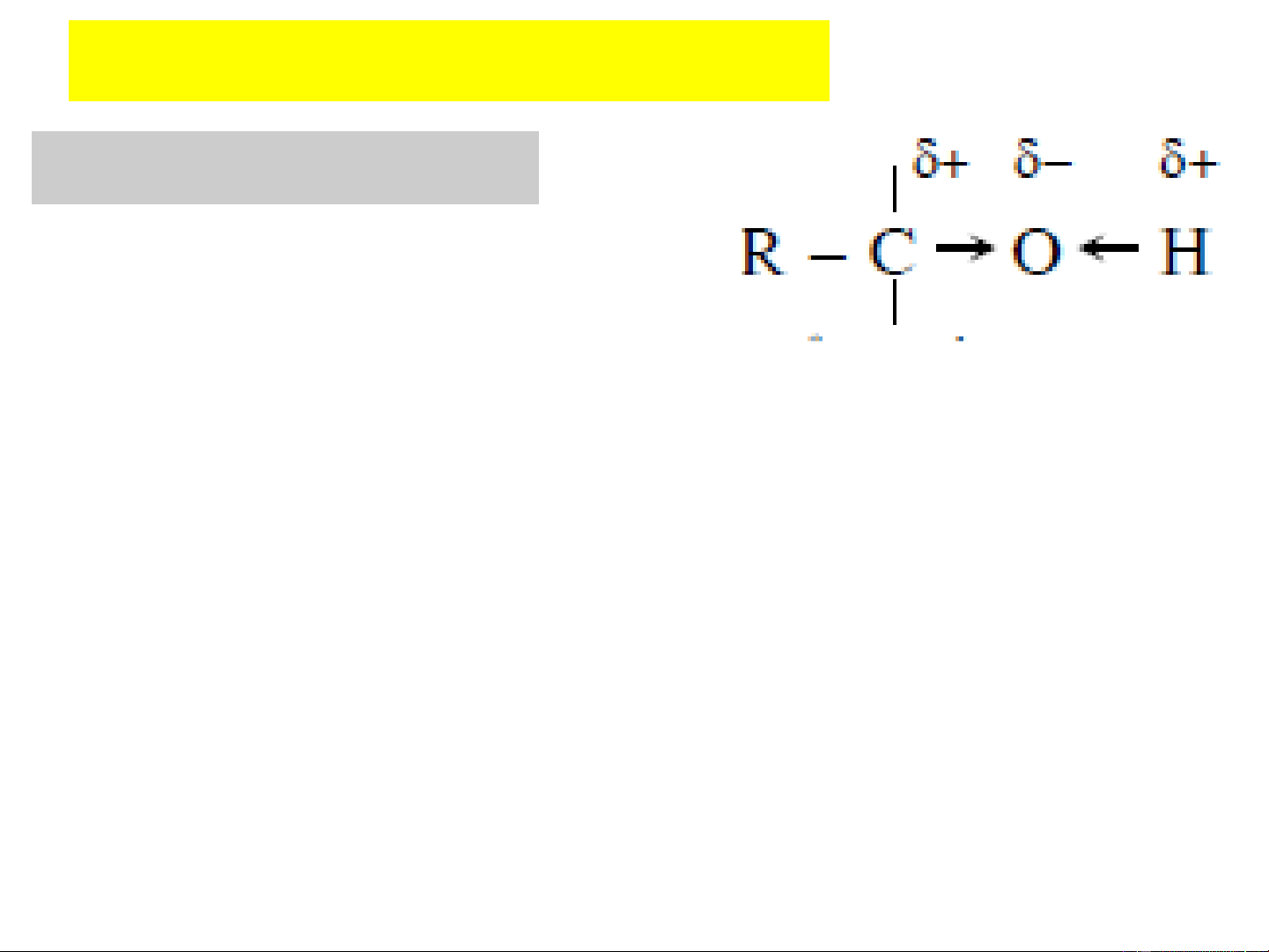


Preview text:
HỢP CHẤT ANCOL (1) ANCOL (RƯỢU) NO ĐƠN CHỨC 1. KHÁI NIỆM
Ancol là hợp chất có nhóm hydroxyl (OH) liên
kết trực tiếp với nguyên tử cacbon no (cacbon
ở trạng thái lai hoá sp3). Nhóm chức của ancol
là −C−OH, công thức phân tử chung là R−OH.
+ Ancol còn được gọi là RƯỢU ❖Phân loại CH − 2 OH
+ Theo gốc Hydrocacbon:
CH -CH -OH CH =CH-CH -OH 3 2 2 2 ancol no ancol không no Ancol anco b l e th n ơ zy m lic Ancol phenyl metylic 1. KHÁI NIỆM ❖ Phân loại
+ Theo số nhóm -OH: ancol đơn chức (1 nhóm OH)
và ancol đa chức (2 nhóm OH trở lên) - monoancol:
CH −CH −CH OH (1 nhãm OH) 3 2 2 − - diol (diancol): CH CH (2 nhãm OH) 2 2 OH OH - triol (triancol):
CH −CH−CH 2 2 (3 nhãm OH) OH OH OH
- polyol (polyancol) là những ancol có nhiều nhóm OH.
+ Một số loại ancol thông dụng
- Ancol no, đơn chức, mạch hở: Phân tử có 1 nhóm -OH liên
kết với gốc Ankyl: C H OH hay C H O (với n ≥ 1) n 2n+1 n 2n+2
Ví dụ: CH OH, C H OH,... 3 2 5
- Ancol không no, đơn chức, mạch hở: Phân tử có 1
nhóm -OH liên kết với nguyên tử cacbon no của gốc hydrocacbon không no.
Ví dụ: CH =CH-CH -OH, CH -CH=CH-CH -OH, ... 2 2 3 2
- Ancol vòng no, đơn chức: Phân tử có nhóm -OH liên kết
với nguyên tử cacbon no thuộc nhóm hydrocacbon vòng no:
Ví dụ: C H OH xiclohexanol 6 11
- Ancol thơm, đơn chức: Phân tử có nhóm -OH liên kết với
nguyên tử cacbon no thuộc mạch nhánh của vòng benzen
Ví dụ: C H -CH -OH (ancol benzylic) 6 5 2
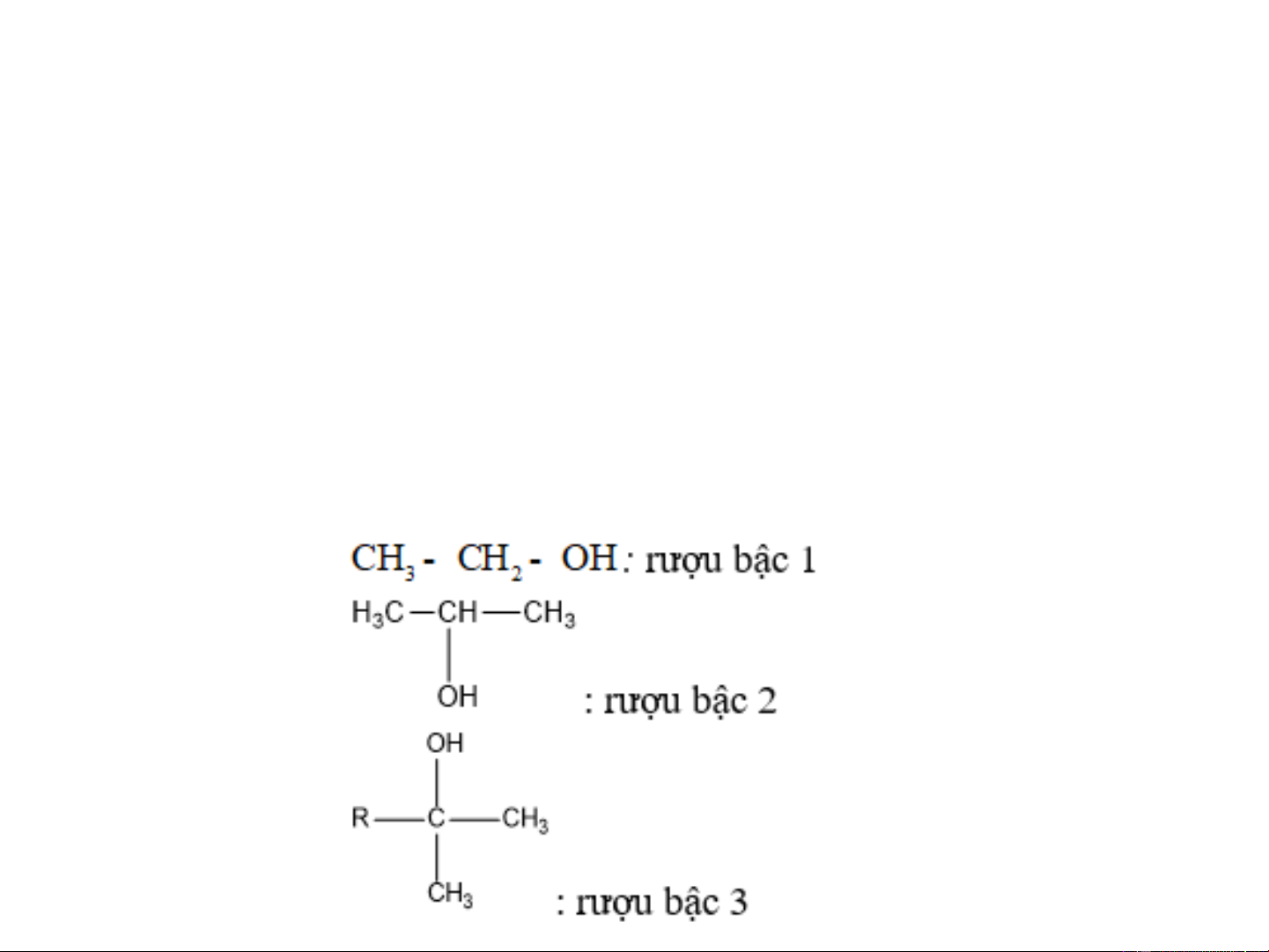
❖ Bậc của Ancol (rượu): bằng bậc của nguyên tử C liên kết với nhóm -OH R - R, - R - CH - OH CH - OH , - R - C - OH ,, - R R R bËc 1 R bËc 2 R bËc 3 2. DANH PHÁP
❖ Tên thông thường: ancol (rượu) + tên của gốc ankyl tương ứng + "ic" CH OH 3
CH −CH−CH 3 3 ancol metylic OH ancol isopropylic C H OH 2 5
CH −CH −CH OH ancol n-propylic ancol etylic 3 2 2
❖ Gọi tên theo Kolbe: Gọi ancol metylic CH OH là “cacbinol”. 3
Các đồng đẳng của ancol metylic được coi là sản phẩm thế H
của cacbinol bằng gốc ankyl
CH −CH−CH 3 3 CH − 3 CH2OH metyl cacbinol OH CH − −
3 CH2 CH2OH etyl cacbinol dimetyl cacbinol 2. DANH PHÁP
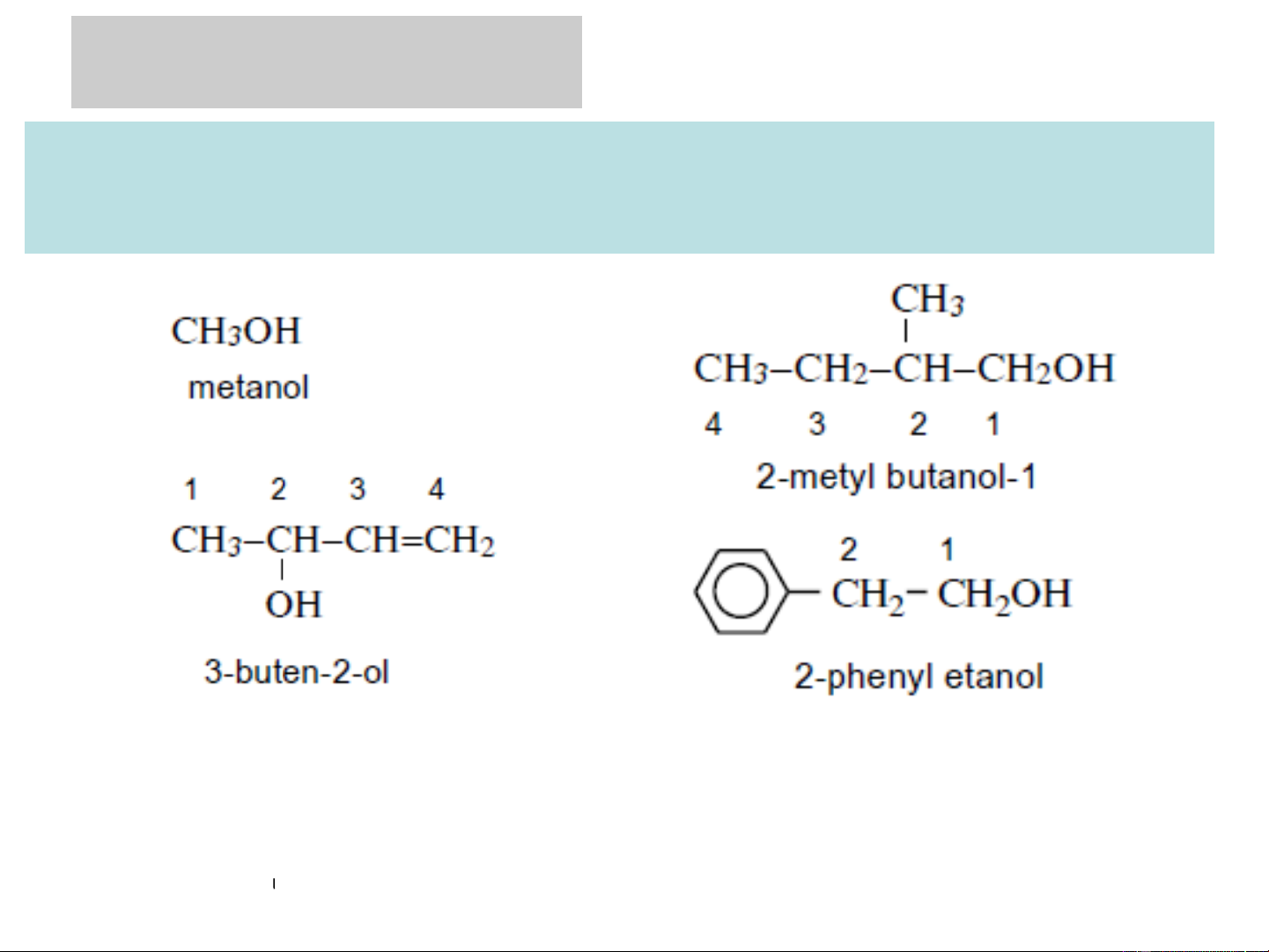
❖Tên theo IUPAC: tên của hydrocacbon tương ứng
+ số chỉ vị trí nhóm OH + "ol" Chú ý:
Đánh số thứ tự mạch bắt đầu từ đầu mạch gần nhóm OH để
nguyên tử cacbon liên kết với nhóm OH có chỉ số nhỏ hơn 3. ĐIỀU CHẾ ANCOL
❖ Điều chế ancol từ CO và H2 CO + H
CH OH + C H OH + n-C H OH + ... 2 3 2 5 3 7
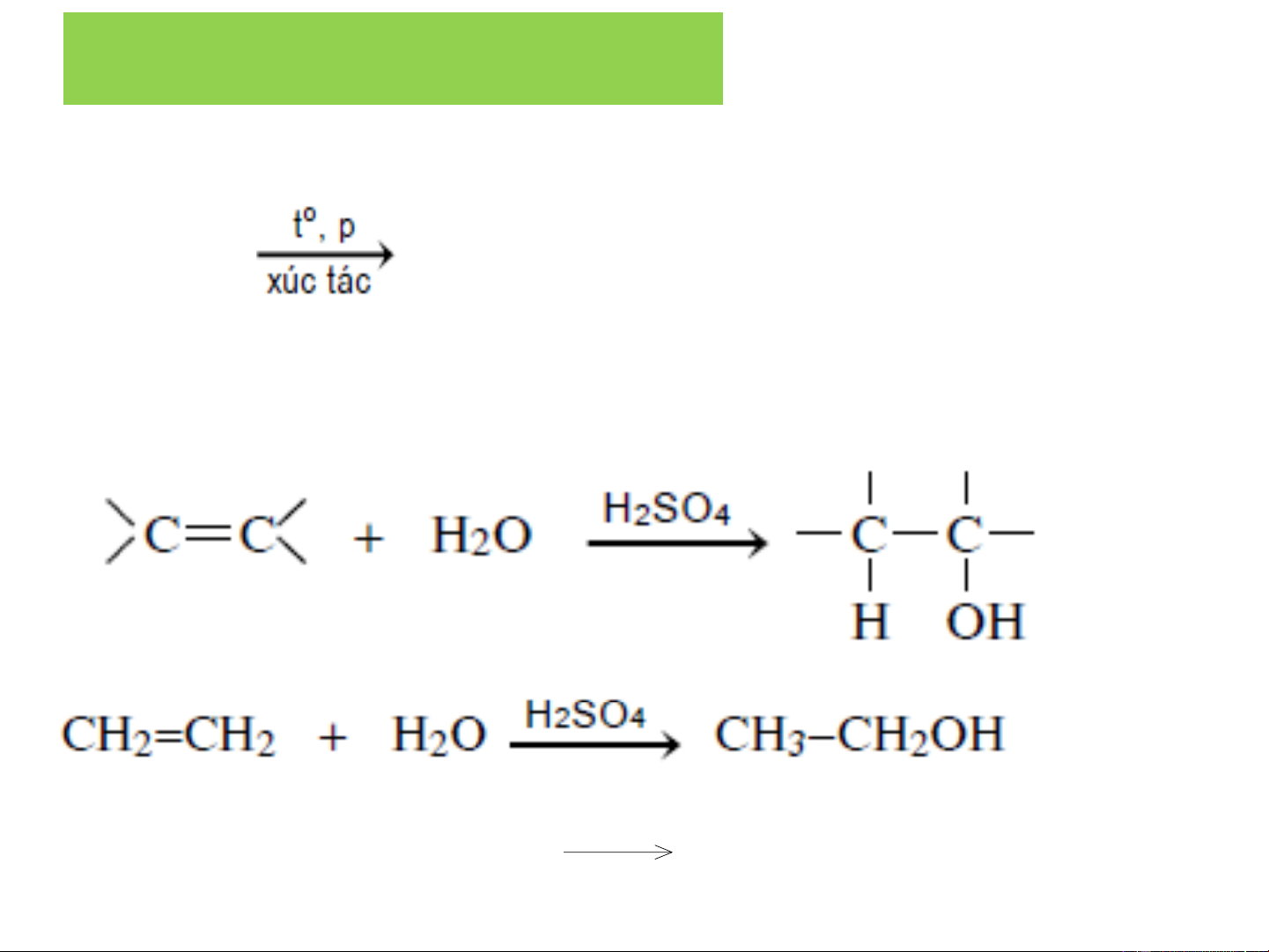
Phản ứng này được áp dụng trong công nghiệp ❖ Hydrat hoá anken: + H C H Hydrat hoá các 2 + 4 H O 2 C H 2 O 5 H đồng đẳng của + etylen tạo H R - CH = CH + ancol bậc 2 2 HOH R - CH - CH3 - hoặc bậc 3 OH
3. ĐIỀU CHẾ ANCOL :
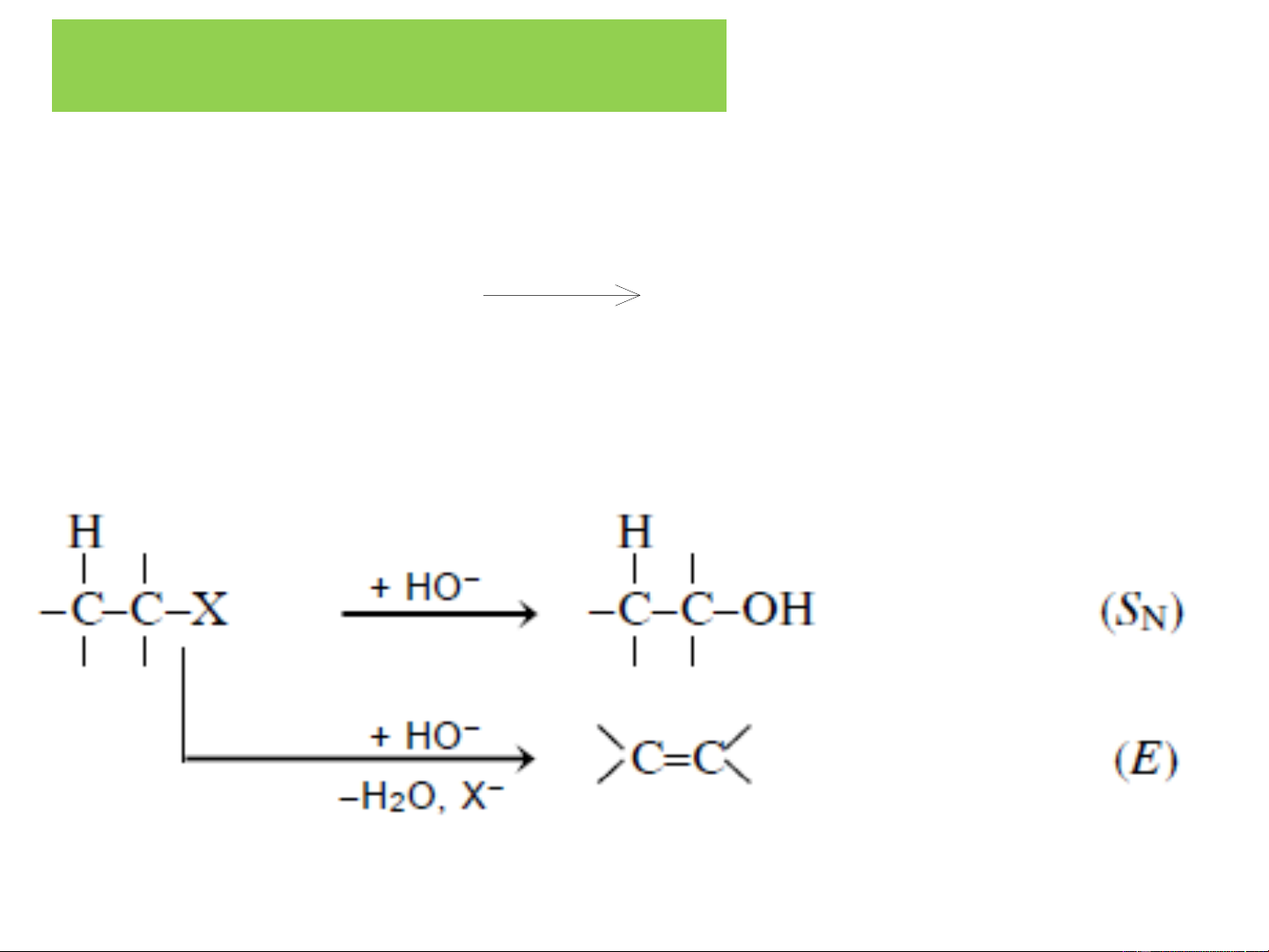
❖ Thuỷ phân dẫn xuất halogen RX OH - RX + H 2O ROH + HX
Ở đây có sự cạnh tranh giữa phản ứng thế nucleophil tạo
ancol và tách HX tạo anken:
Đặc biệt với dẫn xuất halogen bậc 3, phản ứng chủ yếu xảy
ra theo hướng tách loại HX
3. ĐIỀU CHẾ ANCOL :
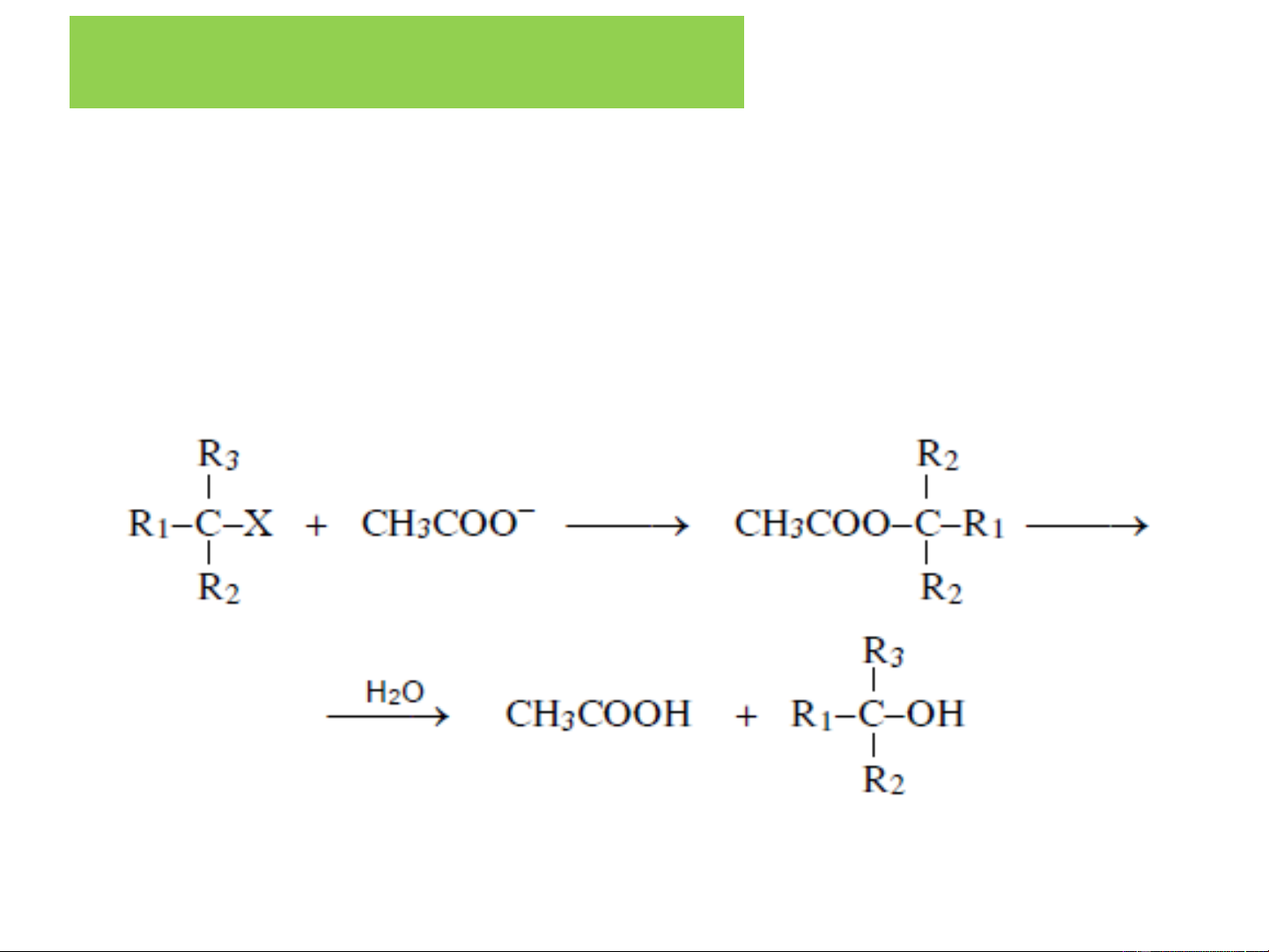
❖ Thuỷ phân dẫn xuất halogen RX
Để thu được ancol bậc 3 người ta dùng tác nhân nucleophil
yếu CH COO− để tạo este, sau đó thuỷ phân este tạo ancol: 3
3. ĐIỀU CHẾ ANCOL :
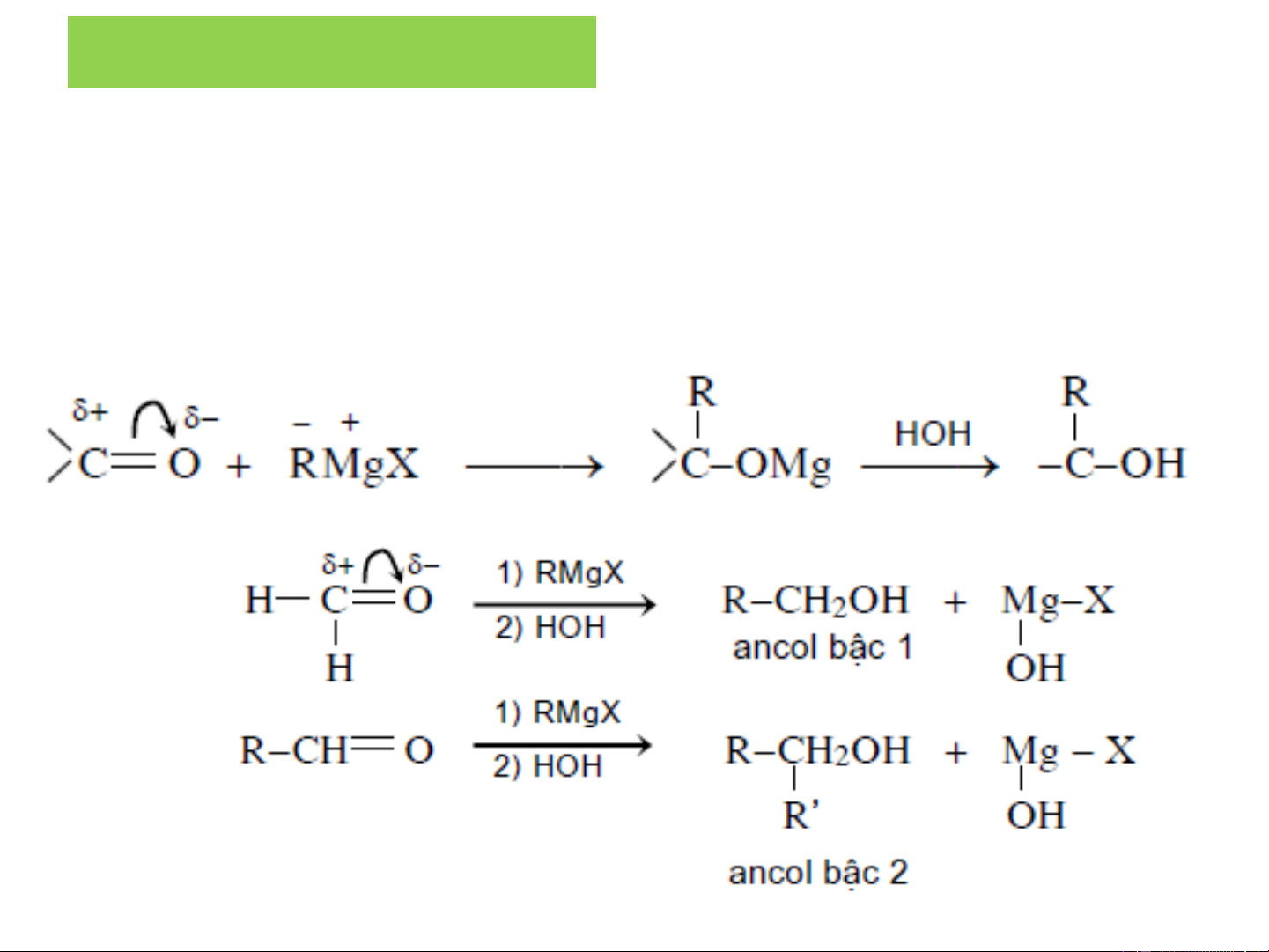
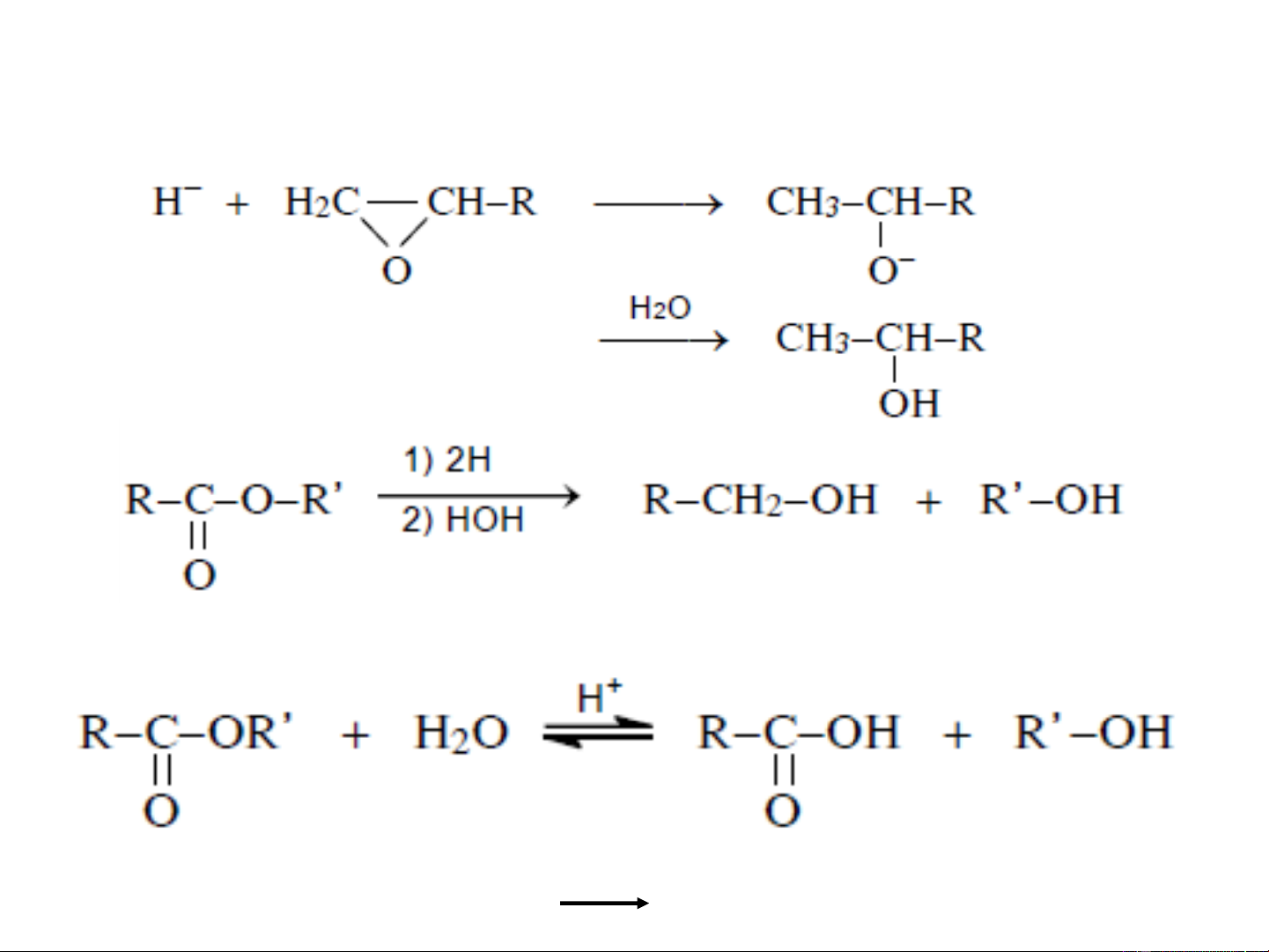
❖Tác dụng hợp chất cơ magie (tác nhân Grignard)
với andehit, xeton, este hoặc ete vòng
Phản ứng để điều chế ancol các bậc khác nhau.
Cơ chế: xảy ra theo cơ chế cộng nucleophil: Ete khan
Xem them bài hợp chất cơ magie
3. ĐIỀU CHẾ ANCOL :
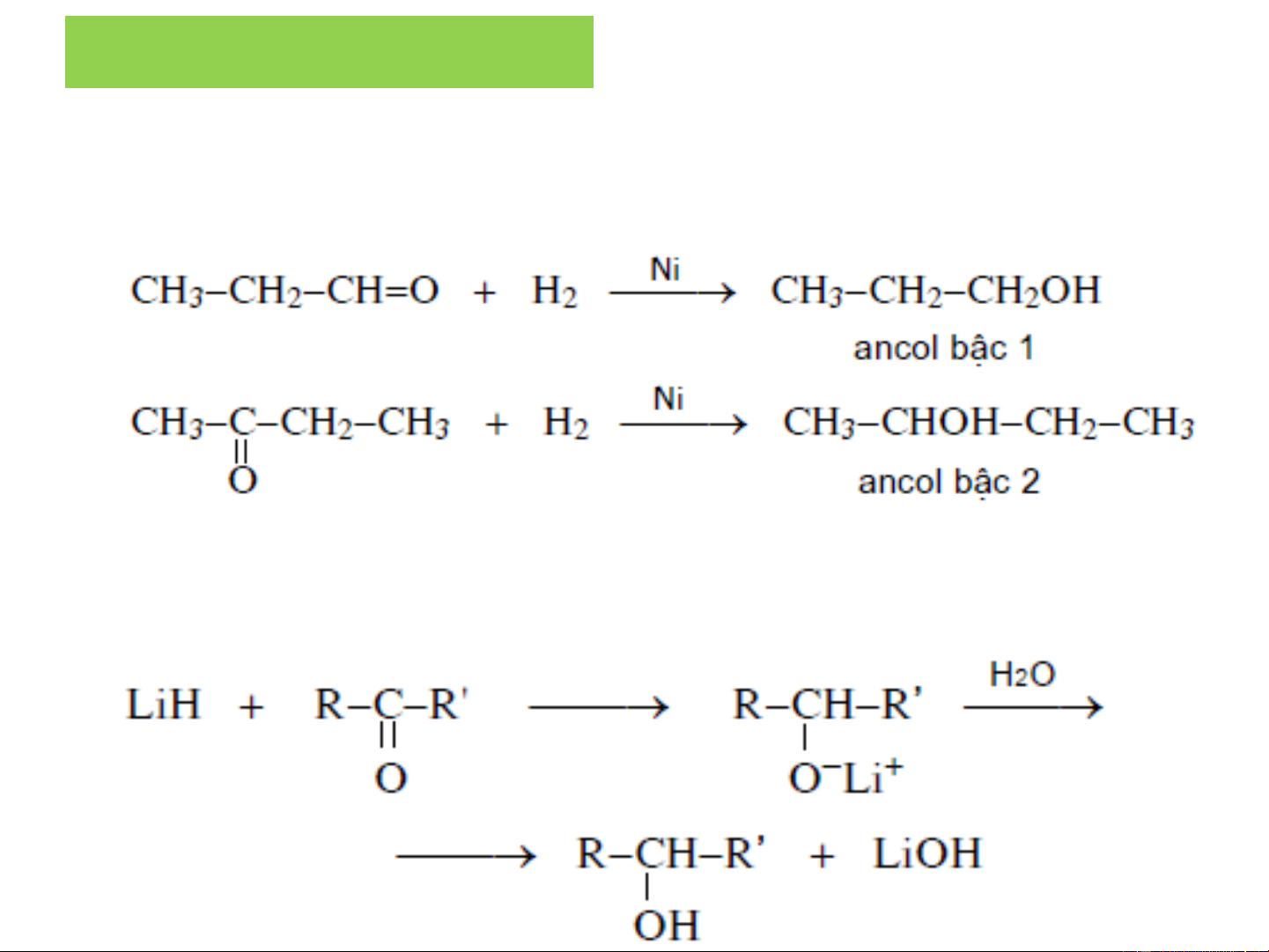
❖Khử hóa aldehyd, xeton, ete, axit, este:
+ Khử bằng H2 có mặt chất xúc tác Ni.
+ Khử bằng hydrua kim loại (LiAlH hoặc LiH): có tính chọn 4
lọc đối với liên kết C=O
❖Khử hóa aldehyd, xeton, ete, axit, este:
+ Khử bằng hydrua kim loại (LiAlH hoặc LiH). 4
❖Thuỷ phân este: RCOOR' + NaOH RCOONa + R'OH
3. ĐIỀU CHẾ ANCOL :
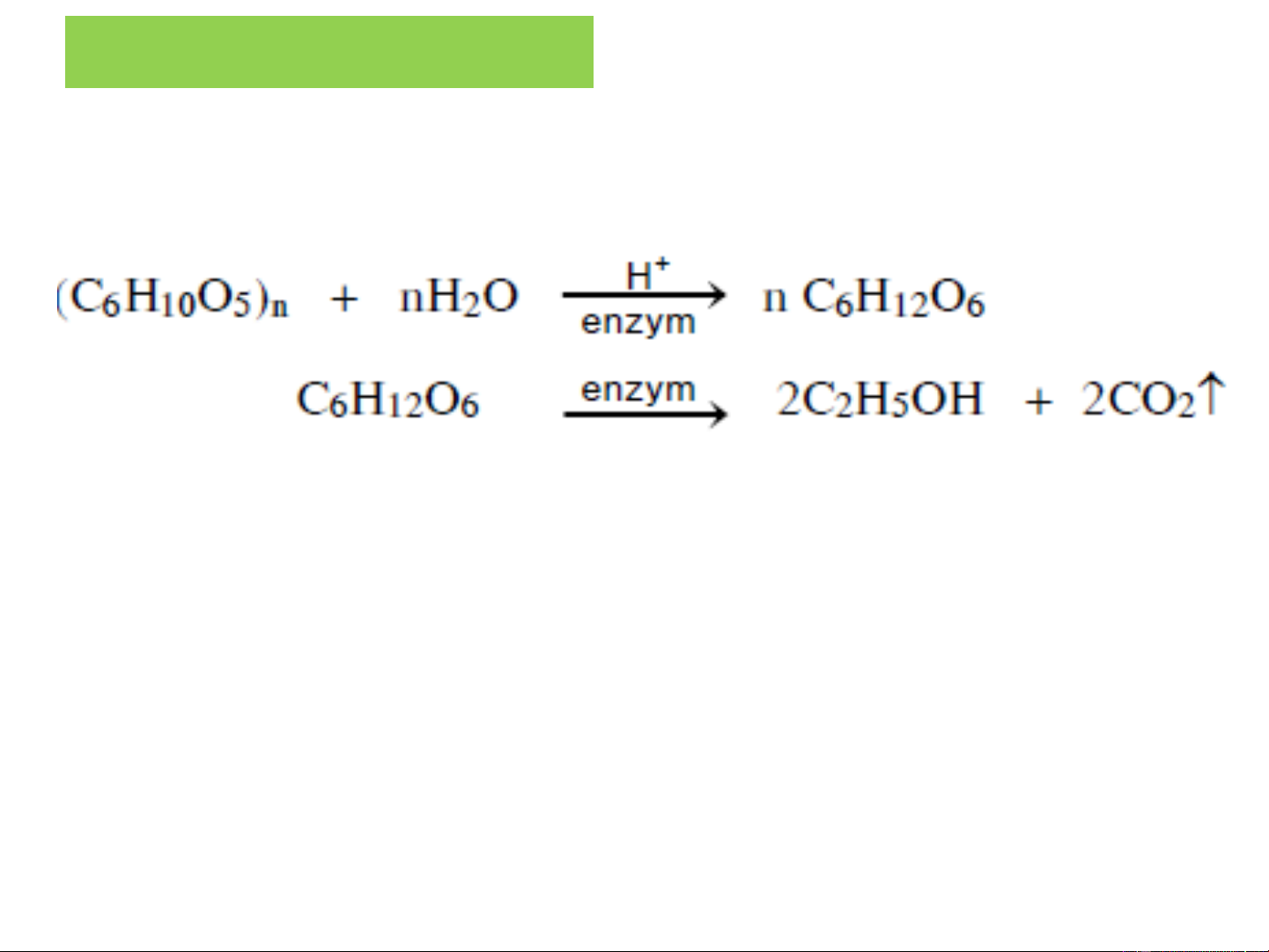
❖Phương pháp khác: + Lên men (enzym): Tinh bột Glucozơ etylic + Oxi hóa: Cu, 100oC CH + O → CH OH 4 2 3 k/khí 100atm
4. TÍNH CHẤT VẬY LÝ
❖ Các hợp chất đầu dẫy đồng đẳng của ancol là chất lỏng,
có mùi đặc trưng, dễ cháy. Các đồng đẳng cao hơn (C > 12)
là chất rắn, hầu hết không có mùi
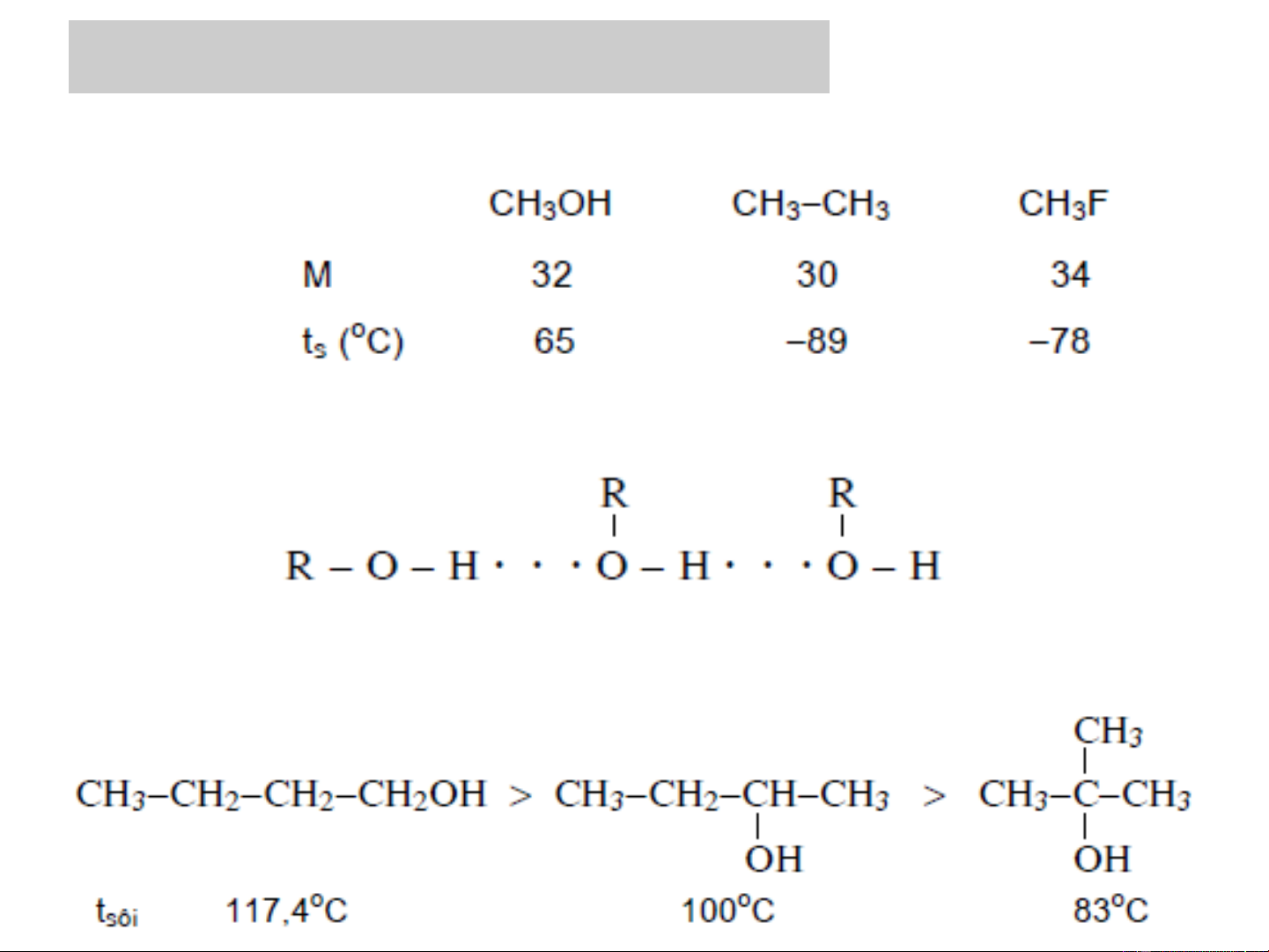
❖ Nhiệt độ sôi của ancol
- So với các chất có M tương đương thì nhiệt độ sôi của: Muối
> Axit > Ancol >Anđehit > Hiđrocacbon, ete và este...
- Giải thích: nhiệt độ sôi của một chất thường phụ thuộc vào các yếu tố:
+ M: M càng lớn thì nhiệt độ sôi càng cao.
+ Độ phân cực của liên kết: liên kết ion > liên kết cộng hóa trị
có cực > liên kết cộng hóa trị không cực.
+ Số liên kết hiđro: càng nhiều liên kết H thì nhiệt độ sôi càng cao.
+ Độ bền của liên kết hiđro: liên kết H càng bền thì nhiệt độ sôi càng cao.
4. TÍNH CHẤT VẬY LÝ
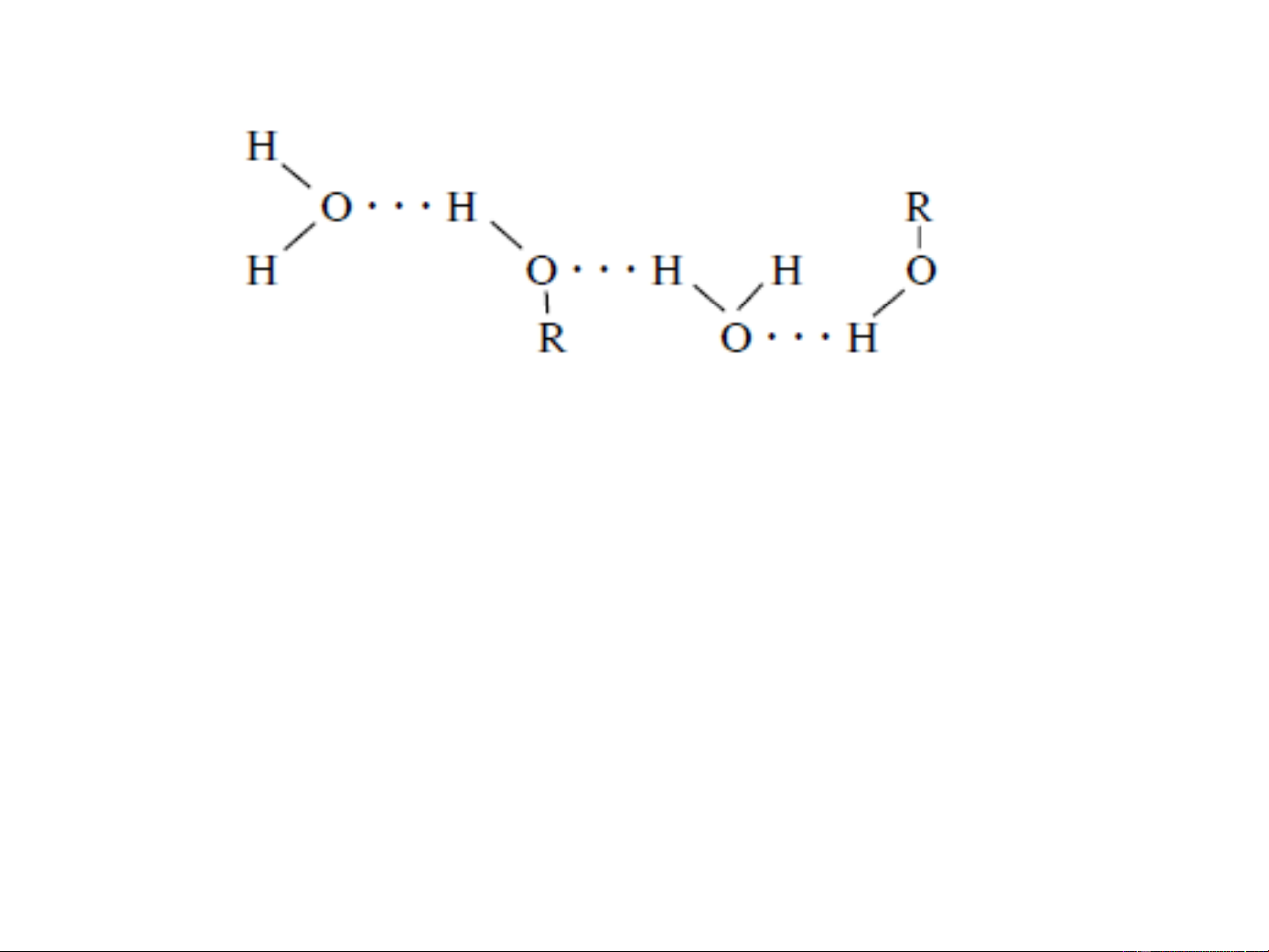
❖ Nhiệt độ sôi của ancol
do có sự liên kết giữa các phân tử ancol bằng liên kết hydro
❖Tăng phần gốc hydrocacbon có tính kỵ nước thì nhiệt
độ sôi và độ tan trong nước đều giảm
Do có liên kết H nên rượu tan được trong nước
- Các rượu từ C đến C tan trong H O theo mọi tỷ lệ. 1 3 2
- Từ C trở lên là những chất lỏng ở dạng dầu hoặc chất rắn 4 không tan trong H O. 2
5. TÍNH CHẤT HÓA HỌC Nhận xét chung:
Do nguyên tử oxy có độ âm
điện lớn làm liên kết C−O và liên kết O−H phân cực
Khả năng phản ứng của ancol (rượu) liên quan
đến việc đứt liên kết C – O hoặc đứt liên kết O – H.
+ Tuỳ theo đặc điểm cấu tạo của gốc hydrocacbon R, sự phân
cực của liên kết C−O có thể tăng hay giảm, đồng thời sự phân
cực liên kết của O−H cũng biến đổi nhưng theo chiều ngược
lại; tức là, khi C−O phân cực mạnh thì O−H phân cực yếu (có
các nhóm ankyl đẩy e) và liên kết C−O phân cực kém thì liên
kết O−H phân cực mạnh hơn (có các nhóm không no, hút e).
Do đó hướng phản ứng chính:
+ Nhóm -OH có khả năng tách H+ thể hiện tính axit yếu
+ Do và O còn cặp e chưa chia nên đóng vai
trò như 1 bazơ Lewis hay tác nhân nuceophil
yếu trong các phản ứng este hóa, dehydrat hóa,... + Phản ứng oxi hóa 5.1. Tính axit - Bazơ
+ Rượu được coi là một chất lưỡng tính, cả tính axit
lẫn bazơ đều rất yếu.
- TÍNH AXIT: Rượu chỉ tác dụng với kim loại hoạt động
mạnh (kiềm), tính axit yếu hơn nước
ROH + Na → RONa + 1/2H 2
So với H O tính axit của rượu còn yếu hơn nên các ancolat 2
đều bị thủy phân trong nước.
RONa + HOH → ROH + NaOH
Hằng số phân ly axit K của H O là 10−16, của CH OH 10−17, a 2 3 của C H OH10−18 2 5