





Preview text:
HỢP CHẤT PHENOL (1) PHENOL ĐƠN CHỨC 1. KHÁI NIỆM
Phenol là dẫn xuất của hydrocacbon
thơm có chứa nhóm –OH liên kết trực tiếp với vòng benzen. ❖Phân loại
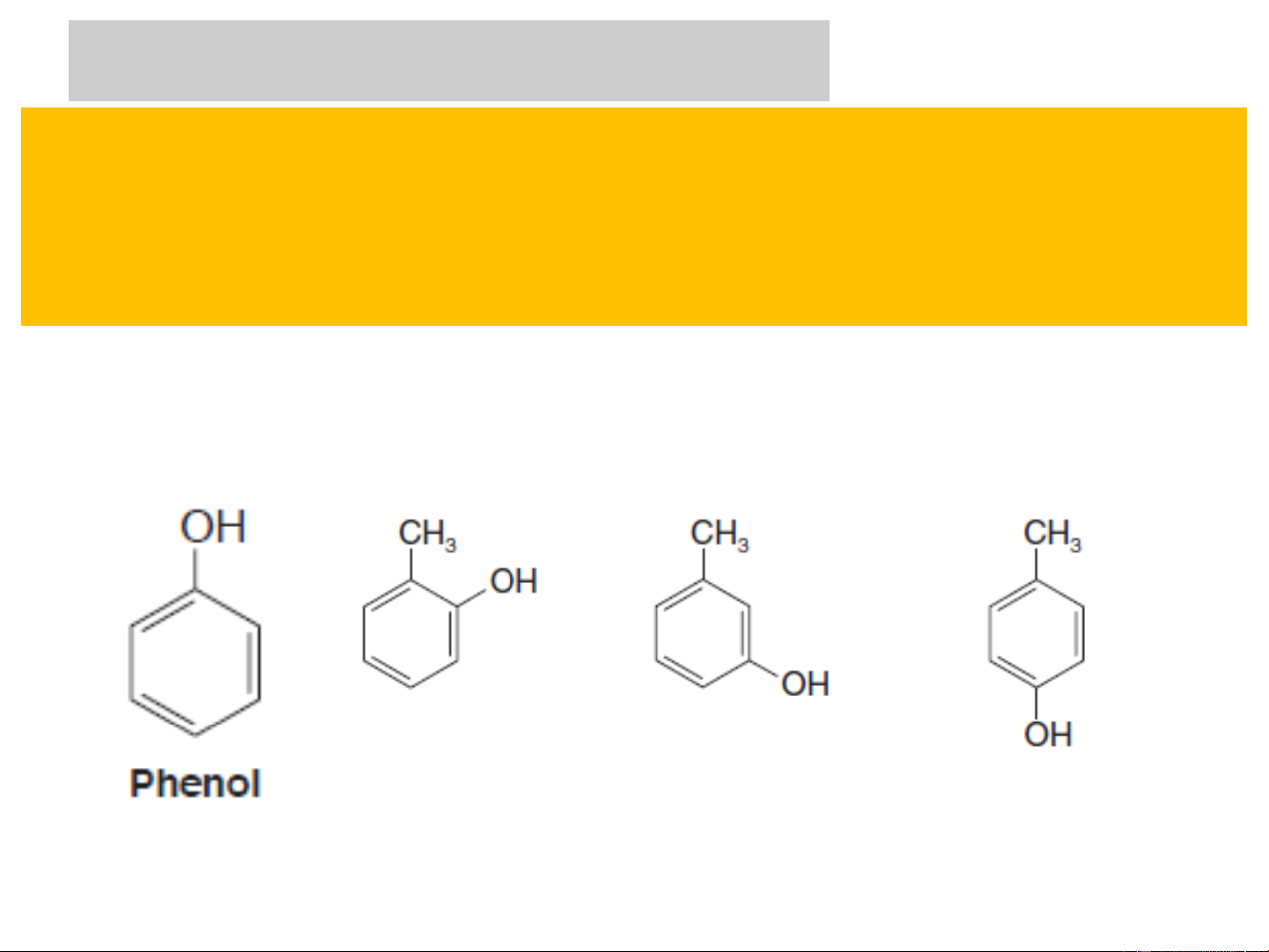
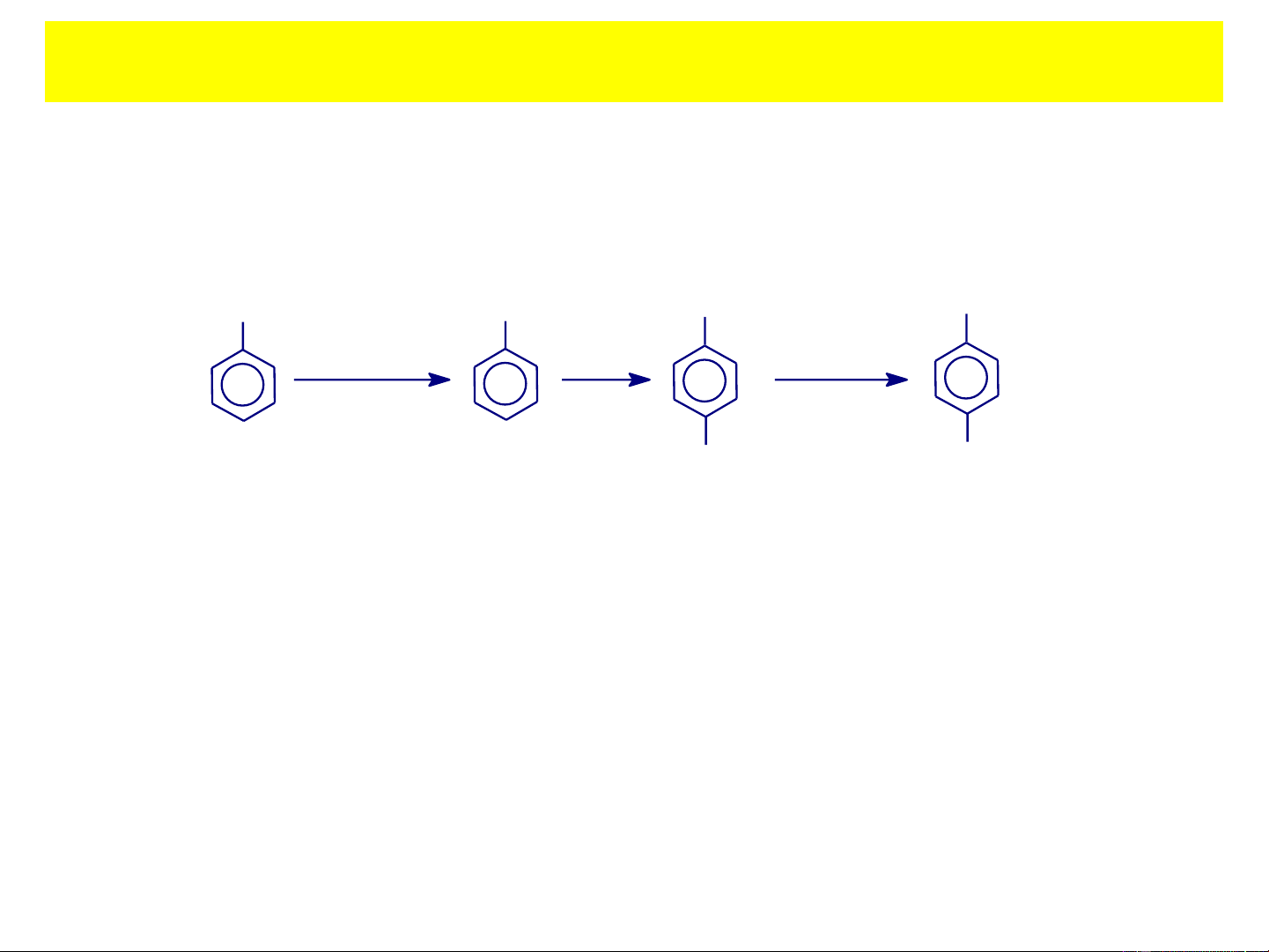
+ Phenol đơn chức: có 1 nhóm –OH gắn với vòng benzen OH CH3 CH3 CH3 OH OH OH Phenol o-Cresol m-Cresol p-Cresol
(Hydroxybenzen) (2-Hydroxytoluen) (3-Hydroxytoluen) (4-Hydroxytoluen)
( Hỗn hợp 3 cresol là dung dịch Gerin, sử dụng làm thuốc sát trùng ) 1. KHÁI NIỆM
Phenol là dẫn xuất của hydrocacbon thơm có chứa
nhóm –OH liên kết trực tiếp với vòng benzen. ❖Phân loại
+ Phenol đơn chức: có 1 nhóm –OH gắn với vòng benzen
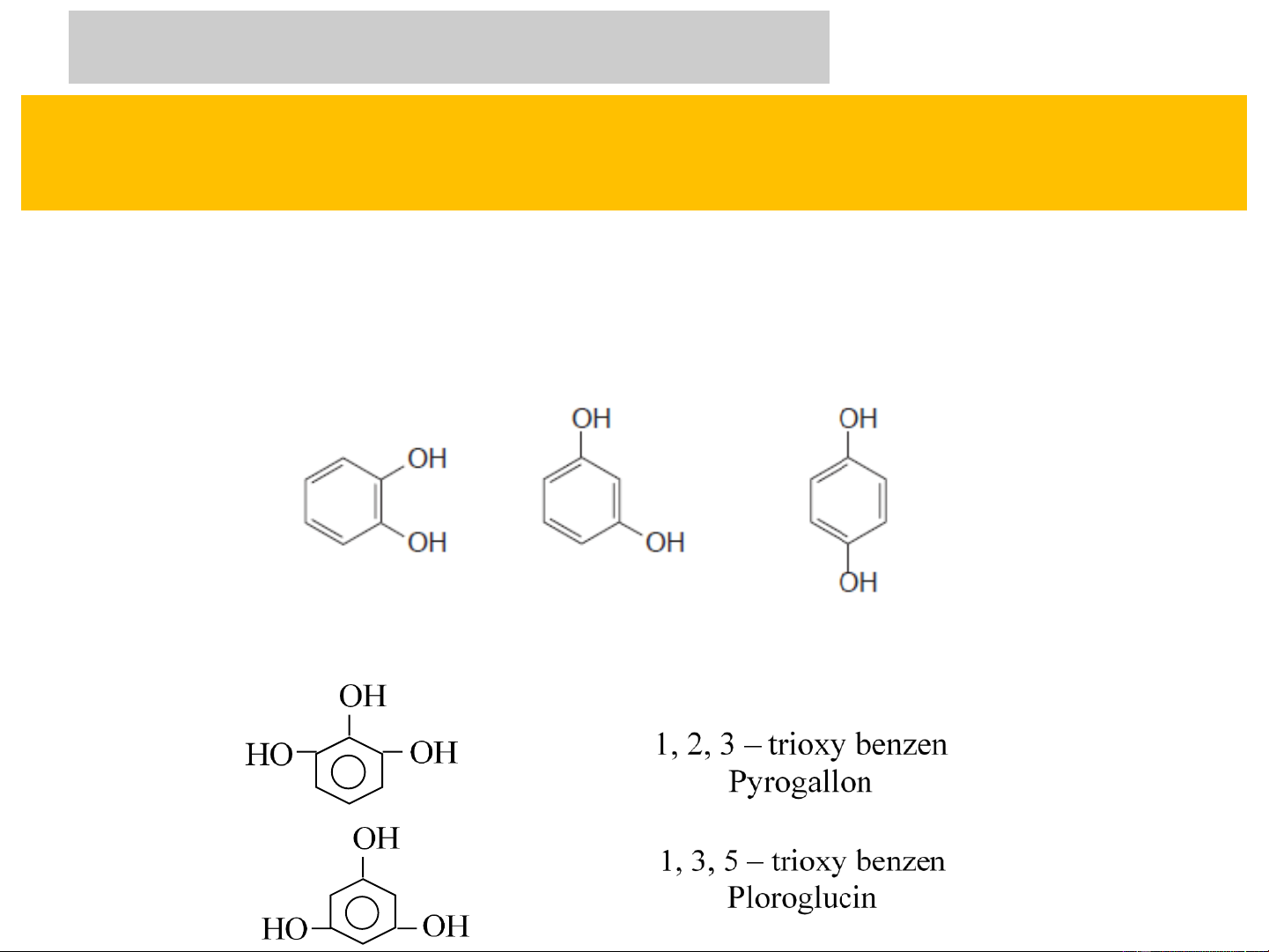
+ Phenol đa chức: có nhiều nhóm –OH gắn với vòng benzen OH OH OH OH OH OH Pyrocatechin Resocinol Hydroquinon (o-Dihydroxybenzen) (m-Dihydroxybenzen) (p-Dihydroxybenzen) OH OH HO OH HO OH Pyrogallol Floroglucin (1,2,3-Trihydroxybenzen) (1,3,5-Trihydroxybenzen)
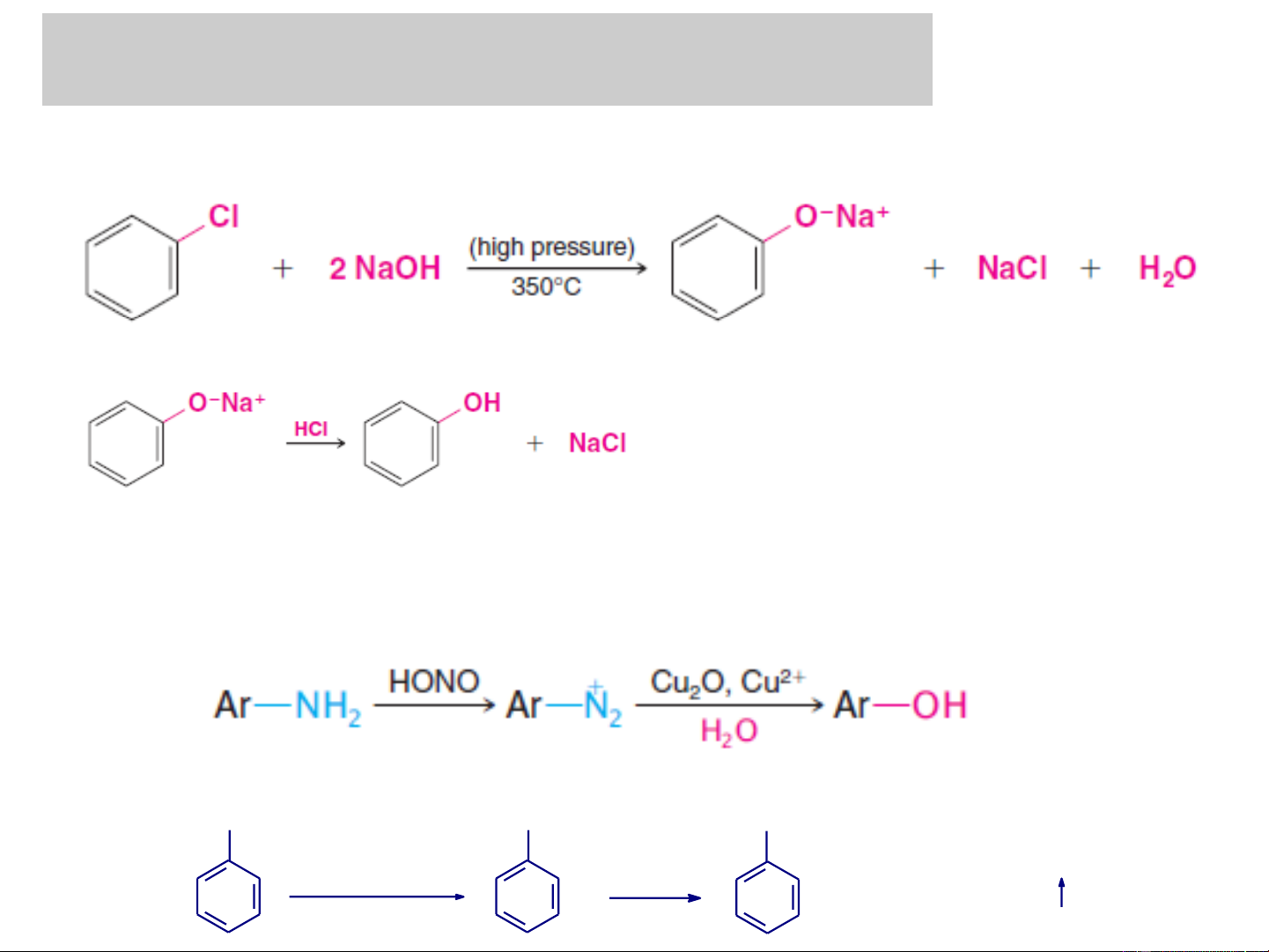
2. Điều chế phenol đơn chức:
+ Điều chế từ nhựa than đá ONa OH NaOH (dung dÞch) sôc CO2 Nhùa than ®¸ H+
có phân đoạn sôi 170-240oC Natri phenolat Phenol
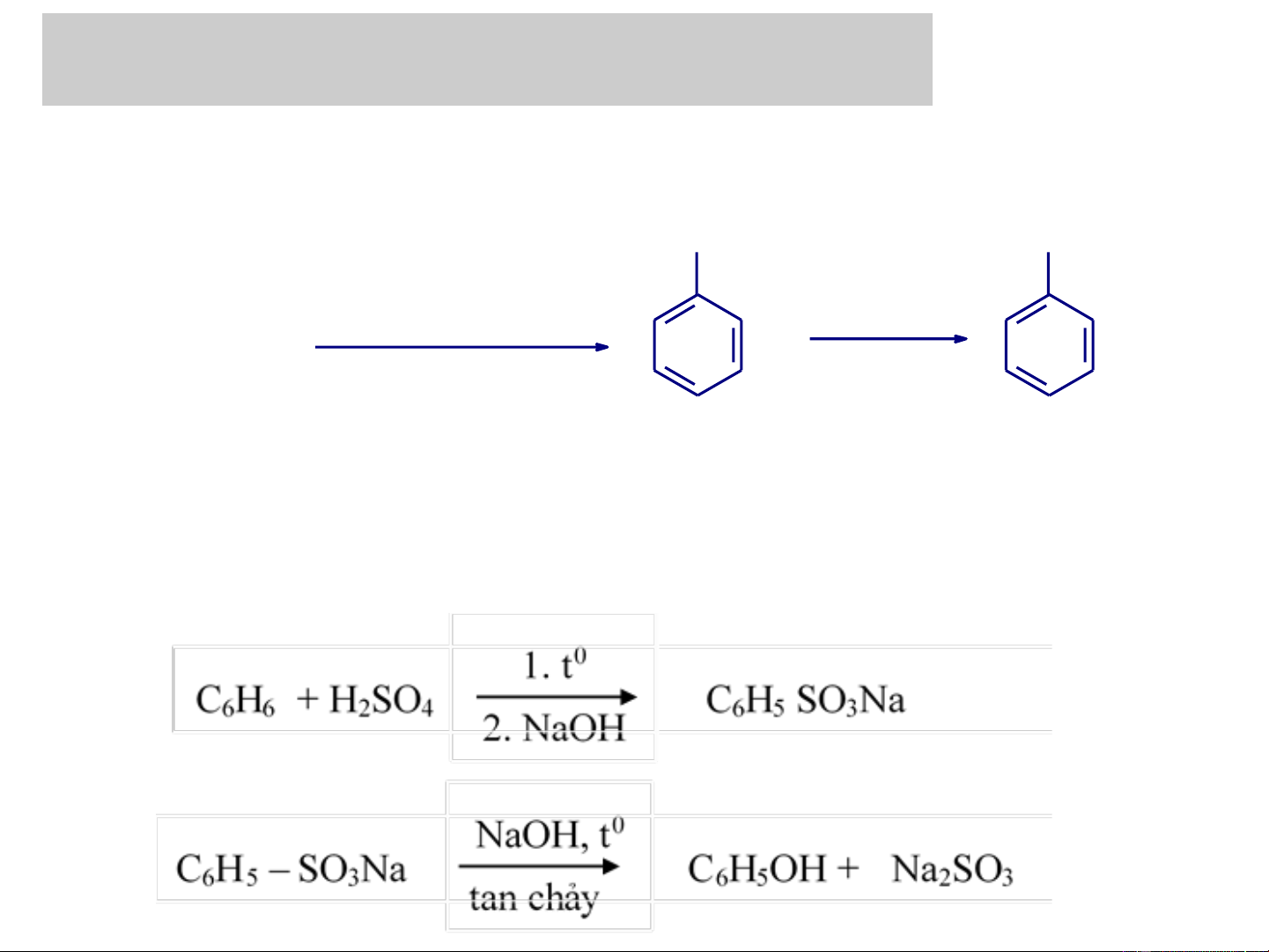
+ Phản ứng tan chảy kiềm của dẫn xuất sunfo
2. Điều chế phenol đơn chức:
+ Phản ứng thủy phân các dẫn xuất benzyl halogenua Hoặc sục CO2
+ Con đường diazo hoá amin thơm NH N 2 2HSO4 OH NaNO2/H2SO4 H2O + H2SO4 + N2 0−5oC to Anilin Phenyldiazoni Phenol hydrosunfat
2. Điều chế phenol đơn chức:
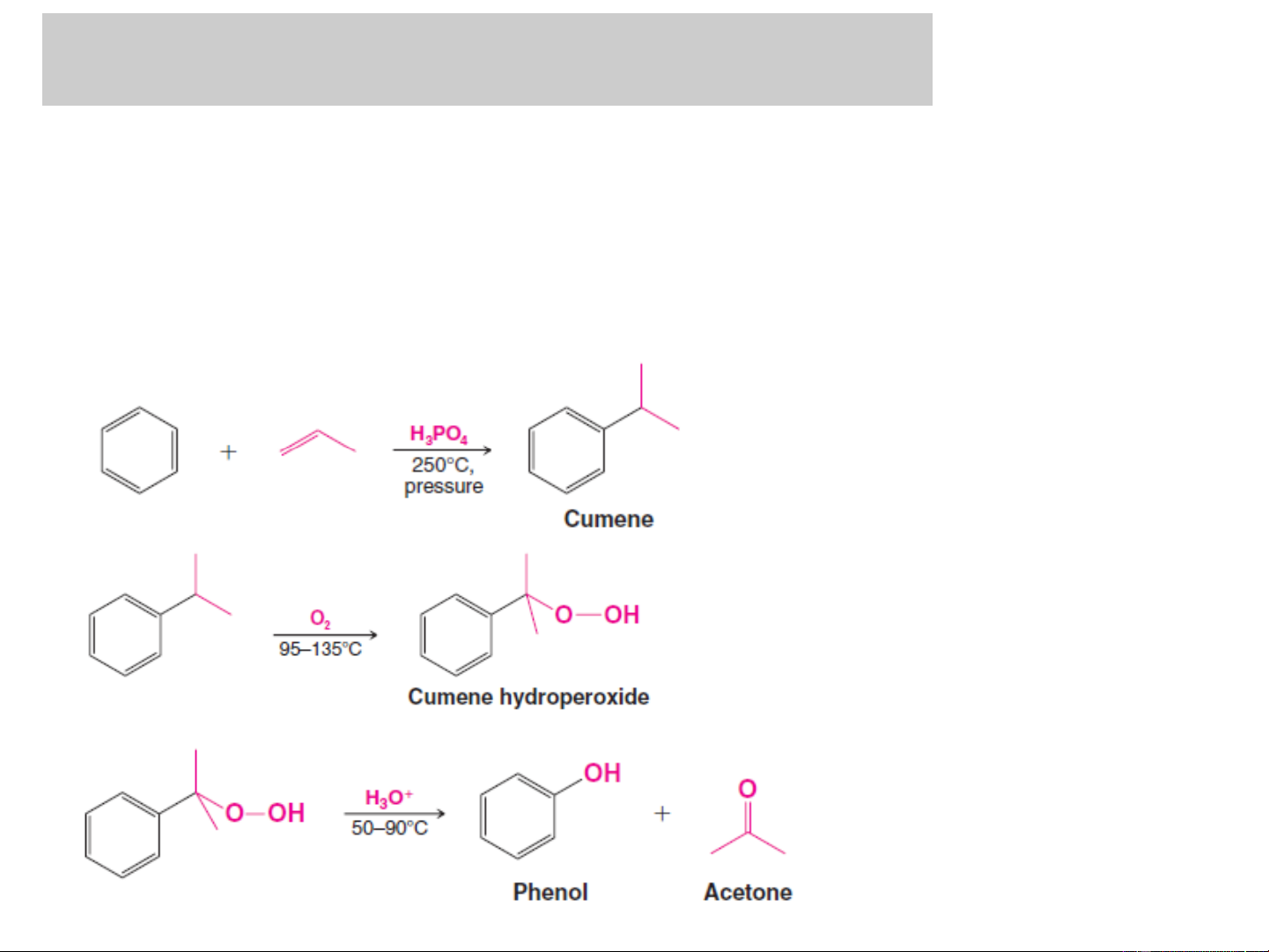
❖ Điều chế trong công nghiệp và PTN
+ Phản ứng oxi hoá cumen (Phương pháp cumen): điều chế phenol và axeton
3. Tính chất vậy lý
+ Phenol là chất rắn, tinh thể không màu, có mùi đặc
trưng, nóng chảy ở 43 °C.
+ Để lâu ngoài không khí, phenol bị oxi hóa một
phần nên có màu hồng và bị chảy rữa do hấp thụ hơi nước.
+ Phenol ít tan trong nước lạnh, tan trong một số
hợp chất hữu cơ. Phenol tan vô hạn ở 660C.
+ Phenol rất độc, gây bỏng nặng khi rơi vào da.
Phenol được dùng trong nhiều lĩnh vực khác nhau:
- Công nghiệp chất dẻo: phenol là nguyên liệu để
điều chế nhựa phenol formandehit.
- Công nghiệp tơ hóa học: Từ phenol tổng hợp ra tơ polyamide.
- Nông dược: Từ phenol điều chế được chất diệt cỏ
dại và kích thích tố thực vật 2,4 - D (là muối natri của axit 2,4 điclophenoxiaxetic).
- Phenol cũng là nguyên liệu để điều chế một số
phẩm nhuộm, thuốc nổ (axit picric).
- Do có tính diệt khuẩn nên phenol được dùng để
trực tiếp làm chất sát trùng, tẩy uế, hoặc để điều chế
các chất diệt nấm mốc (ortho- và para- nitrophenol…)
4. Tính chất Hóa học Nhận xét chung:
Phenol có nhóm -OH liên kết trực tiếp với cacbon
của vòng Benzen. O có hiệu ứng liên hợp mạnh (+C)
đẩy e vào vòng thơm, đồng thời còn có hiệu ứng -I
ngược chiều +C ( nhưng -I có độ lớn nhỏ hơn) làm
mật độ e trên O nhỏ hơn so với rượu.
Do đó hướng phản ứng chính:
+ Nhóm -OH là nhóm thế loại I đẩy e vào hoạt
hóa vòng thơm: phản ứng đặc trưng là thế S . E
+ Do có hai hiệu ứng +C, -I ngược chiều nên
liên kết C-O bền hơn và liên kết O-H phân cực
mạnh hơn về phía O làm tăng tính axit.
+ Phản ứng este hóa kém rượu, cần thực hiện
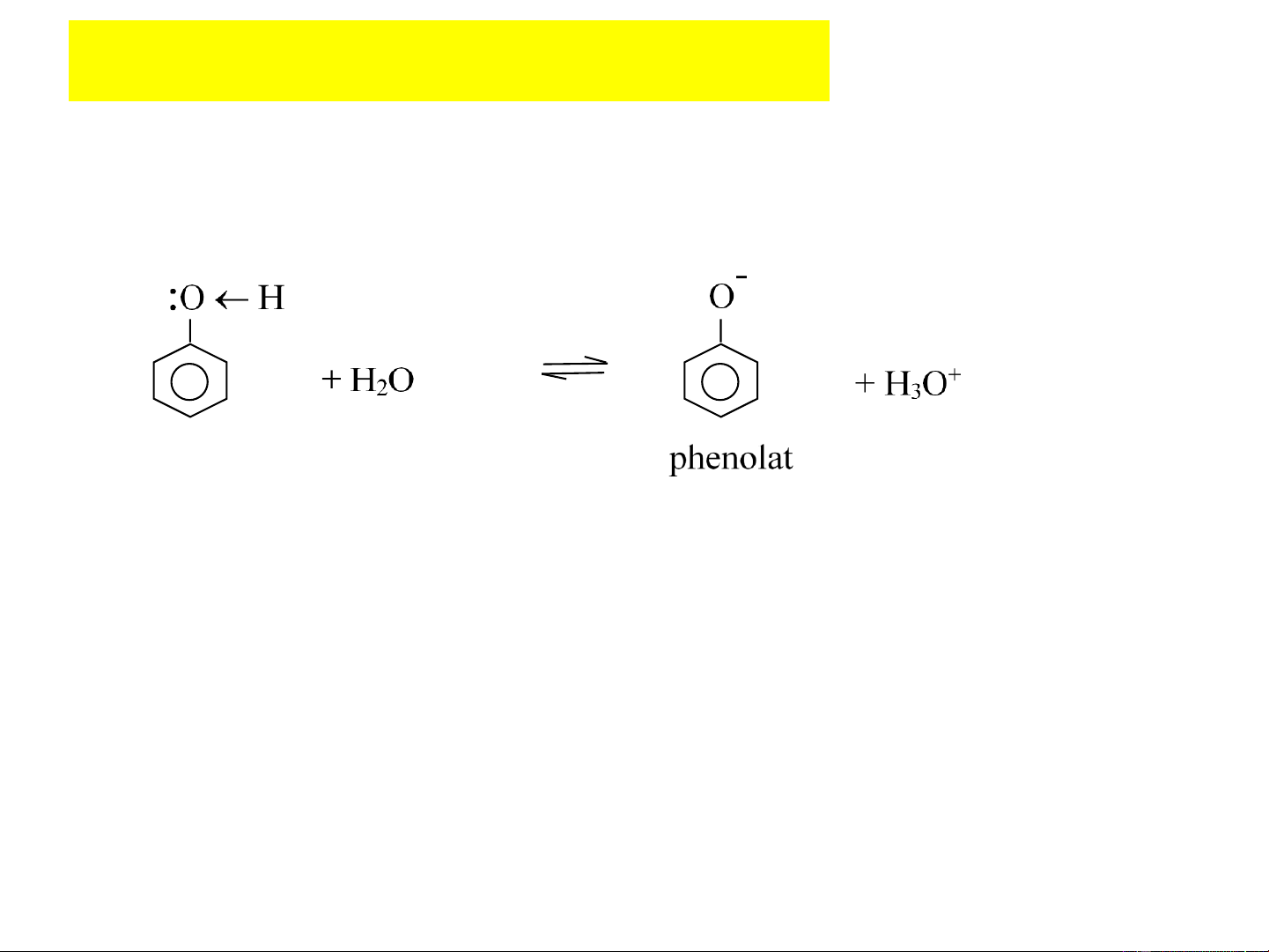
trong môi trường kiềm hoặc tác nhân axyl hóa mạnh 10 4.1. Tính axit
+ Trong dung dịch nước, phenol có khả năng phân ly:
Phenol (K =10-10) là axit mạnh hơn ancol (K =10-16) a a
nhưng tính axit lại yếu hơn axit cacboxylic.
Tính axit của phenol so với các axit vô cơ, axit hữu cơ, ancol và nước :
HCl > R−COOH > H2CO3 > C6H5OH > H2O > R−OH
axit v« c¬ axit h÷u c¬ axit cacbonic phenol n-íc ancol 4.1. Tính axit
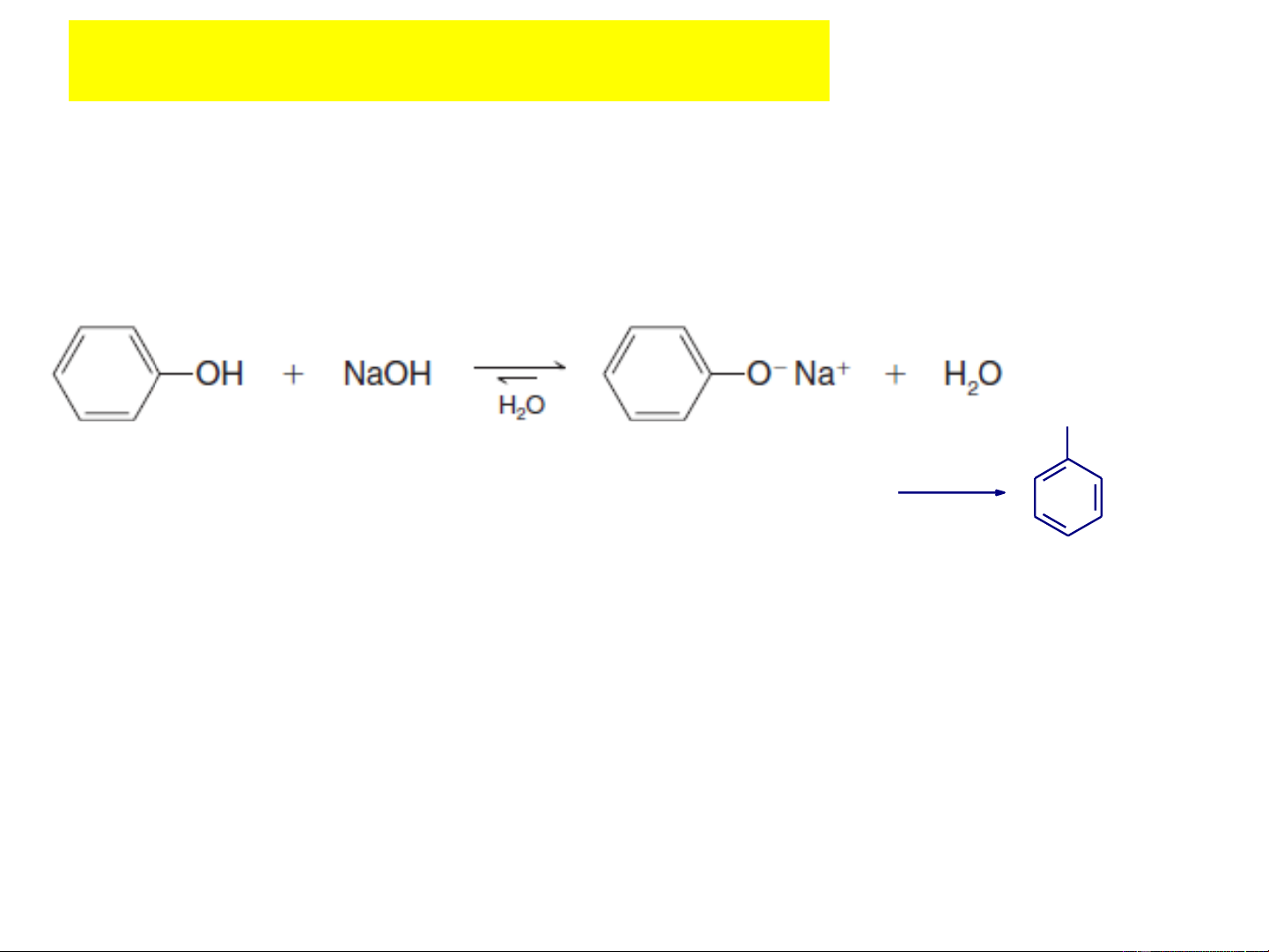
+ Phenol còn được gọi là axit phenic. Phenol có thể bị
trung hoà bởi kiềm mạnh như phản ứng với NaOH, nhưng
không phản ứng với NaHCO3 ONa OH NaOH (dung dÞch) sôc CO2 Nhùa than ®¸ H+ Natri phenolat Phenol
+ Giải thích tính axit của phenol:
Do sự liên hợp của cặp electron chưa chia của O vào vòng benzen
→ liên kết OH bị phân cực mạnh về O → nguyên tử H linh động và
dễ tách ra khỏi phenol ở dạng H+. Mặt khác, ion phenolat bền do
được ổn định hóa nhờ sự giải tỏa điện tích âm vào hệ liên hợp của
vòng benzen dưới dạng các cấu trúc cộng hưởng. 4.1. Tính axit
+ Giải thích tính axit của phenol: Bền hơ - -
n: C H O- >OH > RO 6 5 4.1. Tính axit
+ Giải thích tính axit của phenol:
Nếu trong vòng benzen có sẵn nhóm thế loại II thì tính axit
tăng nhờ khả năng hút electron của nhóm thế loại II làm
proton trong nhóm OH trở nên linh động hơn
4.2 Phản ứng ở nhóm O-H của phenol
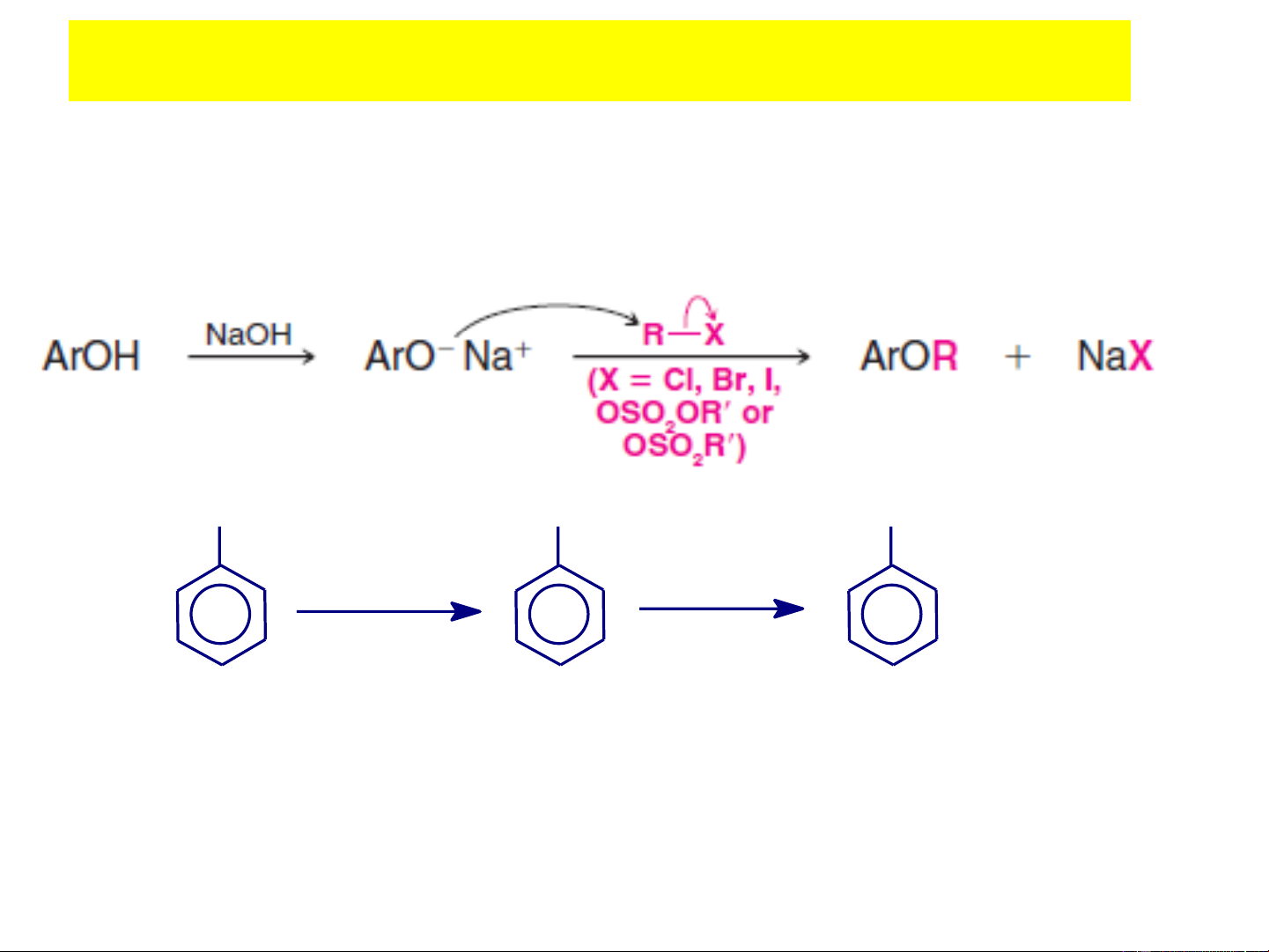
+ Phản ứng ankyl hóa tạo ete hỗn tạp: do mật độ e trên O
giảm nên cần chuyển về dạng phenolat trước khi phản ứng OH ONa OCH3 NaOH CH3I (−H2O) (−NaI) Phenol Natri phenolat Metylphenyl ete C – 6H5 –ONa + CH3 Cl → C6H5OCH3 + NaCl
4.2 Phản ứng ở nhóm O-H của phenol
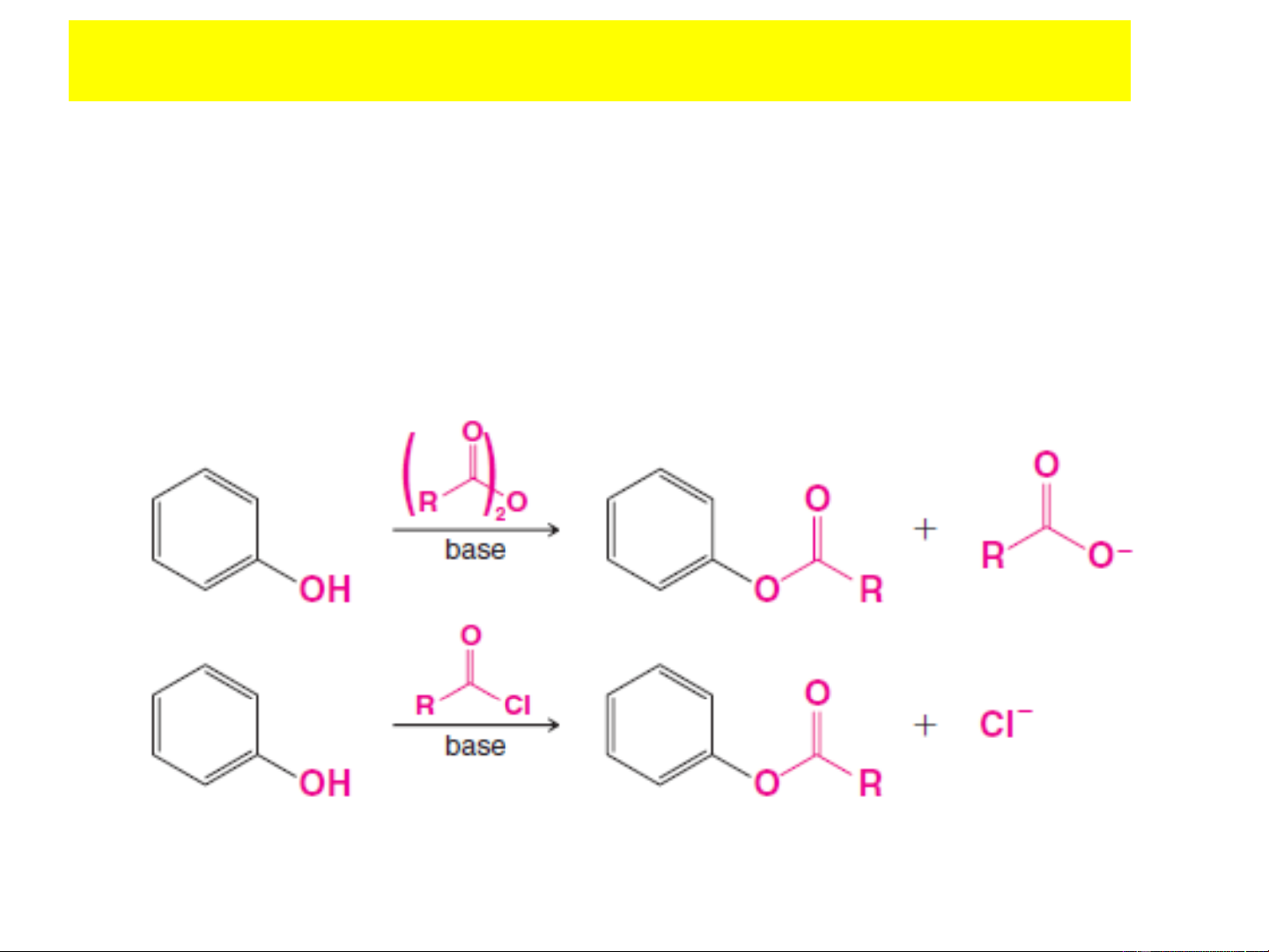
+ Phản ứng axyl hóa tạo este:
- Phản ứng axyl hóa dùng tác nhân là axit cacboxylic R-COOH
xảy ra rất khó khan do mật độ e trên nguyên tử O giảm
- Cần dùng các tác nhân axyl hóa mạnh: clorua axit (RCOCl)
hoặc anhydrit axit [(RCO) O] thì phản ứng xảy ra dễ hơn. 2 C → 6H5OH + (CH3CO)2O C6H5OCOCH3 + CH3COOH Este phenyl axetat
4.2 Phản ứng ở nhóm O-H của phenol
+ Phản ứng dehydrat hóa: ở nhiệt độ cao và có xúc tác
4.3 Phản ứng S ở vòng thơm của phenol E
Phản ứng S của phenol xảy ra dễ dàng hơn nhiều so với E
benzen do sự có mặt của nhóm –OH là nhóm hoạt hóa
nhân thơm và có sự định hướng các nhóm thế vào sau
vào các vị trí ortho và para so với nhóm −OH
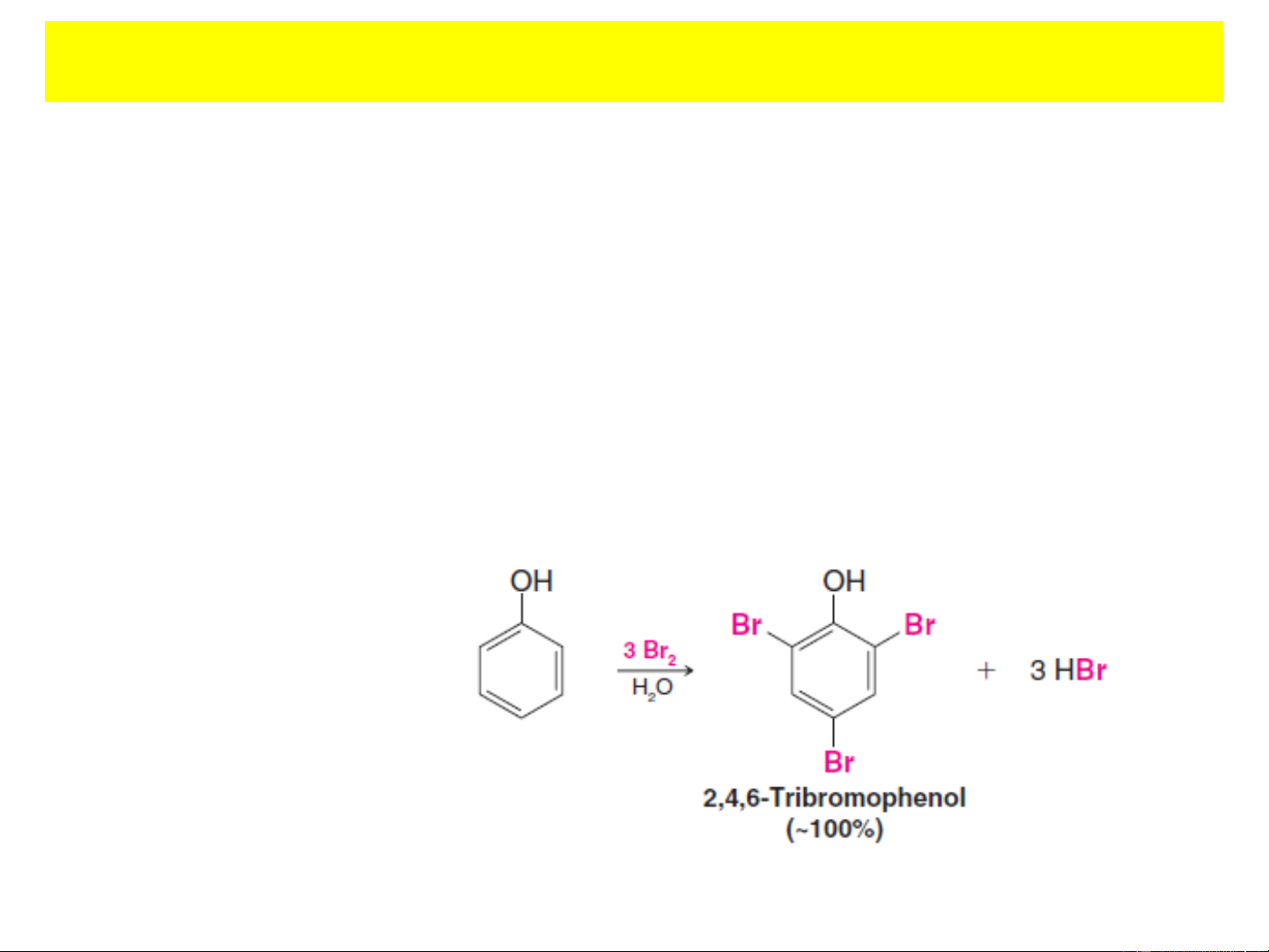
+ Phản ứng halogen hóa:
Phản ứng thế này xảy ra ở cả vị trí ortho và para. Phenol
phản ứng với nước brom tạo thành kết tủa trắng 2,4,6- tribromphenol.
Đây là phản ứng dùng để nhận biết phenol.
4.3 Phản ứng S ở vòng thơm của phenol E
+ Phản ứng halogen hóa:
Để điều chế được các dẫn xuất thế mono bromphenol thì cần
phải thay đổi điều kiện của phản ứng halogen hóa: OH OAc OAc OH CH Br 3COCl 2 a. NaOH b. H3O+ Br Br Phenol
p-Bromphenol + Dùng dung môi kém phân cực
4.3 Phản ứng S ở vòng thơm của phenol E
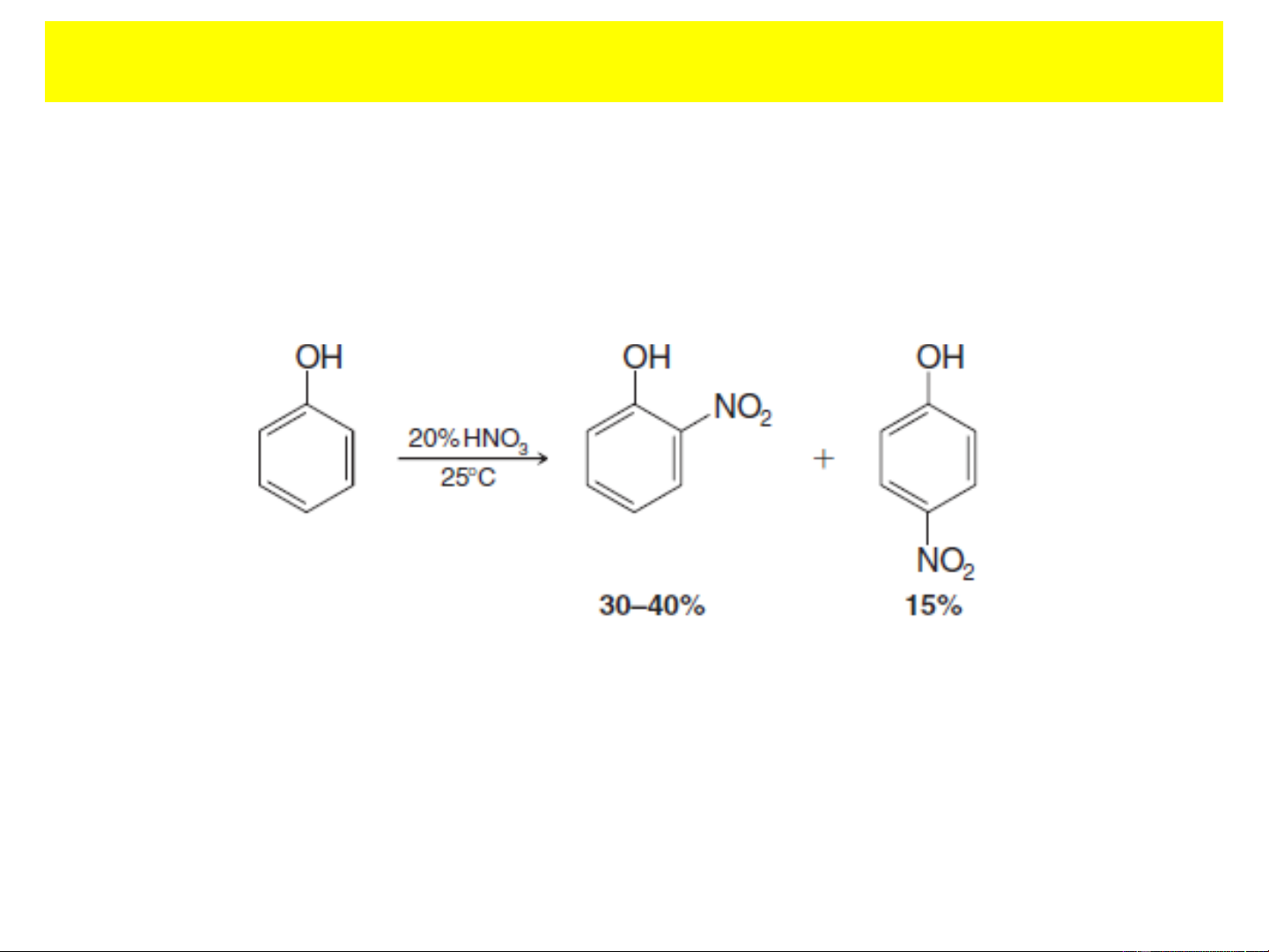
+ Phản ứng nitro hóa:
- Phản ứng nitro hóa phenol bằng hỗn hợp nitro hóa cho hỗn
hợp sản phẩm oxi hóa và thế (chủ yếu ở vị trí ortho, có thể
tách riêng sản phẩm ortho và para bằng cách chưng với hơi nước.)
- Muốn điều chế dẫn xuất mononitro phenol cần đi qua con đường điazo hóa