




Preview text:
HỢP CHẤT DỊ VÒNG (1)
1. Khái niệm - phân loại 2. Cấu trúc
1. KHÁI NIỆM - PHÂN LOẠI ❖ Khái niệm
- Các hợp chất dị vòng là các hợp chất hữu cơ có cấu
trúc mạch vòng khép kín, trong cấu trúc vòng ngoài
nguyên tử C còn có các nguyên tử khác của nguyên tố
khác (gọi là dị tố).
- Các hợp chất dị vòng quan trọng nhất thường chứa các dị tố là N, O và S.
- Tuy nhiên, người ta cũng gặp các dị vòng chứa các
nguyên tố khác như selen, telu, phospho, silic, v.v… H H
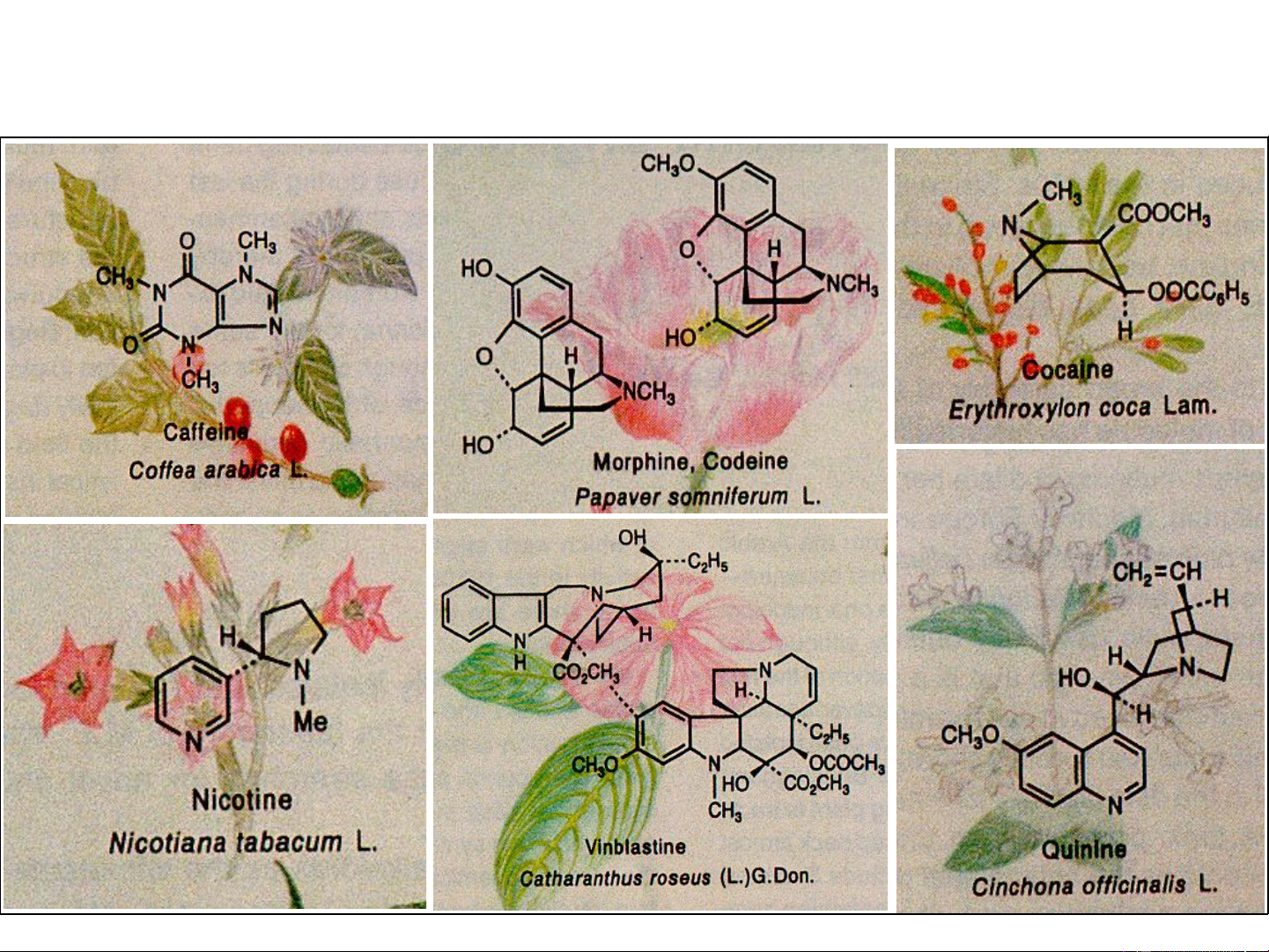
Hợp chất dị vòng rất phổ S CH3 CH biến trong thiên nhiên 2CONH CH3 nhưng cũng có một số N O COOK
lớn các hợp chất dị vòng được tổng hợp. Penicillin
Một số hợp chất thiên nhiên chứa dị vòng 3 ❖ Phân loại
Hợp chất dị vòng được phân loại thành các loại khác nhau:
- Hợp chất dị vòng 5 cạnh;
- Hợp chất dị vòng 6 cạnh;
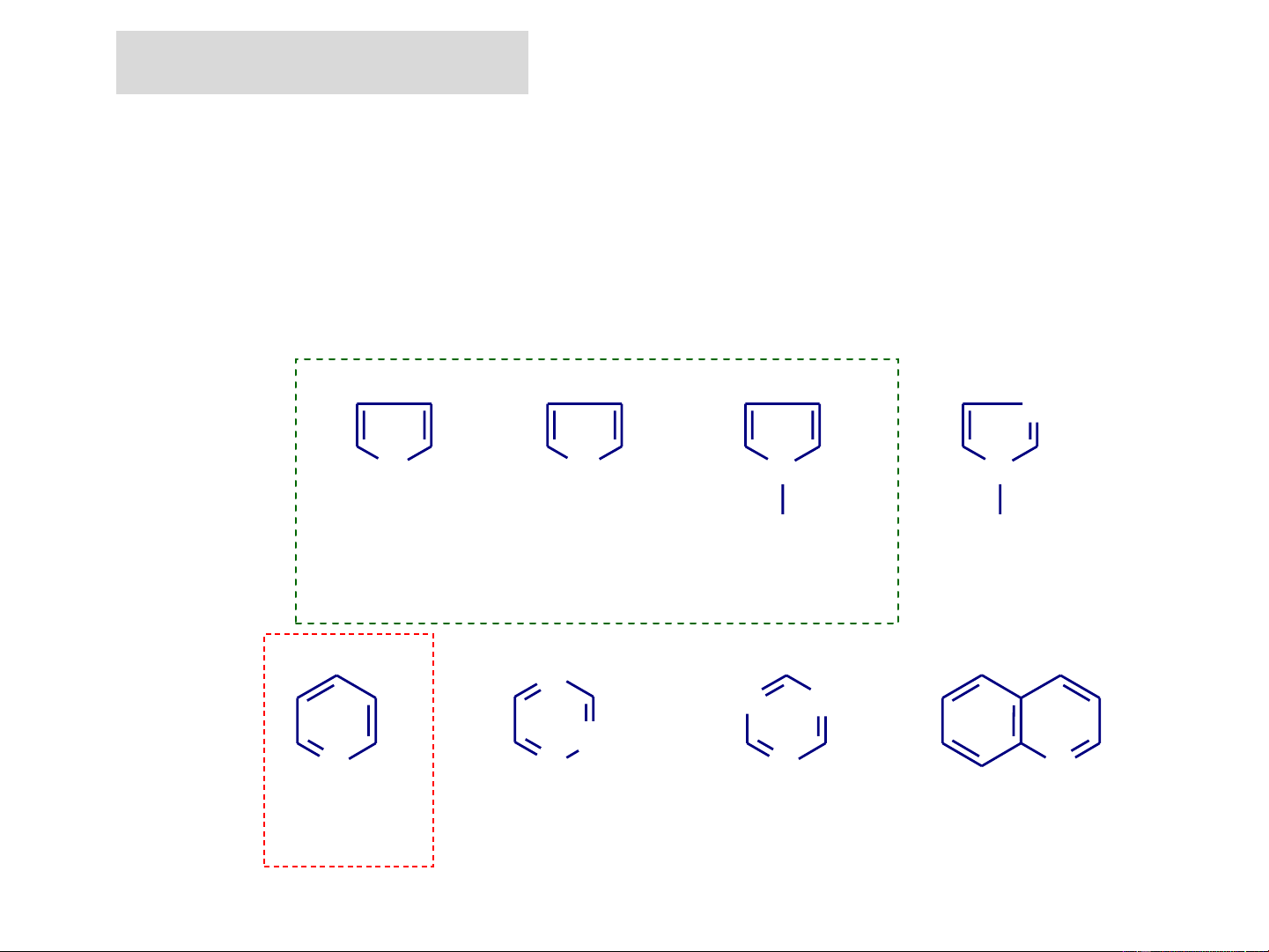
- Hợp chất dị vòng ngưng tụ. 4 3 4 3 4 3 4 N 3 5 2 5 5 2 5 2 2 O S N N 1 1 1 1 Furan H H Thiophen Pyrrol Imidazol 4 3 4 5 4 N 5 3 5 4 5 6 3 N N 3 6 2 6 N 6 2 7 2 N N 2 N N 8 1 1 1 1 Pyridin 1,2,4-Triazin 1,3,5-Triazin Quinolin
Các dị vòng 5 cạnh một dị tố 4 3 ' 4 3 ' 4 3 ' '5 2 '5 2 '5 2 O1 S N 1 1 H Furan : C H O 4 4 Thiophen: C H S Pyrrol: C H N Furan là chất 4 4 4 5 lỏng Pyrrol là chất lỏng không màu, Thiophen là không màu, có nhiệt chất lỏng mùi giống không độ sôi t = 131oC, tan cloroform, rất dễ màu, có nhiệt độ s tốt trong ancol, ete... bay hơi và dễ sôi t = 84oC. s Là tiền chất hóa cháy, có nhiệt dược độ : thuốc Tolmetin sôi t = s hoặc các dẫn xuất 31,4oC. Furan là như một chất độc vitamin B12, sắc tố, porphyrin của gây ung thư. heme,...
Dị vòng 6 cạnh một dị tố: Pyridin
Pyridin là vòng thơm 6 cạnh có chứa một dị tố N 4 5 3 6 2 N .. 1 Pyridin
Pyridin là chất lỏng không màu, có mùi đặc trưng, rất độc,
có thể gây vô sinh, tan được trong dung môi hữu cơ, t =115oC, t = -42oC. s nc
Pyridin được sử dụng làm tiền chất của hóa chất nông
nghiệp và dược phẩm; làm dung môi trong các phản ứng hữu cơ.
2. CẤU TRÚC CỦA CÁC HỢP CHẤT DỊ VÒNG
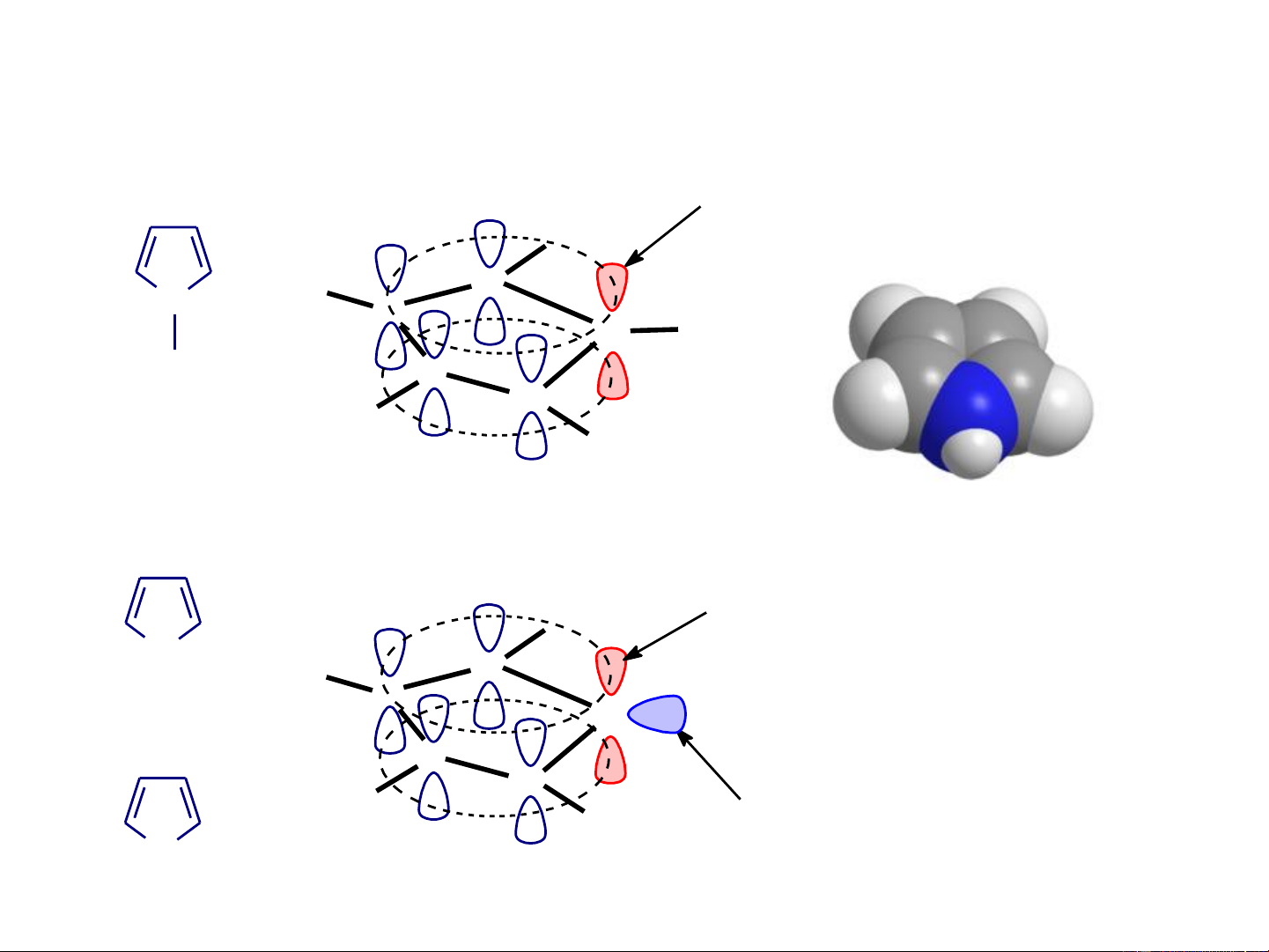
❖ Cấu trúc chung của các dị vòng 5 cạnh
Cấu trúc của các hợp chất dị vòng 5 cạnh một dị tố Orbital nµy chøa 2 electron
tham gia vµo hÖ thèng cña vßng. . H . .. .. C N H C . N H . H C C Pyrrol H H Orbital nµy chøa 2 electron .. . H .
tham gia vµo hÖ thèng cña vßng. .. O .. H C C Furan . .. Z . C C
Orbital nµy vu«ng gãc víi c¸c H .. H
orbital p cña vßng, vµ 2 electron .. S
trªn orbital nµy kh«ng tham gia Thiophen (Z = O, S)
vµo hÖ thèng cña dÞ vßng.
❖Cấu trúc của dị vòng 6 cạnh 1 dị tố : Pyridin
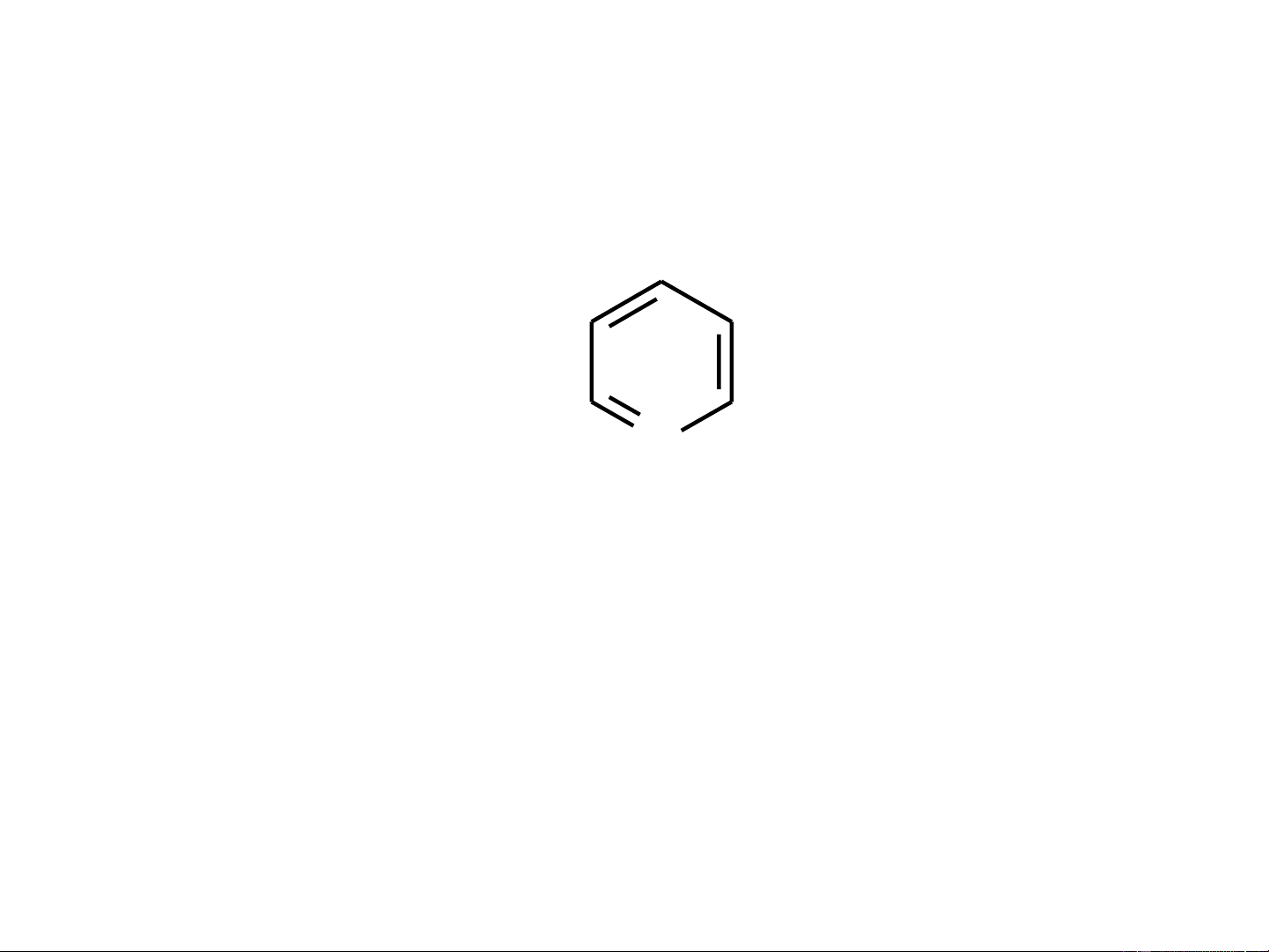
Pyridin có cấu tạo vòng phẳng 6 cạnh gần giống benzen H H H H H H dC-C = 0,139 nm dC-C = 0,139 nm d H H H C-N = 0,134 nm N H .. H Benzen Pyridin
Cấu trúc của pyridin H H C C ..
C¨p electron kh«ng liªn kÕt H C N cña N, kh«ng tham gia vµo
viÖc t¹o thµnh hÖ thèng 6e C C H H
Phân tử pyridin tồn tại ở dạng cấu trúc cộng hưởng giới hạn:
Tính thơm của các hợp chất vòng thơm
Hợp chất có tính thơm là hợp chất có những đặc điểm:
+ Tính bền vững của vòng và đặc trưng bởi năng lượng thơm hóa (E);
+ Khả năng khó tham gia phản ứng cộng và phản ứng oxi hóa;
+ Có khả năng tham gia phản ứng thế ở nhân thơm. Các
nhóm thế ở vòng có những ảnh hưởng rất đặc trưng đến tính
chất hóa học của hợp chất;
Về mặt cấu trúc, các hợp chất thơm có những điều kiện:
+ Phải có hệ vòng kín, các liên kết đơn và đôi liên hợp;
+ Vòng thơm phải có cấu trúc phẳng, không nhất thiết phải
giống benzen, chẳng hạn đa vòng hoặc dị vòng thơm;
+ Các electron p phải cặp đôi và số electron phải thoả
mãn công thức của Hückel (4n + 2)e.
+ Xét về tính thơm, độ bền của vòng, năng lượng ion hóa, khả
năng phản ứng thế, phản ứng cộng, phản ứng oxi hóa thì tính
thơm các hợp chất thơm tiêu biểu sắp xếp theo thứ tự giảm dần:
Benzen > Pyridin > Thiophen > Pyrrol > Furan
+ Benzen có cấu trúc đối xứng, gồm 6 nguyên tử C nên phân
bố mật độ e đều trên toàn vòng, vòng bền nhất và tính thơm
hoàn hảo nhất, khả năng phản ứng ở 6 nguyên tử C là như nhau. 4 4 3 ' 4 3 ' 4 3 ' 5 3 '5 2 '5 2 '5 2 6 2 O1 S N 1 1 N .. 1 H Pyridin
Benzen > Pyridin > Thiophen > Pyrrol > Furan Nội dung cần nhớ
HỢP CHẤT DỊ VÒNG (1)
1. Khái niệm - Phân loại - Dị vòng 5 cạnh
- Dị vòng 6 cạnh – Pyridin 2. Cấu trúc - Trạng thái lai hóa
- Tính thơm các hợp chất dị vòng
HỢP CHẤT DỊ VÒNG (2) 1. Điều chế 2. Hóa tính
1. PHƯƠNG PHÁP ĐIỀU CHẾ
❖ Điều chế pyrrol
- Pyrrol được điều chế bằng cách chưng cất nhựa than đá.
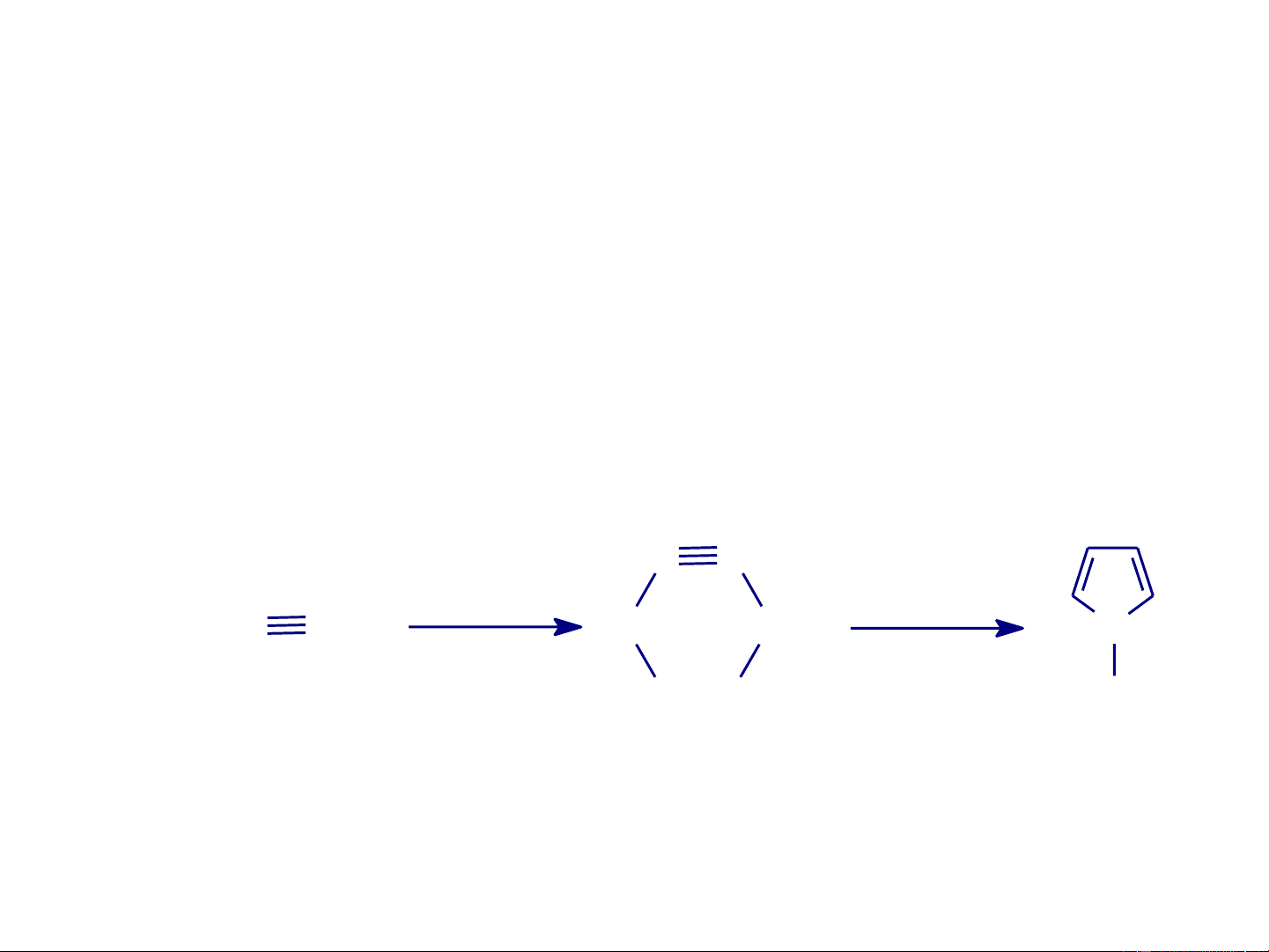
- Pyrrol được điều chế từ axetylen và formandehit: C C 2HCHO NH HC CH CH CH 3, t, P N Cu 2 2 2Cl2 (−2H2O) HO OH H Axetylen Butin-2-diol-1,4 Pyrrol
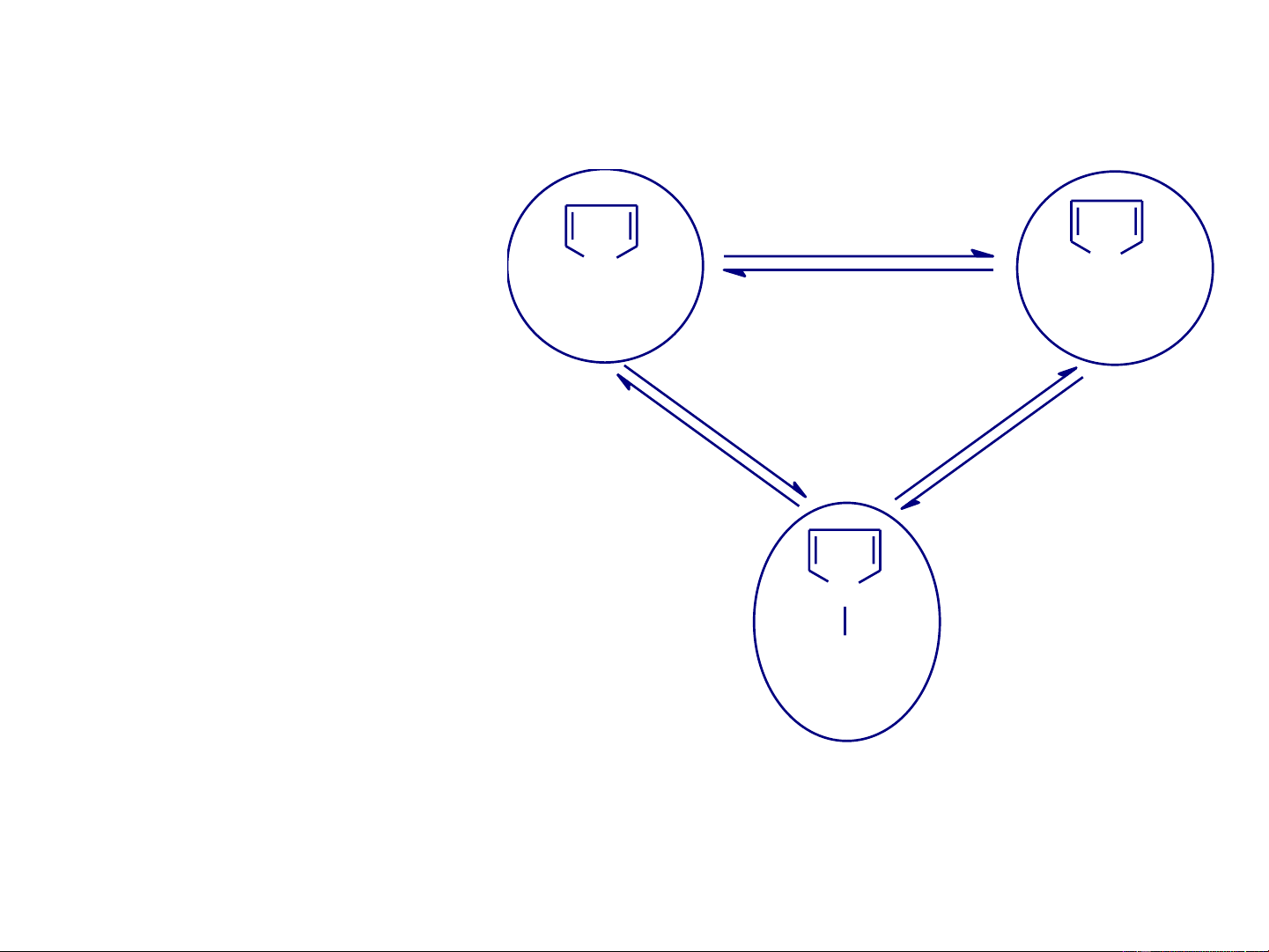
- Phản ứng Iurev (Юрьев): trong công nghệp điều chế
pyrrol bằng cách đun nóng furan với amoniac trên oxit nhôm ở 400-450oC: H2S O S H2O Furan Thiophen NH3 H2S H2O NH3 N H Pyrrol
Các phản ứng chuyển hoá giữa các dị vòng thơm 5
cạnh một dị tố xảy ra khi có mặt xúc tác (các axit rắn:
Al O hoặc SiO ) ở nhiệt độ cao. 2 3 2
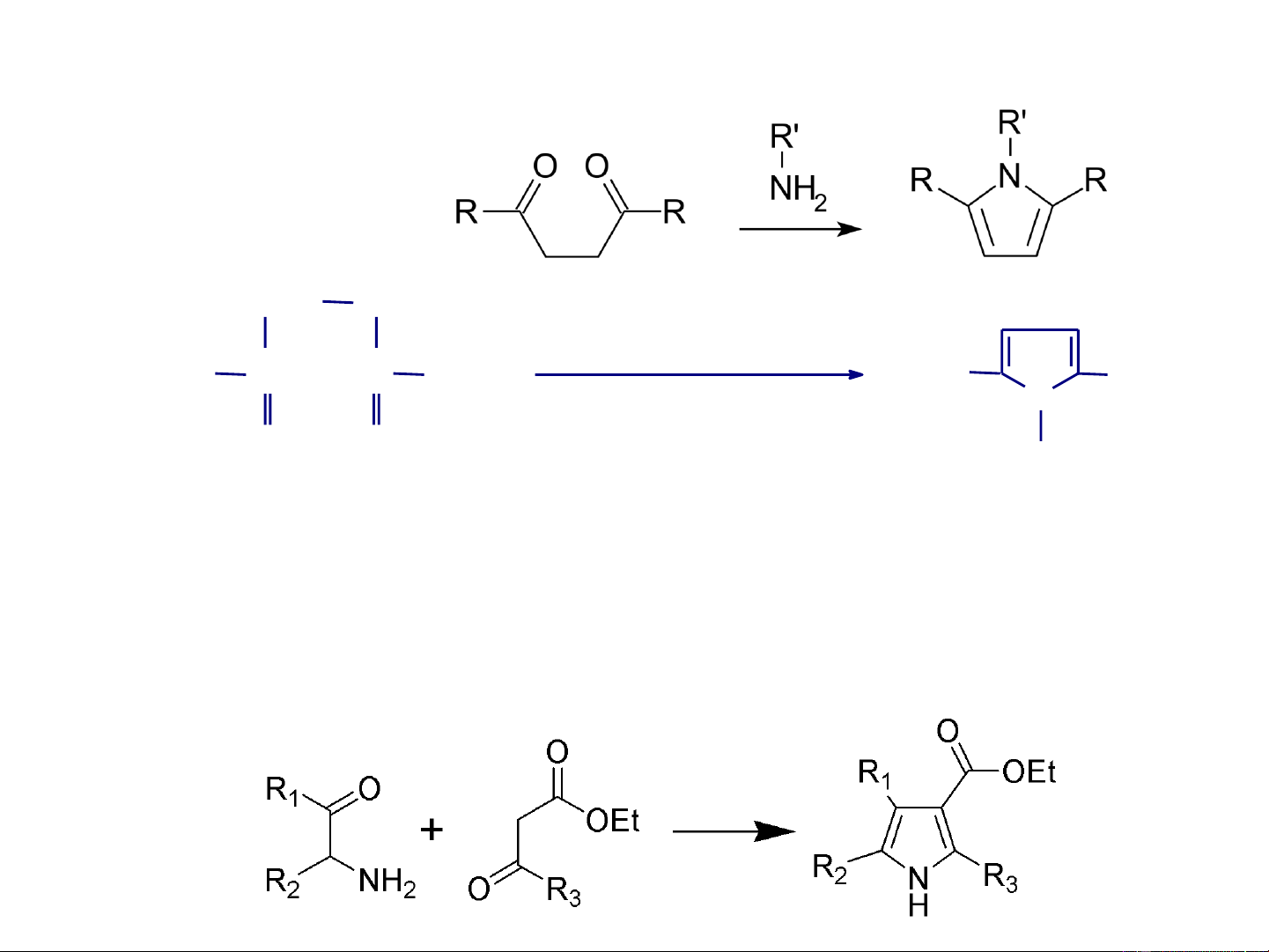
- Tổng hợp Paal-Knorr: Điều chế dẫn xuất của pyrrol từ hợp chất 1,4-dicacbonyl. CH2 CH2 (NH4)2CO3,100oC H C C H 3C CH3 3C CH3 (−NH N 3, −CO2, −3H2O) O O H Hexa-2,5-dion 2,5-Dimetylpyrrol
- Tổng hợp Knorr: tạo thành pyrrol thế từ phản ứng ngưng tụ
của -xetoeste với a-amino xeton hoặc -amino--xetoeste
trong sự có mặt của axit axetic.
❖ Điều chế pyridin
- Trước đây, pyridine được chiết xuất từ nhựa than
đá hoặc thu được như một sản phẩm phụ của quá trình khí hóa than
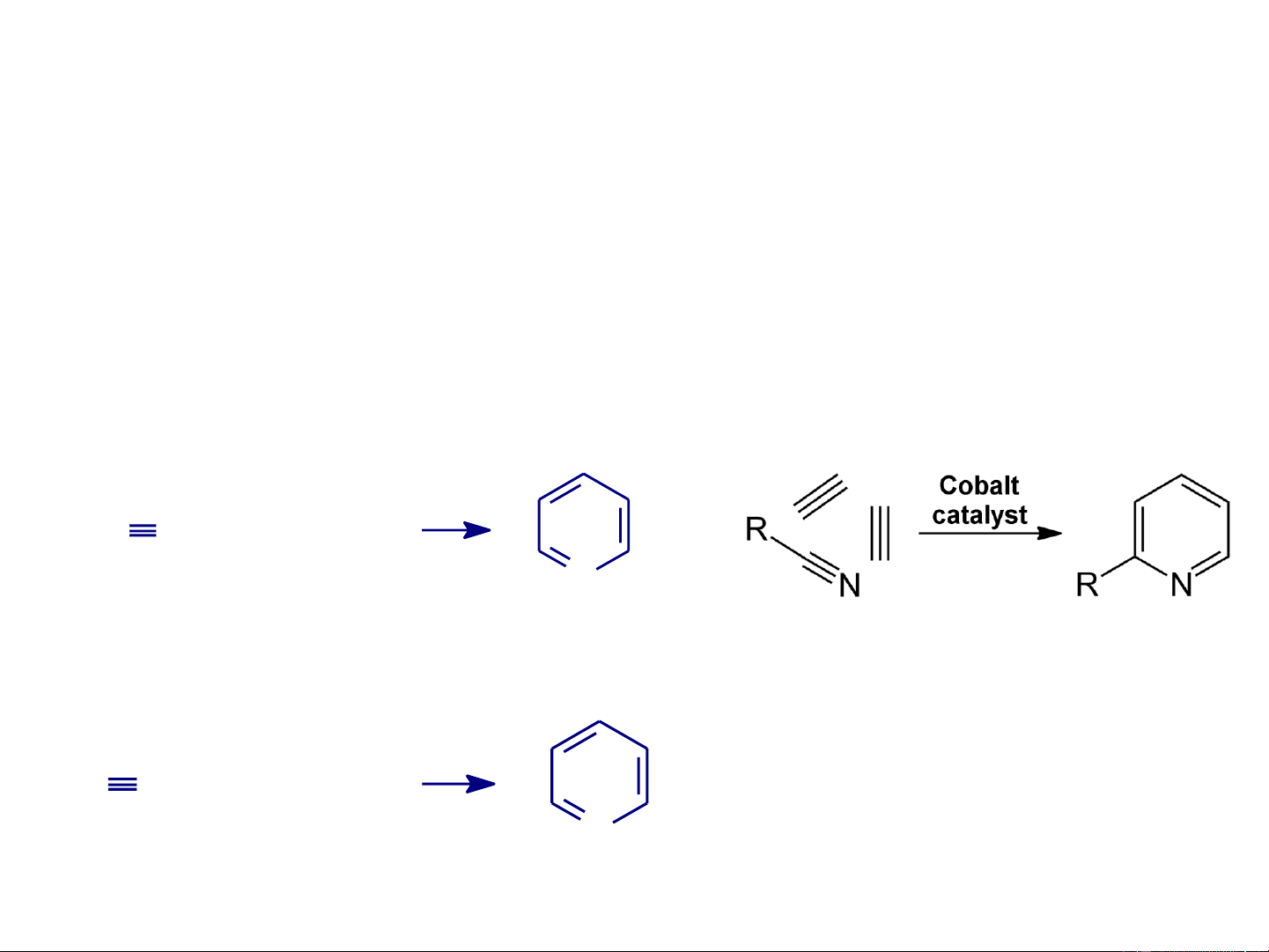
- Ngưng tụ đóng vòng axetilen với amoniac hay axit xianhydric HC CH + NH3 N Axetilen Amoniac Pyridin to HC CH + HCN Axetilen Axit N xianhydric Pyridin
❖ Điều chế pyridin
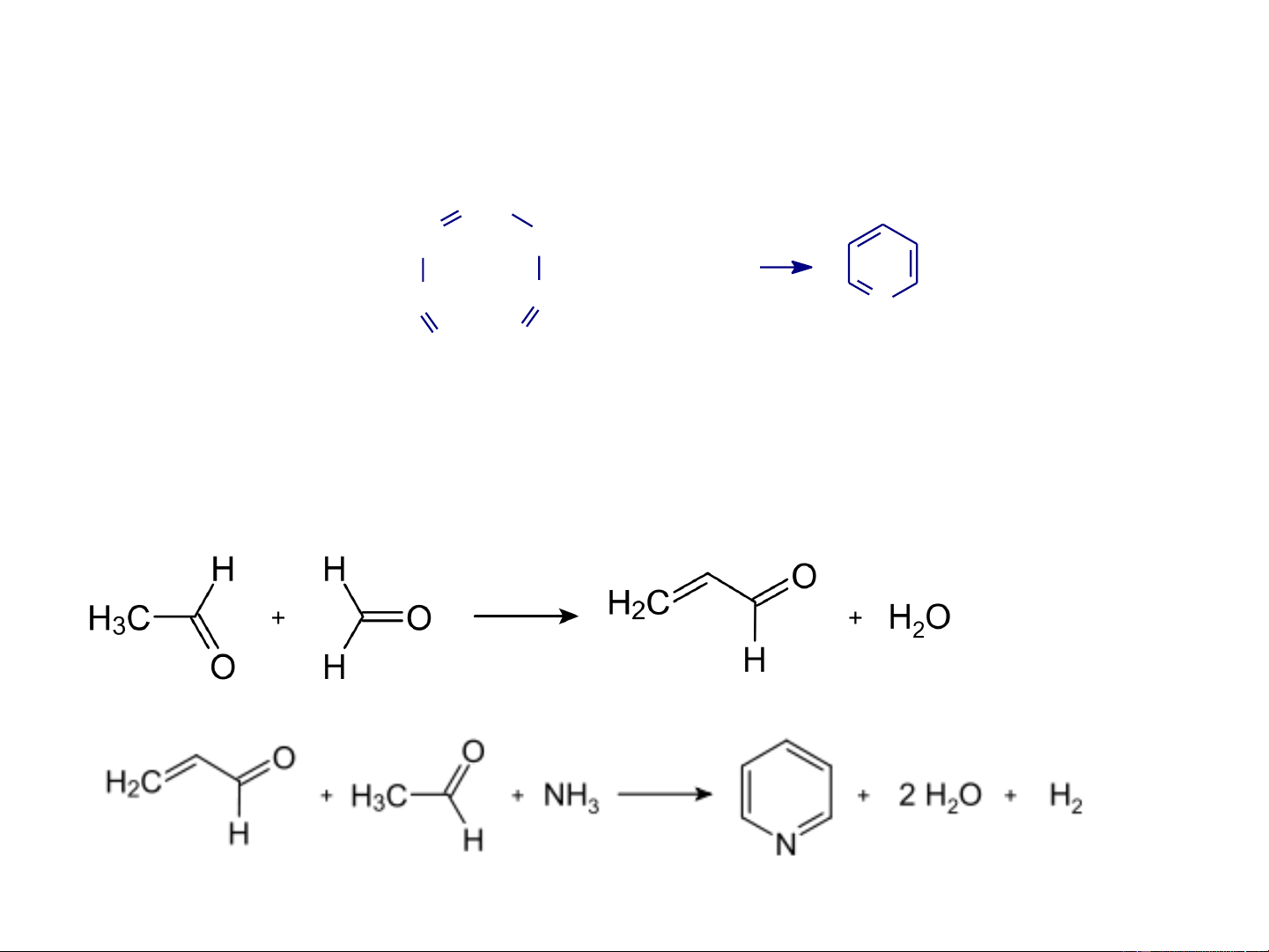
- Ngưng tụ đóng vòng của hợp chất 1,5-dicacbonyl với amoniac CH CH CH2 + NH3 CH CH N O O Di andehit cña Amoniac Pyridin axit glutaconic
- Tổng hợp Chichibabin sử dụng trong công nghiệp
Chất xúc tác thường là một muối kim loại chuyển tiếp florua cadmi(II) hoặc mangan(II)