

















Preview text:
Câu 1: Kháng thể đơn dòng là gì?
Tập đoàn Roche (Mỹ) muốn nghiên cứu tạo kháng thể đơn dòng (mouse IgG) kháng
VEGF để trị bệnh nhân ung thư cổ tử cung có biểu hiện quá mức VEGF. Nếu là nhân
viên R&D của Roche, Anh/Chị sẽ làm gì để đạt đ ợ ư c kháng thể nêu trên? Trả lời:
Kháng thể đơn dòng là các kháng thể đặc hiệu chỉ nhận dạng cho duy nhất chỉ một
epitope của một kháng nguyên. Ví dụ protein S của corona virus là một kháng nguyên,
protein S này có thể được chia ra làm 3 phần ứng với 3 epitope khác nhau, từ đó mỗi
kháng thể liên kết với một epitope trên được gọi là kháng thể đơn dòng. Hiện nay kháng
thể đơn dòng được hướng đến ứng dụng trong điều trị nhiều hơn nhờ vào tính đặc hiệu
cao hơn kháng thể đa dòng.
Để đạt được kháng thể trên, gồm các bước thực hiện sau:
- B1: Dùng pp protein tái tổ hợp để tạo kháng nguyên của ung thư cổ tử cung.
- B2: Sau khi phân lập đc kháng nguyên UTCTC, chích kháng nguyên đó vào
lách chuột => hệ m ễ
i n dịch của chuột sẽ phản ứng lại với kháng nguyên lạ => hệ m ễ
i n dịch kích thích B cell sang trạng thái hoạt độn
g => thu B cell
- B3: Đem lai tế bào sinh kháng thể vs tế bào u tủy bất tử trong môi trường
PEG (polyethylene glycol) để tạo ra tế bào có khả năng tạo kháng thể và bất
tử. Kết quả thu đc 5 loại ế t bào khác nhau gồm:
1. Tế bào bất tử, HGPRT+, IgG+ (B cel l+ myeloma)
2. Tế bào không bất tử, HGPRT+, IgG+ (B cel tự dung hợp) => chết sau vài ngày
3. Tế bào bất tử, HGPRT-, IgG- (myeloma tự dung hợp)
4. Tế bào bất tử, HGPRT-, IgG- (myeloma không dung hợp)
5. Tế bào không bất tử, HGPRT+, IgG+ (B cel không dung hợp) => chết sau vài ngày
- B4: Đem các tế bào đi nuôi cấy trong môi trường HAT (gồm Hypoxanthine,
Aminopterin, Thymidine). Mà tế bào có 2 con đường tổng hợp các nucleotide:
+ De novo pathway: con đường tổng hợp này cần enzyme dihydrofolate
reductase xúc tác nhưng trong HAT lại chứa aminopterin làm ức chế
enzyme dihydrofolate reductase => bất hoạt con đường này
+ Salvega pathway: con đường này cần có xúc tác bởi enzyme HGPRT
để tiến hành, mà enzyme HGPRT đã có sẳn gene mã hóa ở tế bào B cell
=> chỉ có tế bào Hybridoma có thể tăng sinh được trong HAT
- B5: Dùng pp pha loãng tới hạn để phân lập dòng tế bào, sau đó dùng elisa để
sàng lọc tính đặc hiệu của kháng thể.
- B6: Vì tế bào này vẫn là tế bào của chuột nên ta cần modify nó lại bằng cách
cắt tất cả các đoạn gene chuột chỉ giữ lại đoạn VH – VL có chức năng và nối
lại với đoạn gene của người => humanize or kynetic
- B7: Kiểm tra sự tăng sinh và có tạo protein IgG hay không
- B8: Nuôi cấy và trữ đông -196℃
Câu 2: Dựa vào hình dưới, Anh/Chị cho biết các điều kiện để 1 tế bào có thể được gọi là tế bào gốc?
Phân loại tế bào gốc theo source và potency?
Tế bào gốc là loại tế bào chưa biệt hóa mà có thể biệt hóa thành nhiều loại tế bào đặc
biệt khác nó và đồng thời, có thể tăng sinh (thông qua quá trình nguyên phân) để tạo ra
nhiều loại tế bào gốc khác giống hệt nó.
Các điều kiện để 1 tế bào có thể được gọi là tế b o à gốc là:
- Là tế bào không chuyên biệt - Có khả năng tăng sinh
- Có khả năng biệt hóa thành những loại tế bào khác
- Có tồn tại trong phôi và trong cơ thể hoàn chỉnh
Phân loại tế bào gốc theo nguồn gốc (source):
Từ một tinh trùng và trứng ban đầu, qua quá trình thụ tinh sẽ hình thành nên một
hợp tử (giai đoạn 1 tế bào). Qua ngày tiếp theo, thông qua cơ chế tăng sinh sẽ bước vào
giai đoạn 2 tế bào, sau 3 đến 4 ngày sẽ tăng đến giai đoạn 16 tế bào, còn được gọi là
phôi dâu (Morula). Khi bước sang ngày thứ 5, ta có được phôi nang (Blastocyst), bao
gồm: khối tế bào ngoài (outer cel mass), khối tế bào trong (inner cel mass) và khoang
chứa dịch lỏng (fluid cavity).
Ở giai đoạn này, ta có thể lấy ra các thành phần từ một phôi nang được hiến, mỗi
thành phần đóng vai trò khác nhau. Khối tế bào ngoài có khả năng biệt hóa thành nhau
thai (placenta) và cuống rốn (umbilical cord). Khối tế bào trong sau khi lấy ra và nuôi
cấy, ta thu được embryonic stem cel có thể biệt hóa thành nhiều loại tế bào đặc biệt khác trong cơ thể t ô
h ng qua nhiều tín hiệu biệt hóa khác nhau, hoặc tăng sinh để tạo ra
nhiều loại tế bào gốc giống hệt nó.
Trong trường hợp ta không thu được embryonic stem cel ở giai đoạn trên, sau
khi cơ thể hoàn chỉnh hình thành, ta có được adult stem cel lấy từ tủy xương. Tế bào
thu được ở đây có khả năng biệt hóa thành các tế bào thuộc nhiều cơ quan khác nhau
trong cơ thể như tế bào gan, tế bào thần kinh, tế bào máu, tế bào da…
Phân loại tế bào gốc theo khả năng (potency):
Tế bào gốc có thể chia thành 3 loại chính dựa trên khả năng của chúng:
- Totipotent stem cel (tế bào gốc toàn năng): đây là loại tế bào nhận được từ hợp
tử và có thể biệt hóa ra tất cả các tế bào trong cơ thể
- Pluripotent stem cel (tế bào gốc vạn năng): là loại tế bào lấy từ khối tế bào trong
(inner cell mass) trong phôi nang, còn được gọi là embryonic stem cel và có khả
năng biệt hóa ra hầu hết tế bào trừ nhau thai và cuống rốn.
- Multipotent stem cel (tế bào gốc đa năng): là loại tế bào lấy từ tủy xương của
cơ thể hoàn chỉnh ở con người, có thể biệt hóa thành một số loại tế bào nhưng
phải nằm trong cơ quan chứa loại tế bào đó, nói cách khác là biệt hóa theo cục bộ.
Ngoài ra còn có thể tính đến loại Unipotent stem cel (tế bào gốc đơn năng), là loại tế
bào gốc có thể biệt hóa thành một loại tế bào duy nhất, thường là các tế bào tiền thân,
chỉ tạo ra được một loại tế bào chức năng cố định.
Câu 3: Thế nào là proteomics?
Người ta muốn tìm hiểu toàn bộ protein của bệnh nhân tiểu đường type 1 (diabetes type
1) biểu hiện khác với người bình thường như thế nào. Qua đó có thể phát hiện được các
biomarker, giúp cho việc chẩn đoán người bệnh tiểu đường type 1 nhanh chóng hơn.
Anh/Chị hãy đề ra quy trình giúp phát hiện các biomarker này? Trả lời:
Proteomics là ngành khoa học nghiên cứu về protein.
Bao gồm: + Pr ote omic pr of ilin g.
+ Phosphoproteomic profiling.
Người ta muốn tìm hiểu toàn bộ protein của bệnh nhân tiểu đường type 1 (diabetes
type 1) biểu hiện khác với người bình thường như thế nào. Qua đó có thể phát hiện
được các biomarker, giúp cho việc chẩn đoán người bệnh tiểu đường type 1 nhanh
chóng hơn. Anh/Chị hãy đề ra quy trình giúp phát hiện các biomarker này?
Biomarker là chỉ dấu sinh học đóng vai trò quan trọng trong việc phát hiện ra dấu
hiệu của một loại bệnh.
Protein của người bệnh tiểu đường type 1 so sánh với protein người bình thường sẽ
có những biệu hiện khác thì đó những biomarker.
Quy trình phát hiện các biomarker: 1. Thu th ập mẫu:
- Mẫu máu: Huyết tương hoặc huyết thanh t ừ người bệnh tiểu đường type 1 và người khỏe mạnh.
- Mẫu mô: Mô tuyến tụy từ bệnh nhân tiểu đường type 1 và người hiến tặng khỏe mạnh. 2. Xử lý mẫu:
- Với mẫu máu: Ly tâm mẫu máu để thu huyết tương hoặc huyết thanh.
- Với mẫu mô: P hâ n hủy enzyme hoặc chiết xuất cơ học để thu protein.
Sử dụng các kỹ thuật tách chiết protein phù hợp để thu thập protein từ cả hai loại mẫu trên. 3. Phân tích protein
- Điện di 2 chiều (2-DE): Phân tách các protein dựa trên kích thước và điện tích.
Quan sát và so sánh 2 bản đồ protein từ người bệnh tiểu đường type 1 và người
khỏa mạnh để xác định protein khác biệt.
- Khối phổ (Mass spectrometry-MS): Xác định khối lượng và cấu trúc phân tử
của protein khác biệt được phát hiện trong giai đoạn điện di hai chiều. 4. Xác nhận biomarker
- Lặp lại các thí nghiệm trên nh ó m bệnh nhân tiểu đường type 1 và nhóm người
khỏe mạnh để xác địn h tí nh nhất quán về các protein khác biệt.
- Đánh giá hiệu suất của các biomarker tiềm năng trong việc phân biệt bệnh
nhân tiểu đường type 1.
Câu 4: Dựa vào hình dưới đây, Anh/Chị hãy trả lời các câu hỏi sau:
- Liệu pháp gì được miêu tả trong hình?
- Cấu trúc CAR phải được thiết kế như thế nào?
- Giải thích cơ chế của liệu pháp này?
Liệu pháp tế bào CAR – T:
Các thành phần qua n t r ọng của thụ thể CAR gồm: (i)
vùng nhận dạng kháng nguyên ngoại bào, ví dụ phân đoạn biến đối chuỗi đơn (scFv) (ii)
vùng xuyên màng tế bào và một vùng bản lề giúp đính thụ thể lên màng tế
bào và phóng scFv ra không gian ngoại bào
(i i) các vùng truyền tín hiệu nội bào được kích hoạt nhờ tương tác với kháng nguyên trên scFv
Tính đặc hiệu kháng nguyên của CAR được quyết định bởi vùng scFv (vùng chức năng
nhỏ nhất của một kháng thể đơn dòng). scFv chỉ chứa vùng biển đổi chuỗi nhẹ và chuỗi
nặng dung hợp lại với nhau thông qua một linker rất linh động. Ưu điểm của việc sử
dụng scFv làm vùng nhận dạng kháng nguyên CAR là: dễ ghép vào cấu trúc CAR chung
và tính đặc hiệu cao do chúng được tao ra để gần đặc hiệu kháng nguyên quan tâm.
Vùng chức năng bản lề và xuyên màng:
- Vùng chức năng bản lề linh động là một đoạn peptide ngắn giúp scFv tự do biến
đổi cấu hình, qua đó scFv tự do bám với kháng nguyên đích biểu hiện trên tế bào
ung thư. Vùng này có thể được sử dung một mình hoặc liên kết với một vùng
chức năng đệm để phóng scFv ra khỏi bề mặt tế bào T. Vai trò của vùng chức
năng xuyên màng là tác động đến biểu hiện của CAR và liên kết với các protein
màng nội sinh của tế bào T.
Vùng chức năng đồng hoạt hoá:
- Eshar and các cộng sự là những người đầu tiên chứng minh được rằng gần scFv
với chuỗi z (zeta) hoặc gamma của thụ thể tế bào T (T cel receptor) mang lại
cho tế bào lympho T tính đặc hiệu như kháng thể và khả năng hoạt hoá tất cả các
chức năng của một tế bào hiệu ứng (effector), bao gồm sản xuất IL-2 và phá huỷ
tế bào đích. Những cải tiến nhằm tăng khả năng tăng sinh, tiết IL-2, sống sót và
chức năng gây độc của tế bào CAR-T bao gồm: gắn kèm chuỗi zeta z (thế hệ thứ
nhất), gắn thêm chuỗi zeta và CD28 (thế hệ thứ 2), hoặc kết hợp thêm một vùng
chức năng truyền tín hiệu thứ 3 (thế hệ thứ 3) như 4-1BB (CD137), OX40
(CD134), ICOS và CD 27. Thế hệ thứ 4 bao gồm các CAR được bảo vệ để tăng
cường tính bền bỉ trong môi trường khối u.
Sau khi thiết kế xong CAR, cần đưa gen mã hoá nó vào tế bào T một cách bền vững.
Hai vector được sử dụng phổ biến nhất cho mục đích này là retrovirus mất khả năng
nhân lên: g-retrovirus và lentivirus. Cả hai loại virus này đều sử dụng nguyên liệu di
truyền là RNA mà được phiên mã ngược thành DNA sau khi chuyển nạp tế bào T, và
sau đó được cài vào hệ gen của tế bào chủ và biểu hiện thành protein. Nhờ những đặc
điểm như vậy mà CAR có chức năng kép (a) nhận dạng các kháng nguyên biểu hiện
trên bề mặt tế bào ung thư (b) chủ động kích thích và khuyếch đại các tín hiệu hoạt hoá
và xúc tác phá huỷ tế bào ung thư.
Ưu điểm của hệ thống này:
- Cung cấp các tế bào T được tái lập trình mang cơ chế hoạt hoá ex-novo
- Tránh được các cơ chế ức chế đáp ứng miễn dịch do tế bào ung thư gây ra
- Nhận dạng kháng nguyên ung thư và xúc tác phá huỷ tế bào ung thư không cần
thông qua HLA, bằng cách đó có thể vượt qua được các rào cản để liệu pháp
miễn dịch tế bào được ứng dụng rộng rãi hơn.
Câu 5: Anh/Chị giải thích hình dưới đây để cho biết cel balance và nguyên nhân gây ung thư?
Ở tế bào người, khi tế bào bị đột biến có thể sửa sai hoặc chúng có thể t ế i n hành chết theo 3 cơ chế sau:
- Apoptosis: là quá trình tế bào chết theo lập trình, quá trình này được điều
khiển bởi các cel signaling cụ thể có bản chất là protein báo hiệu cho tế bào
chết đi theo một chuỗi các bước được lập trình sẵn.
- Autophagy: là quá trình sinh học tự nhiên giúp loại bỏ các thành phần tế bào
không cần thiết hoặc bị hư hỏng, đồng thời tái chế các thành phần này để
cung cấp năng lượng và nguyên liệu cho tế bào khác một cách có trật tự.
- Necrosis: là quá trình tế bào chết đi do những tác động của các yếu tố bên
ngoài như bị nhiễm trùng, chấn thương, nhiễm độc, từ đó làm cho quá trình
hoạt động của tế bào mất ổn định, gây chết tế bào.
Nhờ có 3 cơ chế này mà tế bào cân bằng. Nhưng khi DNA bị đột biến làm tế bào
tăng sinh quá mức mà cơ thể không thể sửa chữa được nữa thì dẫn đến tế bào mất
khả năng apoptosis. Từ đó, tế bào tăng sinh không kiểm soát và không dừng lại dẫn
đến hình thành tế bào ung thư.
Các nguyên nhân gây ra ung thư:
- Do DNA bị đột biến dẫn đến protein tín hiệu bị đột biến làm tế bào không có
tín hiệu để tiến hành chết đi làm tế bào tăng sinh quá mức hình thành tế bào ung thư.
- Do ngoại di truyền làm gene bị im lặng:
+ Methyl hóa: CH3 gắn vào cytosine kế bên guanine theo chiều 5’ – 3’
ở promoter làm quá trình phiên mã không xảy ra dẫn đến protein tín
hiệu bị im lặng nhưng DNA không bị đột biến.
+ Histone modification: tác nhân ngoại lai làm histone không tháo xoắn
dẫn đến phiên mã không được diễn ra, protein tín hiệu bị im lặng.
+ Do miRNA và siRNA: RISC hủy mRNA làm quá trình dịch mã không
diễn ra dẫn đến gene bị im lặng.
Câu 6: Herceptin là kháng thể đơn dòng dùng trong điều trị ung thư vú ở người.
Anh/Chị hãy cho biết các yếu tố sau phải được chọn lựa như thế nào để việc sản
xuất Herceptin đạt hiệu suất cao nhất và giải thích vì sao Anh/Chị lựa chọn các thông số đó? - Host cel , - Plasmid,
- Phương pháp đưa plasmid vào host cell, - Chọn lọc clones, - Tinh sạch Herceptin. Trả lời:
Host cel : CHO vì herceptin là kháng thể điều trị ung thư vú ngừi, n ên ta cần có kháng
nguyên của ung thư vú của ngừi => tb động vật có vú => host cel phải lài CHO thì mới
đủ khả năng tải gen người .
Plasmid: dùng plasmid expression vì để giúp sàng lọc lại chủng tb có hoạt tính mà ta
cần. Ngoài ra loại plasmid này còn giúp tb mang những gene cần thiết để biểu hiện
những tính trạng cần thiết.
Phương pháp đưa plasmid vào host cell:
- Microporator: điện xung để phá vỡ thành tb
- Lipofection: liposome(-) gắn vào DNA(+) dính vào tb=> mang dna vào nhân
tb, sau đó tích hợp vs promotor để tb chủ tạo mRNA, tiếp tục tiến ra tbc và dịch mã.
- Chọn lọc clones: dùng phương pháp pha loãng tới hạn nuôi ở mỗi giếng 1 tb
để phân lập ra dòng tb có hoạt tính.
- Tinh sạch hercerptin: dùng Tag-his6 để tinh sạch herceptin. Vì đây không
phải nhóm kháng thể Ig nên không dùng unTag được.
Câu 7: Thế nào là proteomics?
Proteomics: là một ngành trong công nghệ OMICS nghiên cứu về hệ protein toàn bộ
protein trong cơ thể con người được tạo ra hoặc chỉnh sửa bởi các vi sinh vật sống hoặc
hệ thống. Được phân loại thành 3 máng tùy thuộc vào mục đích nghiên cứu gồm: cấu
trúc, chức năng và mức độ biêu hiện.
Anh/Chị hãy giải thích hình sau để phản biện lại Thuyết Dogma “1 gene : 1 mRNA : 1 protein”?
Thuyết Dogma "1 gene: 1 mRNA: 1 protein" trên thực tế là không đúng. Vì trong
thực tế, ở con người có 22.000 - 25.000 gene nhưng khi phiên mã tạo ra khoảng
100.000 mRNA nhờ vào cắt intron và nối exon (alternative splicing) ở eukaryote và
dịch mã tạo ra 1 triệu protein, tạo ra hơn 5.000 compounds nhờ vào biến đổi sau
dịch mã (PTM) chỉ có ở eukaryote, chỉ cần addding và folding khác nhau thì sẽ có
chức năng khác nhau từ đó tạo ra sự đa dạng.
Câu 8: Anh/Chị cho biết liệu pháp nào đang được nêu trong hình dưới đây?
Giải thích chi tiết hình để làm rõ các cách có thể tiến hành để tấn công mục tiêu
CD47 trên tế bào ung thư?
Trả lời: (Hình này ở slide 39- Chapter 6.2)
Liệu pháp được nêu trong hình trên chính là liệu pháp miễn dịch (Immune therapy) còn
hay gọi là liệu pháp trúng đích (Targeted therapy). Liệu pháp này được sử dụng để
kháng ung thư bằng cách sử dụng kháng thể đơn dòng (Monoclonal therapy) kháng lai
thụ thể chỉ có ở tế bào ung thư, cụ thể hơn chính là thụ thể CD47 để ức chế tế bào ung thư.
Nhìn hình trên, ta sẽ có 5 cách để thực hiện liệu pháp này:
- Cách 1: Tạo ra kháng thể đơn dòng, kháng thể này sẽ gắn vào thụ thể CD47 làm
cho tế bào ung thư chết theo lập trình (Apoptosis).
- Cách 2: Làm cho tế bào ung thư chết theo 2 con đường khác nhau.
+ Thứ nhất là con đường ADCC (Antibody-dependent cel cytoxicity) còn được
gọi là gây độc tế bào dựa vào kháng thể. Sau khi mAb (Monoclonal antibody)
gắn vào CD47 sẽ gọi NK cel (Natural kil er cel ) đến để giết tế bào ung thư.
+ Thứ hai là con đường CDC (Complement-dependent cytoxicity) còn được
gọi là gây độc tế bào dựa vào bổ thể (Complement). Riêng CDC thì không
cần NK cel mà lai tạo ra nhiều bổ thể, làm cho tế bào ung thư thủng 1 chỗ
gây mất cân bằng các chất ra vào dẫn đến tế bào chết.
- Cách 3: Sau khi mAb gắn vào CD47 thì lại gọi đại thực bào đến (Macrophage)
tạo ra phức hợp gồm CD47-Anti-CD47 mAb Macrophage receptor SIRPα Fc .
Đại thực bào sẽ thực bào tế bào ung thư (Phagocytosis) và tiết ra enzyme phân hủy tế bào ung thư.
- Cách 4: Nhìn hình ta sẽ thấy ở mAb kháng CD47 sẽ không được sử dụng mà
thay vào đó là mAb kháng SIIRPα. Do sử dụng phần Fc (Fragment crystal izable
region) của SIRPα và sử dụng mAb kháng SIRPα gọi đại thực bào đến và gây
chết tế bào ung thư theo con đường thực bào (Phagocytosis).
- Cách 5: Ta sẽ sử dụng mAB kháng CD47, gắn vào CD47 thì phát hiện tế bào
hình tua ( Dendirtic cel ). Tế bào hình tua sẽ được gắn vào phức hợp CD47 -
Anti-CD47 mAb rồi hoạt hóa. Tiếp đến tế bào hình tua sẽ đi vào CD8+ T cell và
CD4+ T cel . CD8+ T cel sẽ gây hoạt hóa giết tế bào khối u, CD4+ T cel sẽ gọi
các tế bào khác đến giết tế bào ung thư.
Câu 9: Bệnh nhân A bị phỏng phức tạp (complicated wound), cần phải được chữa
trị bằng các phương pháp khác nhau. Anh/Chị hãy đề nghị 02 phương pháp bất kỳ
liên quan đến vật liệu sinh học (biomaterials) để giúp bệnh nhân này? Giải thích sự lựa chọn? Trả lời:
Có 3 pp điều trị bỏng : dùng tế bào gốc vạn năng, yếu tố sinh trưởng, vật l ệ i u mới.
- Pp1: chọn sử dụng da đồng loại allograf để điều trị vết bỏng phức tạp (vật liệu mới )
+ Vì da đồng loại al ograf có khả năng giúp đóng kín vết thương, ngăn ngữa
vi khuẩn, nhiễm trùng, hạn chế mất máu, giảm đau.
+ Ghép da đồng loại tạo một môi trường vi mô tốt hơn giúp làm lành vết
thương và cung cấp hàng rào sinh lý làm giảm sự mất nước, chất điện giải,
protein và nhiệt qua vết thương.
+ Ngoài ra al ograf là loại vật liệu sinh học phù hợp nhất để thay thế da
người bị bỏng vì chúng có nguồn gốc từ da người nên có thể tránh sự đào
thải của cơ thể người bệnh. Phù hợp cho vết bỏng sâu, diện rộng,...
- Pp2: Dùng súng bắn da để phun tế bào gốc lên vết bỏng (liệu pháp tế bào gốc)
+ Vì phương pháp này mang đến kết quả nhanh chóng và hiệu suất cao trong
việc làm lành vết thương.
+ Có thể linh hoạt phù hợp với nhiều kích cỡ vết thương khác nhau.
+ Không gặp trường hợp đào thải vì tế bào gốc được lấy ra từ chính người
bệnh. Rút gắn tỉ lệ tưởng nhiễm khuẩn, nhiễm trùng của vết thương.
Câu 10: Dựa vào hình (1) dưới đây, Anh/Chị hãy giải thích cơ c ế h giúp tế bào ung thư vượt qua hệ m ễ i n dịch cơ thể?
Phương pháp nào của liệu pháp miễn dịch được dùng trong hình (2)? Giải thích phương pháp? 1 2
Cơ chế giúp tế bào ung thư vượt qua tế bào miễn dịch:
Neoantigen là những protein của khối u hay kháng nguyên của khối u do DNA đột
biến mã hóa thành. Những neoantigen có thể được tế bào T nhận diện và tấn công.
Về cơ chế, tamoxifen có ái lực với ER lớn hơn estrogen, vậy nên chúng sẽ bám chặt lên
ER, hình thành phức hợp tamoxifen – ER, ngăn cản sự hình thành của estrogen – ER.
Thêm vào đó, phức hợp tamoxifen – ER không có vai trò như một tín hiệu phiên mã
(transcriptional factor), vậy nên tế bào vú sẽ không bị kích thích tăng sinh.
Câu 12: Thế nào là dược lực học ? Thuốc tác động vào 4 đích đến chính (drug targets) nào trong cơ thể ?
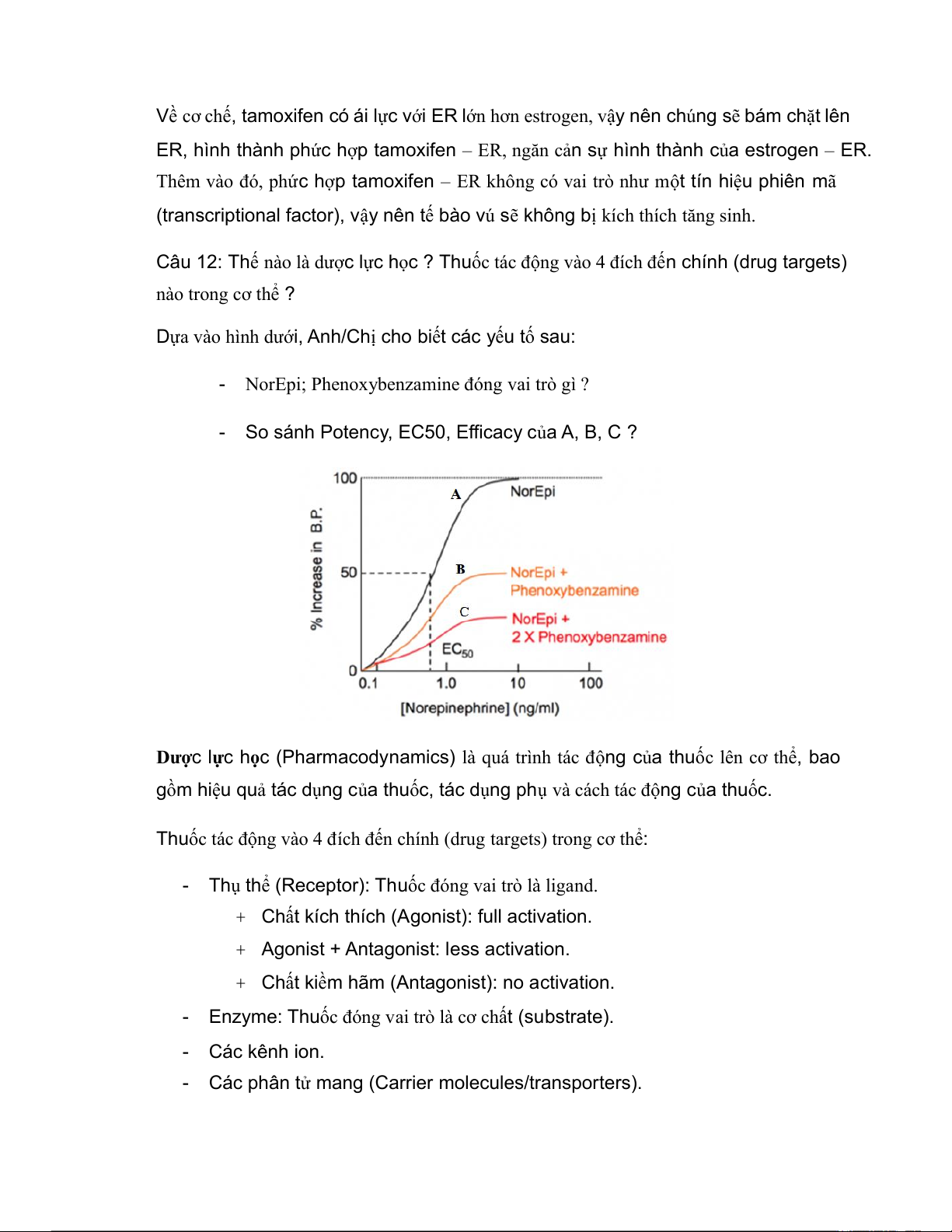
Dựa vào hình dưới, Anh/Chị cho biết các yếu tố sau:
- NorEpi; Phenoxybenzamine đóng vai trò gì ?
- So sánh Potency, EC50, Efficacy của A, B, C ?
Dược lực học (Pharmacodynamics) là quá trình tác động của thuốc lên cơ thể, bao
gồm hiệu quả tác dụng của thuốc, tác dụng phụ và cách tác động của thuốc.
Thuốc tác động vào 4 đích đến chính (drug targets) trong cơ thể:
- Thụ thể (Receptor): Thuốc đóng vai trò là ligand.
+ Chất kích thích (Agonist): ful activation.
+ Agonist + Antagonist: less activation.
+ Chất kiềm hãm (Antagonist): no activation.
- Enzyme: Thuốc đóng vai trò là cơ chất (substrate). - Các kênh ion.
- Các phân tử mang (Carrier molecules/transporters).




