


















Preview text:
ĐẠI HỌC QUỐC GIA HÀ NỘI
TRƢỜNG ĐẠI HỌC KHOA HỌC TỰ NHIÊN
-----------------------------
N g u y ễ n V ă n R i Tạ thị thảo Thực tập phân tích Hoá học PHẦN 1
PHÂN TÍCH ĐỊNH LƢỢNG HOÁ HỌC Hà nội 2006 http://www.ebook.edu.vn MỤC LỤC
Phần 1 Phân tích định lƣợng hoá học cơ bản Chƣơng 1
Phƣơng pháp chuẩn độ axit-bazơ 2 Bài 1
Chuẩn độ đơn axit, đơn bazơ 2 1.1
Hiệu chỉnh thể tích buret 2 1.1.1
Thực hành cân nƣớc cất 2 1.1.2
Vẽ đƣờng cong hiệu chỉnh thể tích buret 3 1.2
Pha chế dung dịch chuẩn axit oxalic để xác định bazơ 3 1.3
Xác định các nồng độ đơn axit đa bazơ 3 1.3.1
Thiết lập nồng độ NaOH theo dung dịch gốc H2C2O4 3 1.3.2 Xác định nồng độ HCl 4 1.3.3
Xác định nồng độ CH3COOH 4 1.3.4 Xác định nồng độ NH3 5 1.3.5
Xác định hàm lƣợng NH +
4 theo phƣơng pháp foocmalin 5 Bài 2 Chuẩn độ đa axit 6 2.1 Dung dịch chuẩn 6 2.1.1
Pha chế dung dịch từ fixanal 6 2.1.2
Thiết lập nồng độ HCl theo natri tetraborat 6 2.2
Xác định nồng độ đa axit và muối của nó 7 2.2.1
Xác định nồng độ dung dịch H3PO4
bằng dung dịch chuẩn NaOH 7 2.2.2
Xác định nồng độ HCl và H3PO4 trong cùng hỗn hợp 7 2.2.3
Xác định nồng độ KH2PO4 và K2HPO4 trong cùng hỗn hợp 8 Bài 3 Chuẩn độ đa bazơ 9 3.1 Các dung dịch chuẩn 9 3.1.1
Thiết lập nồng độ HCl theo Na2CO3 9 3.1.2
Thiết lập nồng độ NaOH theo HCl đã chuẩn 9 3.2
Xác định đa bazơ bằng axit mạnh 10 3.2.1
Xác định nồng độ Na2CO3 và NaHCO3 trong hỗn hợp 10 3.2.2
Xác định hàm lƣợng Na2CO3 trong NaOH công nghiệp 10 3.2.3
Xác định độ cứng tạm thời của nƣớc máy 11 3.3
Câu hỏi ôn tập phần các phản ứng axit-bazơ 12 Chƣơng 2
Phƣơng pháp chuẩn độ complexon 13 Bài 4
Chuẩn độ trực tiếp xác định các ion kim loại 13 4.1 Pha dung dịch chuẩn EDTA 13 4.2
Xác định các ion kim loại 13 4.2.1
Xác định Zn2+, Mg2+, Pb2+, chất chỉ thị ETOO ở pH 10 13 4.2.2
Xác định Ni2+, Cu2+, Ca2+, chỉ thị Murexit 14 4.2.3
Xác định Fe3+, chỉ thị axít sunfosalixilic H2SSal 15 4.2.4
Xác định Cu2+ chỉ thị PAN, pH =5 15 Bài 5
Các kỹ thuật chuẩn độ complexon 16 5.1
Chuẩn độ phân đoạn xác định Bi3+, Pb2+ 16 5.2
Chuẩn độ ngƣợc xác định Pb2+bằng Zn2+ và EDTA 16 1 http://www.ebook.edu.vn 5.3 Chuẩn độ thay thế 17 5.3.1 Xác định Pb2+ 17 5.3.2
Xác định Ba2+ khi có mặt Mg2+ hoặc MgY2- 17 5.4
Xác định Ni2+ với hệ chỉ thị CuY2—PAN 18 Bài 6
Các kỹ thuật chuẩn độ complexon (tiếp) 19 6.1
Xác định hàm lƣợng PO 3- 4 19 6.1.1 Nguyên tắc 19 6.1.2 Quy trình phân tích 19 6.2
Xác định Hg2+, Zn2+ trong hỗn hợ p 20 6.2.1 Nguyên tắc 20 6.2.2 Quy trình phân tích 21 6.3
Xác định độ cứng toàn phần của nƣớc máy 21 Bài 7
Xác định hỗn hợp Al3+, Ca2+, Mg2+ (bài kiểm tra) 22 7.1 Nguyên tắc 22 7.2 Quy trình phân tích 22 7.3 Câu hỏi ôn tập 23 Chƣơng 3
Phƣơng pháp chuẩn độ kết tủa tạo phức 24 Bài 8
Xác định các halogenua, SCN- 24 8.1
Phƣơng pháp Mohr xác định Cl-, Br- 24 8.2
Phƣơng pháp Fajans xác định Cl-, Br-, I-, SCN- 24 8.3
Phƣơng pháp Volhard xác định Cl-, Br-, I-, SCN- 25 8.4
Xác định Cl- bằng Hg(NO3)2 26 8.5 Câu hỏi ôn tập 26 Chƣơng 4
Các phƣơng pháp oxi hoá - khử 27 Bài 9 Phƣơng pháp pemanganat 27 9.1
Xác định nồng độ dung dịch pemanganat 27 9.2
Xác định nồng độ H2O2 công nghiệp 27 9.3 Xác định nồng độ NO - 2 28 9.4
Xác định nồng độ Fe2+, Fe3+ trong hỗn hợp 28 9.5
Xác định hàm lƣợng Ca2+ 29 Bài 10 Phƣơng pháp dicromat 30 10.1 Pha dung dịch K2Cr2O7 30 10.2
Xác định nồng độ Na2S2O3 30 10.3
Xác định Pb2+ bằng phƣơng pháp diromat 31 10.3.1 Nguyên tắc 31 10.3.2 Quy trình phân tích 31 10.4
Xác định hàm lƣợng crom trong mẫu nƣớc thải 32 10.4.1 Nguyên tắc 32 10.4.2 Quy trình phân tích 32 Bài 11
Phƣơng pháp chuẩn độ iot-thiosunfat 33 11.1
Đặc điểm của phƣơng pháp 33 11.2 Pha dung dịch chuẩn 34 11.2.1 Pha dung dịch Na2S2O3 34 2 http://www.ebook.edu.vn 11.2.2 Pha dung dịch I2 34 11.3
Xác định nồng độ dung dịch Cu2+ 35 11.4
Xác định nồng độ dung dịch natrisunfit 35 11.5
Xác định nồng độ dung dịch natriasenit 36 11.6
Xác định hàm lƣợng clo hoạt động trong nƣớc javen 37 Bài 12
Phƣơng pháp chuẩn độ bromat, iođat 38 12.1
Nguyên tắc của phƣơng pháp 38 12.2
Xác định nồng độ dung dịch Sb3+ bằng phép đo bromat 38 12.3
Xác định hàm lƣợng Al3+ trong mẫu bằng phép đo bromat 39 12.4
Xác định nồng độ H+ bằng phép đo iođat 40 Chƣơng 5
Phƣơng pháp trọng lƣợng 41 Bài 13
Phƣơng pháp phân tích trọng lƣợng xác định Mg2+ 41 13.1 Kỹ thuật lọc 41 13.1.1 Giấy lọc không tàn 41 13.1.2
Cách gấp giấy lọc và kỹ thuật lọc 41 13.2
Xác định Mg theo phƣơng pháp trọng lƣợng 42 13.2.1 Nguyên tắc xác định 42 13.3 Quy trình phân tích 43 Bài 14
Phƣơng pháp phân tích trọng lƣợng xác định Fe 44 14.1 Nguyên tắc 44 14.2
Xác định hàm lƣợng Fe trong phèn sắt 44 Bài 15 Xác định SO 2-
4 bằng phƣơng pháp trọng lƣợng và complexon 45 15.1 Xác định SO 2-
4 bằng phƣơng pháp trọng lƣợng 45 15.1.1 Nguyên tắc xác định 45 15.1.2 Quy trình phân tích 45 15.2 Xác định SO 2-
4 bằng phƣơng pháp complexon 45 15.2.1 Nguyên tắc xác định 45 15.2.2 Quy trình phân tích 46 15.3 Câu hỏi ôn tập 46 Phần 2 Phân tích mẫu thực tế 47 Chƣơng 6 Phân tích hợp kim 47 Bài 16
Xác định hàm lƣợng Mn trong gang 47 16.1 Nguyên tắc xác định 47 16.2 Quy trình phân tích 48 16.3 Tính toán kết quả 48 16.4 Hoá chất 48 Bài 17
Phân tích Al, Cu, Zn trong hợp kim Devada 49 17.1 Nguyên tắc xác định 49 17.2 Quy trình phân tích 49 Bài 18
Xác định Fe, Cr, Ni trong hợp kim inox 50 18.1 Nguyên tắc xác định 50 18.2 Quy trình phân tích 50 18.3 Tính toán kết quả 52 3 http://www.ebook.edu.vn 18.4 Hoá chất 52 Bài 19
Xác định Cu, Sn, Pb, Zn trong đồng thau 53 19.1 Nguyên tắc xác định 53 19.2 Quy trình phân tích 53 19.2.1 Xác định Sn 53 19.2.2
Xác định Cu, Pb, Sn trong dung dịch nƣớc lọc 54 19.3 Tính toán kết quả 54 19.4 Hoá chất 54 Bài 20
Xác định hàm lƣợng Cu, Fe, Al, Zn trong hợp kim nhôm 55 20.1 Nguyên tắc xác định 55 20.2 Quy trình phân tích 55 20.3 Tính toán kết quả 56 20.4 Hoá chất 56 Chƣơng 7
Phân tích các sản phẩm công nghiệp 57 Bài 21
Xác định hàm lƣợng Al2O3, Fe2O3, CaO, MgO trong xi măng pooclăng 57 21.1 Chuẩn bị mẫu 57 21.2 Phân huỷ mẫu 57 21.3 Nguyên tắc xác định 57 21.4
Quy trình phân tích (theo TCVN 139 1991) 58 21.4.1
Xác định hàm lƣợng Fe2O3 58 21.4.2
Xác định hàm lƣợng Al2O3 58 21.4.3
Xác định hàm lƣợng CaO 58 21.5 Tính toán kết quả 59 21.6 Hoá chất 59 Bài 22
Xác định hàm lƣợng P2O5 trong phân bón NPK 60 22.1
Nguyên tắc xác định photpho (quy về P2O5) 60 22.2 Quy trình phân tích 61 22.3 Tính toán kết quả 61 22.4 Hoá chất 61 Bài 23
Xác định Mn trong quặng piroluzit 62 23.1 Nguyên tắc xác định 62 23.2 Quy trình phân tích 62 23.3 Tính toán kết quả 62 23.4 Hoá chất 62 Chƣơng 8 Phân tích môi trƣờng 63 Bài 25
Xác định một số chỉ tiêu hoá học của nƣớc và nƣớc thải 63 25.1
Xác định hàm lƣợng oxi hoà tan (DO) trong nƣớc 63 25.1.1 Nguyên tắc xác định 63 25.1.2 Quy trình phân tích 64 25.2
Xác định nhu cầu oxi hoá học trong nƣớc (COD) 64 25.2.1 Nguyên tắc 64 25.2.2 Lấy mẫu và bảo quản 65 4 http://www.ebook.edu.vn 25.2.3 Quy trình phân tích 65 25.3 Tính toán kết quả 65 25.4 Hoá chất 65 Bài 24
Phân tích một số chỉ tiêu hoá học của nƣớc bề mặt 66 24.1
Xác định hàm lƣợng SO 2- 4 66 24.2
Xác định hàm lƣợng H2S 66 24.3
Xác định hàm lƣợng Cl- (phƣơng pháp Mohr) 66 24.4 Xác định độ axit 67 24.5 Xác định độ kiềm 67 24.6 Xác định độ cứng 67 24.7
Xác định hàm lƣợng Ca2+ 69 24.8 Tính toán kết quả 69 24.9 Hoá chất 69 Chƣơng 9 Phân tích thực phẩm 70 Bài 26
Phân tích một số chỉ tiêu của nƣớc mắm 70 26.1 Chuẩn bị mẫu 70 26.2
Quy trình phân tích (theo TCVN-1520-74) 70 26.2.1
Xác định độ axit trong nƣớc mắm (tính theo CH3COOH) 70 26.2.2
Xác định hàm lƣợng muối NaCl 70 26.2.3
Xác định hàm lƣợng N-foocmon trong nƣớc mắm 71 26.2.4
Xác định N toàn phần của nƣớc mắm 71 26.3 Tính toán kết quả 72 26.4 Hoá chất và dụng cụ 72 Bài 27
Phân tích hàm lƣợng các loại đƣờng trong sữa đặc có đƣờng 74 27.1
Nguyên tắc phƣơng pháp phân tích 74 27.2 Chuẩn bị mẫu 74 27.3 Quy trình phân tích 75 27.3.1
Định lƣợng đƣờng lactoza 75 27.3.2
Định lƣợng đƣờng sacaroza 75 27.4 Tính toán kết quả 75 26.5 Hoá chất 75 Bài 28
Phân tích một số chỉ tiêu hoá học của chất béo 76 28.1 Xác định chỉ số axit 76 28.1.1 Nguyên tắc 76 28.1.2 Cách tiến hành 76 28.2
Xác định chỉ số xà phòng 76 28.2.1 Nguyên tắc 76 28.2.2 Cách tiến hành 76 28.3 Xác định chỉ số este 77 28.4 Xác định chỉ số iot 77 28.5
Xác định chỉ số peoxit 77 28.5.1 Nguyên tắc 78 28.5.2 Quy trình phân tích 78 5 http://www.ebook.edu.vn 28.6 Tính toán kết qu ả 78 28.7 Hoá chất 78 Bài 29
Xác định một số chỉ tiêu hoá học của rƣợu uống 79 29.1
Xác định độ axit toàn phần 79 29.2
Xác định hàm lƣợng axít xianhidric 79 29.2.1 Nguyên tắc 79 29.2.2 Cách tiến hành 80 29.3
Xác định hàm lƣợng andehit 80 29.3.1 Nguyên tắc 80 29.3.2 Cách tiến hành 80 29.4
Xác định hàm lƣợng este 81 29.4.1 Nguyên tắc xác định 81 29.4.2 Cách tiến hành 81 29.5 Tính toán kết quả 81 29.6 Hoá chất 81 Bài 30
Xác định hàm lƣợng foocmandehit, phenol trong nƣớcuống
Xác định hàm lƣợng KIO3 trong muối iot 82 30.1
Xác định hàm lƣợng anđehitfoocmic 82 30.1.1 Nguyên tắc xác định 82 30.1.2 Cách tiến hành 82 30.2 Định lƣợng phenol 82 30.2.1 Nguyên tắc 82 30.2.2 Cách tiến hành 83 30.3
Định lƣợng KIO3 trong muối iot (theo TCVN 1998) 83 30.3.1 Nguyên tắc 83 30.3.2 Cách tiến hành 83 30.4 Tính toán kết quả 83 30.5 Hoá chất 83 Chƣơng 10 Các phụ lục 84 Phụ lục 1 Đo trọng lƣợng 84 P1.1 Các loại cân 84 P1.2
Quy tắc sử dụng cân phân tích 86 Phụ lục 2 Đo thể tích 87 P2.1
Các dụng cụ đo thể tích thông thƣờng 87 P2.2
Làm sạch dụng cụ thuỷ tinh 87 P2.3
Hiệu chỉnh dụng cụ đo thể tích 88 P2.4 Xác định dung tích pipet 89 Phụ lục 3
Các thiết bị sử dụng trong phân tích trọng lƣợng 90 P3.1 Tủ sấy 90 P3.2 Lò nung 90 P3.3 Chén nung 92 Phụ lục 4
Nguyên tử khối của một số nguyên tố thƣờng gặp 94 Phụ lục 5
Các hằng số phân ly axit ở 25oC 94 6 http://www.ebook.edu.vn Phụ lục 6
Một số chỉ thị axit-bazơ quan trọng 95 Phụ lục 7
Một số chỉ thị sử dụng trong chuẩn độ complexon 96 Phụ lục 8
Một số chỉ thị oxi hoá khử 96 Phụ lục 9
Các giá trị Y(H) đ ể phức complexonat kim loại tạo thành hoàn toàn 96 Phụ lục 10
Hằng số bền của các complexonat kim loại 97 Phụ lục 11
Hằng số tạo thành của một số phức ở 25oC 97 Phụ lục 12
Tích số tan của một số hợp chất khó tan ở 25o C 100 Phụ lục 13
Một số thế điện cực tiêu chuẩn 101 Phụ lục 14
Nồng độ của một số axit-bazơ đặc bán trên thị trƣờng 104 7 http://www.ebook.edu.vn LỜI NÓI ĐẦU
Phân tích định lƣợng đƣợc dùng để xác định quan hệ định lƣợng giữa các thành
phần của chất nghiên cứu, trong đó chất phân tích đóng vai trò là trung tâm.
Tuỳ thuộc vào yêu cầu và đặc trƣng kỹ thuật sử dụng để xác định thành phần của
chất phân tích, các phƣơng pháp phân tích định lƣợng đƣợc chia thành 3 nhóm: các
phƣơng pháp phân tích hóa học, vật lý và hoá lý còn gọi là phƣơng pháp phân tích công cụ.
Các phƣơng pháp phân tích hoá học gồm phƣơng pháp phân tích trọng lƣợng và
phân tích thể tích (gồm phƣơng pháp chuẩn độ thể tích, phƣơng pháp thể tích khí, phƣơng
pháp thể tích lắng đọng).
Các phƣơng pháp chuẩn độ thể tích dựa trên 4 loại phản ứng cơ bản gồm phản ứng
axit- bazơ, phản ứng tạo phức, phản ứng kết tủa và phản ứng oxi hoá khử.
Các phƣơng pháp phân tích công cụ xác định các chất phân tích dựa vào các tính
chất hoá lý của chúng, thí dụ tính chất dẫn điện, tính chất hấp thụ quang.v.v, liên quan
trực tiếp tới nồng độ các chất phân tích. Điểm khác biệt cơ bản giữa phƣơng pháp phân
tích hoá học và phƣơng pháp phân tích công cụ ở chỗ để xác định chất, phƣơng pháp phân
tích hoá học dựa vào các phản ứng hoá học có thƣớc đo là khối lƣợng chất, thể tích dung
dịch, còn các phƣơng pháp phân tích công cụ có thƣớc đo là tín hiệu đƣợc ghi lại dƣới
dạng một vạch phổ, một xung điện v.v.
Trang bị của một phòng thí nghiệm phân tích hoá học bao gồm các dụng cụ thuỷ
tinh, nhƣ buret, pipet, ống đong, bình định mức .v.v, để phân tích trọng lƣợng cần có các
thiết bị nung, sấy, cân, các dụng cụ kèm theo để kết tủa chất, lọc rửa kết tủa v.v.
Trang bị của một phòng thí nghiệm phân tích công cụ gồm các thiết bị hiện đại hơn,
đắt tiền hơn, đƣợc chia làm 3 nhóm:
+ Nhóm các thiết bị phân tích quang học bao gồm: các máy đo phổ hấp thụ phân tử
UV- VIS, máy đo phổ hấp thụ nguyên tử và máy đo phổ phát xạ nguyên tử.
+ Nhóm các thiết bị phân tích điện hoá gồm: các máy đo thế và đo dòng điện liên
quan tới nồng độ của chất phân tích trong dung dịch, đó là các máy cực phổ với hệ điện
cực khác nhau, các máy đo thế v.v.
+ Nhóm các thiết bị tách, bao gồm tách sắc ký và tách chiết. Tách là một kỹ thuật
phân chia riêng biệt các chất từ một hỗn hợp. Kết hợp với phần nhận biết bằng quang học
hoặc điện hoá, có thể định lƣợng chất phân tích ở giới hạn phát hiện thấp cỡ phần triệu
(ppm), phần tỷ (ppb), đôi khi tới phần nghìn tỷ (ppt). 8 http://www.ebook.edu.vn
Một phòng thí nghiệm phân tích tuỳ theo nhiệm vụ mà trang bị các thiết bị cho phù
hợp, tuy nhiên phải đảm bảo tính phổ thông, trang bị các thiết bị thông thƣờng để chuẩn
bị mẫu và phân tích các chất đa lƣợng, vừa đảm bảo tính hiện đại, có các thiết bị tiên tiến
để phân tích đƣợc các chất có hàm lƣợng thấp, vết và siêu vết. Sự kết hợp cả phần phân
tích hoá học và phân tích công cụ là không thể thiếu.
Trong xu thế của hội nhập khu vực và toàn cầu, chúng ta ngày càng phải nâng cao
chất lƣợng của mọi loại hình sản phẩm trong đó không ít các sản phẩm có đóng góp của
chuyên ngành Hoá học Phân tích. Đó là phân tích nguyên liệu và sản phẩm của quá trình
sản xuất trong nông nghiệp cũng nhƣ trong nông nghiệp, phân tích các mẫu trong nghiên
cứu khoa học, phân tích lâm sàng, phân tích các mẫu phục vụ cho qúa trình điều tra phá
án, v.v. Một khối lƣợng khổng lồ các mẫu phân tích nhƣ vậy không ít mẫu liên quan trực
tiếp tới sự thành bại của một doanh nghiệp, sức khoẻ, và đặc biệt là sinh mạng chính trị
của con ngƣời. Điều đó nói lên nhu cầu thực tế đòi hỏi tính chính xác và tính đúng đắn
của các kết quả phân tích.
Để giúp sinh viên có những kiến thức cơ bản về thực hành Hoá phân tích, đáp ứng
cho công việc khi ra trƣờng, chúng tôi đã biên soạn lại cuốn "Thực tập phân tích định
lƣợng, phần 1 các phƣơng pháp phân tích hoá học" nhằm trang bị cho sinh viên những
kiến thức và những kỹ năng cơ bản về phân tích định lƣợng.
Cuốn sách gồm hai phần: Phần 1 là các bài thực hành phân tích định lƣợng cơ bản.
Trƣớc hết, các kỹ thuật làm việc với các dụng cụ dùng trong phân tích định lƣợng nhƣ cân
phân tích, dụng cụ thuỷ tinh v.v., sao cho đáp ứng đƣợc các nhu cầu độ chính xác của
phƣơng pháp. Bốn phản ứng cơ bản là axít-bazơ, tạo phức, kết tủa và oxi hoá khử đã đƣợc
cụ thể hoá thành các bài xác định nồng độ các chất. Sau mỗi phần có các bài kiểm tra
đánh giá kỹ năng thực hành của sinh viên bằng các mẫu của phòng thí nghiệm.
Phần 2 là các bài phân tích các mẫu thực tế, bao gồm các quy trình đã đƣợc kiểm
nghiệm đƣợc áp dụng phân tích các mẫu thực nhƣ mẫu thực phẩm, mẫu nƣớc, hợp kim,
phân bón v.v. Trong phần này, sinh viên đƣợc trang bị các kiến thức liên quan đến mẫu
thực tế, các tình huống phải xử lý để thu đƣợc kết quả phân tích chính xác.
Để có đƣợc cuốn sách này, chúng tôi đã đƣợc sự góp ý rất quý báu của các Thầy,
Cô của bộ môn Hoá phân tích, khoa Hoá học, Trƣờng Đại học Khoa học Tự nhiên cũng
nhƣ của nhiều đồng nghiệp khác. Nhân dịp này, chúng tôi xin chân thành cảm ơn các
Thầy, Cô và các bạn đồng nghiệp. Do thời gian có hạn, cuốn sách không khỏi có những
thiếu sót, rất mong đƣợc sự góp ý của độc giả để cuốn sách ngày càng hoàn thiện hơn. 9 http://www.ebook.edu.vn Các tác giả PHẦN 1
PHÂN TÍCH ĐỊNH LƢỢNG HOÁ HỌC CƠ BẢN CHƢƠNG 1
PHƢƠNG PHÁP CHUẨN ĐỘ AXÍT - BAZƠ
BÀI 1: CHUẨN ĐỘ ĐƠN AXÍT, ĐƠN BAZƠ
1.1 HIỆU CHỈNH THỂ TÍCH BURET
1.1.1 Thực hành cân nước cất
(Các loại cân phân tích và cách sử dụng đã trình bày ở phụ lục 1 trang 87-88)
Nguyên tắc: Thành trong của buret thƣờng không thẳng đều, nhƣng khi sản xuất ngƣời ta
thƣờng đánh dấu thể tích theo khoảng cách, điêù đó dẫn tới sai lệch thể tích của từng đoạn
cũng nhƣ của cả buret. Cân nƣớc cất để tìm ra thể tích thực của từng đoạn sau đó biểu
diễn sự sai lệch vào đồ thị và điều chỉnh trong quá trình phân tích sau này.
Tiến hành: Rửa sạch buret, tráng nƣớc cất hai lần, không cần sấy khô, lấy nƣớc cất vào
buret đến vạch ―0‖. Một cốc cân có nắp đạy đặt ở dƣới buret, cân thể tích của từng đoạn,
mỗi đoạn 5ml, cho tới hết thể tích buret (50ml hoặc 25 ml), sau đó lập bảng số liệu theo
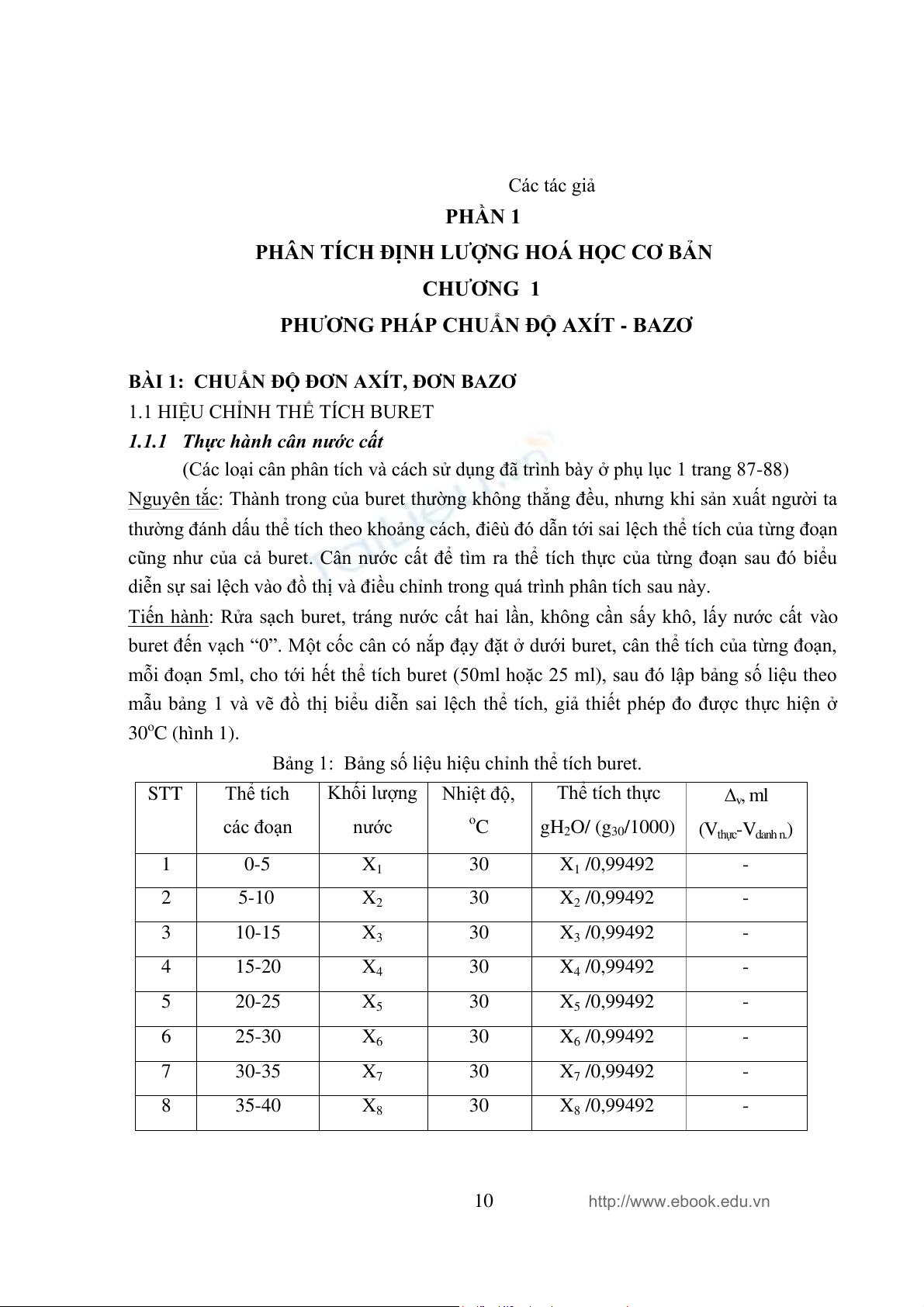
mẫu bảng 1 và vẽ đồ thị biểu diễn sai lệch thể tích, giả thiết phép đo đƣợc thực hiện ở 30oC (hình 1).
Bảng 1: Bảng số liệu hiệu chỉnh thể tích buret. STT Thể tích
Khối lƣợng Nhiệt độ, Thể tích thực v, ml các đoạn nƣớc oC
gH2O/ (g30/1000) (Vthực-Vdanh n.) 1 0-5 X1 30 X1 /0,99492 - 2 5-10 X2 30 X2 /0,99492 - 3 10-15 X3 30 X3 /0,99492 - 4 15-20 X4 30 X4 /0,99492 - 5 20-25 X5 30 X5 /0,99492 - 6 25-30 X6 30 X6 /0,99492 - 7 30-35 X7 30 X7 /0,99492 - 8 35-40 X8 30 X8 /0,99492 - 10 http://www.ebook.edu.vn 9 40-45 X9 30 X9 /0,99492 - 10 45-50 X10 30 X10 /0,99492 -
1.1.2 Vẽ đường cong hiệu chỉnh thể tích buret v, ml + 0,05 V,ml 0 10 20 30 40 50 - 0,05
Hình 1: Đƣờng cong hiệu chỉnh thể tích buret
1.2 PHA CHẾ DUNG DỊCH CHUẨN AXIT OXALIC ĐỂ XÁC ĐỊNH BAZƠ
Nguyên tắc: Ngƣời ta cân một lƣợng xác định chất gốc trên cân phân tích có độ chính
xác 0,0001 hoặc 0,00001 g, hoà tan định lƣợng lƣợng cân trong bình định mức có dung
tích thích hợp rồi pha loãng bằng nƣớc tới vạch.
Tiến hành : Cân, pha dung dịch chuẩn H2C2O4 0,025 M (M=126,066)
Cân chính xác 0,7879 gam H2C2O4.2H2O có độ tinh khiết phân tích trong cốc cân,
chuyển axít qua phễu vào bình định mức 250ml (hình 2). Tráng cốc cân 3 lần bằng nƣớc
cất vào bình định mức. Thêm khoảng 150ml nƣớc cất nữa và lắc kĩ cho tan hết sau đó
thêm nƣớc cất đến vạch mức, lắc kĩ để trộn đều, ta có dung dịch chuẩn axit oxalic 0,025M.
Hình 2 Pha dung dịch axít oxalic
1.3 XÁC ĐỊNH NỒNG ĐỘ CÁC DUNG DỊCH ĐƠN AXIT, ĐƠN BAZƠ 11 http://www.ebook.edu.vn
1.3.1 Thiết lập nồng độ dung dịch NaOH theo dung dịch gốc H2C2O4
Nguyên tắc: phƣơng pháp có cơ sở là phản ứng trung hoà
H2C2O4 + 2NaOH Na2C2O4 + 2 H2O
Axit oxalic có pK1=1,25; pK2 = 4,27. Do bƣớc nhảy thứ nhất ngắn, phải chuẩn độ
đến muối trung hoà. Tại điểm tƣơng đƣơng thứ hai, dung dịch chỉ có muối bazơ Na2C2O4,
có pH 9, làm đổi màu chỉ thị phenolphtalein, nên phép chuẩn độ kết thúc khi xuất hiện
màu hồng bền trong 30 giây của chất chỉ thị.
Tiến hành: Dùng pipet lấy chính xác Vml (10ml) dung dịch axit oxalic chuẩn vào bình
nón cỡ 250ml. Thêm 2-3 giọt dung dịch chất chỉ thị phenolphtalein 0,1% trong cồn, lắc
đều. Từ buret, vừa nhỏ từ từ dung dịch NaOH cần xác định nồng độ vào bình nón, vừa lắc
đều đến khi dung dịch xuất hiện màu hồng thì ngừng chuẩn độ. Ghi số ml NaOH đã
chuẩn độ - V0 ml. Làm 3 lần và lấy kết quả trung bình.
Nồng độ mol/l dung dịch NaOH đƣợc tính theo công thức . 2 (C .V ) C oxalic oxalic NaOH V 0
1.3.2 Xác định nồng độ dung dịch HCl
Nguyên tắc: Cơ sở của phƣơng pháp dựa vào phản ứng trung hoà: HCl + NaOH = NaCl + H2O
Tại điểm tƣơng đƣơng, dung dịch muối NaCl là muối trung tính, pH=7, hơn nữa
đƣờng cong chuẩn độ có bƣớc nhảy pH lớn (4-10), có thể dùng các chất chỉ thị là
phenolphtalein hoặc metyl da cam, metyl đỏ v.v.
Tiến hành: Lấy chính xác Vml (10ml) dung dịch HCl cần xác định nồng độ vào bình
nón cỡ 250ml, thêm 2-3 giọt dung dịch chất chỉ thị. Từ buret, nhỏ dung dịch NaOH đã
biết nồng độ vào và lắc đều bình nón cho tới khi dung dịch có màu hồng bền trong
khoảng 30 giây thì dừng chuẩn độ. Ghi số ml dung dịch NaOH đã chuẩn độ - V0ml. Làm
3 lần rồi lấy kết quả trung bình và tiến hành thí nghiệm với hai chất chỉ thị và so sánh kết
quả, giải thích (khi dùng chất chỉ thị metyl da cam thì màu của dung dịch chuyển từ đỏ
sang vàng). Nồng độ mol/l của HCl đƣợc xác định nhƣ sau: C V . NaOH C 0 HCl V HCl 12 http://www.ebook.edu.vn
1.3.3 Xác định nồng độ dung dịch CH3COOH
Nguyên tắc: Cơ sở của phƣơng pháp dựa vào phản ứng trung hoà:
CH3COOH + NaOH CH3COONa + H2O
Tƣơng tự nhƣ phép chuẩn độ axit oxalic, tại điểm tƣơng đƣơng chỉ có muối
NaCH3COO, có pH 9 nên sử dụng chất chỉ thị phenolphtalein
Tiến hành: Lấy chính xác Vml (10ml) dung dịch axit axetic vào bình nón cỡ 250ml thêm
2-3 giọt chất chỉ thị phenolphtalein. Từ buret, nhỏ dung dịch NaOH đã biết nồng độ vào,
lắc đều cho tới khi dung dịch có màu hồng bền trong khoảng 30 giây thì dừng lại. Ghi số
ml NaOH đã chuẩn độ - V0ml. Làm 3 lần rồi lấy kết quả trung bình. C V . NaOH C 0 HAc V HAc
Tiến hành tƣơng tự với chất chỉ thị metyl da cam, so sánh các kết quả và giải thích.
1.3.4 Xác định nồng độ dung dịch NH3
Nguyên tắc: Cơ sở của phƣơng pháp dựa vào phản ứng trung hoà: NH3 + HCl NH4Cl + H2O
Tại điểm tƣơng đƣơng, muối NH4Cl, có pH 5 nên sử dụng chất chỉ thị metyl đỏ.
Tiến hành: Dùng pipet lấy chính xác Vml (10ml) dung dịch NH3 cần xác định nồng độ
vào bình nón cỡ 250ml. Thêm 2-3 giọt dung dịch chất chỉ thị metyl đỏ rồi tiến hành chuẩn
độ bằng dung dịch HCl đã biết nồng độ. Khi dung dịch chuyển từ màu vàng sang màu đỏ
thì dừng chuẩn độ. Ghi số ml HCl đã chuẩn độ - V0ml. Làm 3 lần và lấy kết quả trung
bình. Nồng độ mol/l của NH3 đƣợc tính nhƣ sau: C V HCl. 0 C N 3 H V NH3
Tiến hành tƣơng tự với chất chỉ thị phenolphtalein, so sánh các kết quả và giải thích.
1.3.5. Xác định hàm lượng muối amoni theo phương pháp focmalin
Nguyên tắc: Muối amoni tác dụng với HCHO trong nƣớc ( HCHO.H2O) tạo ra lƣợng axit
tƣơng ứng đƣợc xác định bằng NaOH. 4 NH + +
4 + 6 CH2O (CH2)6N4 + 4 H + 6 H2O 13 http://www.ebook.edu.vn
Tiến hành: Dùng ống đong lấy 5 ml dung dịch focmalin vào bình nón 250 ml, pha loãng
bằng nƣớc cất đến 20 ml, thêm 2-3 giọt chỉ thị phenolphtalein và trung hoà lƣợng
HCOOH có trong focmalin bằng dung dịch chuẩn NaOH đến màu hồng.
Cân trên cân phân tích a g NH4Cl (khoảng 0,2-0,3 g), đổ vào dung dịch focmalin đã trung
hoà ở trên. Lắc cẩn thận hỗn hợp, để yên 3-5 phút và chuẩn độ lƣợng axit giải phóng ra
bằng dung dịch chuẩn NaOH. Ghi số ml NaOH tiêu tốn cho quá trình chuẩn độ. Hàm lƣợng N-NH +
4 trong muối NH4Cl đƣợc tính theo công thức: C .V .M NaOH NaOH X (%) NH4 1 . 00 N 4 H 100 . 0 a -----*-----
BÀI 2 CHUẨN ĐỘ ĐA AXIT 2.1. DUNG DỊCH CHUẨN
2.1.1. Pha chế dung dịch chuẩn từ fixanal
Nguyên tắc: Dùng những lƣợng chất chất rắn hay những thể tích chất lỏng tinh khiết
hoá học đã đƣợc cân, đo chính xác đựng trong ống fixanal (hình 3)để pha các dung dịch
có độ chuẩn xác định.
Fixanal là ống bằng thuỷ tinh có cấu tạo đặc biệt: có hai vị trí rất mỏng giúp ngƣời
phân tích có thể dễ dàng dùng đũa thuỷ tinh để chọc thủng, sau đó chuyển toàn bộ chất ở
trong fixanal vào bình định mức bằng tia nƣớc cất sau đó hoà tan và định mức. 2 1
Hình 3: Fixanal chứa chất chuẩn
(Các điểm 1, 2 trên hình vẽ là các điểm cần phải đƣợc chọc thủng bằng đũa thuỷ tinh
để chuyển vào bình định mức)
Trên mỗi ống Fixanal ngƣời sản xuất đã ghi rõ dung tích cần pha để thu đƣợc nồng độ
nhất định. Thí dụ: Fixanal đựng Na2B4O7.10H2O trên đó có ghi ―N/10‖ nhƣ vậy, ngƣời ta
đã cân 19,0685gam Na2B4O7.10H2O để pha thành 1lit dung dịch có nồng độ 0,1N hay 0,05M. 14 http://www.ebook.edu.vn
2.1.2 Thiết lập nồng độ dung dịch HCl theo natri tetraborat
Muối natri tetraborat kết tinh (Na2B4O7.10H2O) có khối lƣợng phân tử lớn
(M=381,37), có thể dùng làm chất gốc.
Trong dung dịch loãng, ion tetraborat phản ứng với H+ tạo thành axit boric: B 2- + 4O7 + 2H + 5 H2O 4 H3BO3
Axit boric là đa axit yếu, pK1=9,24 ; pK2=12,74 ; pK3 = 13,8 . Do K1 ≫ K2 , K3 có
thể xem nhƣ đơn axit yếu có pKA= pK1. Khi chuẩn độ dung dịch natri tetraborat bằng
dung dịch HCl, tại điểm tƣơng đƣơng, hình thành axit boric, do đó tính pH tại điểm tƣơng
đƣơng nhƣ một axít yếu:
pHtđ = 1/2 pK1 - 1/2 lg Ca = 4,62 + 0,5 = 5,12
Đối với pH này có thể dùng metyl đỏ để làm chất chỉ thị.
Tiến hành: Cân chính xác 2,3835g Na2B4O7.10H2O cho vào bình định mức 250 ml, thêm
khoảng 150 ml nƣớc cất nóng, lắc kỹ cho tan hết, để nguội đến nhiệt độ phòng thêm nƣớc
cất tới vạch mức, đảo kỹ, ta có dung dịch nồng độ 0,025M.
Lấy V1 ml (10 ml) dung dịch natritetraborat có nồng độ C1 vừa điều chế vào bình nón
250 ml, thêm vào mỗi bình 2-3 giọt dung dịch metyl đỏ (có khoảng đổi màu 4,4 - 6,2),
dung dịch có màu vàng. Từ buret nhỏ từng giọt dung dịch HCl cho tới khi dung dịch
chuyển từ màu vàng sang màu da cam, hết V ml HCl. Để phép chuẩn độ đƣợc chính xác
cần dùng dung dịch đối chứng là dung dịch 100 ml axit boric loãng cỡ 1 % trong đệm có
pH = 5,1-5,2 có thêm 2-3 ml NaCl 1 M và 2-3 giọt dung dịch chất chỉ thị metyl đỏ, dung
dịch có màu da cam. Tiến hành chuẩn độ ba lần, lấy kết quả trung bình. Nồng độ mol/l
HCl đƣợc xác định nhƣ sau: C 2 V C 1 1 HCl V
2.2 XÁC ĐỊNH NỒNG ĐỘ ĐA AXÍT VÀ MUỐI CỦA NÓ
2.2.1. Xác định nồng độ dung dịch H3PO4 bằng dung dịch chuẩn NaOH
Nguyên tắc: Cơ sở của phƣơng pháp dựa vào phản ứng trung hoà H3PO4 theo hai nấc:
Nấc 1 : H3PO4 + NaOH NaH2PO4 + H2O
H3PO4 có pK1 = 2,12 ; pK2 = 7,21, pK3 = 12,36 ;
Tại điểm tƣơng đƣơng 1 pH = 1/2pK1 + 1/2pK2 = 4,665, dùng metyl da cam có pT = 4
hoặc metyl đỏ có pT = 5 làm chất chỉ thị. 15 http://www.ebook.edu.vn
Nấc 2 : NaH2PO4 + NaOH Na2HPO4 + H2O;
Tại điểm tƣơng đƣơng 2, pH = 1/2pK2 + 1/2pK3 = 9,785, dùng phenolphtalein có
pT=9 làm chất chỉ thị là phù hợp.
Tiến hành: Dùng pipet lấy chính xác Vml (10ml) dung dịch H3PO4 cho vào bình nón cỡ
250ml. Thêm 2-3 giọt dung dịch chất chỉ thị metyl da cam, dung dịch có màu đỏ. Dùng
dung dịch chuẩn NaOH chuẩn độ tới khi dung dịch từ màu đỏ chuyển sang màu vàng thì
dừng lại. Ghi số ml NaOH đã chuẩn độ - V1ml. Thêm vào dung dịch chuẩn độ 2-3 giọt
chất chỉ thị phenolphtalein, tiếp tục chuẩn độ (nấc thứ hai của axit H3PO4) bằng NaOH
cho tới khi dung dịch có màu hồng bền trong 30 giây thì dừng lại, ghi số ml NaOH đã
chuẩn độ - V2ml. Làm 3 lần lấy kết quả trung bình. V1 C . 2. NaOH V C C NaOH H PO 3 4 V V
2.2.2. Xác định nồng độ HCl và H3PO4 trong cùng hỗn hợp
Nguyên tắc: Dùng dung dịch NaOH để chuẩn độ HCl và H3PO4 với hai chất chỉ thị là
metyl da cam và phenolphtalein. Khi metyl da cam đổi màu (pT=4), toàn bộ HCl đã đƣợc
chuẩn độ cùng với nấc 1 của axit H3PO4. Khi phenolphtalein đổi màu (pT=9), nấc thứ hai
của H3PO4 đƣợc chuẩn độ, số mol NaOH dùng cho nấc này chính là số mol H3PO4. Số
mol NaOH chênh lệch của hai lần chuẩn độ chính là số mol HCl.
Tiến hành: Lấy chính xác 10ml dung dịch hỗn hợp HCl và H3PO4 cần phân tích cho vào
bình nón cỡ 250ml; thêm 2-3 giọt dung dịch metyl da cam, lắc đều và chuẩn độ bằng
dung dịch NaOH có nồng độ C tới khi dung dịch chuyển sang màu vàng. Ghi số ml
NaOH đã chuẩn độ (V1). Thêm vào 3 giọt dung dịch phenolphtalein và tiếp tục chuẩn độ
tới khi dung dịch chuyển sang màu hồng. Ghi số ml NaOH đã chuẩn độ lần 2 (V2). Làm 3
lần rồi lấy kết quả trung bình. Nồng độ mol/l của axit photphoric đƣợc tính nhƣ sau: V C V V C 2. ( 1 2). C ; H PO C 3 4 10 HCl 10
2.2.3. Xác định nồng độ KH2PO4 và K2HPO4 trong cùng hỗn hợp
Nguyên tắc : Có 2 cách xác định hỗn hợp trên
- Cách 1: Chuẩn độ bằng KOH cho tới đổi màu chất chỉ thị phenolphtalein để xác
định KH2PO4, sau đó dùng HCl để chuẩn độ dung dịch vừa nhận đƣợc tới chuyển màu 16 http://www.ebook.edu.vn
metyldacam (lúc này cả hai muối đều phản ứng) số milimol HCl chính là tổng milimol
của hai loại. Hiệu số milimol của HCl và KOH là số milimol của K2HPO4.
- Cách 2: Chuẩn độ bằng HCl cho tới đổi màu chất chỉ thị metyl da cam để xác
định K2HPO4, sau đó dùng KOH chuẩn độ dung dịch vừa nhận đƣợc cho tới chuyển màu
phenolphtalein để xác định tổng số. Hiệu số milimol của KOH và HCl chính là số milimol của KH2PO4.
Tiến hành :(làm theo cách 1) Lấy vào bình nón 10 ml dung dịch mẫu phân tích, thêm 2
giọt dung dịch chất chỉ thị phenolphtalein. Dùng dung dịch NaOH có nồng độ C1 chuẩn
độ tới xuất hiện màu hồng, hết V1ml. Thêm vào dung dịch vừa chuẩn độ 3 giọt dung dịch
metyl da cam, dùng dung dịch HCl có nồng độ C2 chuẩn độ cho tới khi dung dịch xuất hiện màu đỏ, hết V2.
Tính kết quả: Nồng độ KH2PO4 và nồng độ K2HPO4 đƣợc tính theo công thức: 1 C . 1 V C V C V 2 . 2 1. C 1 C KH2PO4 10 K2HPO4 10 -----*-----
BÀI 3 CHUẨN ĐỘ ĐA BAZƠ 3.1. CÁC DUNG DỊCH CHUẨN
3.1.1. Thiết lập nồng độ dung dịch HCl theo Na2CO3
Natri cacbonat khan có M=105,99, là muối trung hoà của axit cacbonic (H2CO3).
Muối Na2CO3 tinh khiết, khan cũng đƣợc dùng làm chất gốc đƣợc chuẩn bị bằng cách
nung Na2CO3 loại tinh khiết phân tích tới khối lƣợng không đổi ở 270oC trong tủ sấy 1 giờ.
Phản ứng giữa HCl và Na2CO3 0,1M có hai nấc nhƣ sau: Na2CO3 + HCl NaHCO3 + H2O NaHCO3 + HCl H2CO3 + NaCl Axit cacbonic có K -7 -11 1 = 4,3.10 ; K2 = 5,61.10
hay pK1 và pK2 của nó tƣơng ứng là
6,35 và 10,32. Tại điểm tƣơng đƣơng thứ nhất ta có: 17 http://www.ebook.edu.vn pK1 + pK pH 2 6,37 + 10,25 = = = 8,21 1 2 2
Với pH này, ta dùng phenolphtalein làm chất chỉ thị.
Tại điểm tƣơng đƣơng thứ hai, hình thành H2CO3 là đa axit yếu, tuy nhiên K1>>K2
nên xem nhƣ một đơn axit yếu, Ca= 0,1M (bỏ qua pha loãng), pH đƣợc tính nhƣ sau: 1 1 pH pK log Ca 1 , 3 85 5 , 0 , 3 685 2 2 1 2
Nhƣ vậy sử dụng chất chỉ thị metyl da cam làm chất chỉ thị là phù hợp.
Tiến hành : Cân chính xác trên cân phân tích a gam Na2CO3 khan, p.a (khoảng 0,10g),
cho vào bình nón 250ml, thêm nƣớc cất, lắc đều đến tan hết. Thêm 2 giọt dung dịch
phenolphtalein, chuẩn độ bằng HCl cho đến khi dung dịch mất màu hồng, hết V1ml.
Thêm tiếp vài giọt dung dịch metyl da cam (hoặc bromocresol xanh) và chuẩn độ tiếp
bằng HCl cho tới khi dung dịch có màu da cam (hoặc màu xanh lá cây), đun sôi để đuổi
H2CO3, để nguội, lúc này dung dịch có pH=8,3. Tiếp tục chuẩn độ tới khi dung dịch
chuyển sang màu da cam hoặc màu xanh lá cây, hết tổng cộng V2ml.
Nồng độ mol/l HCl đƣợc tính nhƣ sau: 2.a 100 . 0 C HCl 2 V 1 . 05 99 ,
3.1.2 Thiết lập nồng độ NaOH theo HCl đã chuẩn
(Xác lập nồng độ NaOH theo HCl đƣợc tiến hành giống mục 1.4.2 trong bài 1 )
3.2. XÁC ĐỊNH ĐA BAZƠ BẰNG AXÍT MẠNH
3.2.1. Xác định nồng độ Na2CO3 và NaHCO3 trong hỗn hợp
Việc xác định Na2CO3 và NaHCO3 trong hỗn hợp đƣợc thực hiện theo 2 cách:
Cách 1: Chuẩn độ hỗn hợp bằng HCl với chất chỉ thị phenolphtalein. Khi đó 1 nấc
Na2CO3 bị trung hoà thành NaHCO3. sau đó tiếp tục chuẩn độ tổng NaHCO3 bằng dung
dịch chuẩn HCl với chất chỉ thị metyl da cam.
Kết hợp 2 giai đoạn chuẩn độ sẽ tính đƣợc hàm lƣợng Na2CO3 và NaHCO3
(sinh viên tự thiết lập qui trình thí nghiệm và công thức tính hàm lƣợng từng chất) 18 http://www.ebook.edu.vn
Cách 2: Chuẩn độ hỗn hợp Na2CO3 và NaHCO3 bằng HCl khi có chất chỉ thị metyl da
cam. Sau đó thêm một lƣợng dƣ chính xác dung dịch kiềm vào mẫu khác có dung dịch
hỗn hợp 2 muối để chuyển chúng thành muối cacbonat và thêm tiếp lƣợng dƣ BaCl2 để
tạo kết tủa BaCO3. Không cần lọc kết tủa, chuẩn độ lƣợng kiềm dƣ khi có mặt chất chỉ thị phenolphtalein: HCO - - 2- 2-
3 + OH CO3 + H2O ; Ba2+ + CO3 BaCO3
Cách này cho kết quả tốt hơn khi hỗn hợp cần phân tích chứa NaHCO3 ít hơn Na2CO3.
Tiến hành (theo cách 2): Hút 10 ml hỗn hợp cần chuẩn độ, thêm 2-3 giọt dung dịch chất
chỉ thị metyl da cam và chuẩn độ đến khi dung dịch có màu da cam, hết V1 ml.
Lấy 10 ml dung dịch mẫu phân tích mới, thêm vào đó 25 ml dung dịch chuẩn NaOH,
10 ml dung dịch BaCl2 1M và 2-3 giọt dung dịch phenolphtalein. Chuẩn độ lƣợng kiềm
dƣ đến mất màu phenolphtalein, hết V2 ml.
Hàm lƣợng Na2CO3 và NaHCO3 đƣợc tính theo công thức sau: 2 .
5 CNaOH V2.CHCl C NaHC 3 O 10 V C C V C 1. HCl ( . 25 NaOH 2 . HCl ) C Na 2C 3 O 10 .2
3.2.2. Xác định hàm lượng Na2CO3 trong NaOH công nghiệp
Nguyên tắc: Phản ứng giữa Na2CO3 với HCl có 2 nấc. Tại điểm tƣơng đƣơng thứ nhất,
dung dịch sẽ có pH khoảng 8,21 (xem mục 3.1.1 bài 3) nên dùng chất chỉ thị
phenolphtalein là phù hợp. Mặt khác khi chuẩn độ bazơ mạnh bằng axit mạnh, đƣờng
cong chuẩn độ có bƣớc nhảy ở pH 4-10, khi kết thúc với chất chỉ thị phenolphtalein, toàn
bộ NaOH cũng phản ứng hết với HCl, các phản ứng nhƣ sau:
NaOH + HCl NaCl + H2O ; Na2CO3 + HCl NaHCO3 + H2O
Nhƣ vậy số milimol HCl cũng chính là số milimol tổng của NaOH và Na2CO3 khi
phenolphtalein mất màu hồng. Chuẩn độ tiếp bằng HCl tới tƣơng đƣơng 2 sẽ phản ứng: NaHCO3 + HCl NaCl + H2CO3
Tại điểm tƣơng đƣơng 2, dung dịch H2CO3 có pH 4, làm đổi màu metyl da cam từ
vàng sang đỏ, số milimol HCl phản ứng ở đây là số milimol Na2CO3. Hiệu số của số
milimol HCl tổng số và số milimol HCl của phản ứng sau là số milimol của NaOH. 19 http://www.ebook.edu.vn




