





















Preview text:
BÀI 1
CHỨNG MINH MỘT SỐ CƠ CHẾ GÂY PHÙ
TRÊN ĐỘNG VẬT THỰC NGHIỆM Thí nghiệm 1.1
TRAO ĐỔI MUỐI NƯỚC QUA DA Ở ẾCH 1.1.1. MỤC TIÊU
1. Thực hiện được các thao tác thí nghiệm về trao đổi nước qua da ở ếch theo đúng quy trình.
2. Giải thích kết quả thí nghiệm. 1.1.2. NGUYÊN TẮC
Bình thường áp lực thẩm thấu giữa khoảng gian bào và tế bào là bằng nhau.
Nếu xảy ra sự chênh lệch áp lực thẩm thấu thì nước sẽ được trao đổi để điều chỉnh
lại. Làm tăng áp lực thẩm thấu ở dịch gian bào của ếch sẽ dẫn đến những thay đổi về
trọng lượng, màu sắc và tính chất da của ếch. 1.1.3. PHƯƠNG TIỆN
* Động vật thí nghiệm
- Ếch khỏe mạnh, trọng lượng tương đương khoảng 150 – 300g. * Hóa chất
- Dung dịch NaCl 6,5‰ (dung dịch đẳng trương đối với ếch). - Dung dịch NaCl 20%. * Dụng cụ
- 3 bình thủy tinh (dung tích 5-10 lít) . - Cân để bàn. - Bơm tiêm loại 5ml. 1.1.4. TIẾN HÀNH
- Dán nhãn 3 bình thủy tinh (A, B, C): bình A, B chứa nước máy; bình C chứa
NaCl 20% (thể tích nước ở 3 bình là bằng nhau, khoảng 2/3 bình).
- Tiêm vào túi cùng bạch huyết Ếch A: 2 ml NaCl 6,5‰ Ếch B: 2ml NaCl 20%. Ếch C: Không tiêm.
- Lau khô từng con ếch cho vào túi cân, xác định trọng lượng của từng con.
- Ngâm ếch A và ếch B vào bình chứa nước máy, ngâm ếch C vào bình chứa NaCl 20%.
- Xác định lại trọng lượng ếch sau khi ngâm 15 phút và sau khi ngâm 30 phút. - Chỉ tiêu theo dõi: + Trọng lượng ếch.
+ Quan sát da: màu sắc, độ căng bóng, lớp nhầy trên da.
- So sánh ếch ở các bình trước và sau khi ngâm vào bình. 1
- Tiến hành thí nghiệm chứng minh tính chất sinh học của da ếch:
+ Lột da ở hai chân ếch và tạo thành hai cái túi: 1 cái túi theo đúng chiều trong
ngoài như trên ếch, 1 cái túi “lộn ngược” - theo chiều trong ngoài ngược với chân ếch.
+ Cho 10 – 20 ml NaCl 20% vào mỗi túi.
+ Ngâm túi vào bình chứa nước máy, sau khoảng 30 phút lấy ra. Đổ toàn bộ lượng
dịch trong mỗi túi vào ống facol. So sánh với lượng dịch cho vào ban đầu và nhận xét.
1.1.5. NHẬN ĐỊNH KẾT QUẢ
- Nhận xét sự thay đổi ở 3 ếch A, B và C. - Giải thích kết quả. 2 Thí nghiệm 1.2
THÍ NGHIỆM TẠO GARO CHÂN ẾCH 1.2.1. MỤC TIÊU
1. Thực hiện được các thao tác thí nghiệm tạo garo ở chân ếch theo đúng quy trình.
2. Mô tả được các hiện tượng xảy ra và giải thích các kết quả thí nghiệm. 1.2.2. NGUYÊN TẮC
Garo chân ếch làm tăng áp lực t ủ
h y tĩnh trong lòng mạch, nước bị đẩy từ lòng
mạch ra khoảng gian bào gây phù làm thay đổi kích thước, màu sắc, độ căng của da chân. 1.2.3. PHƯƠNG TIỆN
* Động vật thí nghiệm
- Ếch khỏe mạnh, trọng lượng khoảng 150 – 300g. * Dụng cụ - Chỉ khâu loại to. 1.2.4. TIẾN HÀNH
- Garo gốc đùi một chân sau ếch bằng chỉ khâu.
- Thả ếch trong bồn có ít nước (giống điều kiện tự nhiên).
- Sau 24h quan sát và so sánh hai chân sau ếch về: kích thước, màu sắc, độ căng của da ếch.
1.2.5. NHẬN ĐỊNH KẾT QUẢ
- Nhận xét và giải t hích các kết quả. 3 Thí nghiệm 1.3
THÍ NGHIỆM GÂY GIẢM PROTEIN HUYẾT TƯƠNG Ở THỎ 1.3.1. MỤC TIÊU
1. Trình bày được các bước tiến hành thí nghiệm gây giảm protein huyết tương ở thỏ theo đúng quy trình.
2. Phân tích được ý nghĩa các thao tác.
2.Giải thích được các kết quả thí nghiệm. 1.3.2. NGUYÊN TẮC
Loại bỏ protein huyết tương của thỏ để làm giảm áp lực keo, nước thoát ra
khoảng gian bào gây phù, tràn dịch các màng (màng tim, màng phổi, màng bụng, ...) 1.3.3. PHƯƠNG TIỆN
* Động vật thí nghiệm
- Thỏ trọng lượng ≥ 2kg. * Hóa chất - Natri citrat 7%, heparin. - Dung dịch NaCl 9‰. - Novocain. * Dụng cụ
- Canuyn (dụng cụ luồn động mạch thỏ). - Chỉ khâu loại to.
- Bộ dụng cụ mổ thỏ.
- Hệ thống bình chứa và dây truyền dịch.
- Facol loại 15 ml, ống nghiệm 1 - 0 20ml. - Pipet. - Máy li tâm. 1.3.4. TIẾN HÀNH
- Cố định thỏ trên bàn mổ, tiêm thuốc tê ở dưới da vùng cổ của thỏ. - Bộc lộ một bên ộ
đ ng mạch cảnh và luồn canuyn vào động mạch cảnh.
- Truyền NaCl 9‰ vào tĩnh mạch rìa tai thỏ.
- Lấy máu từ từ qua canuyn cho vào ống nghiệm đã có chất chống đông. Lấy 30%
tổng thể tích máu thỏ để loại bỏ huyết tương (lấy làm 3 lần, mỗi lần lấy không quá 10% thể tích máu).
- Ống nghiệm chứa máu cho quay ly tâm 1500 – 2000 vòng/phút x 5 phút.
- Lọc bỏ huyết tương, tái hòa tan hồng cầu bằng dung dịch NaCl 9‰ rồi truyền lại
cho thỏ qua đường tĩnh mạch rìa tai (thể tích truyền vào tương đương với lượng huyết tương đã loại bỏ).
- Sau khi truyền tĩnh mạch 1h, mổ thỏ và quan sát ở các vị trí màng phổi, màng bụng,
màng tim. Dùng pipet hút dịch ở các vị trí này: ghi lại số lượng ml dịch, màu sắc, tính chất dịch. 4
Chú ý: Sinh viên tự tính toán lượng máu thỏ cần phải lấy biết rằng tổng thể tích máu
thỏ bằng 1/14 – 1/12 trọng lượng thỏ.
1.3.5. NHẬN ĐỊNH KẾT QUẢ
- Trình bày cách tính toán số lượng máu thỏ cần lấy.
- Nhận xét và giải thích kết quả. 5 BÀI 2
CHỨNG MINH MỘT SỐ HIỆN TƯỢNG TRONG RỐI LOẠN TUẦN HOÀN
TẠI Ổ VIÊM TRÊN ĐỘNG VẬT THỰC NGHIỆM Thí nghiệm 2.1
THÍ NGHIỆM GÂY VIÊM MẠC TREO RUỘT ẾCH 2.1.1. MỤC TIÊU
1. Thực hiện được các thao tác thí nghiệm gây viêm mạc treo ruột ếch theo đúng qui trình.
2. Quan sát được các rối loạn vận mạch và phản ứng bạch cầu trên tiêu bản viêm màng treo ruột ếch
3. Giải thích được hiện tượng xảy ra trong các thí nghiệm. 2.1.2. NGUYÊN TẮC
Gây viêm mạc treo ruột ếch bằng cách cho tiếp xúc với không khí hoặc muối
Natri clorid. Quan sát các giai đoạn rối loạn vận mạch và b ạch cầu xuyên mạch. 2.1.3. PHƯƠNG TIỆN * Động vật
- Ếch khỏe mạnh, trọng lượng tương đương nhau (150 – 200 gram). * Hóa chất - Natri clorid. * Dụng cụ - Khay quả đậu.
- Bộ dụng cụ mổ và cố định ếch: kéo thẳng to, kéo thẳng nhỏ, nỉa, dùi phá tủy, kẹp phẫu tích.
- Kính hiển vi quang học với vật kính 10 và 40. - Khăn lau. 2.1.4. TIẾN HÀNH - Bắt ếch, lau khô.
- Bất động ếch bằng cách phá tủy. Có 2 cách phá tủy:
+ Cách thứ nhất: cắt bỏ não ếch. Dùng một miếng vải bọc ếch lại để hở đầu và
hai chân sau, tay trái nắm ếch, tay phải luồn lưỡi kéo vào giữa hai hàm và cắt hàm
trên ở phía dưới của mắt. Qua vết cắt ta nhìn thấy tủy sống nằm trong ống sống. Dùng
dùi chọc tủy chọc vào ống sống đến khi hai chân sau của ếch duỗi thẳng.
+ Cách thứ 2: không cần cắt bỏ não ếch. Tay trái giữ chặt ếch, ngón trỏ ấn gập
đầu ếch xuống sao cho đầu và thân tạo thành một góc vuông. Tay phải cầm dùi, chọc
mũi dùi và khớp giữa hộp sọ và đốt sống cổ thứ nhất rồi lựa dùi, đẩy dùi vào sâu ống
sống cho đến khi thấy 2 chân sau ếch duỗi thẳng.
- Dùng đinh ghim để cố định ếch nằm sấp trên bàn mổ (chú ý: đặt phần bụng
bên phải con ếch sát với lỗ trên bàn mổ). 6
- Tiến hành cắt khoảng 1,5 cm da và lớp cơ bụng bên phải con ếch (chú ý: cắt
càng sát mặt bàn càng tốt, tránh chảy nhiều máu). Dùng kẹp phẫu tích kéo nhẹ nhàng
một quai ruột ra ngoài, vừa kéo vừa ghim xung quanh lỗ tròn trên bàn mổ (chú ý:
ghim sao cho lớp màng treo ruột ếch phía trên lỗ phải tương đối phẳng, không căng
quá và không chùng quá, mạc treo song song với bàn mổ).
- Đặt tiêu bản mạc treo ruột ếch vừa làm lên kính hiển vi, vị trí lỗ trên bàn mổ
tương ứng với vị trí trên vật kính.
- Dùng vật kính x10 quan sát:
+ Xác định được tiểu động mạch, mao mạch, tiểu tĩnh mạch.
- Dùng vật kính x40 quan sát:
+ Quan sát sự di chuyển của các tế bào máu trong lòng mạch.
+ Quan sát sự thay đổi tốc độ tuần hoàn, kích thước các mạch máu.
- Quan sát hiện tượng dòng máu đong đưa, ứ trệ máu .
- Quan sát bằng kính hiển vi truyền hình: nhận dạng các tế bào máu (hồng cầu,
bạch cầu), quan sát hiện tượng tập trung bạch cầu làm tại ổ viêm, hiện tượng bám
mạch và xuyên mạch của bạch cầu.
2.1.5. NHẬN ĐỊNH KẾT QUẢ
Giải thích các hiện tượng quan sát được. 7 Thí nghiệm 2.2
THÍ NGHIỆM GÂY VIÊM DA THỎ DO NHIỆT 2.2.1. MỤC TIÊU
1. Mô tả được các hiện tượng xảy ra trong thí nghiệm gây viêm da thỏ do nhiệt.
2. Giải thích được hiện tượng xảy ra trong các thí nghiệm. 2.2.2. NGUYÊN TẮC
Dùng nhiệt độ gây viêm một vùng da thỏ. Tại chỗ viêm xuất hiện hiện tượng
sưng nề, ứ dịch rỉ viêm. Quan sát sự hình thành dịch rỉ viêm với chất chỉ thị màu xanh Evans. 2.2.3. PHƯƠNG TIỆN * Động vật
- Thỏ trắng khỏe mạnh, trọng lượng 2 – 2,5kg * Hóa chất - Dung dịch xanh Evans * Dụng cụ - Bơm tiêm 5ml - Ấm đun nước - Nhiệt kế - Chai thủy tinh 250ml 2.2.4. TIẾN HÀNH - Cố định thỏ.
- Cắt lông hai bên sườn bụng thỏ (chú ý: không làm tổn thương da thỏ). - Tiê
m 2ml xanh Evans hoặc xanh Trypan vào tĩnh mạch rìa tai thỏ.
- Dùng chai nước nóng 60 C -
70 C áp vào một bên thành bụng ở vị trí đã cắt lông.
- Sau 15 – 30 phút áp nóng, quan sát vị trí áp nóng (màu sắc, sự phù nề) và so sánh với bên ố đ i diện.
2.2.5. NHẬN ĐỊNH KẾT QUẢ
- Nhận xét và giải thích hiện tượng quan sát được. 8 BÀI 3
CHỨNG MINH MỘT SỐ YẾU TỐ GÂY RỐI LOẠN HÔ HẤP TRÊN ĐỘNG
VẬT THỰC NGHIỆM Thí nghiệm 3.1
ẢNH HƯỞNG CỦA MỘT SỐ YẾU TỐ ĐẾN THÔNG KHÍ 3.1.1. MỤC TIÊU
1. Quan sát được sự thay đổi hô hấp trên thỏ khi cho ngửi amoniac, tiêm tĩnh
mạch acid lactic và natri bicacbonat.
2. Giải thích được kết quả của các thí nghiệm. 3.1.2. NGUYÊN TẮC
Gây tác động lên thần kinh trung ương hoặc thay đổi thành phần khí máu của
thỏ sẽ làm thay đổi tần số, biên độ thở. Bộc lộ khí quản và sử dụng đầu đo cảm biến
lưu lượng khí, bộ phận cảm biến áp suất ghi lại sự thay đổi theo thời gian. Tín hiệu
được ghi lại bằng phần cứng Powerlab và hiển thị trên máy tính. 3.1.3. PHƯƠNG TIỆN
* Động vật thí nghiệm
- Thỏ khỏe mạnh, trọng lượng từ 2,5 - 3kg. * Hóa chất - Amoniac đậm ặ đ c (95%), - Acid lactic 3%, - Natri bicacbonat 10% - Natri citrat 7% - Heparin - Novocain 3% - Dicain 1%. * Dụng cụ
- Hệ thống PowerLab: máy tính, bộ đo hô hấp trên động vật, bộ đo huyết áp trên động vật. - Bàn mổ thỏ.
- Bộ dụng cụ mổ: dao mổ, kéo, pince, …
- Bơm kim tiêm 1ml, 5ml, 10ml.
- Bông, gạc, chỉ, dây buộc. 3.1.4. TIẾN HÀNH
3.1.4.1. Chuẩn bị trước khi tiến hành thí nghiệm
Chuẩn bị máy móc, dụng cụ:
- Kết nối máy tính với phần cứng của hệ thống Powerlab. Bật hệ thống PowerLab
ít nhất 5 phút trước khi sử dụng. 9
- Kết nối bộ đo hô hấp trên động vật vào cổng 1 (input 1) với phần cứng của hệ
thống PowerLab. Đầu còn lại kết nối với 1 đầu của canuyn chữ T gắn khí quản của
động vật. Ấn nút Zero Pod trên màn hình. Chuẩn hô hấp:
- Kết nối bộ đo huyết áp trên động vật vào cổng 2 (input 2) với phần cứng của hệ
thống PowerLab. Đầu còn lại kết nối với bộ cảm biến áp suất đã được nối với canuyn
luồn động mạch. Chuẩn huyết áp.
Chuẩn bị động vật thí nghiệm
- Thỏ được cố định ngửa trên bàn mổ, cắt sạch lông vùng cổ.
- Gây tê dưới da bằng Novocain 3%.
- Bộc lộ khí quản và động mạch cảnh:
Rạch đường giữa cổ dài khoảng từ 8-10 cm, dùng ery tách lớp cân và cơ để lộ khí
quản. Bên cạnh khí quản có bó mạch cảnh và dây thần kinh X.
Dùng kéo nhỏ cắt khí quản, luồn canuyn chữ T vào khí quản, 1 đầu của canuyn
được nối với hệ thống Powerlab thông qua đầu đo hô hấp, đầu còn lại được kẹp chặt.
Tìm động mạch cảnh ở bên cạnh khí quản để luồn canuyn thỏ vào động mạch
cảnh: luồn hai sợi chỉ xuống dưới động mạch, thắt chặt một sợi về phía đầu (buộc sát
lên phía trên). Dùng pince kẹp mạch máu cách sợi chỉ buộc 5 cm về phía tim. Dùng
kéo nhỏ cắt theo hình chữ V đáy về phía tim, nhát cắt ngay sát dưới nút thứ nhất.
Luồn canuyn (đã bơm đầy heparin) và cố định canuyn vào động mạch cảnh bằng cách
buộc chặt sợi chỉ thứ hai ở phía trên chỗ phình.
Chú ý: buộc chặt để tránh tụt chỉ trong thí nghiệm. Nối canuyn với bộ đo huyết
áp động vật thông qua bộ cảm b ế i n áp suất.
3.1.4.2. Tiến hành thí nghiệm Ngửi NH3 - Ghi các chỉ tiê
u trước thí nghiệm: Tần số, biên độ hô hấp.
- Cho thỏ ngửi bông tẩm NH3 đậm đặc trong thời gian 2-3 giây (lần 1): theo dõi
diễn biến hô hấp của thỏ sau khi ngửi. h
G i kết quả vào biên bản thí nghiệm.
- Để thỏ trở về tình trạng ổn định (các thông số huyết áp, hô hấp trở về bình thường).
- Nhỏ 1-2 giọt Dicain 1% vào niêm mạc mũi thỏ. Sau khi nhỏ Dicain 1-2 phút,
cho thỏ ngửi lại bông tẩm NH3 (lần 2): theo dõi diễn biến hô hấp của thỏ. Ghi kết quả
vào biên bản thí nghiệm.
Tiêm dung dịch acid lactic
- Để các chỉ số hô hấp, huyết áp về bình thường.
- Tiêm dung dịch acid lactic 3% với liều 1ml/kg cân nặng vào tĩnh mạch rìa tai thỏ.
- Theo dõi sự thay đổi của hô hấp, huyết áp và tình trạng toàn thân của thỏ. Ghi
kết quả vào biên bản thí nghiệm.
Tiêm dung dịch Natri bicacbonat
- Chờ cho thỏ ổn định trở lại, lấy lại các chỉ tiêu: huyết áp, hô hấp và tình trạng
toàn thân trước thí nghiệm. 10
- Tiêm dung dịch Natri bicacbonat 10% với liều 4ml/kg cân nặng vào tĩnh mạch rìa tai thỏ.
- Theo dõi sự thay đổi của hô hấp, huyết áp và tình trạng toàn thân của thỏ. Ghi
kết quả vào biên bản thí nghiệm.
Biên bản thí nghiệm trên thỏ Hô hấp Thí nghiệm Huyết áp Toàn trạng Tần số Biên độ Trước Ngửi NH3 Sau lần 1 Sau lần 2 Trước Tiêm acid lactic Sau Trước Tiêm NaHCO3 Sau
3.1.5. NHẬN ĐỊNH KẾT QUẢ 11 Thí nghiệm 3.2
GÂY NGẠT TRÊN THỎ THỰC NGHIỆM 3.2.1. MỤC TIÊU
1. Mô tả được 3 giai đoạn của ngạt trên thỏ thực nghiệm.
2. Giải thích được kết quả của thí nghiệm. 3.2.2. NGUYÊN TẮC
Khi áp suất khí thở không thay đổi nhưng thay đổi thành phần chất khí (giảm
oxy, tăng cacbonic khí thở) sẽ khiến con vật bị ngạt. Quan sát 3 giai đoạn của quá
trình ngạt và khả năng hồi phục của từng giai đoạn. 3.2.3. PHƯƠNG TIỆN
* Động vật thí nghiệm
- Thỏ khỏe mạnh; trọng lượng 2,0 – 2,5 kg. * Hóa chất - Novocain 3%. * Dụng cụ
- Hệ thống PowerLab: máy tính, bộ đo hô hấp trên động vật, bộ đo huyết áp trên động vật. - Bàn mổ thỏ.
- Bộ dụng cụ mổ: dao mổ, kéo, pince, …
- Bơm kim tiêm 1ml, 5ml, 10ml. - Bông, gạc. 3.2.4. TIẾN HÀNH
3.2.4.1. Chuẩn bị trước khi tiến hành thí nghiệm
Chuẩn bị máy móc, dụng cụ:
- Kết nối máy tính với phần cứng của hệ thống Powerlab. Bật hệ thống PowerLab
ít nhất 5 phút trước khi sử dụng.
- Kết nối bộ đo hô hấp trên động vật vào cổng 1 (input 1) với phần cứng của hệ
thống PowerLab. Đầu còn lại kết nối với 1 đầu của canuyn chữ T gắn khí quản của
động vật. Ấn nút Zero Pod trên màn hình. Chuẩn hô hấp:
- Kết nối bộ đo huyết áp trên động vật vào cổng 2 (input 2) với phần cứng của hệ
thống PowerLab. Đầu còn lại kết nối với bộ cảm biến áp suất đã được nối với canuyn
luồn động mạch. Chuẩn huyết áp.
Chuẩn bị động vật thí nghiệm
- Thỏ được cố định ngửa trên bàn mổ, cắt sạch lông vùng cổ.
- Gây tê dưới da bằng Novocain 3%.
- Bộc lộ khí quản và động mạch cảnh:
Rạch đường giữa cổ dài khoảng từ 8-10 cm, dùng ery tách lớp cân và cơ để lộ khí
quản. Bên cạnh khí quản có bó mạch cảnh và dây thần kinh X.
Dùng kéo nhỏ cắt khí quản, luồn canuyn chữ T vào khí quản, 1 đầu của canuyn
được nối với hệ thống Powerlab thông qua đầu đo hô hấp, đầu còn lại được kẹp chặt. 12
Tìm động mạch cảnh ở bên cạnh khí quản để luồn canuyn thỏ vào động mạch
cảnh: luồn hai sợi chỉ xuống dưới động mạch, thắt chặt một sợi về phía đầu (buộc sát
lên phía trên). Dùng pince kẹp mạch máu cách sợi chỉ buộc 5 cm về phía tim. Dùng
kéo nhỏ cắt theo hình chữ V đáy về phía tim, nhát cắt ngay sát dưới nút thứ nhất.
Luồn canuyn (đã bơm đầy heparin) và cố định canuyn vào động mạch cảnh bằng cách
buộc chặt sợi chỉ thứ hai ở phía trên chỗ phình.
Chú ý: buộc chặt để tránh tụt chỉ trong thí nghiệm. Nối canuyn với bộ đo huyết
áp động vật thông qua bộ cảm b ế i n áp suất.
3.2.4.2. Tiến hành thí nghiệm
- Lấy các chỉ tiêu: huyết áp, hô hấp và tình trạng toàn thân trước khi kẹp khí quản.
- Kẹp khí quản gây ngạt bằng pinc . e
- Quan sát hành vi toàn trạng, thu nhập các thông số huyết áp, hô hấp ở từng giai
đoạn của ngạt: hưng phấn, ức chế, suy sụp.
- Mở kẹp để thỏ phục hồi lại ở các giai đoạn ức chế và giai đoạn suy sụp.
- Ghi kết quả vào bảng sau: Bản
g kết quả thí nghiệm trên thỏ Hô hấp Thí nghiệm Huyết áp Toàn trạng
Tần số Biên độ Trước Gây ngạt Hưng phấn
thực nghiệm Ức chế Suy sụp
3.2.5. NHẬN ĐỊNH KẾT QUẢ
Nhận xét sự thay đổi của thỏ trong quá trình gây ngạt và ở từng giai đoạn 13 Thí nghiệm 3.3
SỰ THAY ĐỔI HÔ HẤP Ở CHUỘT TRONG MÔ HÌNH LÊN CAO THỰC NGHIỆM 3.3.1. MỤC TIÊU
1. Mô tả được sự thay đổi hô hấp ở chuột trong mô hình lên cao thực nghiệm.
2. Giải thích được kết quả của các thí nghiệm trên. 3.3.2. NGUYÊN TẮC
Giữ nguyên tỷ lệ thành phần các chất khí nhưng thay đổi áp suất khí thở thì hệ
hô hấp sẽ có sự điều chỉnh phù hợp trong từng điều kiện. Ngưỡng kích thích hô hấp
có thể tăng hoặc giảm khi cho thêm các chất ức chế hoặc hưng phấn thần kinh. 3.3.3. PHƯƠNG TIỆN
- Chuột nhắt trắng 18 – 20g
- Máy hút chân không và hệ thống bình thông nhau. - Đồng hồ bấm giây. - Cafein, Urethal. 3.3.4. TIẾN HÀNH
- Tiến hành trên 03 chuột nhắt trắng có trọng lượng tương đương nhau.
+ Chuột số 1 (Gây hưng phấn thần kinh): Tiêm 0,2ml Cafein vào ổ bụng.
+ Chuột số 2 (Gây ức chế thần kinh): Tiêm 0,2 Urethal vào ổ bụng.
+ Chuột số 3: Không tiêm thuốc
- Cho chuột vào hệ thống bình thông nhau.
- Sau khi tiêm 2-3 phút, đếm nhịp thở trong 1 phút và quan sát hành vi của 3 chuột nhắt trắng.
- Đậy kín hệ thống bình thông nhau, làm giảm áp suất không khí trong bình nhờ
máy hút chân không tương ứng với áp suất không khí ở độ cao 4.000m, 6.000m, 8.000m và 10.000m.
- Tương ứng với mỗi độ cao, đếm nhịp thở và quan sát hành vi của từng chuột.
- Xác định độ cao gây chết đối với từng chuột.
3.3.5. NHẬN ĐỊNH KẾT QUẢ
- Ghi lại kết quả thí nghiệm
- Nhận xét và giải thích kết quả. Bản
g kết quả thí nghiệm trên chuột Chuột 1 Chuột 2 Chuột 3 Độ cao (Tiêm Cafein) (Tiêm Urethal) (Bình thường) 0m 4.000m 6.000m 8.000m 10.000m 14 BÀI 4
NHẬN ĐỊNH ĐẶC ĐIỂM CỦA MỘT SỐ TẾ BÀO MÁU
TRÊN TIÊU BẢN MÁU BỆNH LÝ 4.1. MỤC TIÊU
1. Mô tả và giải thích được đặc điểm về hình dạng, kích thước và màu sắc của
hồng cầu trên các tiêu bản: tiêu bản thiếu máu nhược sắc, tiêu bản hồng cầu lưới.
2. Mô tả và giải thích được đặc điểm về hình dạng, kích thước và màu sắc của
bạch cầu và hồng cầu trên các tiêu bản: tiêu bản Leucose cấp và tiêu bản Leucose mạn. 4.2. NGUYÊN TẮC
Soi dưới kính hiển vi; dựa vào hình dạng, kích thước và sự bắt màu của nhân (các hạt ặ
đ c hiệu trong bào tương) để nhận dạng hồng cầu và các loại bạch cầu. 4.3. PHƯƠNG TIỆN
- Kính hiển vi quang học. - Dầu Séc.
- Tiêu bản máu đàn bình thường.
- Tiêu bản thiếu máu do thiếu sắt đã được nhuộm Giemsa.
- Tiêu bản hồng cầu mạng lưới đã được nhuộm tươi bằng chất Cresyl bóng.
- Tiêu bản Leusoce cấp và mạn tính. 4.4. TIẾN HÀNH
4.4.1. Quan sát tiêu bản máu bình thường
Đặt tiêu bản lên mâm kính, xác định vi trường khoảng 2/3 cuối của tiêu bản,
quan sát ở vật kính x10 rồi nhỏ một giọt dầu séc vào tiêu bản và chuyển sang vật kính
x100 để quan sát và đánh giá:
- Hồng cầu: hình dạng, kích thước, màu sắc.
- Bạch cầu: các loại bạch cầu (hình dạng, kích thước, màu sắc).
- Tỷ lệ bạch cầu/hồng cầu trên một vi trường.
4.4.2. Quan sát tiêu bản thiếu máu nhược sắc
Đặt tiêu bản lên mâm kính, xác định vi trường khoảng 2/3 cuối của tiêu bản,
quan sát ở vật kính x10 rồi nhỏ một giọt dầu séc vào tiêu bản và chuyển sang vật kính
x100 để quan sát: hình dạng hồng cầu, kích thước (to, nhỏ), sự bắt màu (đậm, nhạt).
4.4.3. Quan sát tiêu bản hồng cầu lưới
Qui trình như xem tiêu bản thiếu máu nhược sắc.
4.4.4. Quan sát tiêu bản Leucose cấp, mạn tính
Đặt tiêu bản lên mâm kính, xác định vi trường khoảng 2/3 cuối của tiêu bản,
quan sát ở vật kính x10 và đánh giá:
- Hồng cầu: kích thước, hình dạng, độ bắt màu…
- Bạch cầu: Số lượng bạch cầu (so sánh tỷ lệ bạch cầu/ hồng cầu) trên một vi
trường so với bình thường? dòng bạch cầu nào chiếm đa số? Tuổi bạch cầu (hình
dạng, kích thước, độ bắt màu của nhân, nguyên sinh chất)?. 15
4.5. NHẬN ĐỊNH KẾT QUẢ
- Nhận xét và giải thích các đặc điểm đã quan sát được trên tiêu bản thiếu máu nhược sắc.
- Nhận xét và giải thích các đặc điểm về hình dạng, kích thước, màu sắc mạng lưới của hồng cầu lưới.
- Nhận xét và giải thích các đặc điểm về hình dạng, kích thước, màu sắc của bạch cầu
và hồng cầu trên 2 tiêu bản leucose cấp và mạn tính. 16
TÀI LIỆU THAM KHẢO
Hình thái bình thường của dòng bạch cầu hạt
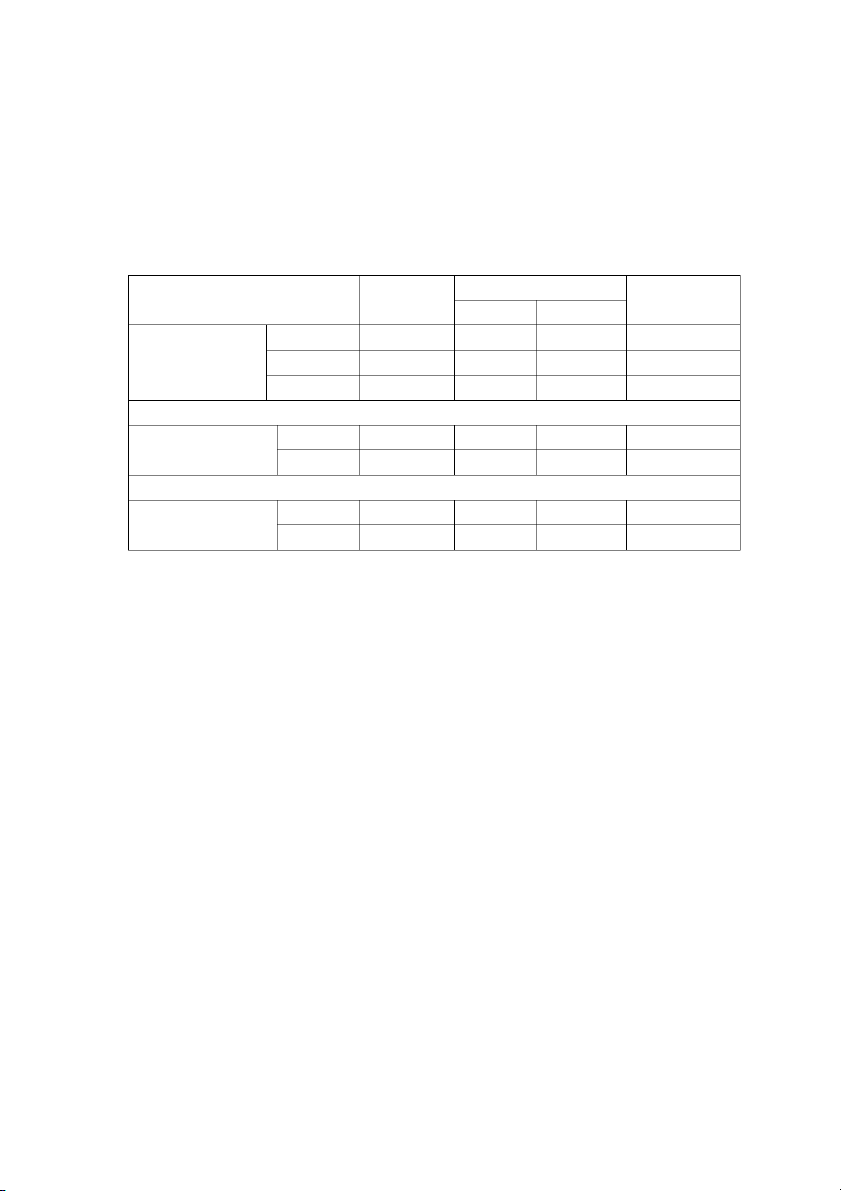
1. Nguyên tủy bào (Myeloblast)
Trong quá trình biệt hóa dòng bạch cầu hạt, đây là giai đoạn sớm nhất có thể xác
định được dựa trên các đặc điểm hình thái. Các tế bào có đường kính trung bình từ
10-18 µm. Chất nhân mịn và đều với một đến vài hạt nhân nhạt màu. Bào tương hẹp,
ưa bazơ và không có hạt. Que Auer – có dạng hình que bắt màu đỏ, bản chất là sự
ngưng kết của các lysosome, có thể quan sát được nhưng chỉ trong các trường hợp bệnh lý.
2. Tiền tủy bào (Promyelocyte)
Là lứa tuổi biệt hóa thứ hai của dòng bạch cầu hạt. Đặc điểm nổi bật của tiền
tủy bào là hình ảnh các hạt bào tương dày đặc, đôi khi làm che lấp, lu mờ các đặc
điểm hình thái khác của tế bào. Đó là những hạt nguyên phát, ưa azur và bản chất là
các enzym myeloperoxidase và chloroacetate esterase. Về kích thước, tiền tủy bào
lớn hơn nguyên tủy bào với đường kính trung bình khoảng 14 đến 20 µm và có tỷ lệ
nhân và nguyên sinh chất thấp hơn. Chất nhân thô hơn, còn quan sát thấy hạt nhân và
bào tương màu xanh xám nhạt. 17
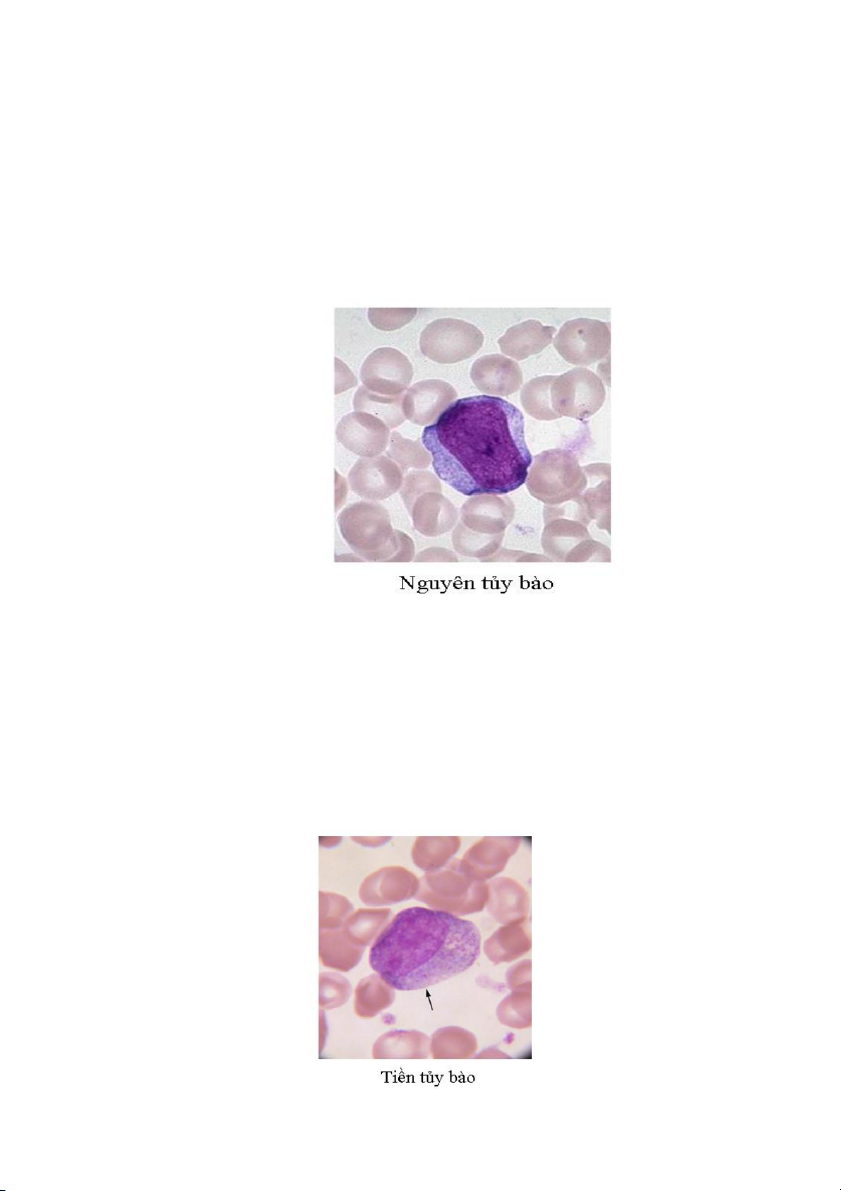
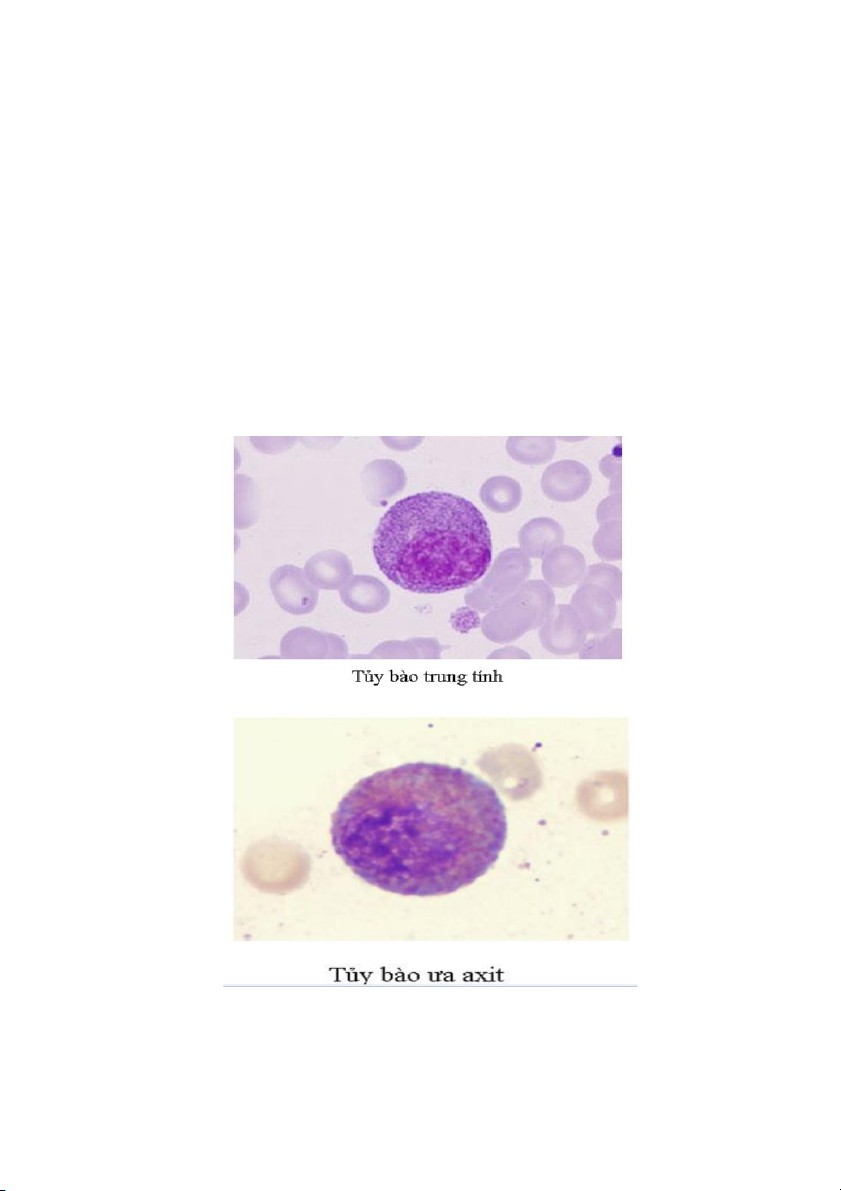
3. Tủy bào (myelocyte)
Đây là giai đoạn biệt hóa thứ ba của dòng bạch cầu hạt. Các tủy bào có thể dễ
dàng nhận biết trên các tiêu bản vì trong bào tương có rất nhiều hạt thứ phát hay hạt
đặc hiệu. Cũng từ giai đoạn này, dựa vào tính chất bắt màu thuốc nhuộm của các hạt
bào tương để phân biệt các loại tủy bào trung tính, tủy bào ưa axit hay tủy bào ưa bazơ.
Các tủy bào thường có đường kính trung bình khoảng 12 đến 18 µm. Tỷ lệ nhân
so với nguyên sinh chất thấp hơn so với tiền tủy bào, và nhân có dạng bầu dục rõ hơn,
không còn thấy hạt nhân, và chất màu nhân thô hơn.
Các hạt trung tính khá mịn và bắt màu hồng nhạt trên tiêu bản nhuộm Wright. Các
hạt ưa axit có kích thước lớn hơn hạt trung tính, hình tròn hoặc bầu dục, bắt màu vàng
cam và chiết quang mạnh hơn. Các hạt ưa bazơ bắt màu xanh đậm và phân bố dày đặc trong bào tương. 18
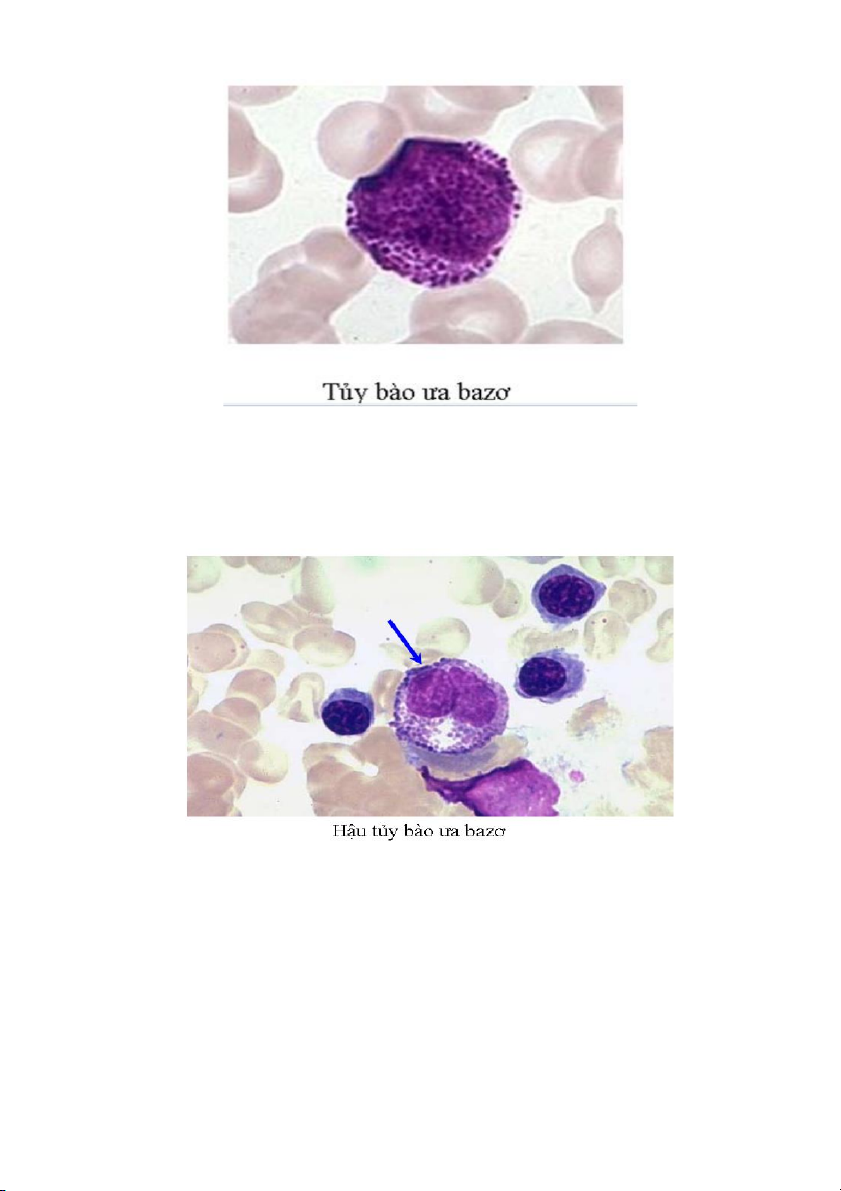
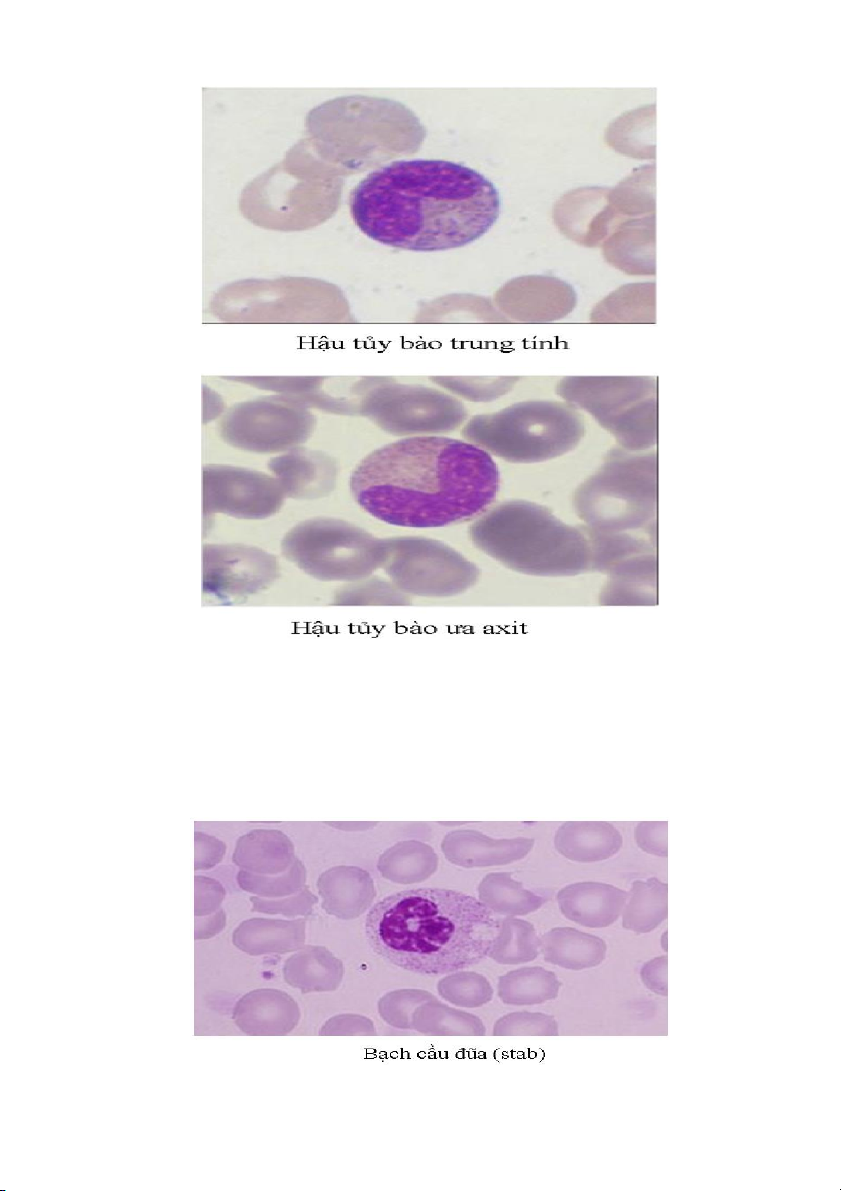
3. Hậu tủy bào (metamyelocyte)
Là giai đoạn biệt hóa thứ tư của dòng bạch cầu hạt. Đặc trưng của các hậu tủy bào
hình thái của nhân bắt đầu thắt lại và có dạng quả thận hoặc hình hạt đậu. Chất nhân
thô hơn so với tuổi tủy bào. Màu của các hạt đặc hiệu trong bào tương trở nên khác
biệt rất rõ ràng giữa màu trung tính, ưa acid hay ưa base. 19
5. Bạch cầu đũa (Band hoặc Stab)
Đây là giai đoạn biệt hóa cuối cùng trước khi các tế bào trở nên thực sự trưởng
thành thành bạch cầu hạt. Trong điều kiện bình thường, có một tỷ lệ nhỏ các bạch cầu
đũa cũng lưu hành trong máu. Về hình thái, các tế bào này có nhân kéo dài hình que, hình gậy... 20 6. Bạch cầu hạt
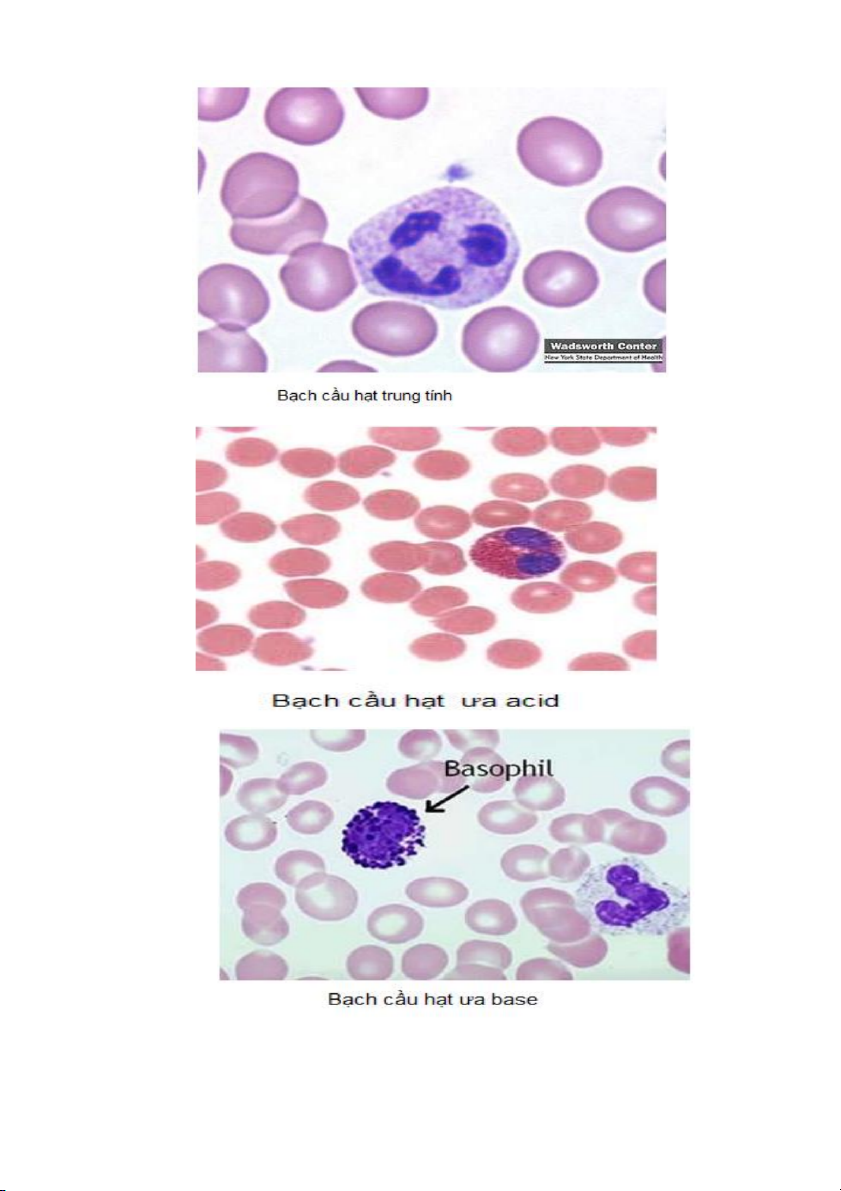
Loại tế bào này có một số tên gọi khác nhau: bạch cầu đa nhân, bạch cầu đoạn
hay bạch cầu hạt. Điều này xuất phát từ đặc điểm của nhân chia thành nhiều thùy nhỏ.
Dựa vào cách bắt màu của các hạt đặc hiệu trong bào tường để xếp thành bạch cầu
hạt trung tính, bạch cầu hạt ưa bazơ và bạch cầu hạt ưa axit. Đây là giai đoạn biệt hóa
cuối cùng của dòng bạch cầu hạt. Bạch cầu hạt trung tính điển hình có nhân chia làm
nhiều thùy, trong khi đó bạch cầu hạt ưa axit có nhân thường chia thành hai thùy.
Giữa các thùy nhân được nối với nhau bằng phần liên kết nhỏ. Bạch cầu hạt ưa bazơ
khó quan sát vì các hạt đặc hiệu bắt màu xanh tím và che phủ lên trên nhân.
Các hạt đặc hiệu bản chất được tạo thành từ lưới nội bào có hạt sau đó được chuyển
đến thể Golgi. Các loại hạt đặc hiệu bắt màu khác nhau khi nhuộm trên tiêu bản:
- Hạt trung tính bắt màu hồng tím, bản chất giàu các thành phần có hoạt tính diệt vi
khuẩn, bao gồm các enzym hydrolase, lysozyme và myeloperoxydase. Một số hạt
chính là các lysosome điển hình.
- Hạt ưa acid bắt màu vàng cam, bản chất không có lysozyme. Có hai loại khác nhau:
+ Loại hạt nhỏ không chứa các tinh thể, chiếm tỷ lệ thấp trong các tuổi trưởng
thành và thành phần chủ yếu là các phosphatase axit.
+ Loại hạt lớn chứa các tinh thể, chiếm tỷ lệ cao. Các hạt tinh thể này có hình
elip, kích thước lớn hơn so với hạt trung tính, bản chất chứa các enzym peroxydase
(không giống với myeloperoxydase của bạch cầu hạt trung tính), và ngoài ra còn có các enzym phosphatase axit.
- Hạt ưa bazơ bắt màu xanh tím, chứa heparin và histamine. 21 22 BÀI 5
Thí nghiệm 5.1. ỨNG DỤNG K THUẬT MIN DỊCH ĐNH DẤU GẮN
ENZYM (ELISA: ENZYM LINK IMMUNO-SORBENT ASSAY) ĐỂ XC
ĐỊNH KHNG NGUYÊN/ KHNG THỂ CỦA VIRUS VIÊM GAN B 5.1.1. MỤC TIÊU
Trình bày được nguyên lý, các bước tiến hành và cách nhận định kết quả kỹ
thuật miễn dịch đánh dấu enzym (ELISA) để xác định kháng nguyên bề mặt virus viêm gan B (HbsAg) 5.1.2. NGUYÊN TẮC
Dựa vào nguyên lý của phản ứng kết hợp kháng nguyên – kháng thể. Các
kháng nguyên hoặc kháng thể được gắn lên bản nhựa, sau đó cho kháng thể hoặc
kháng nguyên đặc hiệu tương ứng vào để tạo phản ứng kết hợp kháng nguyên – kháng
thể. Các kháng thể hoặc kháng nguyên đã biết trước được gắn với enzym. Enzym sẽ
phân hủy cơ chất không màu thành một sản phẩm có màu đặc trưng. Mật độ màu
được nhận định sơ bộ bằng mắt thường hoặc được đọc chính xác bằng máy ELISA. 5.1.3. PHƯƠNG TIỆN
* Mẫu bệnh phẩm
- Huyết tương cần kiểm tra. * Dụng cụ - Găng tay cao su.
- Ống nghiệm lấy máu (ống nghiệm đã có chất chống đông) - Bơm tiêm 5ml - Bông vô trùng - Cồn sát trùng
- Micropipet các loại và đầu col tương ứng. - Giấy bản - Bộ kít HBsA g - Máy li tâm - Hệ thống máy EL ISA 5.1.4. TIẾN HÀNH
Các bước tiến hành thực hiện như sau: 23
- Sát khuẩn và lấy 2ml máu tĩnh mạch của người thử
- Rửa các giếng thử bằng dung dịch rửa, rửa 4-5 lần/giếng, thể tích rửa 350μl/giếng
- Giếng trắng đặt ở vị trí A1
- Thêm 150 μl chứng âm vào 3 giếng B1, C1, D1
- Thêm 150 μl chất hiệu chuẩn vào giếng E1, F1
- Thêm 150 μl chứng dương vào giếng G1
- Thêm 150 μl huyết tương của người thử vào từng giếng tiếp theo sau giếng G1
- Thêm 100 μl dung dịch liên hợp vào từng giếng trừ giếng A1
- Đậy bản giếng và ủ 120 phút ở nhiệt độ 37°C ±1°C
- Sau khi ủ xong đem rửa 5 lần bằng dung dịch rửa, rửa 4-5 lần/giếng, thể tích rửa 350μl/giếng
- Ngay sau khi rửa, thêm 200 μl dung dịch chất nền vào từng giếng
- Đậy bản giếng và ủ ở nhiệt độ phòng 18° - 24°C trong 30 phút
- Thêm 100 μl H2SO4/giếng để dừng phản ứng
- Kiểm tra sơ bộ các giếng bằng mắt thường hoặc đo quang
5.1.5. NHẬN ĐỊNH KẾT QUẢ Yêu cầu Giếng trắng < 0.100
Chứng âm (NC) sau kh < 0.050 trừ đi giếng trắng Chất hiệu chuẩn S/Co > 2 Chứng dương > 1.000 Giá trị Cu - t off (Co): Co = NC + 0.05 S/Co Kết quả < 0.9 Âm tính 0.9 – 1.1 Nghi ngờ > 1.1 Dương tính 24
Thí nghiệm 5.2. TEST LẨY DA 5.2.1. Mục tiêu
- Trình bày được nguyên lý của test lẩy da.
- Thực hiện được các bước tiến hành test lẩy da theo đúng quy trình.
- Giải thích được kết quả của test lẩy da và nhận định được 1 số biểu hiện của phản ứng quá mẫn. 5.2.2. Nguyên lý
Khi đưa một lượng dị nguyên đã được pha loãng tới nồng độ thích hợp vào
lớp thượng bì của da người bệnh để kiểm tra phản ứng của cơ thể người bệnh với loại
dị nguyên đó. Nếu kháng thể IgE đặc hiệu với dị nguyên trong máu của bệnh nhân sẽ
biểu hiện trên da với các mức độ khác nhau.
5.2.3. Chuẩn bị
5.2.3.1. Chuẩn bị phương tiện, dụng cụ - Bông vô trùng - Găng tay - Khăn giấy
- Kim lẩy/kim tiêm nội bì (26-27G)
- Micropipet (0,01-5 ul) và đầu côn tương ứng - Bút b i - Thước đo phản ứng
- Hộp đựng vật sắc nhọn - Cồn sát trùng
- Dung dịch histamin 1mg/ml (chứng dương)
- Dung dịch NaCl 0,9% (chứng âm)
- Dị nguyên (sữa bò, bột mỳ, dưa hấu, táo… )
- Hộp cấp cứu phản vệ
3.2. Chuẩn bị bệnh nhân
- Hỏi tên, tuổi, giải thích cho người được thử về mục đích và cách tiến hành kỹ thuật.
- Ghi tên, địa chỉ và thông tin của người được thử test - Người đ ợ
ư c thử test ngồi ở tư thế thoái mái 25
5.2.4. Tiến hành thí nghiệm
- Sát khuẩn 1/3 mặt trước trong cẳng tay (lưu ý: vị trí thử test là những vị trí
rộng rãi không có tổn thương da như mặt trước trong cẳng tay, lưng), đợi khô.
- Đánh dấu các vùng test trên da bằng bút bi. Ghi rõ tên dung dịch bên cạnh
(Các vị trí chích trên da sẽ được thực hiện ngay cạnh vị trí đánh dấu để tránh nhầm lẫn).
- Nhỏ các giọt dung dịch cách nhau 3-5 cm vào vùng da đã sát khuẩn:
1 giọt dung dịch NaCl 0,9% (chứng âm)
1 giọt dung dịch dị nguyên nghi ngờ
1 giọt dung dịch Histamin 1mg/ml (chứng dương)
- Dùng kim tiêm lẩy da cắm vào giữa giọt dung dịch trên (mỗi giọt một kim
riêng), qua lớp thượng bì tạo với mặt da một góc 45 độ rồi lẩy nhẹ, không được làm chảy máu
- Đọc kết quả sau 20 phút
Lưu ý: theo dõi người được thử trong suốt quá trình làm test. Nếu xảy ra phản
vệ, xử lý cấp cứu như trong phác đồ “Xử trí phản vệ”
5.2.5. Nhận định kết quả Mức độ Ký hiệu Biểu hiện Âm tính -
Giống như chứng âm tính Nghi ngờ +/-
Xuất hiện sẩn ở vị trí dị nguyên, đường kín
ban sần đường kính <3mm Dương tính +
Xuất hiện sẩn ở vị trí dị nguyên, đường kín
sần ≥ 3mm hoặc trên 75% so với chứng âm 26 PHỤ LỤC I.
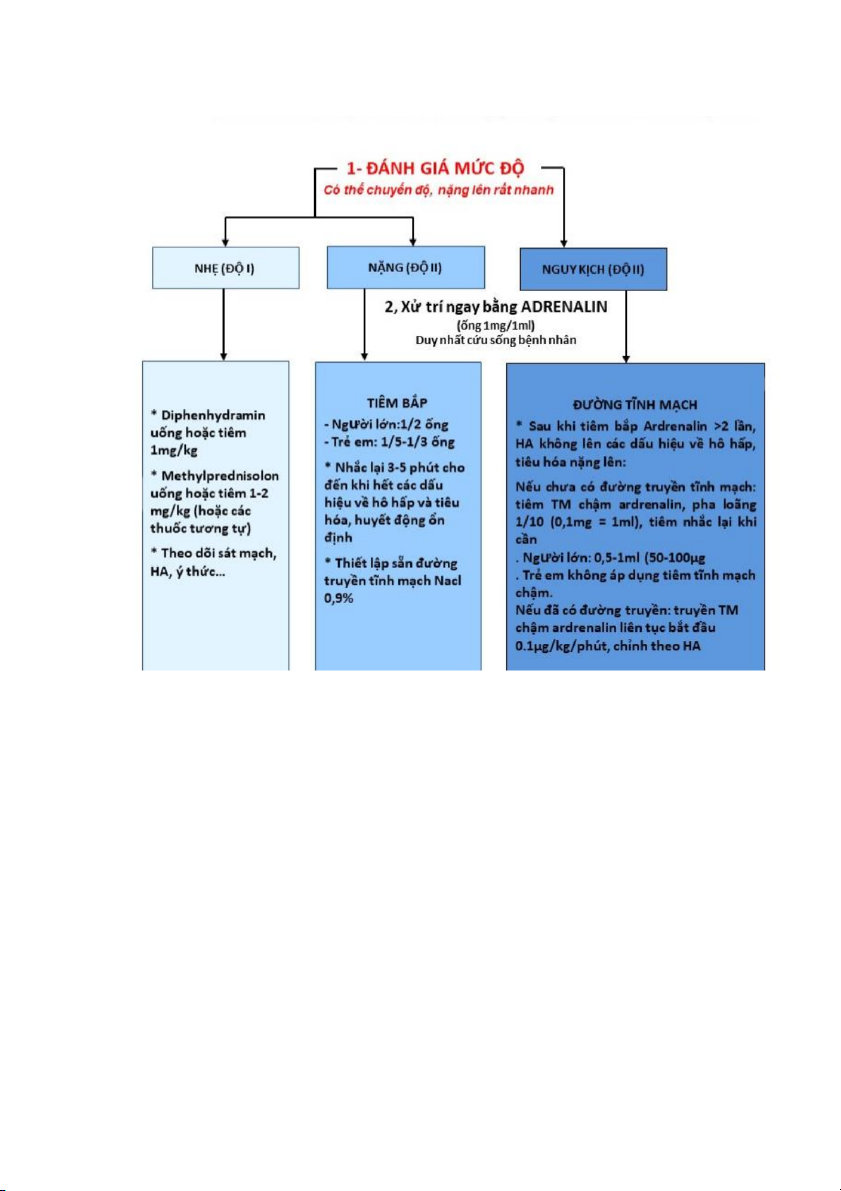
HỘP THUỐC CẤP CỨU PHẢN VỆ VÀ TRANG THIẾT BỊ Y TẾ
(Ban hành kèm theo Thông tư số 51/2017/TT-BYT ngày 29 tháng 12 năm 2017 của Bộ trưởng Bộ Y tế)
I. Thành phần hộp thuốc cấp cứu phản vệ: STT Nội dung
Đơn vị Số lượn g
Phác đồ, sơ đồ xử trí cấp cứu phản vệ (Phụ lục II 1 bản 01 Phụ lục X) Bơm kim tiêm vô khuẩn - Loại 10ml cái 02 2 - Loại 5ml cái 02 - Loại 1ml cái 02 - Kim tiêm 14-16G cái 02
3 Bông tiệt trùng tẩm cồn gói/hộp 01 4 Dây garo cái 02 5 Adrenalin 1mg/1ml ống 05 6 Methylprednisolon 40mg lọ 02 7 Diphenhydramin 10mg ống 05 8 Nước cất 10ml ống 03
II. Trang thiết bị y tế và thuốc tối thiểu cấp cứu phản vệ tại cơ sở khám
bệnh, chữa bệnh. 1. Oxy.
2. Bóng AMBU và mặt nạ người lớn và trẻ nhỏ. 3. Bơm xịt salbutamol.
4. Bộ đặt nội khí quản và/hoặc bộ mở khí quản và/hoặc mask thanh quản.
5. Nhũ dịch Lipid 20% lọ 100ml (02 lọ) đặt trong tủ thuốc cấp cứu tại nơi sử
dụng thuốc gây tê, gây mê.
6. Các thuốc chống dị ứng đường uống.
7. Dịch truyền: natriclorid 0,9%./. 27
PHỤ LỤC I .I
SƠ ĐỒ CHẨN ĐON VÀ XỬ TRÍ PHẢN VỆ
(Ban hành kèm theo Thông tư số 51/2017/TT-BYT ngày 29 tháng 12 năm 2017 của Bộ trưởng Bộ Y tế) I.
Sơ đồ chi tiết về chẩn đoán và xử trí phản vệ 28
II. Sơ đồ tóm tắt về chẩn đoán và xử trí phản vệ 29




