





Preview text:
BÀI 3: PHƯƠNG PHÁP CHUẨN ĐỘ AXIT – BAZƠ XÁC ĐỊNH NỒNG ĐỘ H PO 3
4 BẰNG DUNG DỊCH NaOH I. NGUYÊN TẮC.
Khi trung hòa một axit ( đơn hay đa axit ) bằng bazơ mạnh, pH tăng dần trong quá trình trung
hòa. Đường pH = f(V) với V là thể tích dung dịch NaOH thêm vào có dạng khác nhau tùy theo
axit được trung hòa là axit mạnh hay axit yếu. Với axit đa chức, nếu các chức của axit có pKa
khác nhau quá 4 đơn vị, ta có thể lần lượt trung hòa từng nấc một. Từ giá trị thể tích NaOH ở
mỗi điểm tương đương, ta suy ra nồng độ đương lượng của axit.
Trong bài này ta tiến hành chuẩn dộ hai chức đầu của H3PO bằng dung dịch NaOH chuẩn. Từ 4
đó ta vẽ đường pH = f(V) đường cong này có hai điểm uốn tại hai bước nhảy tương ứng với hai
điểm tương đương đầu. Từ giá trị Vtd ta tính được nồng độ tương đương của H3PO và từ điểm 4
bán tương đương suy ra giá trị pKa và pKa 1 của H 2 3PO . 4
Để việc xác định Vtd được chính xác ta có thể dựa vào:
● Đồ thị ∆𝑝𝐻/∆𝑉 theo Vtd
● Tính ∆2𝑝𝐻/(∆𝑉) . 2
Phương pháp này giúp loại trừ sai số do chất chỉ thị gây ra và có thể xác định được nồng độ axit
của các dung dịch có màu mà phương pháp xác định điểm tương đương bằng chất chỉ thị màu không thực hiện được.
II. TIẾN HÀNH THÍ NGHIỆM.
1. Chuẩn độ dung dịch NaOH ≈ 0,1N bằng dung dịch H2C2O4 0,1N với chất chỉ thị phenolphtalein.
Pha dung dịch H2C2O 0,1N: cân 0,63g axit H 4 2C2O vào beccher 4
Nạp dung dịch NaOH vào buret 25 ml, dùng pipet lấy 10 ml dung dịch axit oxalic 0,1N vào erlen
250ml, thêm vào 3 giọt phenolphtalein. Chuẩn độ bằng NaOH đến khi dung dịch xuất hiện màu
hồng nhạt bền trong 30 giây, ghi thể tích NaOH đã tiêu tốn. Lặp lại thí nghiệm 3 lần, lấy kết quả
trung bình. Từ đó tính ra nồng độ chính xác của NaOH.
2. Chuẩn độ dung dịch H3PO4
Chuẩn thô: dùng pitpet lấy 10ml dung dịch mẫu H3PO cho vào erlen 250ml, thêm 4 vào vài giọt
heliantin, sau đó chuẩn độ bằng dung dịch NaOH đến khi dung dịch từ màu đỏ cam chuyển sang
màu da cam. Ghi nhận thể tích V đã dùng gọi là V NaOH tđ1 gần đúng. Chuẩn tinh:
Hiệu chỉnh máy đo pH với các dung dịch đệm: 7,0; 4,0 và 10,0.
Tiến hành chuẩn độ để biết chính xác nồng độ H3PO4 .
Hút chính xác 10ml dung dịch H3PO cho vào becher 250ml, lắp điện cực của 4 máy đo pH vào,
thêm nước cất đến khi ngập điện cực. Cho cá từ vào và bật máy để khuấy trộn đều dung dịch, để
dung dịch ổn định 30 giây, ghi giá trị pH trên máy khi số đã hiện ổn định. Sau đó, mỗi lần thêm
1ml dung dịch NaOH, ghi giá trị pH ứng với NaOH đã thêm. Cho đến VNaOH = 30ml. + Vtd2 gần đúng ≈ 2Vtd1
+ Rửa sạch điện cực bằng nước cất và ngâm điện cực trong dung dịch KCl có nồng độ thích hợp với điện cực. III. KẾT QUẢ
1. Lượng cân H2C2O4.2H2O = 0.63 g
V1= 10.6ml V2= 10.6ml V3= 10.5ml × C ¿ 0.1 10 =0.095 NaOH N 10.56 2. Bảng số liệu: ∆pH/ ∆²pH/ VNaOH pH Vtb ∆V ∆pH ∆V (∆V)² 0 2.56 1 2.65 0.5 1 0.09 0.09 0.0081 2 2.74 1.5 1 0.09 0.09 0.0081 3 2.86 2.5 1 0.12 0.12 0.0144 4 3.02 3.5 1 0.16 0.16 0.0256 5 3.24 4.5 1 0.22 0.22 0.0484 5.2 3.32 5.1 0.2 0.08 0.4 0.16 5.4 3.39 5.3 0.2 0.07 0.35 0.1225 5.6 3.49 5.5 0.2 0.1 0.5 0.25 5.8 3.6 5.7 0.2 0.11 0.55 0.3025 6 3.74 5.9 0.2 0.14 0.7 0.49 6.1 3.86 6.05 0.1 0.12 1.2 1.44 6.2 3.94 6.15 0.1 0.08 0.8 0.64 6.3 4.03 6.25 0.1 0.09 0.9 0.81 6.4 4.28 6.35 0.1 0.25 2.5 6.25 6.5 4.75 6.45 0.1 0.47 4.7 22.09 6.6 5.13 6.55 0.1 0.38 3.8 14.44 6.7 5.4 6.65 0.1 0.27 2.7 7.29 6.8 5.55 6.75 0.1 0.15 1.5 2.25 6.9 5.67 6.85 0.1 0.12 1.2 1.44 7 5.8 6.95 0.1 0.13 1.3 1.69 7.1 5.82 7.05 0.1 0.02 0.2 0.04 7.2 5.93 7.15 0.1 0.11 1.1 1.21 7.3 6.02 7.25 0.1 0.09 0.9 0.81 7.4 6.07 7.35 0.1 0.05 0.5 0.25 7.5 6.11 7.45 0.1 0.04 0.4 0.16 7.6 6.17 7.55 0.1 0.06 0.6 0.36 7.7 6.24 7.65 0.1 0.07 0.7 0.49 7.8 6.26 7.75 0.1 0.02 0.2 0.04 7.9 6.32 7.85 0.1 0.06 0.6 0.36 8 6.34 7.95 0.1 0.02 0.2 0.04 8.2 6.41 8.1 0.2 0.07 0.35 0.1225 8.4 6.48 8.3 0.2 0.07 0.35 0.1225 8.6 6.55 8.5 0.2 0.07 0.35 0.1225 8.8 6.6 8.7 0.2 0.05 0.25 0.0625 9 6.64 8.9 0.2 0.04 0.2 0.04 10 6.86 9.5 1 0.22 0.22 0.0484 11 7.06 10.5 1 0.2 0.2 0.04 12 7.25 11.5 1 0.19 0.19 0.0361 13 7.45 12.5 1 0.2 0.2 0.04 14 7.69 13.5 1 0.24 0.24 0.0576 15 8.07 14.5 1 0.38 0.38 0.1444 16 8.86 15.5 1 0.79 0.79 0.6241 17 9.73 16.5 1 0.87 0.87 0.7569
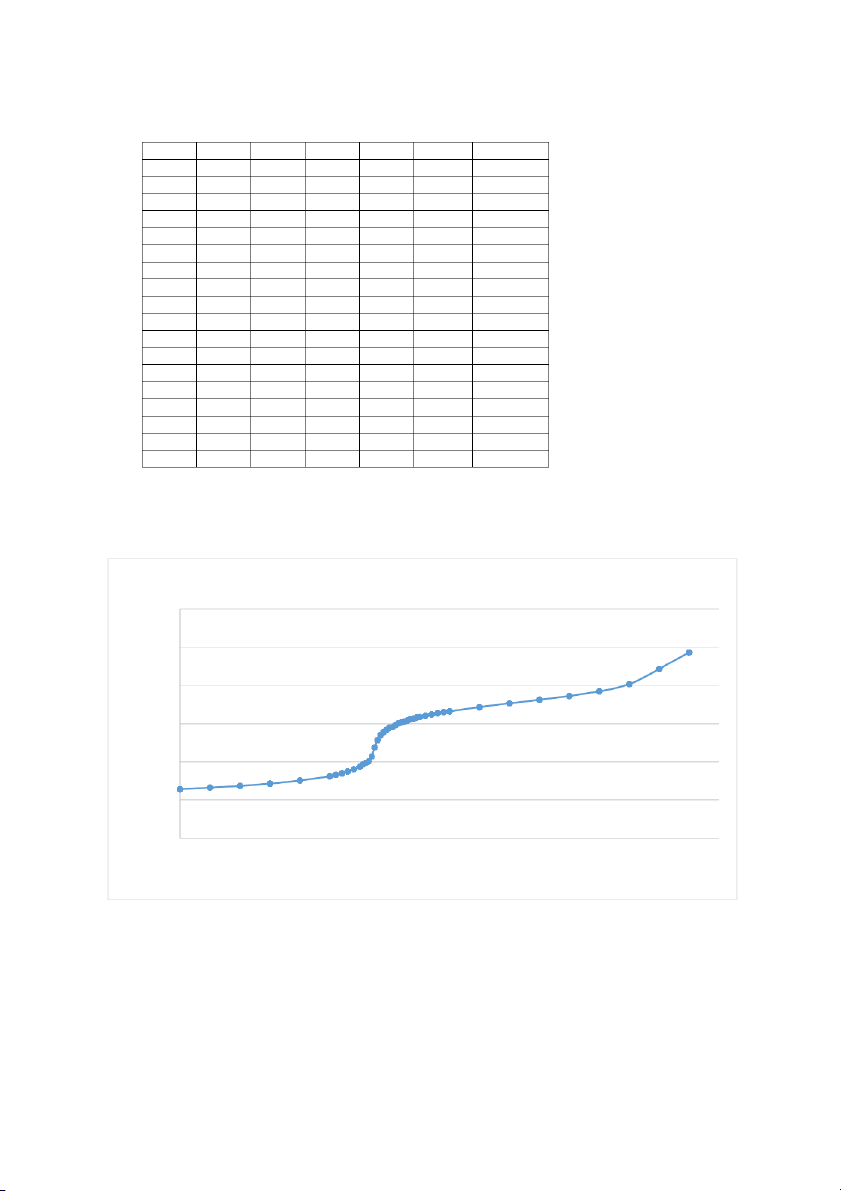
Biểu Diễn Đồ Thị pH = f(V) 12 10 9.73 8 6 pH 4 2 00 2 4 6 8 10 12 14 16 18 VNaOH
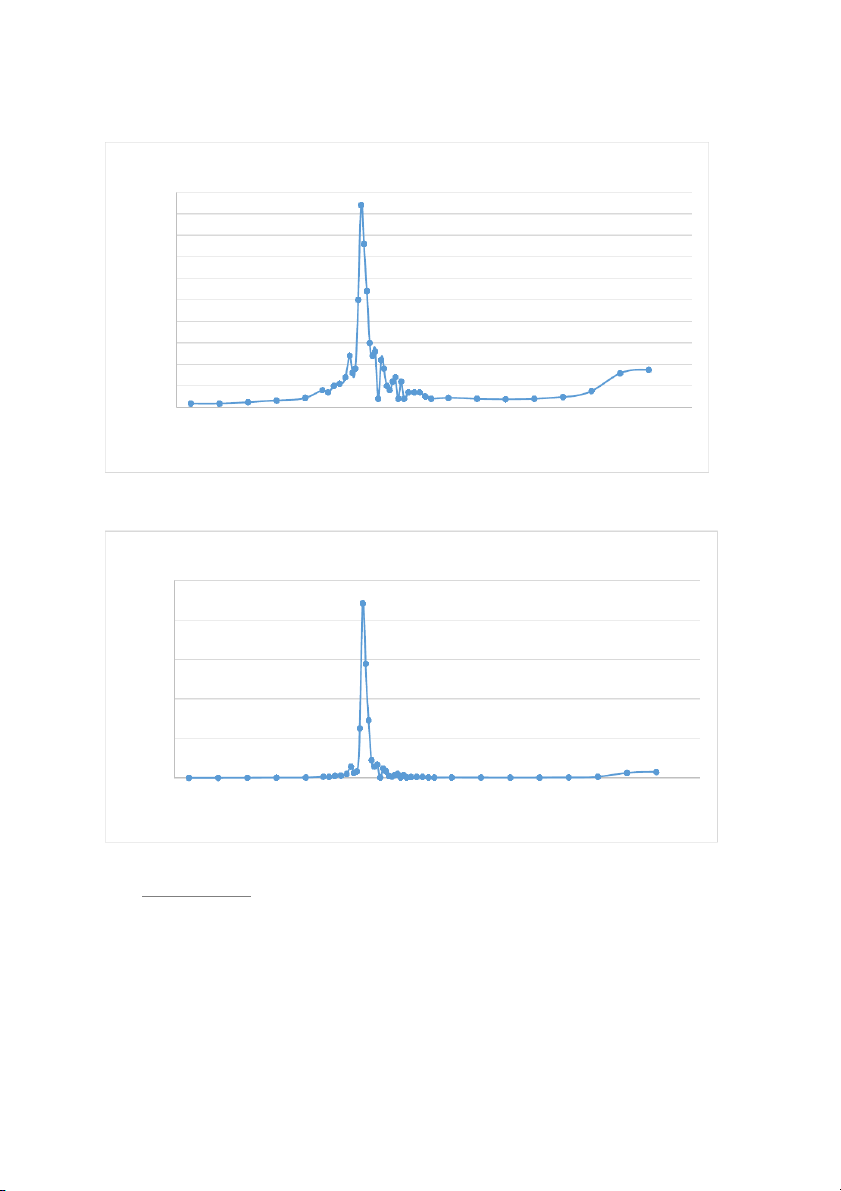
Biểu Đồ Thể Hiện ∆pH/∆V = f(V) 5 4.5 4 3.5 3 V 2.5 /∆ H 2 ∆p 1.5 1 0.870000000000001 0.5 00 2 4 6 8 10 12 14 16 18 Vtb
Đồ Thị Biểu Hiện ∆²pH/(∆V)² = f(V) 25 20 )² 15 V /(∆ H 10 p ∆² 5 0.756900000000002 00 2 4 6 8 10 12 14 16 18 Vtb Tính toán kết quả:
Dựa vào đồ thị ta có
Tại điểm tương đương thứ 1: 22.09 𝑉 = 6.74 𝑚𝑙
𝑡𝑑1 = 6.45 + (6.55 – 6.45) × 22.09−(14.44) 6.74 ×0.095 𝐶𝐻 − = = 0.064 N 2𝑃𝑂4 10 22.09
𝑝𝐻 = 4.03 + (4.28 – 4.03) × = 4.75 22.09−(14.44) 2,78+2,96 𝑝𝐾 = 2,87 𝑎1 = 2 𝐾𝑎1 = 10−2,87
Tại điểm tương đương thứ 2: 1.69
Vtd2 = 6.95 + (7.05 – 6.95) × = 7.05 ml 1.69−0.04 7.05× 0.095 𝐶𝐻𝑃𝑂 2− = = 0.067 N 4 10 1.69
𝑝𝐻 = 6.34 + (6.41 – 6.34) × = 6.41 1.69−0.04 6,44+6,18 𝑝𝐾 = 6,31 𝑎2 = 2 𝐾𝑎2 = 10−6,31
BÀI 6: SẮT KÝ CỘT TRAO ĐỔI ION TÁCH HỖN HỢP METHYL DA CAM VÀ METHYL XANH
A. Định lượng ion Ca2+ trong mẫu nước cứng trước và sau khi qua cột trao đổi cation.
1. Định tính ion Ca2+
Cho vào ống nghiệm khoảng 20 giọt nước cứng ban đầu + 20 giọt dung dịch xà phòng, lắc đều
có kết rủa trắng có Ca2+
2. Định lượng Ca2+
a) Chuẩn độ mẫu trắng
Dùng pipet hút chính xác 10ml nước cất cho vào erlen 250ml +5ml dung dịch NaOH 1M, thếm
một ít chất chỉ thị murexide. Tiến hành chuẩn độ với dung dịch EDTA 0,01M đến khi dung dịch
từ màu đỏ chuyển sang màu tím sen.
Ghi thể tích EDTA đã dùng, Lặp lại thí nghiệm 3 lần, lấy giá trị trung bình. V1=0,5ml V2=0,4ml V = 0,5ml 3 Vtb=0,5 ml
b) Chuẩn độ mẫu nước cứng
Dùng pipet hút chính xác 10ml nước cứng cho vào erlen 250ml + 5ml dung dịch NaOH 1M,
thêm một ít chất chỉ thị murexide. Tiến hành chuẩn độ với dung dịch EDTA 0,01M đến khi dung
dịch từ màu đỏ chuyển sang màu tím sen. Ghi thể tích EDTA đã dùng. Lặp lại thí nghiệm 3 lần, lấy giá trị trung bình.
V1=12,5ml V2= 12,5ml V =12,6ml 3 Vtb= 12,5ml
3. Tiến hành trao đổi ion
a) Chuẩn bị cột trao đổi ion
Cân khoảng 2g nhựa trao đổi cation, ngâm trong nước cất khoảng 10 phút. Cho vào cột (đã lót
bông ở đáy cột ), tạo cột nhựa cao khoảng 15cm. Tránh bọt khí lẫn vào nhựa bằng cách luôn giữ
1 lớp nước trên mặt nhựa. Rửa cột vài lần bằng nước cất. b) Trao đổi cation
Dùng pipet hút chính xác 10ml mẫu nước cứng cho vào cột trao đổi cation. Để yên khoảng 5
phút. Hứng lấy dung dịch qua cột vào erlen 250ml. Chuẩn độ lại ion Ca2+ bằng dung dịch EDTA
0,01M. tính toán hàm lượng ion Ca2+ còn lại trong dung dịch sau khi qua cột. Thể tích EDTA đã dùng: 1,9ml
B. Phân tách hỗn hợp màu methyl da cam và methylen xanh bằng phương pháp sắt ký cột.
1. Chuẩn bị cột sắt ký
- Lắp cột sắt ký, gắn cột vào giá đỡ.
- Cân 5g Al2O3 vào cốc thủy tinh 100ml, cho tiếp 10ml ethanol vào để tạo dạng huyền phù trong
ethanol rồi đổ từ từ đến hết vào cột sắt ký đã lót sắn bông ở đáy. Mở khóa cho dung môi chảy từ
từ xuống và chờ cho cột ổn định.
2. Quá trình tách hỗn hợp bằng sắt ký
- Rót 2ml dung dịch chứa hỗn hợp 2 thuốc thử (dung dịch II) vào cột. Theo dõi hình thành các
vùng có màu cam và màu xanh trong quá trình dung dịch chất màu chảy qua cột sắt ký.
3. Rửa giải từng thành phần trên cột
- Phần methyl da cam được rửa bằng 5ml nước cất vao thu vào ống thủy tinh 100ml.
- Thay cốc thủy tinh khác và rửa bằng ethanol để thu hồi methylen xanh.
- Cô đuổi dung môi để thu được từng chất màu riêng biệt. III. KẾT QUẢ
Nồng độ canxi trong mẫu nước cứng: ( − ) Cca²⁺ =CEDTA× VEDTA 12.5 0.5 × 0.01 = =¿0.012 mol/l VCa ² ⁺ 10
Hàm lượng ion Ca2+ : 0.012 (mol/l) × 40(g/mol) × 1000 = 480 (mg/l)
Nồng độ canxi trong mẫu nước cứng sau khi qua cột trao đổi ion: C CEDTA× VEDTA Ca²⁺ =
= (1.9−0.5)× 0.01 = 0.0014 mol/l VCa ² ⁺ 10
Hàm lượng ion Ca2+ : 0.0014 (mol/l) × 40(g/mol) × 1000 = 56 (mg/l) a
Dung lượng trao đổi ion = ( molđlgCa ² ⁺ ) b g
Trong đó: a là mili đượng lượng ion Ca2+
b là số gam nhựa Cationid ΔVEDTA=12.5 - 1.9= 10.6 ml -3 ∆ V ×C ×1000 × 10 ×
Dung lượng trao đổi ion = = 10.6
0.01 ×1000 = 0.0106 ¿) 2 2 IV. CÂU HỎI
1. Methyl da cam và methylene xanh: A) methyl da cam:
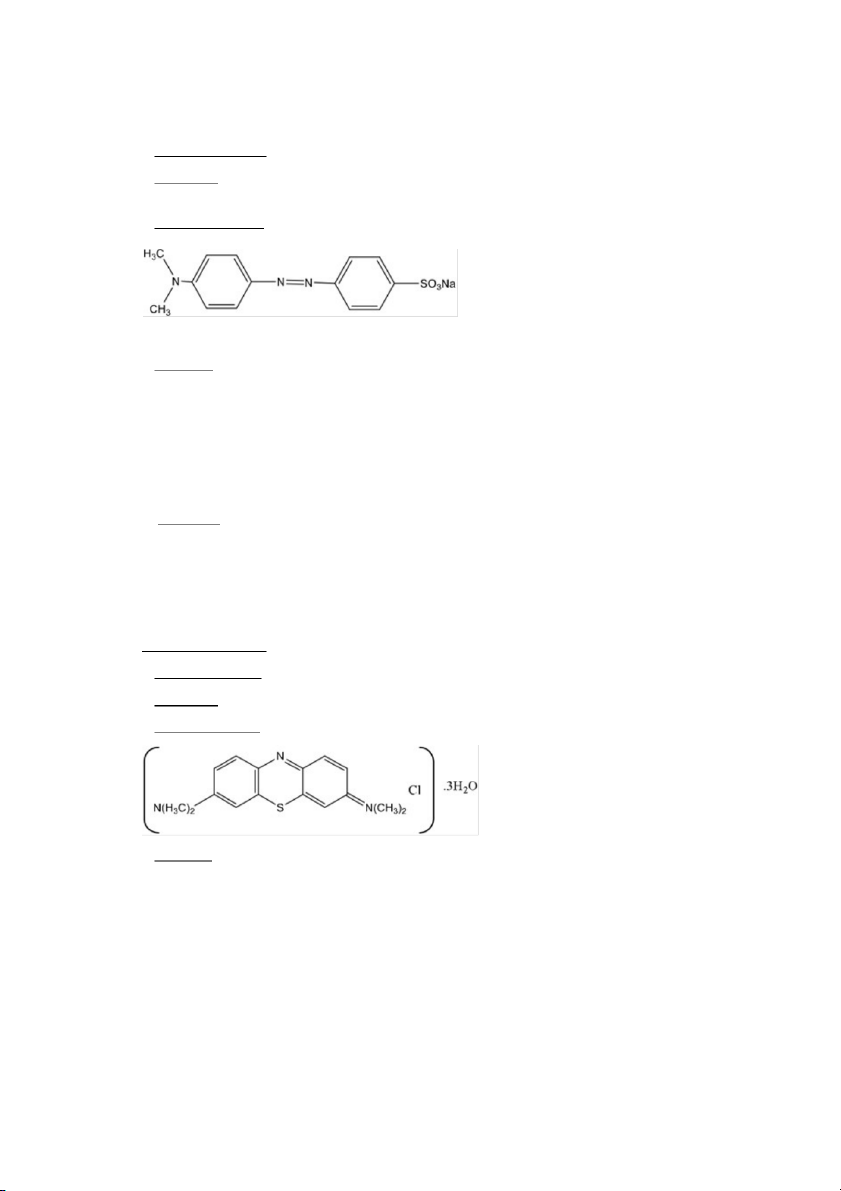
● Công thức phân tử: C14H14O3N SNa 3
● Danh pháp: p-(p-dimetyl aminophenylazo)-benzensulfonate natri; 4-dimetylaminoazobenzen- 4-sulfonate natri; dacan III. ● Công thức cấu tạo : ● Tính chất:
- Dạng rắn lá nhỏ hột màu da cam vàng.
- Tan ít trong nước lạnh (độ tan ≈ 0,2g) tạo dung dịch màu vàng.
- Không tan trong rượu etylic.
- Methyl da cam đổi màu từ đỏ hồng trong môi trường acid sang vàng nhạt trong môi trường bazo ● Ứng dụng:
- Làm chất chỉ thị pH, chuyển màu từ đỏ sang vàng trong khoảng pH=3-4.
- Xác định Sn2+ bằng phương pháp phân tích thể tích( đun nóng làm mất thuốc thử)
- Phát hiện các chất khử mạnh (Ti3+, Cr2+,…) và chất oxi hóa mạnh (Cl , Br 2 ) do các chất này làm 2 chất màu chỉ thị. B) Methylene xanh:
● Công thức phân tử: C16H N 18 SCl.3H 3 O 2
● Danh pháp: 3,9-bis-Dimetylaminophenazothionincrua; Tetrametylen-Thioninclorua trihydrat. ● Công thức cấu tạo: ● Tính chất :
- Tinh thể màu xanh lá cây thẩm có ánh đồng đỏ hoặc là bột nhỏ xanh lá cây thẫm.
- Khó tan trong nước lạnh và rượu etylic, khi đun nóng dễ tan hơn tạo dung dịch màu xanh.
- Không tan trong eter, benzen, CH Cl. Tan trong H 3
2SO đậm đặc cho dung dịch màu vàng nhạt. 4
- Màu xanh lá cây khi tan trong nước thì chuyển sang màu xanh lam.
- Mất màu xanh khi phản ứng với Zn bột hoặc dung dịch iod.
- Dung dịch NaOH làm dung dịch từ màu xanh chuyển sang màu tím. ● Ứng dụng:
- Làm chỉ thị oxi hóa khử.
- Dùng trong phân tích thể tích, phương pháp đo màu xác định thế oxi hóa khử.
- Dùng trong phép soi kính hiển vi và làm chất nhuộm màu trong vi sinh vật học.
2. Ứng dụng của chất hấp phụ oxit nhôm trong hóa phân tích:
- Làm chất hấp phụ, chất xúc tác hoặc chất mang xúc tác.
- Phân tán pha hoạt động của chất xúc tác, tăng diện tích tiếp xúc của pha hoạt động xúc tác với
môi trường, ngăn cản quá trình thiêu kết và tái kết tinh pha hoạt động, tăng độ bền và khả năng
truyền nhiệt của chất xúc tác,…
- Làm pha tĩnh trong kỹ thuật chiếc pha rắn để làm giàu và phân tích ion kim loại nặng trong nước.




