














Preview text:
Đại học Duy Tân Khoa: Khoa học tự nhiên. Tổ chuyên môn: Hóa.
Giảng viên: ThS. Phan Thị Việt Hà. TẬP BÀI GIẢNG
Môn học: Hóa đại cƣơng Mã môn học: CHE 101. Số tín chỉ: 2 trong đó Lý thuyết: 30h Thực hành: không.
Dành cho sinh viên ngành: Kĩ thuật (Xây dựng, công nghệ thông tin, điện tử, môi trƣờng, điều dƣỡng, dƣợc).
Khoa/Trung tâm: Xây dựng, công nghệ thông tin, điện tử, môi trƣờng, y, dƣợc. ậc
đào tạo: ại học, cao đẳng. Học kỳ: I, II Năm học: 2019 - 2020.
PHÂN BỐ GIỜ GIẢNG DẠY: 30 giờ. GIỜ THỨ NỘI DUNG TRANG 1,2,3,4
Chƣơng 1: Nhiệt động hóa học – Nhiệt hóa 3-18 học. 5,6
Chƣơng 2: Chiều và giới hạn của quá trình hóa 19-26 học . 7,8,9,10 Chƣơng 3: ộng hóa học 27-37 11,12,13,14
Chƣơng 4: Cân bằng hóa học – Cân bằng pha 38-52 15,16,17 Chƣơng 5: Dung dịch 53-67 18 Kiểm tra thƣờng kỳ
19,20,21,22,23,24,25,26 Chƣơng 6: Dung dịch điện li 68-86 27,28,29,30
Chƣơng 7: Các quá trình điện hóa 87-103
Giảng viên biên soạn.
Xét duyệt của Trƣởng bộ môn.
Phan Thị Việt Hà
…………………………………………………
…………………………………………………
…………………………………………………
…………………………………………………
Đà nẵng, ngày …. tháng …. năm …
Kết quả kiểm tra tập bài giảng
…………………………………………………
…………………………………………………
…………………………………………………
…………………………………………………
Đà nẵng, ngày …. tháng …. năm …. Phòng Thanh Tra
CHƢƠNG 1: NHIỆT ĐỘNG HÓA HỌC – NHIỆT HÓA HỌC
A – MỤC TIÊU Nhiệt động học ra đời vào giữa thế kỷ XIX. ầu tiên nó đƣợc ứng dụng
trong cơ học. Về sau dần dần phạm vi nghiên cứu của nó đƣợc mở rộng ra các lĩnh vực khác nhƣ điện, quang,…
Từ những điều nói trên chúng ta thấy rằng nhiệt động học cũng phải đƣợc áp dụng vào hóa
học nhƣ đối với cơ học, quang học,… và các quá trình chuyển hóa hóa học cũng là những quá
trình chuyển động của vật chất có kèm theo sự trao đổi năng lƣợng. Việc áp dụng nhiệt động
học vào hóa học làm xuất hiện một lĩnh vực khoa học độc lập mới là nhiệt động hóa học, mà
nội dung của nó là nghiên cứu các quy luật về sự chuyển biến giữa hóa năng và các dạng năng
lƣợng khác, về hiệu ứng nhiệt của các quá trình hóa học, về điều kiện bền vững của các hệ
hóa học và cũng nhƣ về những quy luật thay đổi của chúng để đạt đƣợc trạng thái cân bằng hóa học.
Tóm lại, nhiệt động hóa học cung cấp cho ta những lý thuyết cần thiết để đi sâu nghiên cứu
các vấn đề của hóa học là cấu tạo, tính chất, hành vi của các chất trong những quá trình chuyển
biến hóa học và từ đó có thể điều khiển quá trình hóa học theo ý muốn.
Sau khi học xong chƣơng 1 sinh viên cần phải nắm đƣợc các kiến thức:
- Nghiên cứu sự trao đổi và chuyển hóa năng lƣợng để hiểu đƣợc sự chuyển động của vật chất.
- Hiểu rõ nội dung và ý nghĩa của nguyên lý I, biết vận dụng nguyên lý I nhiệt động
hóa học để giải các bài toán liên quan. Vận dụng định luật Hess trong việc giải
các bài toán xác định hiệu ứng nhiệt.
- Xác định hiệu ứng nhiệt của một phản ứng bằng thực nghiệm.
B – NỘI DUNG
1.1. MỘT SỐ KHÁI NIỆM MỞ ĐẦU
1.1.1. Hệ (nhiệt động)
Hệ là một vật thể hay nhóm vật thể đƣợc nghiên cứu và tách biệt với môi trƣờng xung quanh.
Hoặc phát biểu cách khác: Hệ là tập hợp các vật thể xác định trong không gian nào đó
và phần còn lại xung quanh gọi là môi trƣờng. Ngƣời ta phân biệt:
- Hệ hở (hệ mở): là hệ trao đổi cả vật chất và năng lƣợng với môi trƣờng.
Ví dụ: phản ứng nung vôi (CaCO3 CaO + CO2 ) đƣợc thực hiện trong một lò hở.
Ngoài năng lƣợng trao đổi, khí CO2 liên tục chuyển từ hệ ra môi trƣờng bên ngoài.
- Hệ kín (hệ đóng): là hệ không trao đổi chất mà chỉ có sự trao đổi năng lƣợng với môi trƣờng xung quanh.
Ví dụ: hệ gồm các chất đang cho phản ứng trong một ống thủy tinh hàn kín.
- Hệ cô lập: là hệ không trao đổi cả chất và năng lƣợng với môi trƣờng xung quanh.
Ví dụ: các phản ứng thực hiện trong bình phản ứng kín, cách biệt với môi trƣờng xung
quanh bằng lớp vỏ cách nhiệt.
Ngoài ra hệ có thể là đồng thể hoặc dị thể:
- Hệ đồng thể: là hệ có các tính chất hóa lý giống nhau ở mọi điểm của hệ, nghĩa là trong
đó không tồn tại bề mặt phân chia giữa các phần tử có trong hệ. Còn nếu trong hệ có bề
mặt phân chia giữa các phần tử có trong hệ thì đó là hệ dị thể.
Ví dụ: Hệ gồm muối ăn hòa tan trong nƣớc tạo thành một dung dịch (không chứa các
hạt muối ăn) thì đó là hệ đồng thể. Còn nếu trong hệ, ngoài dung dịch muối ăn còn chứa các
hạt muối ăn thì đó là hệ dị thể.
Pha là phần đồng thể của hệ, có thành phần và tính chất giống hệt nhau đƣợc ngăn cách
với các phần khác của hệ bởi bề mặt phân chia pha. Hệ đồng thể là hệ 1 pha, hệ dị thể là hệ nhiều pha.
Ví dụ: hệ đƣợc tạo bởi nƣớc lỏng và nƣớc đá có 2 trạng thái lỏng và rắn, có 2 pha nƣớc
lỏng và nƣớc đá (rắn). Cốc nƣớc pha dầu có 1 trạng thái lỏng, 2 pha là nƣớc và dầu.
1.1.2. Trạng thái của hệ, thông số trạng thái và hàm trạng thái
- Trạng thái của một hệ là toàn bộ những tính chất lý hoá của hệ. Trạng thái của hệ đƣợc
đặc trƣng bằng các thông số trạng thái nhƣ nhiệt độ (T), áp suất (P), thể tích (V), số mol (n),...
Các thông số trạng thái đƣợc chia thành hai loại:
+ Thông số trạng thái dung độ: là những thông số tỷ lệ với lƣợng chất.
Ví dụ: thể tích, khối lƣợng, số mol.
+ Thông số trạng thái cƣờng độ: là những thông số không tỷ lệ với lƣợng chất.
Ví dụ: nhiệt độ, áp suất, nồng độ.
- Phƣơng trình trạng thái: mô tả tƣơng quan giữa các thông số trạng thái.
Ví dụ: phƣơng trình trạng thái khí lý tƣởng: PV = nRT. - Hàm trạng thái:
Một đại lƣợng đƣợc gọi là hàm trạng thái của hệ nếu biến thiên của đại lƣợng đó chỉ
phụ thuộc vào trạng thái đầu và trạng thái cuối của hệ, không phụ thuộc vào cách tiến hành.
Ngƣợc lại, nếu sự biến đổi của thông số còn phụ thuộc vào cả cách tiến hành của quá
trình thì không đƣợc gọi là hàm trạng thái (đôi khi gọi là hàm quá trình).
Ví dụ: Năng lƣợng là một hàm trạng thái, nhƣng nhiệt và công không phải là hàm trạng thái.
- Quá trình: khi hệ chuyển từ trạng thái này sang trạng thái khác, ta nói hệ đã thực hiện một quá trình.
Nếu sau một số biến đổi, hệ trở về trạng thái đầu thì quá trình đƣợc gọi là vòng (hay
chu trình), ngƣợc lại là quá trình mở.
+ Quá trình xảy ra ở nhiệt độ không đổi (T=const) đƣợc gọi là quá trình đẳng nhiệt.
+ Quá trình xảy ra ở áp suất không đổi (P=const) là quá trình đẳng áp.
+ Quá trình xảy ra ở thể tích không đổi (V=const) là quá trình đẳng tích.
+ Nếu quá trình không trao đổi nhiệt với môi trƣờng, nhƣng có thể trao đổi công (khi
dãn nở) đƣợc gọi là quá trình đoạn nhiệt.
- Quá trình tự diễn biến và quá trình không tự diễn biến
+ Quá trình tự diễn biến là quá trình thực hiện trong hệ không cần có sự can thiệp từ
bên ngoài, nghĩa là không cần tiêu thụ công từ bên ngoài, trái lại khi kết thúc có thể sinh ra công.
+ Quá trình không tự diễn biến là quá trình không thực hiện đƣợc nếu nhƣ không có sự
can thiệp từ bên ngoài, nghĩa là phải tiêu tốn công.
- Quá trình thuận nghịch và quá trình không thuận nghịch
+ Quá trình 1→2 đƣợc gọi là thuận nghịch nếu nhƣ có thể thực hiện đƣợc quá trình
ngƣợc 2→1 đi qua đúng với mọi trạng thái trung gian nhƣ lần đi thuận, sao cho khi hệ trở về
trạng thái đầu thì không còn tồn tại một biến đổi nào trong chính hệ cũng nhƣ môi trƣờng.
+ Quá trình xảy ra không có khả năng trở lại trạng thái ban đầu gọi là quá trình bất thuận nghịch.
Với quá trình bất thuận nghịch, công và nhiệt sinh ra nhỏ hơn quá trình thuận nghịch: Qtn > Qbtn; Atn > Abtn - Năng lượng:
Năng lƣợng là thƣớc đo vận động của chất. Có hai cách chuyển năng lƣợng:
+ Nếu sự chuyển năng lƣợng có liên quan đến sự di chuyển một hệ cơ học thì sự chuyển
năng lƣợng đƣợc thực hiện dƣới dạng công. Kí hiệu: A.
+ Nếu sự chuyển năng lƣợng có liên quan đến việc tăng tốc độ chuyển động của phân
tử ở vật nhận năng lƣợng thì sự chuyển năng lƣợng đƣợc thực hiện dƣới dạng nhiệt. Kí hiệu: Q.
Q, A là hàm quá trình, có đạo hàm riêng là Q, A.
* Quy ƣớc về dấu năng lƣợng trao đổi:
- Hệ thu nhiệt: dấu (+) (Q>0); hệ tỏa nhiệt: dấu (-) (Q<0).
- Hệ nhận công: dấu (+) (A>0); hệ sinh công: dấu (-) (A<0).
1.2. NGUYÊN LÝ I NHIỆT ĐỘNG LỰC HỌC
1.2.1. Nội năng (U)
Là tổng năng lƣợng dự trữ của hệ. Nội năng của hệ bao gồm: -
ộng năng chuyển động của các phân tử, nguyên tử, hạt nhân và electron (tịnh tiến, quay...). -
Thế năng tƣơng tác (hút, đẩy) của các phân tử, nguyên tử, hạt nhân và các electron.
Nội năng là hàm trạng thái (phụ thuộc trạng thái đầu và cuối), vi phân dU của nó là vi phân toàn phần.
Ở trạng thái 1, nội năng của hệ là U1, ở trạng thái 2 nội năng của hệ là U2.
Khi chuyển từ trạng thái 1 sang trạng thái 2 thì U = U2 – U1.
U > 0 nếu nội năng của hệ tăng, U2 > U1.
U < 0 nếu nội năng của hệ giảm, U2 < U1.
Nội năng đƣợc giải phóng ra khi có 1 quá trình hóa học. Ví dụ:
Cu + S CuS giải phóng 11,6 kcal/mol.
2CO + O2 2CO2 giải phóng 134,677 kcal/mol.
1.2.2. Nhiệt lƣợng (Q)
Nhiệt lƣợng là một dạng năng lƣợng do sự chuyển động nhiệt hỗn loạn giữa các tiểu
phân gây nên. Khi biến đổi hệ có khối lƣợng m từ nhiệt độ t1 đến t2 (nhƣ phản ứng hóa học)
cần cung cấp một nhiệt lƣợng Q là: Q = mC(t2 – t1) (cal).
C: nhiệt dung riêng (tỉ nhiệt), đơn vị là cal/g.độ; kcal/g.độ; J/g.độ. 1cal = 4,184J. 1.2.3. Công (A)
Công là thƣớc đo sự chuyển động có trật tự và có hƣớng của các tiểu phân trong hệ.
Hệ nhận công A > 0, hệ sinh công A < 0. A = -Pngoài(V2 – V1).
1.2.4. Nguyên lý I của nhiệt động lực học
ối với mọi hệ nhiệt động đều tồn tại một hàm trạng thái, đƣợc gọi là nội năng U, mà trong
quá trình biến đổi hệ từ trạng thái (1) sang trạng thái (2), biến thiên nội năng ΔU bằng tổng
nhiệt Q và công A trao đổi với môi trƣờng ngoài. ΔU = U2 – U1 = Q + A (1.1)
( ối với quá trình vi phân ta có dU = Q + A)
Nhƣ vậy, nguyên lý I thực chất là định luật bảo toàn năng lƣợng với sự chấp nhận nội năng là một hàm trạng thái.
Từ hệ thức trên, ta thấy đối với hệ cô lập không có sự trao đổi công và nhiệt với môi trƣờng
bên ngoài (Q=A=0) thì ΔU = 0 nghĩa là nội năng của hệ đƣợc bảo toàn.
Xét hệ nhiệt động đơn giản nhất gồm 1 khối khí xác định đựng trong một xilanh đóng
kín bằng một pitong chuyển động tự do: P = Pngoài =const.
Ở trạng thái 1 hệ có nội năng U1, khi cung cấp cho hệ một nhiệt lƣợng Q, nhiệt độ của
hệ tăng, khí giãn nở từ thể tích V1 đến thể tích V2, từ đó hệ thực hiện một công A = -Pngoài
(V2-V1). Hệ chuyển sang trạng thái 2 có nội năng U2 , theo nguyên lý I ta có: ΔU = U2
– U1 = Q + A = Q - P∆V = Q - Pngoài (V2-V1) (1.2)
1.3. NHIỆT ĐẲNG TÍCH, NHIỆT ĐẲNG ÁP
1.3.1. Nhiệt đẳng tích
Nhiệt đẳng tích là nhiệt lƣợng thu vào hay thoát ra của hệ trong quá trình biến đổi đẳng tích (V = const).
Từ (1.2) ta có: U = Q - P∆V, với V = const, suy ra: Qv = U (1.3)
Vậy nhiệt đẳng tích chính bằng sự biến đổi nội năng của hệ.
1.3.2. Nhiệt đẳng áp
Nhiệt biến đổi đẳng áp là nhiệt lƣợng thu vào hay thoát ra của hệ trong quá trình biến
đổi đẳng áp (P = const).
Từ (1.2) ta có : U = Q - P∆V, với P = const, suy ra: Qp = U + P V
Qp = (U2 – U1) + P(V2 – V1) Qp = (U2 + PV2) - (U1 + PV1)
ặt H = U + PV, ta có: Qp = H2 – H1 = H (1.4)
ại lƣợng H đƣợc gọi là entanpi. Vậy nhiệt đẳng áp chính bằng sự biến đổi entanpi của
hệ. Entanpi là hàm trạng thái.
Entanpi thƣờng đƣợc biểu thị bằng kJ/mol (hoặc kcal/mol). Entanpi đƣợc đo ở điều
kiện: T = 298K và P = 1atm đƣợc gọi là entanpi trạng thái chuẩn. Sự biến đổi entanpi ở trạng
thái chuẩn đƣợc kí hiệu là H0298.
1.3.3. Quan hệ giữa nhiệt đẳng tích và nhiệt đẳng áp Từ H = U + PV, ta có: H = (U + PV) = U + P V Qp = Qv + P V Nếu thay: P V = nRT Qp = Qv + nRT (1.5)
Trong đó: n = (số mol khí sản phẩm) - (số mol khí tham gia).
ối với một phản ứng dạng tổng quát: aA(k) +bB(k) → cC(k) + dD(k) n = (c + d) – (a + b)
Nếu Qp > 0 và Qv > 0 thì đây là quá trình (phản ứng) thu nhiệt.
Nếu Qp < 0 và Qv < 0 thì đây là quá trình (phản ứng) tỏa nhiệt.
1.4. Nhiệt hóa học
Nhiệt hoá học là một lĩnh vực của hoá học nghiên cứu về sự biến đổi nhiệt liên quan đến các phản ứng hoá học.
Trong phản ứng hoá học, vì tổng năng lƣợng của các chất tham gia và các chất tạo thành
không bằng nhau, nghĩa là có sự biến đổi năng lƣợng. Sự biến đổi năng lƣợng (toả ra hay hấp
thụ) đƣợc thể hiện dƣới dạng nhiệt năng, quang năng hay điện năng, trong đó nhiệt năng đóng vai trò quan trọng nhất.
1.4.1. Hiệu ứng nhiệt của phản ứng
Hiệu ứng nhiệt của một phản ứng hoá học là lượng nhiệt toả ra hay thu vào khi một mol
chất tham gia vào phản ứng (hay một mol sản phẩm được tạo thành).
+ Hiệu ứng nhiệt phản ứng ở điều kiện đẳng áp bằng biến thiên entanpi của hệ H.
+ Hiệu ứng nhiệt phản ứng ở điều kiện đẳng tích bằng biến thiên nội năng của hệ U. Vậy: -
Những phản ứng toả nhiệt ra môi trƣờng xung quanh nghĩa là làm nóng môi trƣờng xung
quanh gọi là phản ứng toả nhiệt. Trong trƣờng hợp này hệ phản ứng mất nhiệt nên: H < 0.
Ví dụ: phản ứng trung hòa NaOH + HCl NaCl + H2O là phản ứng tỏa nhiệt.
- Những phản ứng lấy nhiệt của môi trƣờng xung quanh, nghĩa là làm lạnh môi trƣờng
xung quanh gọi là phản ứng thu nhiệt, H > 0. Ví dụ:
Phản ứng nhiệt phân CaCO3 CaCO3 CaO + CO2.
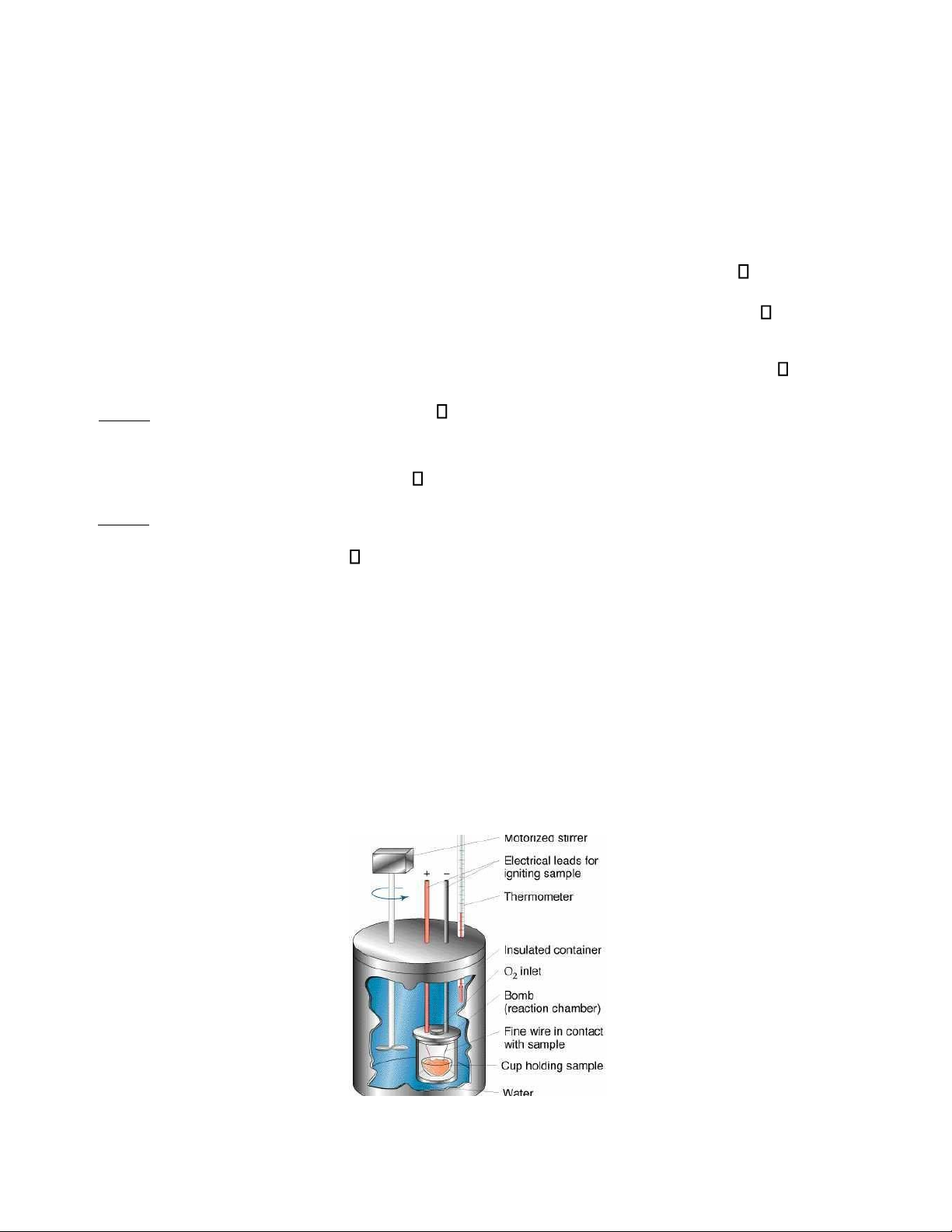
ể xác định hiệu ứng nhiệt phản ứng ngƣời ta dùng nhiệt lƣợng kế (hình 1.1). Nhiệt lƣợng kế
đƣợc thiết kế sao cho không có sự trao đổi nhiệt với môi trƣờng. Nó gồm một thùng lớn đựng
nƣớc, trong đó nhúng ngập một bomb nhiệt lƣợng kế, nơi thực hiện phản ứng hóa học. Trong
thùng còn có nhiệt kế đo sự thay đổi nhiệt độ của nƣớc, que khuấy duy trì cân bằng nhiệt trong
hệ. ể xác định nhiệt đốt cháy của hợp chất hữu cơ, ngƣời ta dùng nhiệt lƣợng kế có bomb đốt
cháy thể tích không đổi trong đó nạp khí oxy áp suất 30atm. Mẫu chất đƣợc đốt cháy bằng
điện, nhiệt thoát ra đƣợc hấp thụ bởi nƣớc và nhiệt lƣợng kế. Nhờ đó ngƣời ta xác định đƣợc
hiệu ứng nhiệt đẳng tích của phản ứng.
Hình 1.1: Nhiệt lƣợng kế đẳng tích.
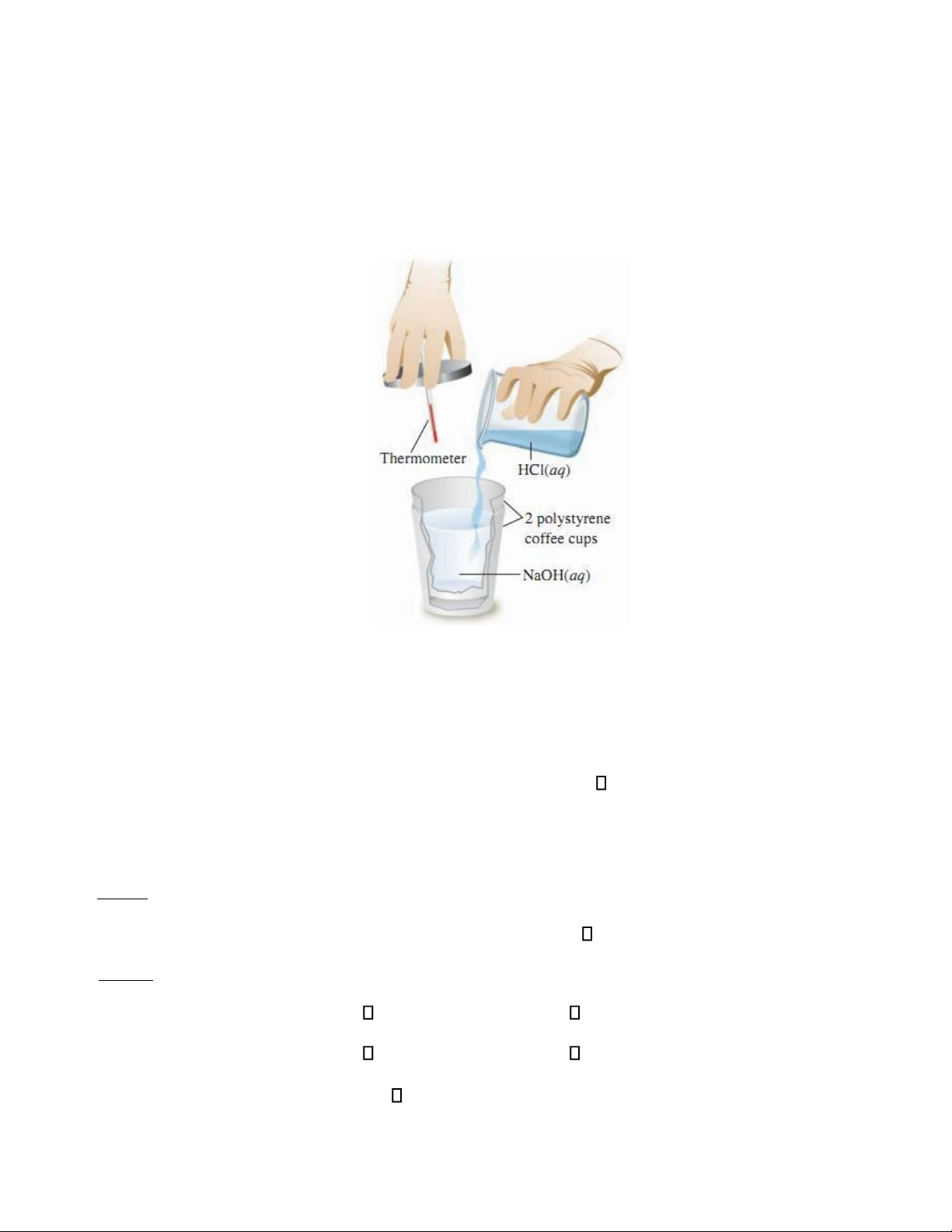
Nhiệt lƣợng kế đẳng áp đƣợc tạo thành từ hai cốc polystyren lồng vào nhau (hình 1.2). Cốc
bên ngoài cách nhiệt phản ứng với môi trƣờng xung quanh. Sau khi các chất phản ứng đƣợc
cho vào cốc bên trong, nhiệt lƣợng kế đƣợc đậy nắp để giảm mất nhiệt ra môi trƣờng bên
ngoài. Nhiệt của phản ứng đƣợc xác định bằng cách ghi lại nhiệt độ đo đƣợc tăng hay giảm
của nhiệt kế so với nhiệt độ ban đầu của các chất lúc chƣa phản ứng.
Hình 1.2: Nhiệt lƣợng kế đẳng áp
* Phương trình nhiệt hoá học là phương trình có ghi thêm nhiệt lượng tỏa ra hay thu
vào và kèm theo trạng thái tập hợp của các chất.
Do hiệu ứng nhiệt phụ thuộc vào nhiệt độ nên để so sánh hiệu ứng nhiệt của các quá
trình, ngƣời ta sử dụng đại lƣợng hiệu ứng nhiệt tiêu chuẩn H0, đó là hiệu ứng nhiệt đƣợc
xác định ở điều kiện chuẩn 250C và 1atm.
Trong phƣơng trình nhiệt hoá học thƣờng ghi cả trạng thái của các chất trong phản ứng. Ví dụ: Cth.chì + O2(k) = CO2(k) H0 = - 94,052kcal.
Chú ý: Khi viết phƣơng trình nhiệt hóa cần chú ý hệ số của phƣơng trình.
CH4(k) + 2O2(k) CO2(k) + 2H2O(k). H = - 802kcal.
2CH4(k) + 4O2(k) 2CO2(k) + 4H2O(k). H = - 1604kcal.
1.4.2. Sinh nhiệt (nhiệt tạo thành) Hs
Sinh nhiệt hay nhiệt tạo thành của một hợp chất là hiệu ứng nhiệt của phản ứng tạo thành
một mol hợp chất đó từ các đơn chất ở điều kiện chuẩn. Ví dụ:
H2(k) + 1/2O2(k) = H2O(k) Hs H O k( 2 )( ) = -57,8 kcal/mol
* Chú ý: Sinh nhiệt của các đơn chất bền ở điều kiện chuẩn bằng 0.
1.4.3. Thiêu nhiệt (nhiệt đốt cháy) Hc
Thiêu nhiệt của một chất là hiệu ứng nhiệt của phản ứng đốt cháy một mol chất đó bằng
oxi vừa đủ để tạo thành oxit bền ở điều kiện chuẩn.
ối với các chất hữu cơ, thiêu nhiệt là hiệu ứng nhiệt của phản ứng đốt cháy hoàn
toàn 1 mol chất đó thành CO2 và hơi nƣớc (hay nƣớc lỏng) và các sản phẩm tƣơng ứng khác.
Ví dụ: CH4 + 2O2 = CO2 + 2H2O
H 0c(CH4 ) = - 212,8 kcal/mol
* Chú ý: ối với các nguyên tố, thiêu nhiệt của một nguyên tố chính là sinh nhiệt của oxit bền của nó.
Ví dụ: Cth.chì + O2(k) = CO2(k) H0 = -94,052 kcal/mol. H0 - Sinh nhiệt của CO2. - Thiêu nhiệt của C.
1.4.4. Nhiệt phân huỷ Hph
Nhiệt phân huỷ của một hợp chất là hiệu ứng nhiệt của phản ứng phân huỷ một mol hợp
chất đó thành các đơn chất bền ở điều kiện chuẩn.
Ví dụ: H2O(l) → H2(k) + 1/2O2(k) H o
ph (H2O,l) = + 285,84 kJ/mol
1.5. ĐỊNH LUẬT HESS VÀ CÁCH XÁC ĐỊNH HIỆU ỨNG NHIỆT PHẢN ỨNG
THEO HỆ QUẢ CỦA ĐỊNH LUẬT HESS
1.5.1. Định luật Hess
Phát biểu: “Hiệu ứng nhiệt của quá trình hóa học chỉ phụ thuộc vào bản chất và trạng
thái của các chất ban đầu và chất sản phẩm mà không phụ thuộc vào cách thực hiện phản ứng”.
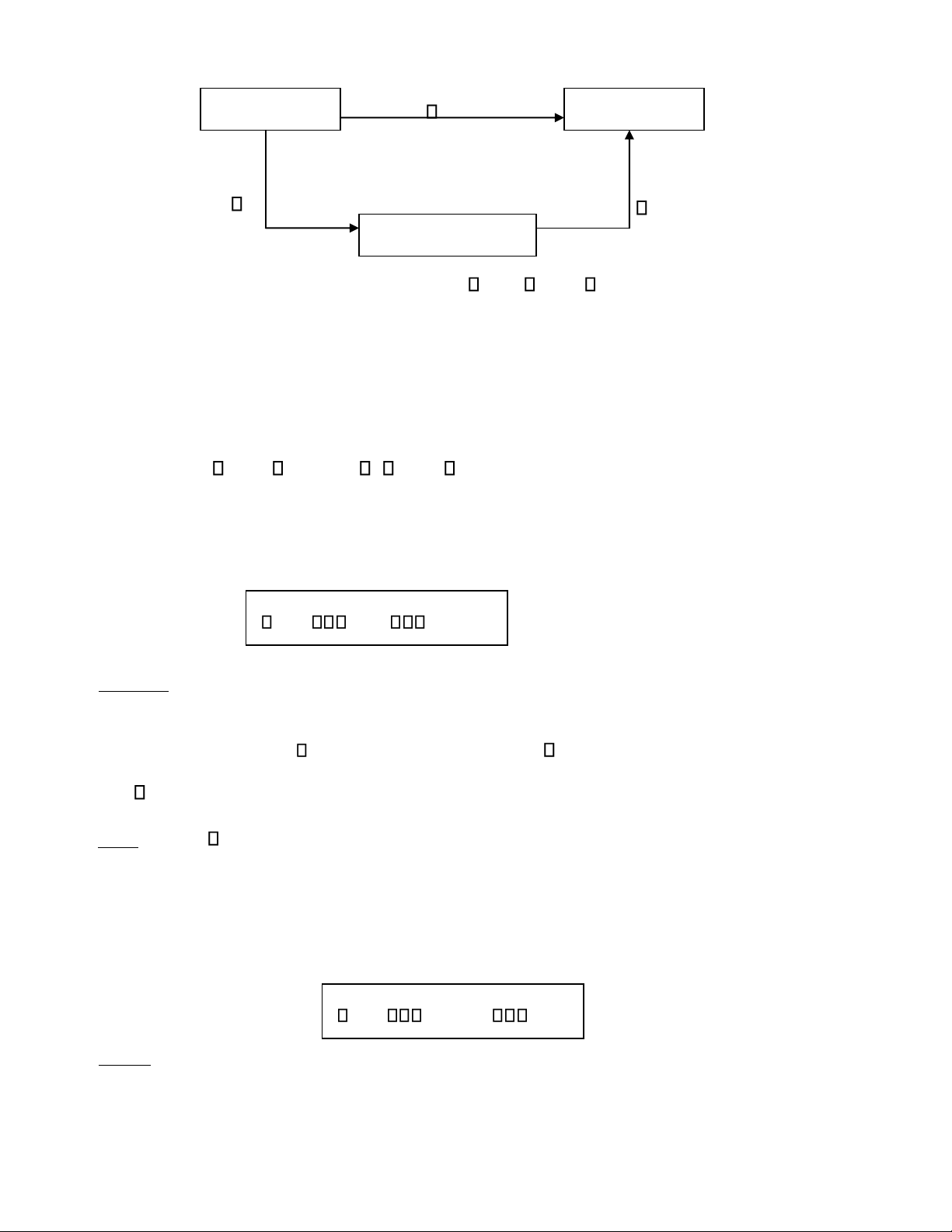
Ví dụ: phân tử CO2 có thể đƣợc tạo thành bằng phản ứng trực tiếp giữa graphit với oxi, hoặc
có thể bằng kết quả của 2 phản ứng trung gian (hình vẽ). C gr + O 2( k ) H 1 CO 2(k ) H 2 H 3 CO (k ) + 1/2O k 2( )
Nhƣ vậy theo định luật Hess, ta có H1 = H2 + H3.
1.5.2. Hệ quả của định luật Hess
1.5.2.1. Hệ quả 1
Hiệu ứng nhiệt của phản ứng thuận bằng hiệu ứng nhiệt của phản ứng nghịch nhƣng ngƣợc dấu. Hth + Hng = 0 Hth= - Hng (1.6)
1.5.2.2. Hệ quả 2
Hiệu ứng nhiệt của một phản ứng bằng tổng nhiệt sinh của các chất sản phẩm trừ đi tổng nhiệt
sinh của các chất tham gia (có kể các hệ số hợp thức của phƣơng trình phản ứng).
(1.7) H298o Hso(sp) Hso(thamgia)
Ví dụ 1: Căn cứ vào giá trị nhiệt tạo thành tiêu chuẩn của CaCO3, CaO, CO2 tìm hiệu ứng nhiệt của phản ứng: CaCO3(r) CaO(r) + CO2(k) H o298 = ? H os -1206,9 -635 -393,5 (kJ/mol) Giải:
H o298 = (-635 – 393,5) + 1206,9 = 177,8 kJ.
1.5.2.3. Hệ quả 3
Hiệu ứng nhiệt của một phản ứng bằng tổng nhiệt cháy của các chất tham gia trừ đi tổng
nhiệt cháy của các chất tạo thành (có kể đến các hệ số hợp thức của phương trình phản ứng). H298o Hco( thamgia) Hco(sp) (1.8)
Ví dụ: Tìm hiệu ứng nhiệt của phản ứng este hóa sau đây căn cứ vào nhiệt đốt cháy của các chất đã cho:
CH3COOH(l) + C2H5OH(l) CH3COOC2H5(l) + H2O(l) H o298 = ? H oc
-871,69 -1366,91 -2284,05 0 (kJ/mol) Giải:
H o298 = -871,69 – 1366,91 + 2284,05 = +45,45 kJ.
1.5.3. Sự phụ thuộc của hiệu ứng nhiệt vào nhiệt độ
Nhiệt dung phân tử đẳng áp (Cp) là lƣợng nhiệt cần thiết để nâng nhiệt độ của một mol
chất nguyên chất lên 1K ở điều kiện áp suất không đổi (P = const) và trong khoảng nhiệt độ
đó không xảy ra sự chuyển pha. ΔCp = d H d( H) = ΔCpdT dT
Khi nhiệt độ của phản ứng biến đổi từ T1 đến T2 thì H biến thiên trong khoảng nhiệt độ đó là T2 T2 T2 d( H) = Cp dT H2 - H1 = Cp dT T1 T1 T1 T 2 H2 = H1 +
Cp dT (1.9) ( iểu thức của định luật Kirchhoff) T 1
Trong đó: Cp = Cp(sp) - Cp(thamgia) là biến thiên nhiệt dung đẳng áp của hệ.
Cp thƣờng là hàm của nhiệt độ, Cp = f(T) và thứ nguyên là J/mol.độ.
Trong trƣờng hợp khoảng nhiệt độ từ T1 đến T2 không lớn thì Cp = const, do đó ta có: (1.10) H2 = H1 + Cp (T2 – T1) Ví dụ: Tính biến thiên H ở 398K của phản ứng CO + 1/2O2 CO2
iết ở 2980K phản ứng có H = -281833J/mol và Cp của CO, O2 và CO2 tƣơng ứng là: 29,041; 29,375; 37,333 J/mol.K.
Giải: iến thiên nhiệt dung đẳng áp:
Cp = 37,333 – (29,041 + . 29,375) = -6,395J/K.
Ta có H2 = H1 + Cp (T2 – T1).
= -281833 - 6,395(398-298) = 282472,5J= 282,4725kJ
1.5.4. Xác định hiệu ứng nhiệt phản ứng dựa vào năng lƣợng liên kết
Phản ứng hóa học xảy ra với sự phá vỡ liên kết giữa các nguyên tử trong phân tử của các chất
tham gia phản ứng và tạo thành liên kết mới giữa các nguyên tử trong phân tử của các chất tạo thành.
Hiệu ứng nhiệt phản ứng bằng tổng năng lƣợng liên kết có trong các chất ban đầu trừ tổng
năng lƣợng liên kết có trong các sản phẩm (có kể đến các hệ số hợp thức của phương trình phản ứng). (1.11)
H Elk thamgia( ) Elk sp( ) (1.11)
Ví dụ: Tìm H của phản ứng sau CH3CH2OH H2O + CH2 = CH2
iết EC-H = 418,4kJ/mol; EC-C = 343,4kJ/mol; EC-O = 351,1kJ/mol; EO-H = 462,3kJ/mol; EC=C = 597,7kJ/mol; Giải:
H0 = (5EC-H + EC-C + EC-O + EO-H) - (2EO-H + 4EC-H + EC=C )
= (5×418,4 + 343,4 +351,1 + 462,3) - (2×462,3 + 4×418,4 + 597,7) = 52,9kJ/mol BÀI TẬP CHƢƠNG 1
* Câu hỏi trắc nghiệm
1. Chọn phát biểu đúng:
A. Biến thiên của hàm trạng thái chỉ phụ thuộc trạng thái đầu.
B. Biến thiên của hàm trạng thái chỉ phụ thuộc trạng thái cuối.
C. Biến thiên của hàm trạng thái phụ thuộc vào cách tiến hành quá trình.
D. Biến thiên của hàm trạng thái phụ thuộc vào trạng thái đầu và trạng thái cuối, không phụ
thuộc vào cách tiến hành quá trình
2. Từ các giá trị ΔH ở cùng điều kiện của các phản ứng
(1) As2O3(r) + O2(k) → As2O5(r) H = -260,68kJ
(2) 3As2O3(r) + 2O3(k) → 3As2O5(r) H = -1067,97 kJ
hãy tính H ở cùng điều kiện đó của phản ứng sau: 3/2 O2(k) → O3(k) A. H = 285,93 kJ B. H = -142,965 kJ C. H = 142,965 kJ D. H = -285,93 kJ
3. Nhiệt sinh của CO2(k) là -393,5kJ/mol. Thiêu nhiệt của carbon (graphit) bằng bao nhiêu? A. 0 B. +393,5kJ/mol C. -393,5kJ/mol D. Một trị số khác. 4. Cho các phản ứng sau; 1. CO(k) + 1/2O2(k) CO2(k) 2. 2C(gr) + O2(k) 2CO(k)
3. CH4(k) +2O2(k) CO2(k) + 2H2O(l) 4. C(gr) + O2(k) CO2(k)
Những phản ứng có H < U là
A. (1) và (2) B. (3) và (4) C. (2) và (3) D. (1) và (3) * Bài tập
1. Tính hiệu số giữa nhiệt phản ứng đẳng áp và đẳng tích của các phản ứng sau đây xảy ra ở 00C: a) C H2 4( )k
3O2( )k 2CO2( )k 2H O2 ( )k b) C H OH2 5 ( )l
3O2(k) 2CO2(k) 3H O2 (k)
2. Hãy tính nhiệt phản ứng đẳng áp của các phản ứng sau ở 250C:
a) PbO( )r S( )r 3O2( )k PbSO4( )r Qv = -686,2kJ 2
b) 2CO(k) O2(k) 2CO2(k) Qv = -563,0kJ
3. Xác định hiệu ứng nhiệt của quá trình:
C(than chì – rắn) → C(kim cƣơng – rắn) ΔH = ? iết: C(than chì – rắn) +
O2(khí) → CO2(khí) ΔH1 = -393,51kJ.
C(kim cƣơng – rắn) + O2(khí) → CO2(khí) ΔH2 = -395,41kJ.
4. Xác định hiệu ứng nhiệt đốt cháy một mol metan theo phản ứng: CH4(k) + 2O2(k) = CO2(k) + 2H2O(l)
Nếu biết hiệu ứng nhiệt tạo thành tiêu chuẩn của các chất CH4(k), CO2(k) và H2O(l) lần lƣợt
bằng: -74,85; -393,51; -285,84 (kJ/mol). A. –604,5 kJ B. 890,34 kJ C. –890,34 kJ D. 604,5 kJ.
5. Từ các giá trị H ở cùng điều kiện của các phản ứng:
(1) 2SO2(k) + O2(k) 2SO3(k) H = -196 kJ (2) 2S(r) + 3O2(k) 2SO3(k) H = -790 kJ
Hãy tính giá trị H ở cùng điều kiện của phản ứng sau : (3) S(r) + O2(k) SO2(k) A. H = -594 kJ B. H = -297 kJ C. H = -398 kJ D. H = -493 kJ
6. Tính H của phản ứng sau: CH4(k) + Cl2(k) CCl4(l) + 4HCl(k) dựa vào các dữ kiện sau:
C(graphit) + H2(k) CH4(k) H = -74,9 kJ C(graphit)
+ 2Cl2(k) CCl4(l) H = -139,0 kJ
H2(k) + Cl2(k) HCl(k) H = -92,3 kJ
7. Tính H phản ứng: 5 C(r) + 6 H2(k) C5H12(l) Dùng các phản ứng với ∆H cho sẵn sau
5H12(l) + 8 O2(k) 5 CO2(k) + 6 H2O(k) H = –3505,8 kJ
C(r) + O2(k) CO2(k) H = –393,5 kJ
2 H2(k) + O2(k) 2 H2O(k) H = –483,5 kJ
8. Tính hiệu ứng nhiệt phản ứng ( H o 298 ) từ các dữ kiện:
Al2O3(r) + 3SO3(k) Al2(SO4)3(r) H o 298 ,tt
-399,09 -94,45 -820,98 kcal/mol
9. Tìm hiệu ứng nhiệt của phản ứng:
Fe2O3(r) + 2Al 2Fe(r) + Al2O3(r) iết nhiệt tạo thành ( Htt) của Fe2O3
= - 196,30kcal/mol, của Al2O3 = -399,09 kcal/mol.
10. Tính hiệu ứng nhiệt của phản ứng:
C2H4(k) + H2(k) C2H6(k). Từ các dữ kiện sau:
a/ Nhiệt tạo thành tiêu chuẩn của C2H4(k), C2H6(k) lần lƣợt là: +12,5kcal/mol; -20,24 kcal/mol
b/ Nhiệt đốt cháy tiêu chuẩn của C2H4(k), H2(k), C2H6(k) lần lƣợt là: -337,3kcal/mol; 372,86kcal/mol; 68,3kcal/mol.
11. Chất nổ nitroglycerin (C3H5N3O9) phân hủy nhanh khi đƣợc kích nổ hoặc va chạm bất
ngờ theo phƣơng trình đã cân bằng sau:
4 C3H5N3O9 (l) 12 CO2(k) + 10 H2O(k) + 6 N2(k) + O2(k) H0 5678kJ
Tính enthalpy tạo thành chuẩn của nitroglycerin. Biết H 0 tt CO , 2( )k 393,5kJ và Htt0,H O( )2k 241,8kJ
12. Những túi làm lạnh tức thời, thƣờng đƣợc dùng cho các chấn thƣơng thể thao trên sân,
chứa amonium nitrate và nƣớc đƣợc ngăn bởi một vách ngăn mỏng bằng nhựa. Khi vách
ngăn bị phá vỡ, amonium nitrate tan ra theo phản ứng thu nhiệt sau: NH + –
4NO3(r) NH4 (aq) + NO3 (aq)
ể đo biến thiên enthalpy cho phản ứng này, 1,25 g NH4NO3 đƣợc hòa tan trong nƣớc để tạo
thành 25 ml dung dịch. Nhiệt độ ban đầu là 25,80C và nhiệt độ cuối cùng (sau khi chất rắn tan
ra) là 21,90C. Tính biến thiên enthalpy cho phản ứng theo kJ. (Dùng khối lƣợng riêng của
dung dịch là 1.0 g/mL và nhiệt dung riêng là 4.18 J/g.0C.
13. Cho phản ứng: C(r) + O2(k) CO2(k). iết Chất
H298o ,s (kJ.mol-1) C op (J.K-1.mol-1) C(r) 0 8,64 O2(k) 0 29,36 CO2(k) -393,51 37,13
Tính hiệu ứng nhiệt ở 25oC và 300oC. 14. Ở 250C phản ứng 1 2
Pb O PbO H; 221,5kJ 2
iết rằng nhiệt dung mol (tính ra J/mol.K) của Pb, O2, PbO lần lƣợt bằng 27,7; 29,4 và 48,5.
Hãy tính H khi phản ứng xảy ra ở 1500C.
15. Viết phƣơng trình nhiệt hóa của phản ứng Fe2O3(r) + 3CO(k) = 2Fe(r) + 3CO2(k)
iết rằng khi khử 52,23g Fe2O3 bằng CO có thoát ra 2,25kcal nhiệt lƣợng trong điều kiện đẳng áp.
16. Khi cho 32,69g Zn tác dụng với dung dịch H2SO4 loãng trong điều kiện đẳng tích ở
250C, ngƣời ta thấy thoát ra 17,10kcal. Tìm hiệu ứng nhiệt đẳng tích và hiệu ứng nhiệt đẳng
áp. Cho R = 1,987.10-3kCal/mol.K.
17. Ở 250C, 1atm; 2,1g bột Fe kết hợp với lƣu huỳnh tỏa ra 0,87kcal trong điều kiện đẳng áp.
Tính nhiệt phân hủy của FeS.
18. Tính H0 của phản ứng : CaCO3(r) = CaO(r) + CO2(k) ở 1100K và 1200K? Cho biết: H 0 0
298 ,s (KJ/mol) CP (J/K.mol) CaO(r) -635,09
48,83 + 4,52.10-3.T + 6,53.105T-2 CaCO3(r) -1206,87
104,52 + 21,92.10-3T – 25,94.105T-2
CO2(k) -393,51 28,66 + 35,7.10-3T
19. Khi đốt cháy 2,61gam CH3OCH3 ở áp suất xác định thì lƣợng nhiệt thoát ra là 82,5kJ.
Xác định H của phản ứng sau: CH OCH3 3(r) 3O2(k) 2CO2(k) 3H O2 ( )l
20. Cho các phản ứng và các dữ liệu nhiệt động nhƣ sau
C(graphite) + O2(k) → CO2(k) ΔH = -393,5kJ H2(k) + 1/2O2(k) → H2O(l) ΔH = -285,8kJ
2C2H2(k) + 5O2(k) → 4CO2(k) + 2H2O(l) ΔH = -2598,8kJ Tính nhiệt sinh của acetylene
2C(graphite) + H2(k) → C2H2(k) 21. Cho các phản ứng sau: 2 NO(k) + O2(k)
2 NO2(k) ΔH° = -173 kJ
2 N2(k) + 5 O2(k) + 2 H2O(l) 4 HNO3(aq) ΔH° = -255kJ N2(k) + O2(k) 2 NO(k) ΔH° = +181 kJ
Tính ΔH° của phản ứng sau 3 NO2(k) + H2O(l)
2 HNO3(aq) + NO(k) ΔH° = ?
22. iết S( )r O2( )k SO2( )k ; H o -296,1 kJ
2SO3(k ) 2SO2(k ) O2(k) ; H o 198 kJ
Tính ΔH0 của phản ứng: 2S( )r 3O2( )k 2SO3( )k
23. Tính ∆H0 của phản ứng sau: W(r) + C(gr) WC(r)
Sử dụng những phản ứng sau với các giá trị ∆H0 đã cho: 0 = -393,5 kJ C(gr) + O2(k) CO2(k) ∆H 0 = -1685,8 kJ 2W(r) + 3O2(k) 2WO3(r) ∆H 2WC(r) + 5O2(k) 2WO3(r) + 2CO2(k) ∆H0 = -2391,8 kJ
24. Tính ∆H0 của phản ứng sau: 4Al(r) + 3MnO2(r) 2Al2O3(r) + 3Mn(r)
Sử dụng những phản ứng sau với các giá trị ∆H0 đã cho: 2Al(r) + 3/2O2(k) Al2O3(r) ∆H0= -1676 kJ Mn(r) + O2(k) MnO2(r) ∆H0= -520 kJ
C - HÌNH THỨC VÀ PHƢƠNG PHÁP DẠY-HỌC
- Giảng viên giảng dạy theo phƣơng pháp thuyết trình, hỏi - đáp.
- Yêu cầu sinh viên trƣớc khi đến lớp phải đọc bài trƣớc ở nhà.
- Sinh viên trả lời các câu hỏi và làm bài tập do giảng viên đƣa ra tại lớp và tự nghiên cứu
những nội dung tham khảo thêm do giảng viên phân công.
D - TÀI LIỆU THAM KHẢO
- Hóa học đại cƣơng – Nguyễn ức Chung – NX H Quốc gia TP HCM – 2002.
- ài tập và trắc nghiệm hóa đại cƣơng – Nguyễn ức Chung – NX H Quốc gia TP HCM – 2002.
- Hóa đại cƣơng – ào Hùng Cƣờng - NX KH và Kĩ thuật Hà Nội – 2006.
- ài tập hóa đại cƣơng - Lê Mậu Quyền – NX Giáo dục - 2006.
- Hóa đại cƣơng – Nguyễn ình Soa - NX H Quốc gia TP HCM – 2007




