





Preview text:
HYDROCACBON THƠM (1)
(AROMATIC HYDROCARBONES) 1. Khái niệm 2. Danh pháp 2. Cấu trúc 2. Điều chế 1. KHÁI NIỆM
❖ Khái niệm Hợp chất thơm
Hợp chất được gọi là “thơm” là do các chất đầu tiên người ta
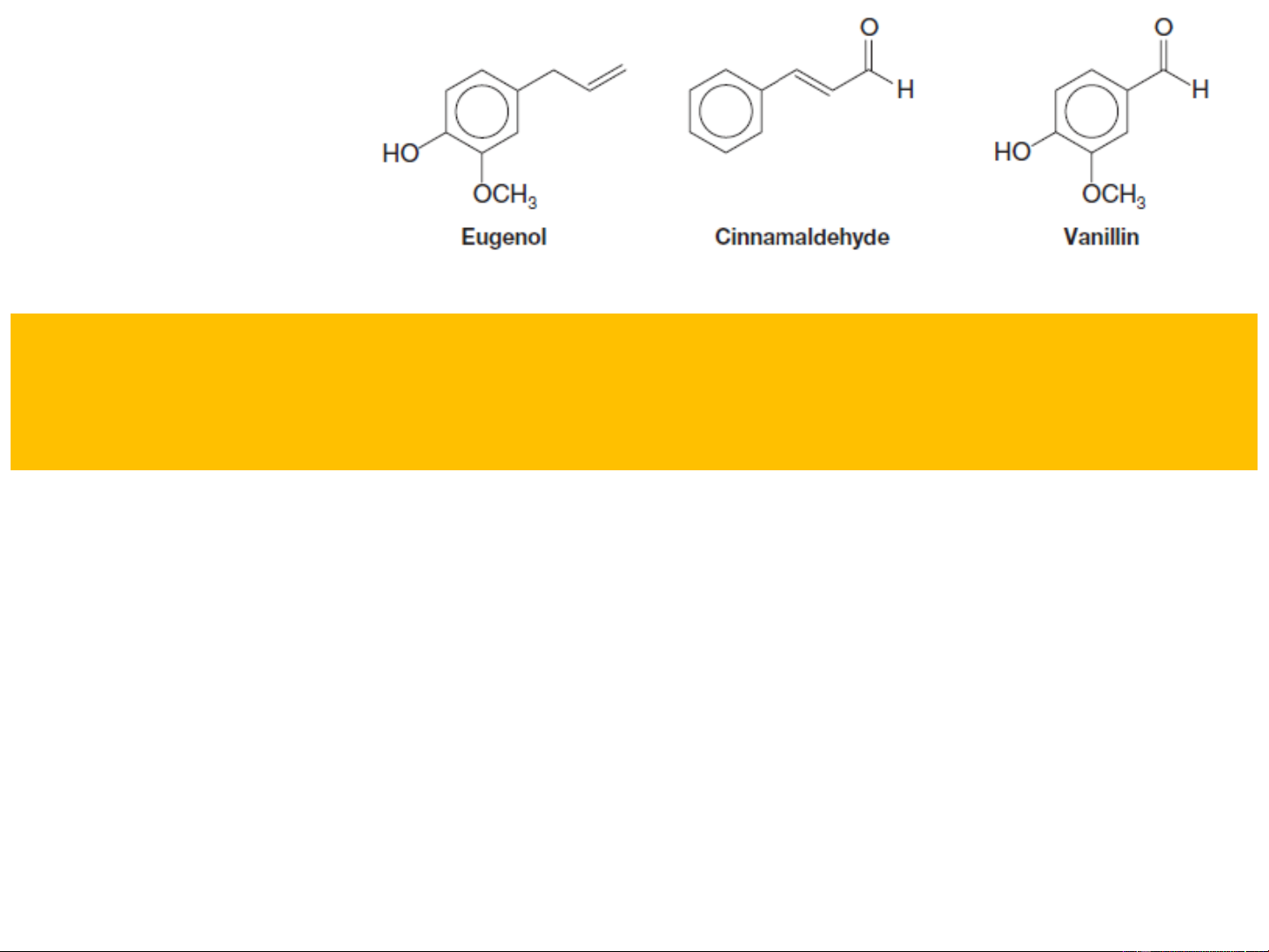
biết về dãy này thực sự có mùi thơm. CH2-OH Ancol benzylic có trong tinh dầu hoa hồng CH Este benzylaxetat có 2COOCH3 trong tinh dầu hoa nhài
CH=CH-CH2-OH Ancol cinnamic có trong tinh dầu hoa dạ hương
Có trong tinh dầu: đinh hương quế vanilla
Hợp chất thơm là các hợp chất mạch vòng, có cấu trúc
electron đặc biệt và là những hợp chất hữu cơ có tính thơm.
Hợp chất có tính thơm là hợp chất có những đặc điểm sau đây:
- Tính bền vững của vòng về mặt nhiệt động, đặc trưng bởi năng
lượng thơm hóa Ep.
- Dễ tham gia phản ứng thế ở nhân thơm, Khó tham gia phản
ứng cộng và phản ứng oxy hóa;
- Phản ứng thế xảy ra có quy luật; các nhóm thế ở vòng có ảnh
hưởng rất đặc trưng đến tính chất hóa học của hợp chất.
Hợp chất thơm là các hợp chất mạch vòng, có cấu trúc
electron đặc biệt và là những hợp chất hữu cơ có tính thơm.
Về mặt cấu trúc, hợp chất phải có những điều kiện sau để có tính thơm :
- Là hệ vòng liên hợp kín giải toả electron p trên toàn hệ thống;
- Vòng thơm phải có cấu trúc phẳng, không nhất thiết
giống benzen (có thể là đa vòng thơm hoặc dị vòng thơm);
- Các electron p phải cặp đôi và số electron p phải thoả
mãn quy tắc của Hückel là quy tắc được thiết lập dựa trên
phương pháp hóa lượng tử). ❖ Phân loại
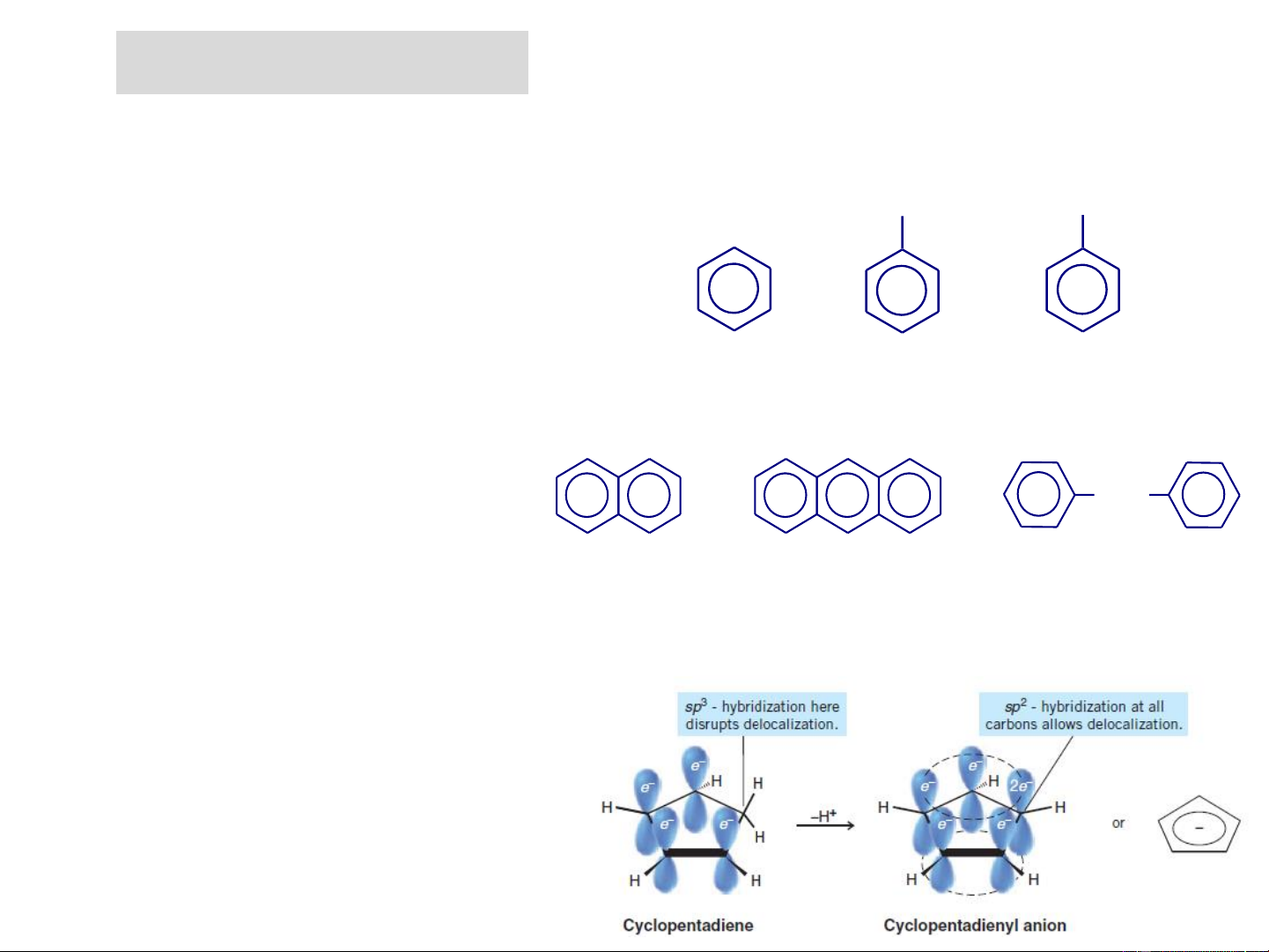
+ Hydrocacbon thơm có chứa vòng benzen; - Hydrocacbon dãy benzen CH CH = CH 3 2 Benzen Toluen Stiren Benzene Toluene Styrene - Hydrocacbon đa nhân thơm CH2 Naphtalen Anthraxen Diphenylmetan
+ Hydrocacbon thơm không chứa
vòng benzene: là các hợp chất
đơn vòng nhưng số electron p
thoả mãn công thức Hückel, do có
(4n+2) electron p giải toả trên một
vòng phẳng nên các hợp chất này đều có tính thơm.
2. Danh pháp của benzen và đồng đẳng
Benzen (C H ) là tên riêng IUPAC lưu dùng 6 6
Các hydrocacbon đơn vòng khác được gọi tên như dẫn xuất
của benzen: tên nhóm thế + benzen
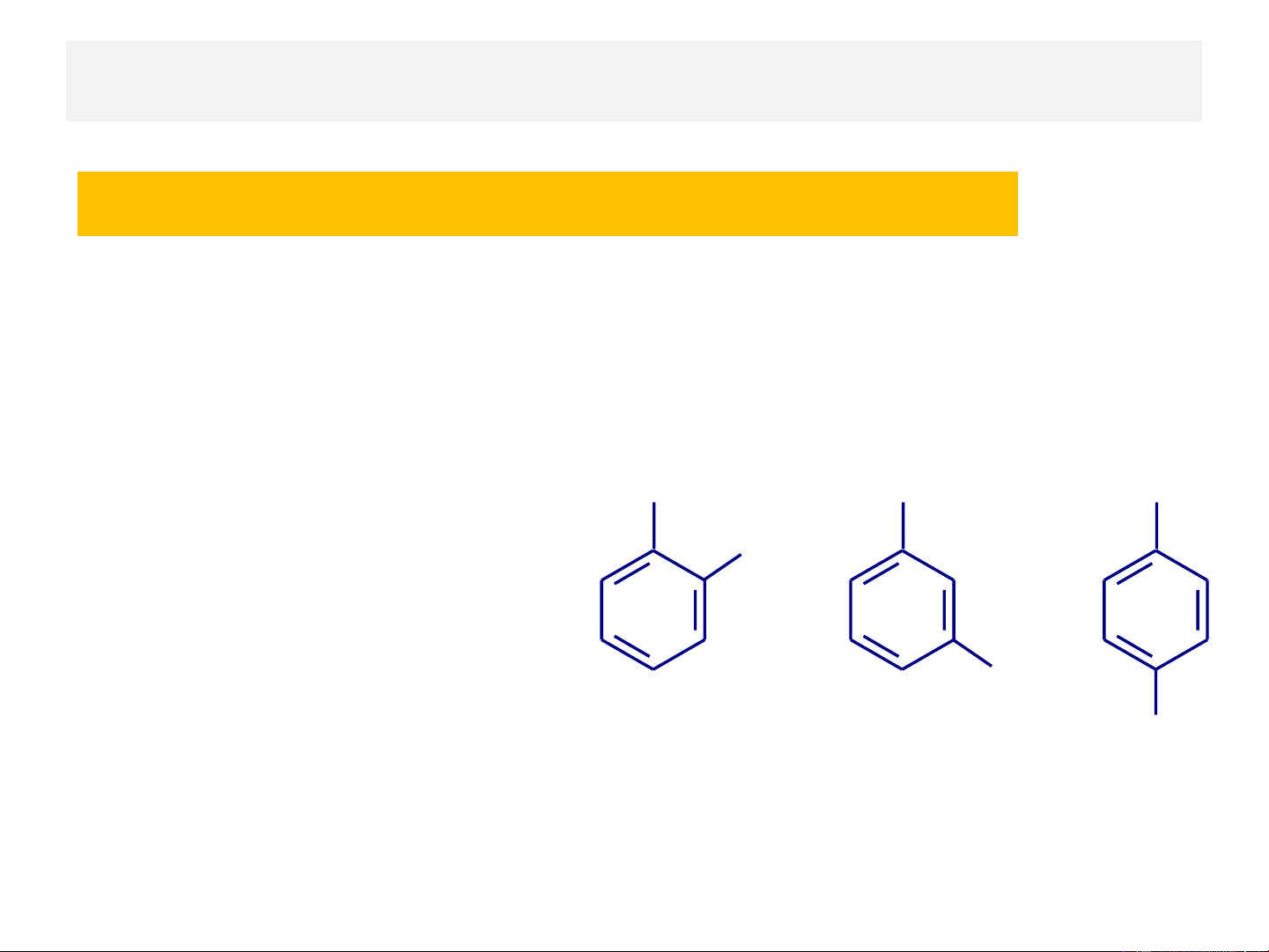
Trong trường hợp vòng
benzen có từ hai nhóm thế X X X
trở lên sẽ xuất hiện đồng 1 Y 1 1
phân vị trí nhóm thế 2 3
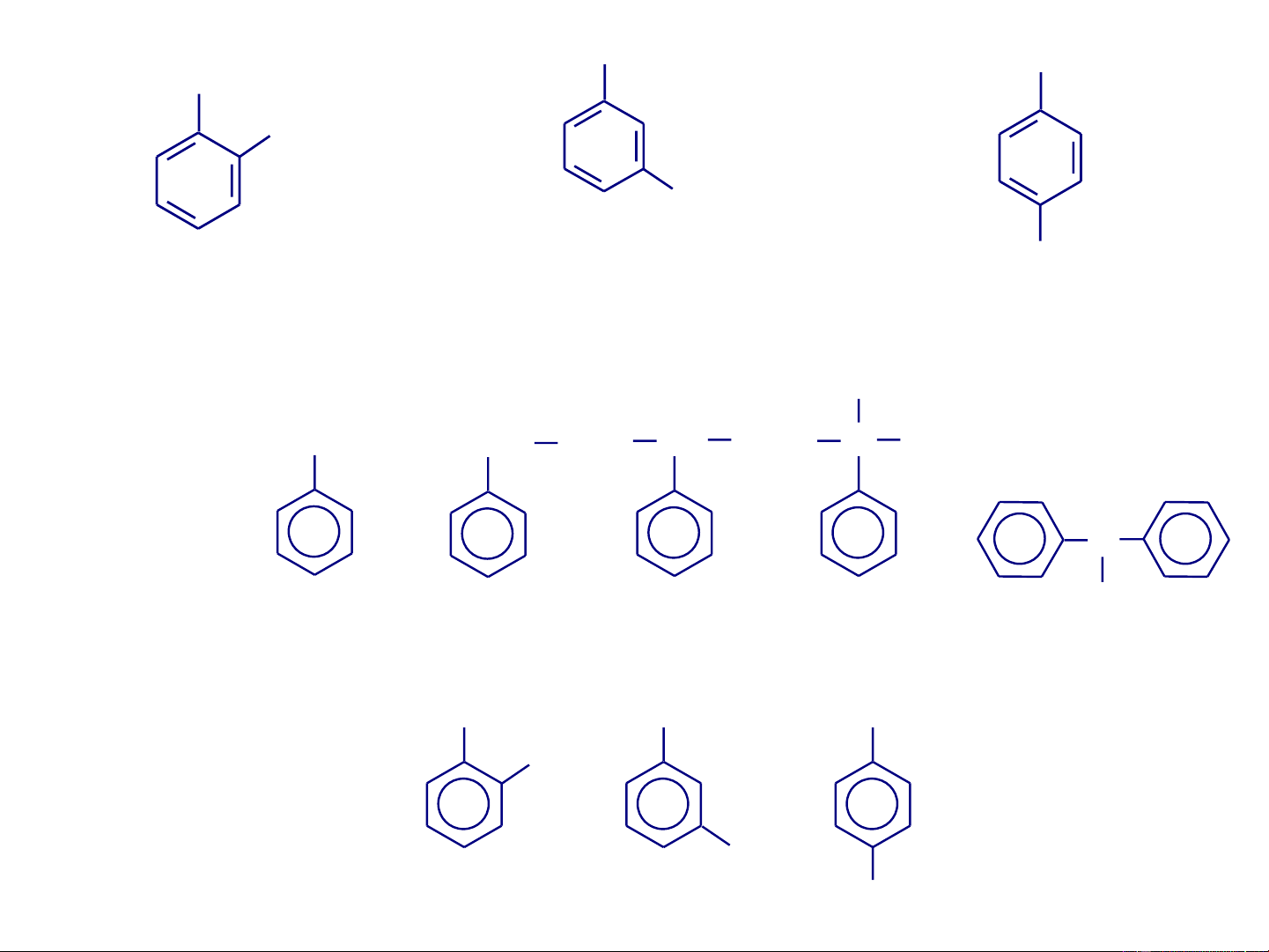
Dẫn xuất thế hai lần của Y 4
benzen có 3 đồng phân vị trí thế 1,2 là Y
ortho-, vị trí thế 1,3 ortho meta para
là meta- và vị trí thế 1,4 là ortho- meta- para- (o- ( )1,2) (m-) (1,3) (p-) (1,4)
para- (viết tắt là o-, m-, p-)
2. Danh pháp của benzen và đồng đẳng
- Tên gọi chung của các hydrocacbon thơm có vòng benzen là aren.
- Nếu tách một nguyên tử hydro (H) ra khỏi các hydrocacbon thơm
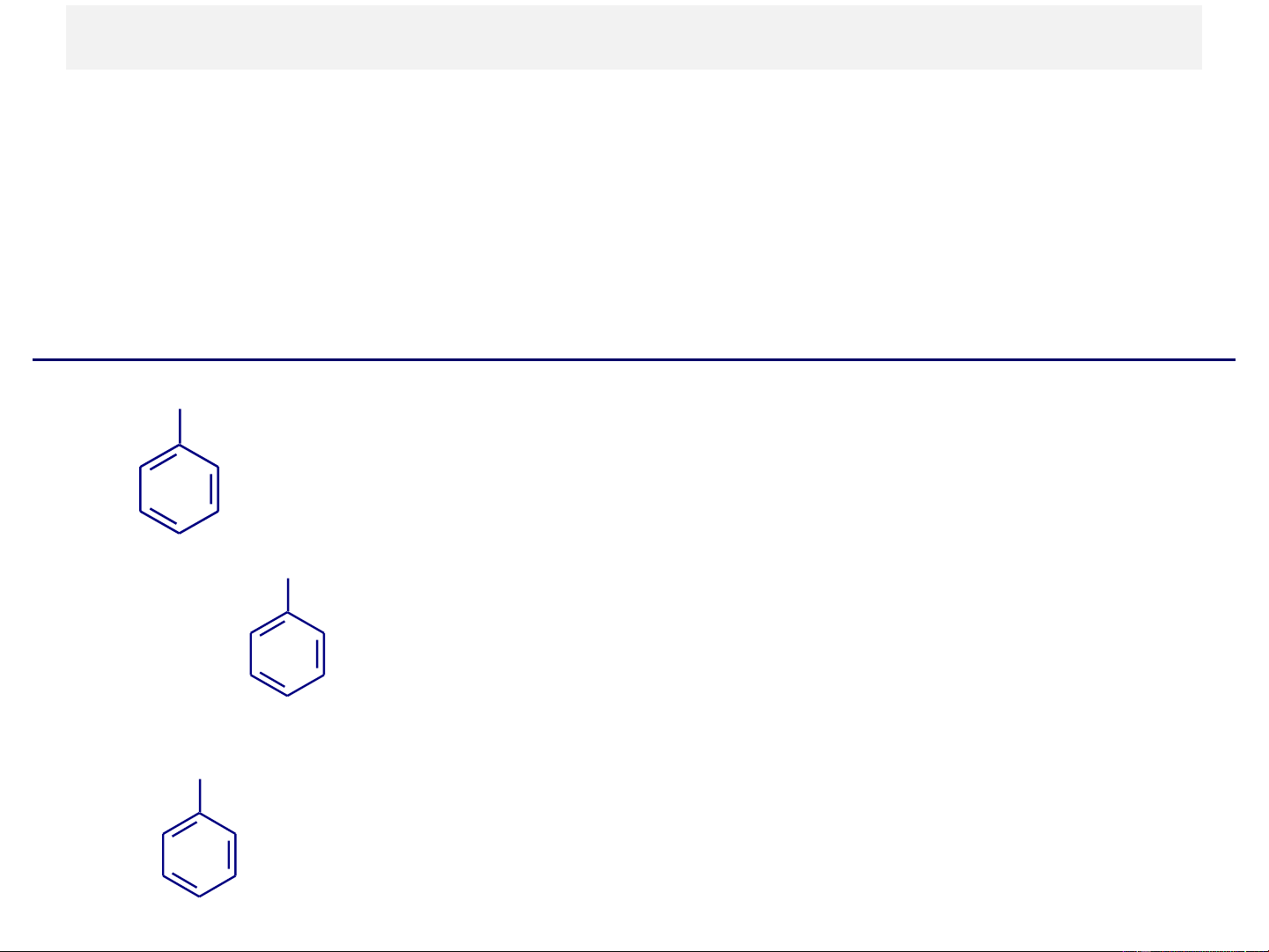
tạo thành gốc hydrocacbon thơm gọi là các nhóm aryl (KH là Ar-). Tên thông thường Tên thay thế CH3 Toluen(e) Metylbenzen(e) CH2-CH3 Etylbenzen(e) CH3-CH- CH3 Cumen(e) Isopropylbenzen(e) CH3 CH CH 3 3 CH3 CH3 o-Xylen CH3 m-Xylen (1,2-Dimetylbenzen) (1,3-Dimetylbenzen) p-Xylen (1,4-Dimetylbenzen) Một số gốc aryl: CH2 CH C H C Phenyl Benzyl Benzal Benzo Benzhydrin CH3 CH CH 3 3 o-Tolyl m-Tolyl p-Tolyl
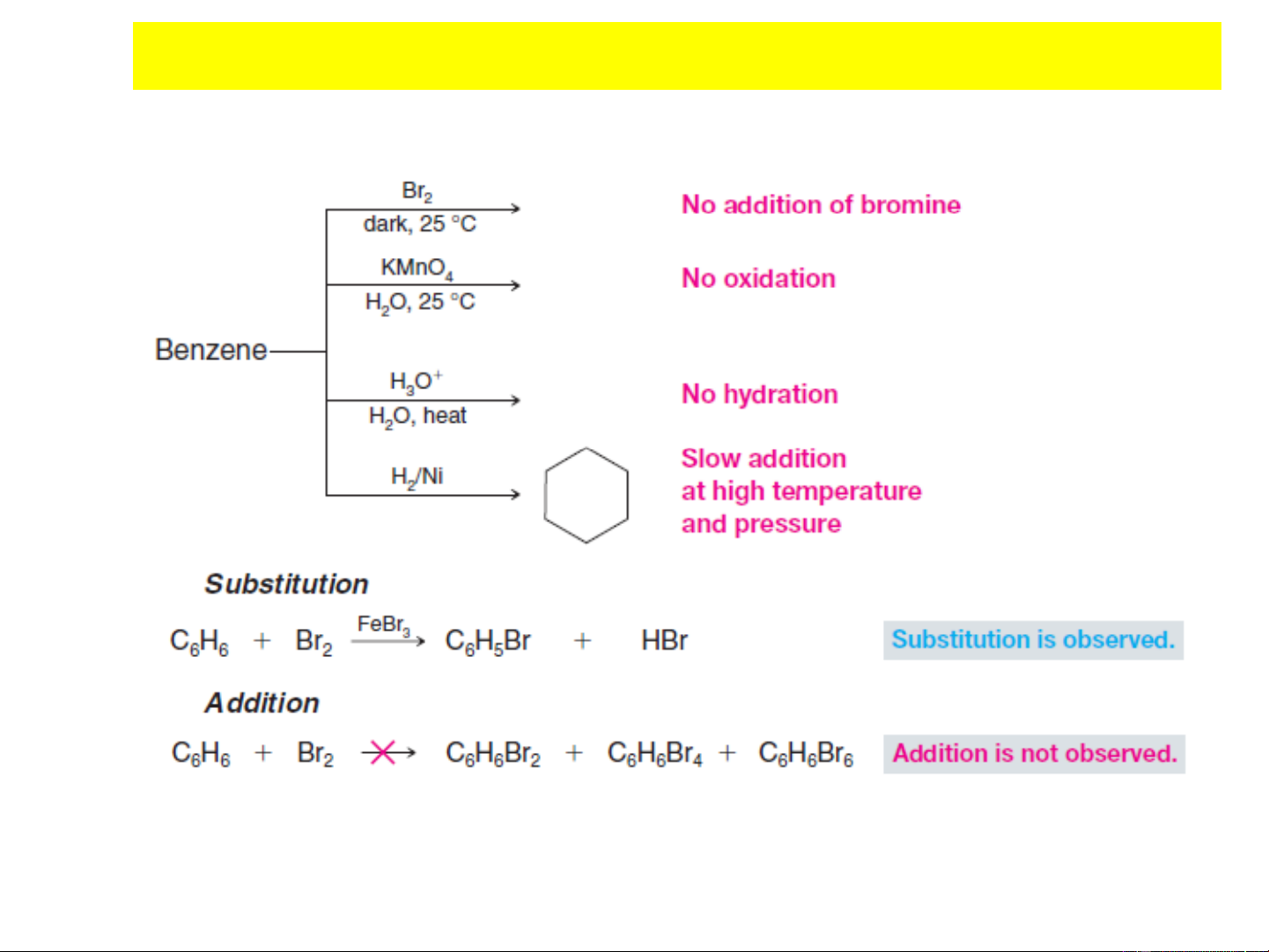
3. CẤU TRÚC VÀ TINH THƠM CỦA BENZEN
Benzen có công thức là C H , được tìm ra năm 1825. 6 6
Dựa trên công thức phân tử và tính chất hóa học của benzen (dễ
thế, khó cộng và khó bị oxy hóa) cần phải đưa ra một cấu tạo
để phù hợp với các đặc tính trên
3. CẤU TRÚC VÀ TINH THƠM CỦA BENZEN
Benzen có công thức là C H , được tìm ra năm 1825. 6 6
Dựa trên công thức phân tử và tính chất hóa học của
benzen (dễ thế, khó cộng và khó bị oxy hóa) cần phải
đưa ra một cấu tạo để phù hợp với các đặc tính trên
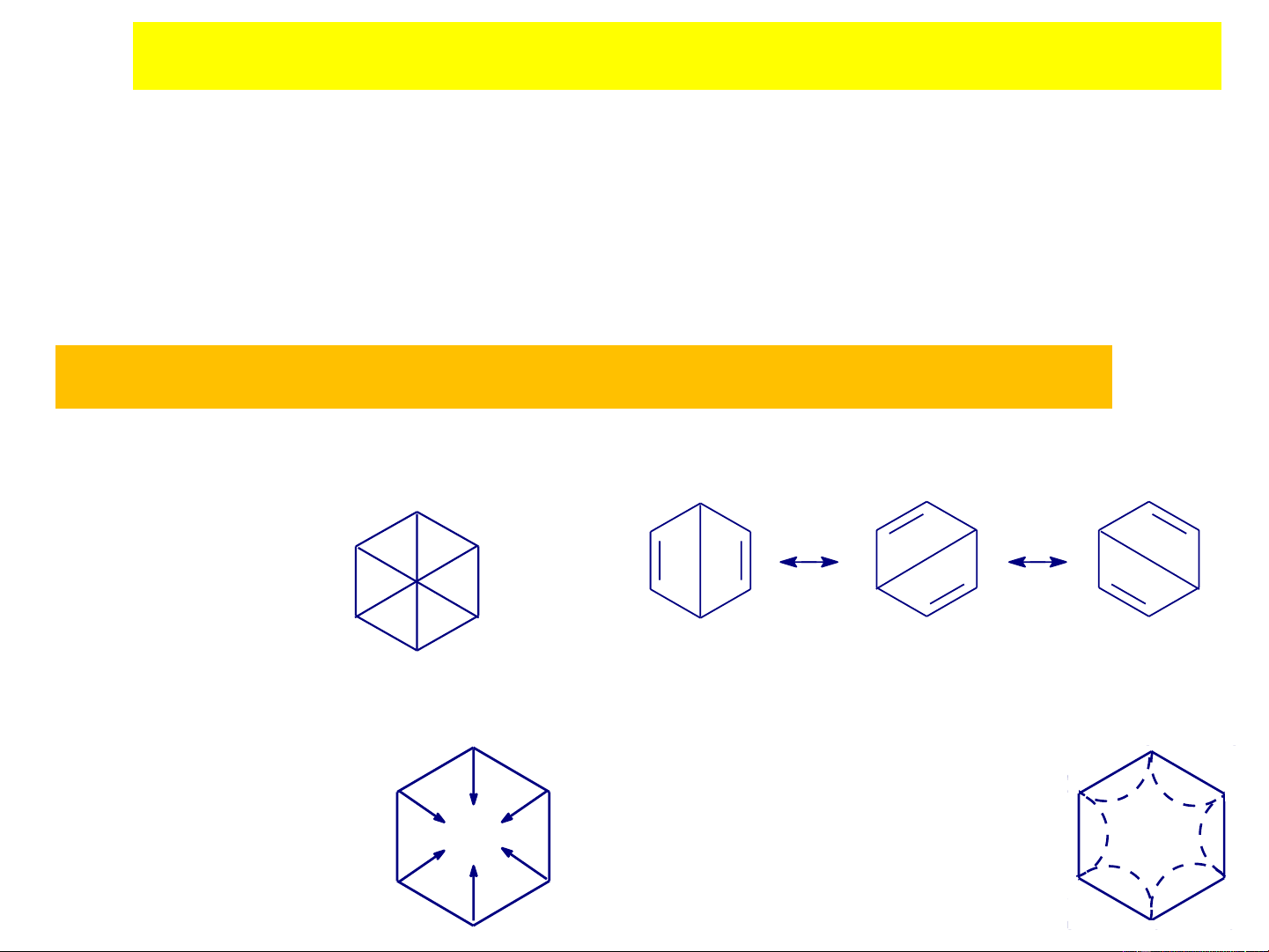
❖ Cấu trúc của benzene theo giả thuyết cổ điển
Công thức đường kính
Công thức đối góc, (Dewar, 1867) (Claus, 1867)
Công thức hóa trị phần,
Công thức hướng tâm
6 hóa trị phần bão hoà (Amstrong-Baeyer,
từng đôi một (Thiele, 1867) 1899)
3. CẤU TRÚC VÀ TINH THƠM CỦA BENZEN
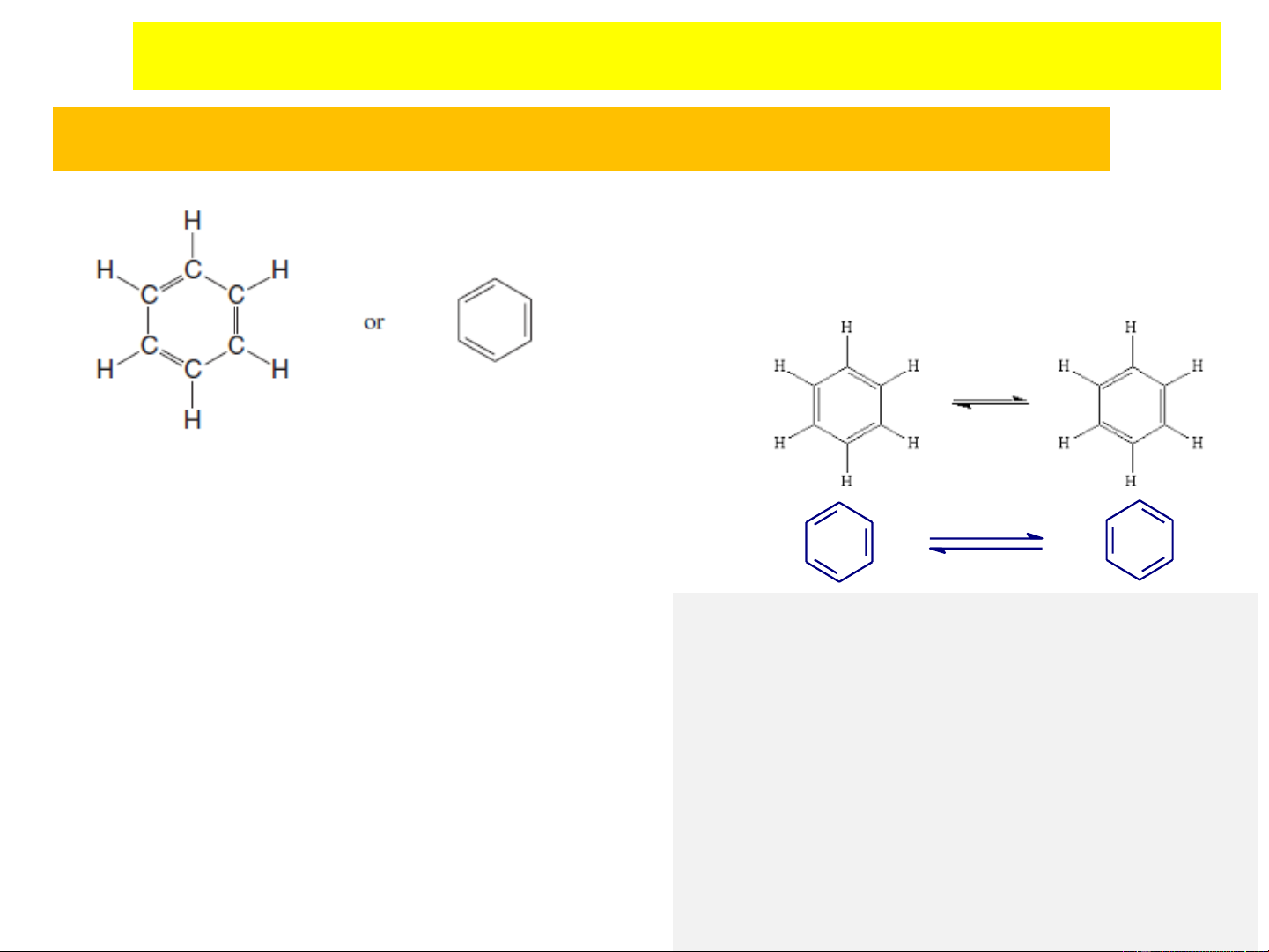
❖ Cấu trúc của benzene theo giả thuyết cổ điển Công thức Kekulé
Theo Kekulé thì C H có cấu tạo vòng 6 6
gồm liên kết đơn và đôi xen kẽ nhau.
+) Trong hệ mạch vòng, tính chất
của liên kết đôi bị giảm đi => khó
tham gia phản ứng cộng hơn so Công thức của Kekulé cũng có một số
với hợp chất chưa no mạch hở. nhược điểm:
- Do chiều dài các liên kết C-C là
+) Có liên kết đơn C - H=> có
1,54Å, C=C là 1,34Å nên benzen sẽ phản ứng thế
không phải là lục giác đều.
- Công thức này chưa giải thích được
Công thức vòng benzen của Kekulé được
tính chất hóa học của benzen là dễ
chấp nhận nhiều nhất, gần với quan điểm
tham gia phản ứng thế, khó tham gia hiện đại phản ứng cộng.
❖ Cấu trúc của benzene theo quan điểm hiện đại
(dựa trên cơ sở hóa học lượng tử và các phương pháp
phân tích hóa lý hiện đại)
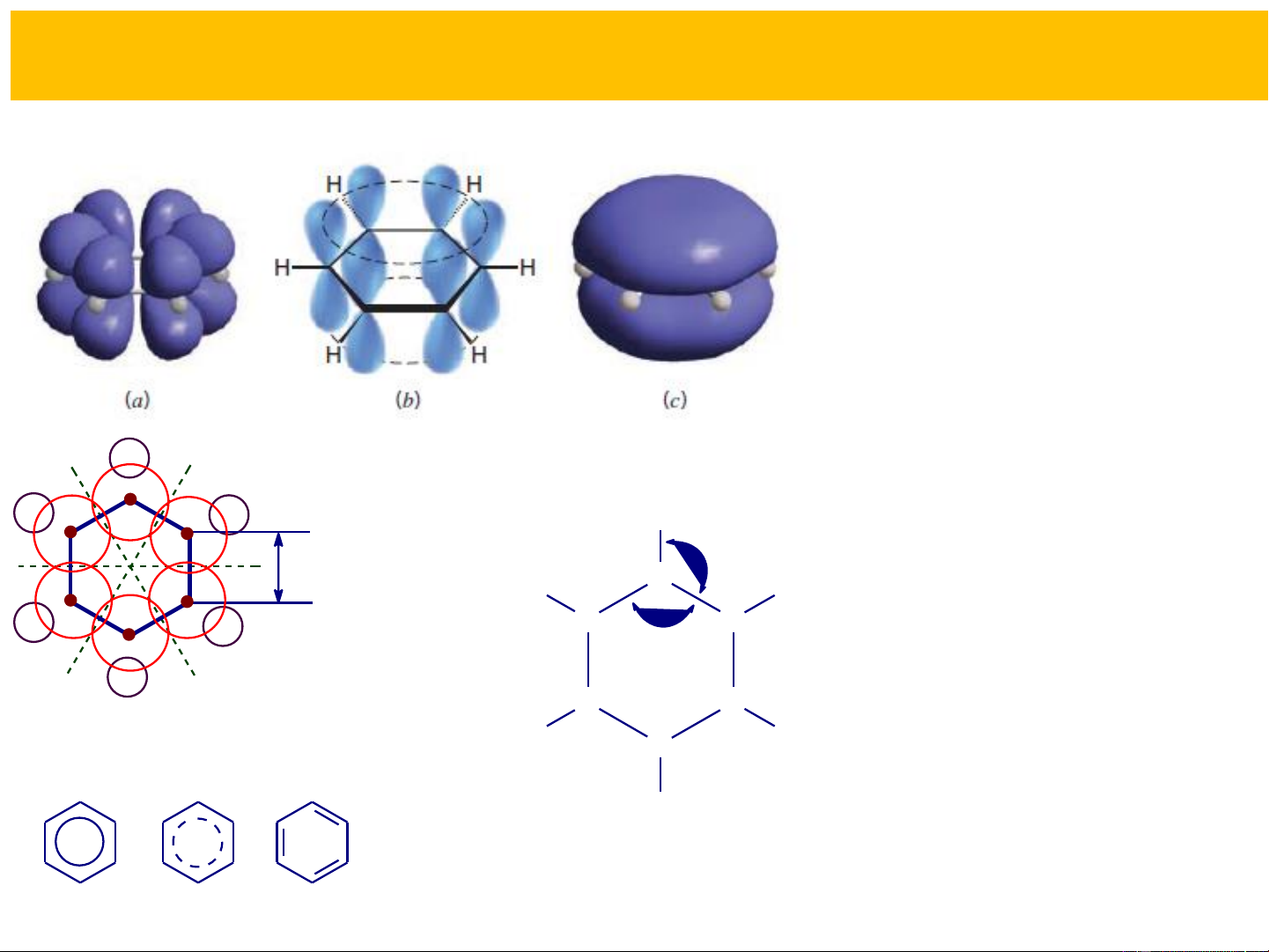
Tính đối xứng: Phân tử benzen rất đối xứng.
-Benzen có một trục đối xứng bậc sáu (khảo sát phổ Raman).
-Benzen có cấu tạo đồng phẳng (6 nguyên tử C và 6 nguyên tử H
cùng nằm trên một mặt phẳng) và vòng 6 cacbon là lục giác đều.
-Khoảng cách giữa các nguyên tử C bằng nhau (1,39Å, nằm giữa trị số của l = 1,54Å, l =1,34Å). C-C C=C
-Khoảng cách giữa các nguyên tử C và nguyên tử H bằng nhau (l = C-H
1,083Å). Góc hóa trị CCC = HCC = 120o.
❖ Cấu trúc của benzene theo quan điểm hiện đại
(dựa trên cơ sở hóa học lượng tử và các phương pháp phân tích hóa lý hiện đại)
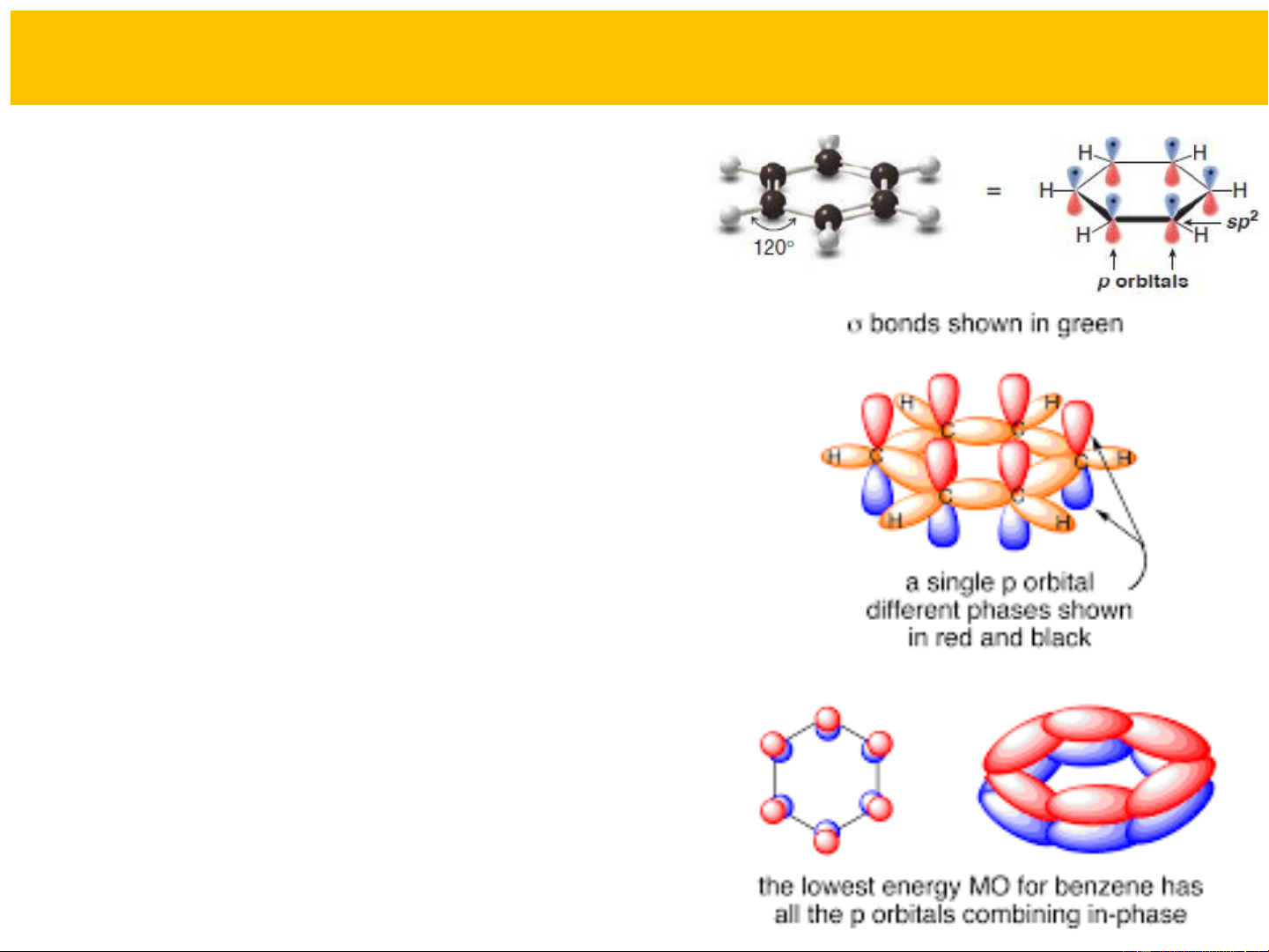
Về trạng thái lai hóa: Cả 6 nguyên
tử C trong vòng benzen đều ở trạng
thái lai hóa sp2. Mỗi nguyên tử có 3 liên kết s (2 liên kết s và 1 liên kết C-C
s ) và còn một obitan p chưa tham C-H
gia lai hóa. Các obitan p chưa lai hóa
của 6 nguyên tử C xen phủ p ở cả hai
phía với mức độ như nhau tạo thành
một hệ liên hợp kín. Các electron p
của benzen tạo thành hệ thống lục tử
p (6ep) giải toả trên toàn bộ vòng benzen.
Độ bền vững: Vòng benzen là một hệ
liên hợp bền vững về mặt nhiệt động, thể
hiện ở năng lượng thơm hóa (năng lượng
cộng hưởng) cao Ep = 36 kcal/mol.
❖ Cấu trúc của benzene theo quan điểm hiện đại
(dựa trên cơ sở hóa học lượng tử và các phương pháp phân tích hóa lý hiện đại) + + + − − §¸m m©y + − electron + + − − − Sù xen phñ s Sù xen phñ p MO−p
Để đơn giản (nhất là
khi viết cơ chế phản H
ứng hoặc chuyển dịch 120o 0,139 nm 0,139 C nm
e do các hiệu ứng) có H H C C
thể sử dụng công thức 120o Kekule nhưng cần Trôc liªn kÕt C C bËc s¸u H H
hiểu theo quan điểm C hiện đại H
§é dµi liªn kÕt vµ gãc liªn kÕt BiÓu diÔn ph©n tö
❖ Cấu trúc của benzene theo quan điểm hiện đại
(dựa trên cơ sở hóa học lượng tử và các phương pháp phân tích hóa lý hiện đại)
Sự hình thành hệ thống liên hợp p là nguyên nhân làm cho benzen có tính thơm:
- Tính tương đối bền vững về mặt nhiệt động học;
- Thỏa mãn quy tắc Hückel có 4n+2 = 1.4+2 = 6 ep;
- Về hình thức rất không no (C H
) nhưng thực chất lại no và trơ n 2n-6 tương đối;
- Khuynh hướng tham gia phản ứng thế chiếm ưu thế (do ở phản
ứng thế hệ thống liên hợp được bảo toàn) và phản ứng thế xảy ra có quy luật;
-Khuynh hướng tham gia phản ứng cộng hợp giảm (do ở phản ứng
cộng phá vỡ hệ thống liên hợp trong vòng);
-Khó bị oxy hóa và không có phản ứng trùng hợp
4. ĐIỀU CHẾ BENZEN VÀ ĐỒNG ĐẲNG
+) Điều chế benzen trong công nghiệp: chủ yếu bằng
phương pháp chưng cất phân đoạn nhựa than đá (trong
thành phần có benzen, toluen, các xylen…).
+) Trong phòng thí nghiệm :
- Trime hóa axetilen và đồng đẳng 3C H C C H 2 2 6000C 6 6 R - Ankyl hóa theo Friedel-Craft AlX − 3 − (áp dụng trong công + R X + H X nghiệp hóa dầu Benzen Ankylbenzen
4. DIỀU CHẾ BENZEN VÀ ĐỒNG ĐẲNG
+) Trong phòng thí nghiệm :
- Dehydro hóa đóng vòng n –ankan Pt n-C + 4H 6H14 2 300oC n-Hexan Benzen CH3 Pt/Al n-CH 2O3 3(CH2)5CH3 + 4H2 300oC n-Heptan Toluen
4. ĐIỀU CHẾ BENZEN VÀ ĐỒNG ĐẲNG
+) Trong phòng thí nghiệm : - Phản ứng Würt-Fittig: X R AlX3 + 2Na + X − R + 2NaX Halogenbenzen Ankylbenzen - Phản ứng khử hoá: C − Zn/HCl CH − R R 2 to O Ankyl phenyl xeton Ankylbenzen CH CH − + H − − R 2 CH2 CH2 R Ni, to Ankenyl benzen Ankylbenzen Nội dung cần nhớ HYDROCACBON THƠM (1)
(AROMATIC HYDROCARBONES) 1. Khái niệm 2. Danh pháp
3. Cấu trúc và tính thơm: -
Theo quan điểm cổ điển -
Theo quan điểm hiện đại
4. Điều chế benzene và đồng đẳng - Trong Công nghiệp - Trong PTN




