




Preview text:
HYDROCACBON CHƯA NO,
CÓ 2 LIÊN KẾT ĐÔI: ANKADIEN 1. Khái niệm chung 2. Điều chế
3. Tính chất Hóa học 1. KHÁI NIỆM CHUNG
Ankadien là hợp chất hydrocacbon chưa no
(không no) mạch hở mà trong phân tử chứa 2 liên kết đôi C=C.
+ Công thức phân tử chung của ankadien là C H với n 3 n 2n-2
❖ Căn cứ vào vị trí liên kết đôi mà chia thành 3 loại:
+ Các Ankadien với 2 liên kết đôi liền nhau: C = C = C
kém bền và có khả năng phản ứng lớn
+ Các ankadien với liên kết đôi cách nhau (2 lk đơn trở
lên): có tính chất không khác biệt nhiều với các anken
+ Các ankadien với hệ liên hợp: có một số tính chất
đặc biệt hơn so với hai loại trên. CH = CH – CH = CH 2 2 1,3-butadien
❖Cách gọi tên quốc tế IUPAC:
Tên quốc tế của các ankadien tương tự
anken đổi đuôi en thành dien - Gọi tên: STT Tên vị trí 2 liên tên HC mạch nhóm thế + nhóm thế + + kết đôi chính (đuôi dien 1 2 3 4 5 6 7
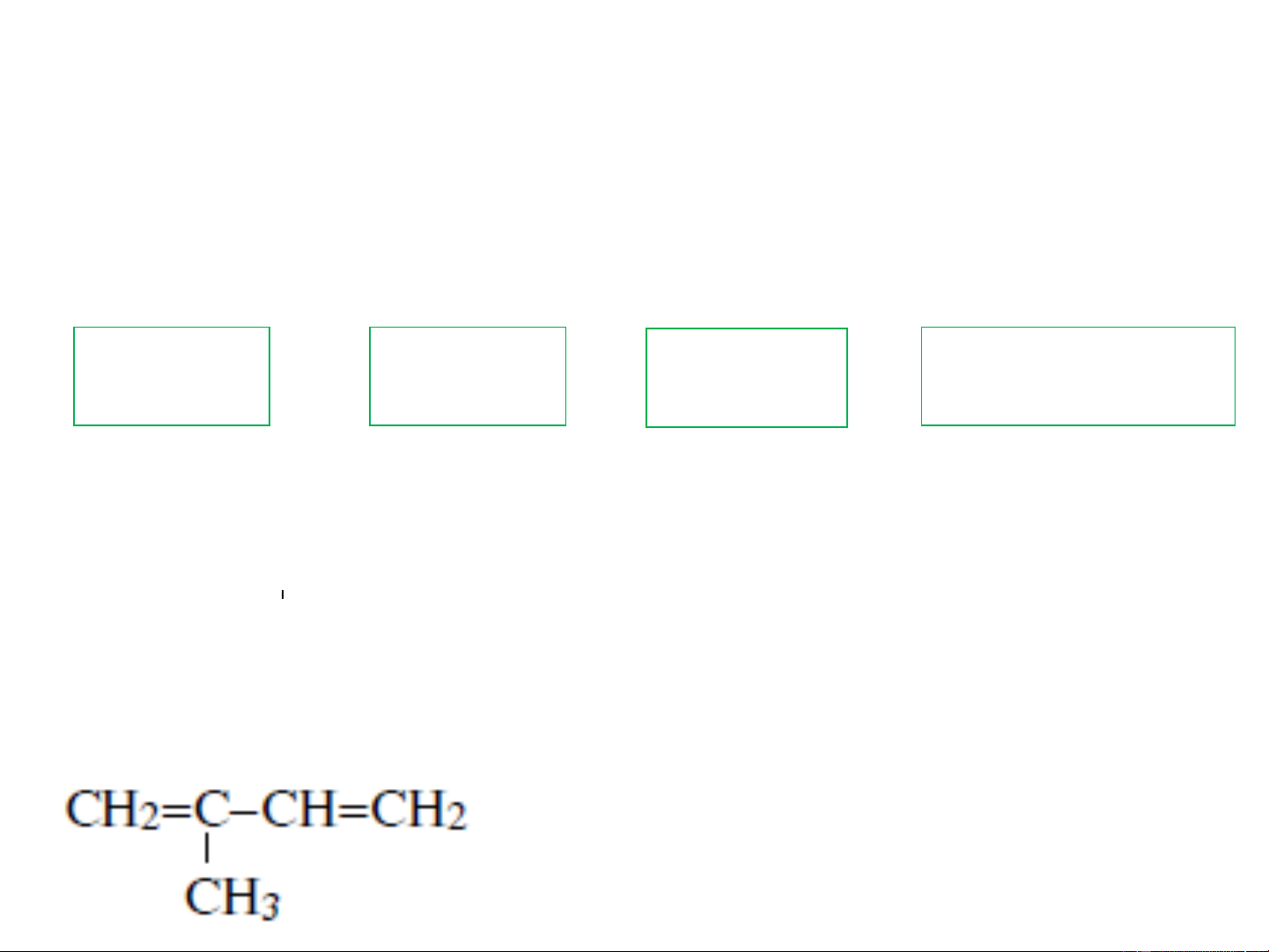
CH −CH=CH−CH −CH=CH−CH 2,5-heptadien 3 2 3 CH =CH−CH=CH
1,3-butadien hay divinyl 2 2
2-metyl 1,3-butadien hay isopren ❖Đồng phân
+ Đồng phân cấu tạo: đồng phân mạch, vị trí liên kết
ba, kiểu liên kết,...
+ Đồng phân lập thể: có đồng phân hình học cis-,
trans- tương tự anken
❖ Tính chất vật lý:
Ở nhiệt độ thường butadien là một chất khí, isopren và
dimetyl butadien là những chất lỏng
2. PHƯƠNG PHÁP ĐIỀU CHẾ
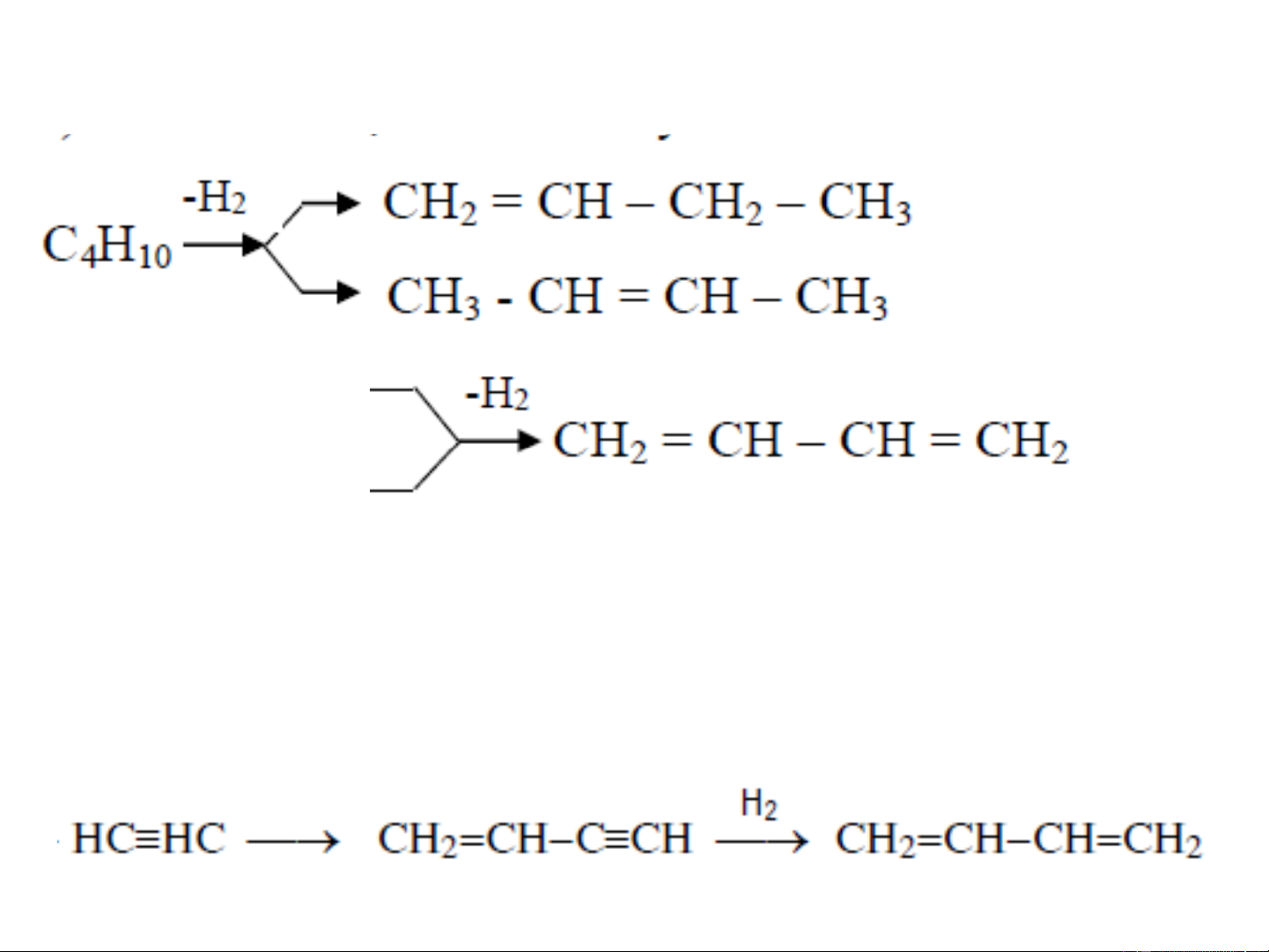
❖ Điều chế từ n-butan và n-buten: dehydro hóa 1,3-butadien
Xúc tác thường dùng: Al O + Cr O ở to = 650oC 2 3 2 3
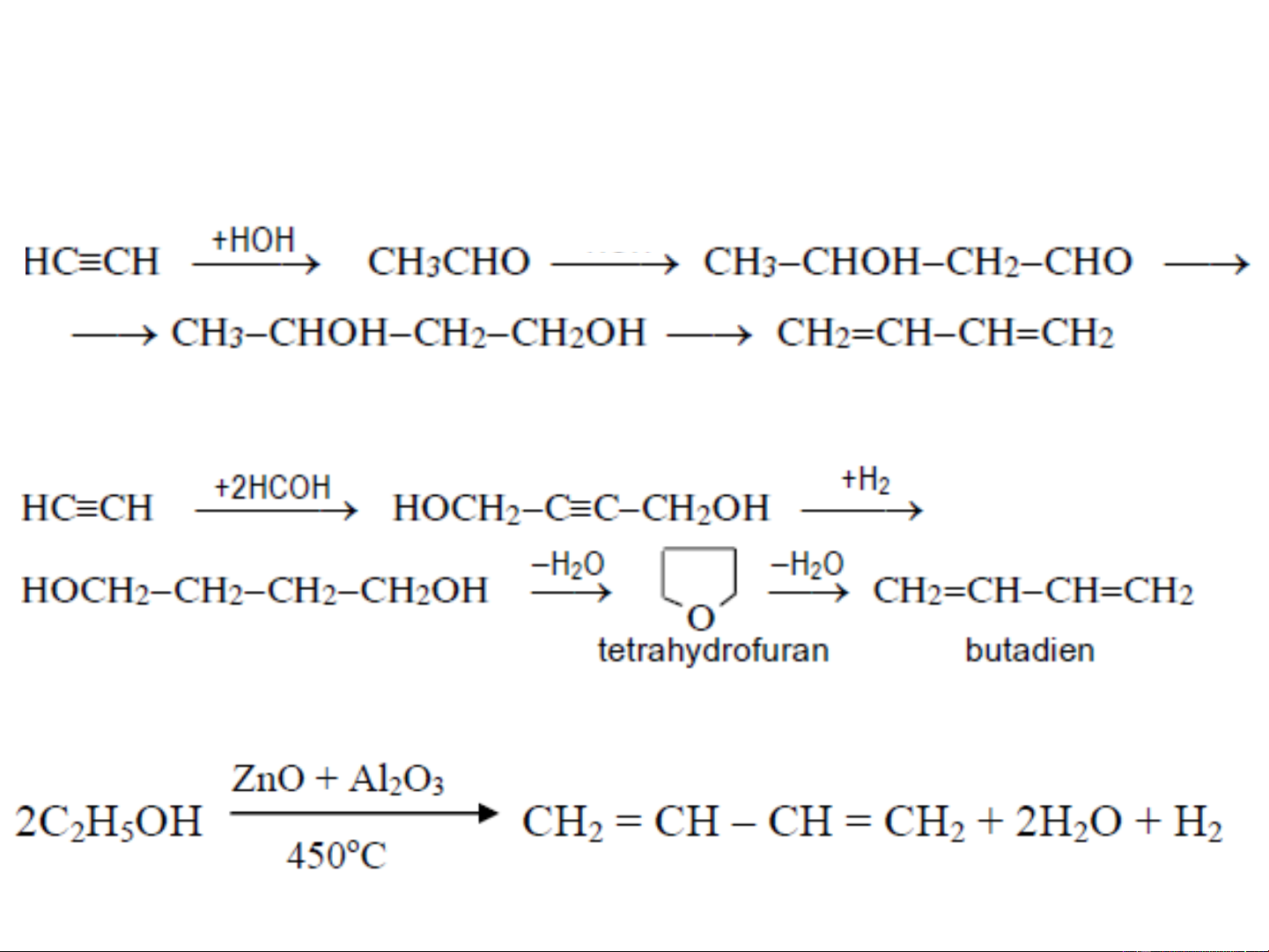
❖ Từ axetylen Cách 1: Cu Cl , 2 2 NH Cl 4 450oC 1,3-butadien
2. PHƯƠNG PHÁP ĐIỀU CHẾ
❖ Từ axetylen: Cách 2: OH-
Cách 3: Reppe 1945
❖ Từ C H OH: pp Lêbêde 2 5 1,3-butadien
2. PHƯƠNG PHÁP ĐIỀU CHẾ
❖ Điều chế isopren:
Cách 1: đề hydro hóa CH -CH-CH -CH ⎯⎯→ Xt, to , p CH = CH-CH=CH 3 2 3 2 2 CH CH 3 3 isopentan isopren
Cách 2: từ axetylen NaNH2
CH CH + CH – CO - CH ⎯⎯→ CH = CH-CH=CH 3 3 2 2 axeton CH3 isopren
3. TÍNH CHẤT HÓA HỌC NHẬN XÉT CHUNG:
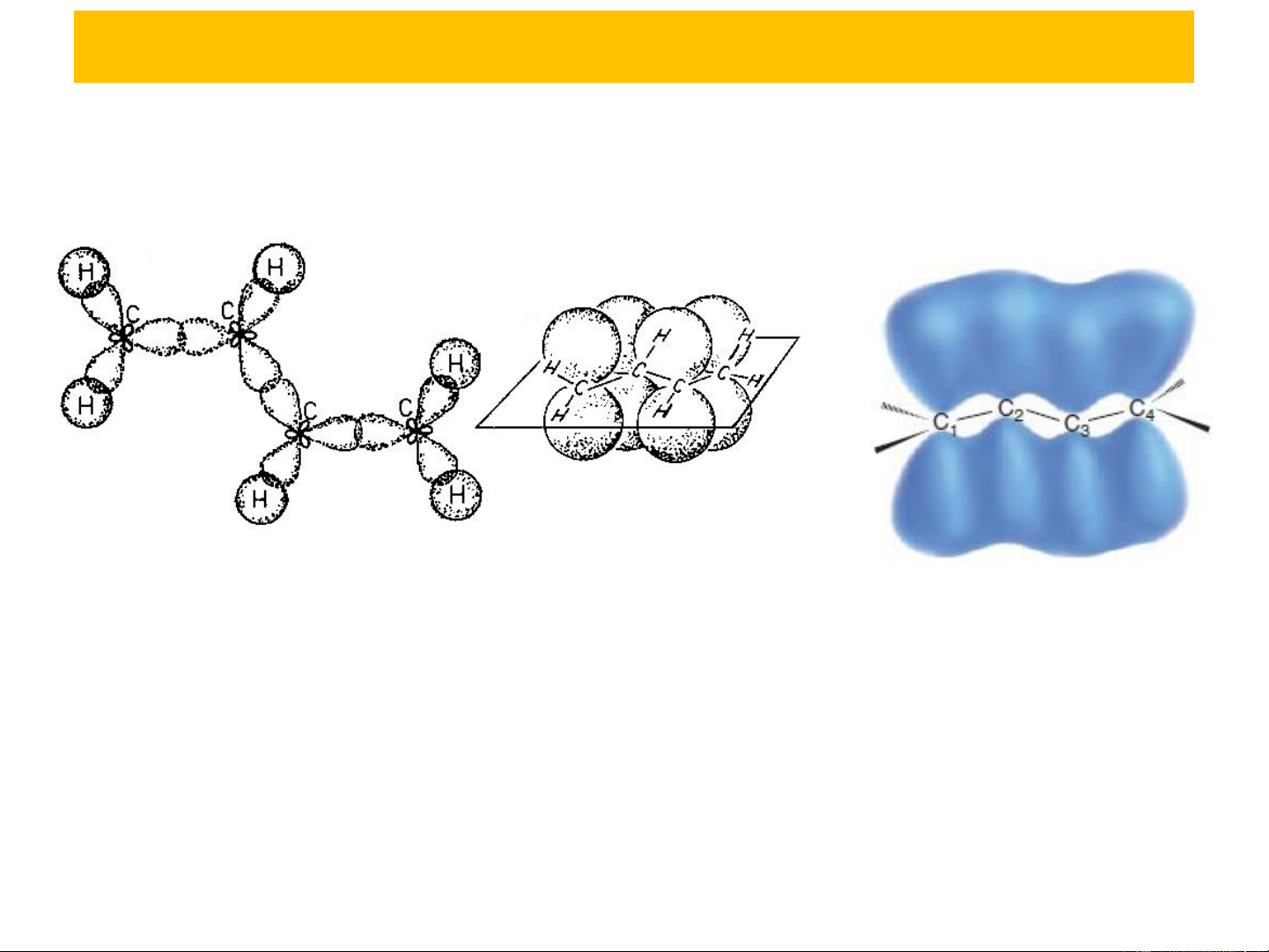
Xét phân tử CH =CH−CH=CH 2 2
Phân tử 1,3-butadien có 4 nguyên tử Cở trạng thái lai hoá
sp2. Chúng liên kết với nhau và với các nguyên tử hydro
bằng liên kết . Các liên kết tạo thành do sự xen phủ của
các orbital lai hoá sp2 của cacbon (liên kết C−C), và do sự
xen phủ của các orbital lai hoá với orbital s của hydro (liên kết C−H)
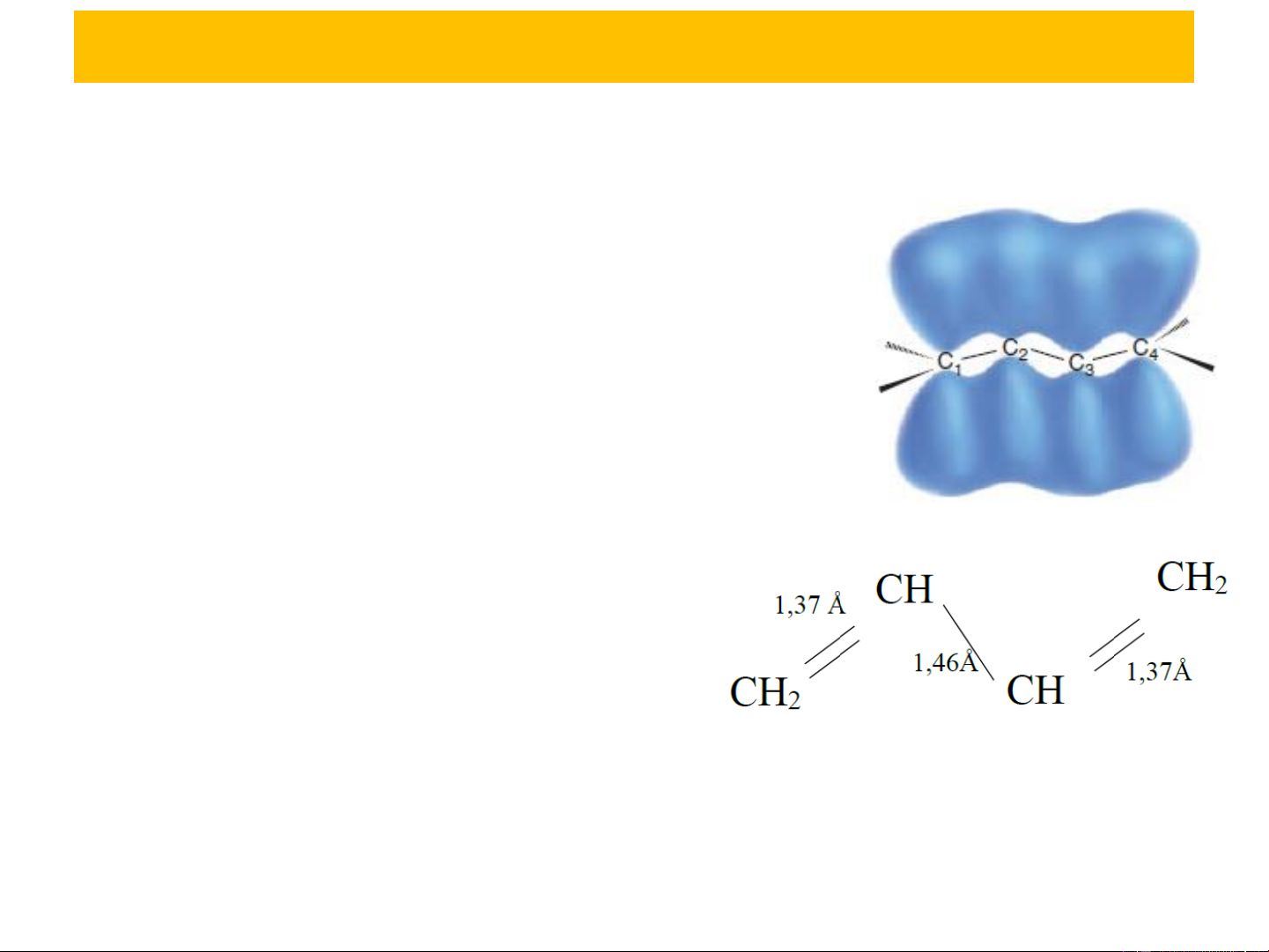
3. TÍNH CHẤT HÓA HỌC NHẬN XÉT CHUNG:
Xét phân tử CH =CH−CH=CH 2 2
Tất cả các nguyên tử cacbon và hydro đều
nằm trên một mặt phẳng, các orbital p của
các nguyên tử C xen phủ lẫn nhau tạo 2
liên kết và 4 electron giải toả trên toàn
bộ phân tử thành hệ e liên hợp làm liên
kết dôi dài ra, liên kết đơn ngắn lại.
Ảnh hưởng liên hợp thể hiện rõ ở
khả năng phản ứng cộng tăng lên
và đặc biệt cho phản ứng cộng 1,4.
Ngoài ra, các ankadien có nối đôi
liên hợp còn rất dễ tham gia phản
ứng trùng hợp thành các polyme
dùng chế tạo cao su nhân tạo.
Từ cấu trúc suy ra các hướng phản ứng chính
của hợp chất Ankadien:
+ Phản ứng cộng A vào hệ liên hợp: sản phẩm E cộng 1,2 hay 1,4
+ Phản ứng cộng đóng vòng
+ Phản ứng trùng hợp
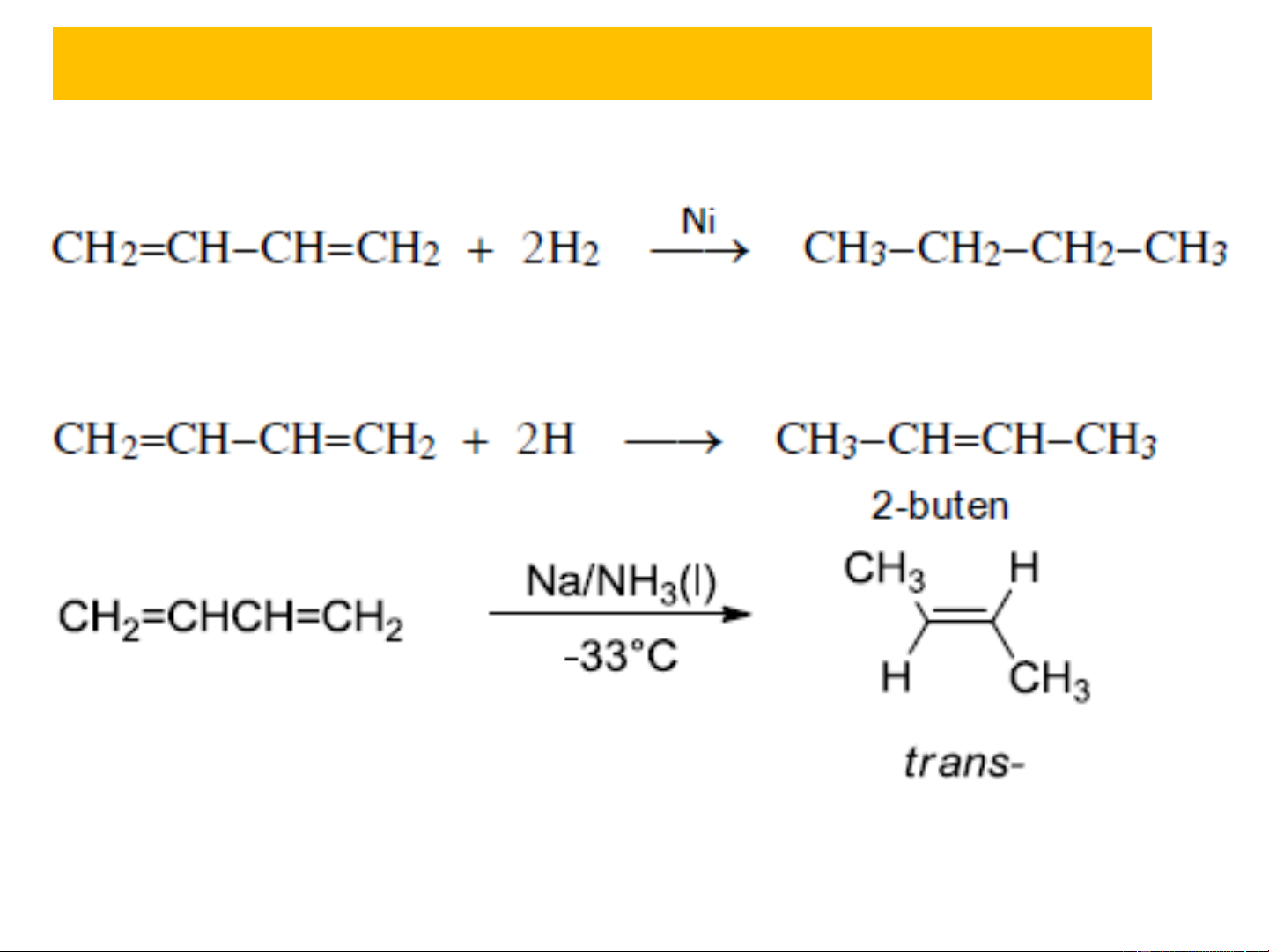
3.1. Phản ứng cộng ❖ Cộng H2
Tùy thuộc tác nhân khử có thể thu butan hoặc 2- buten
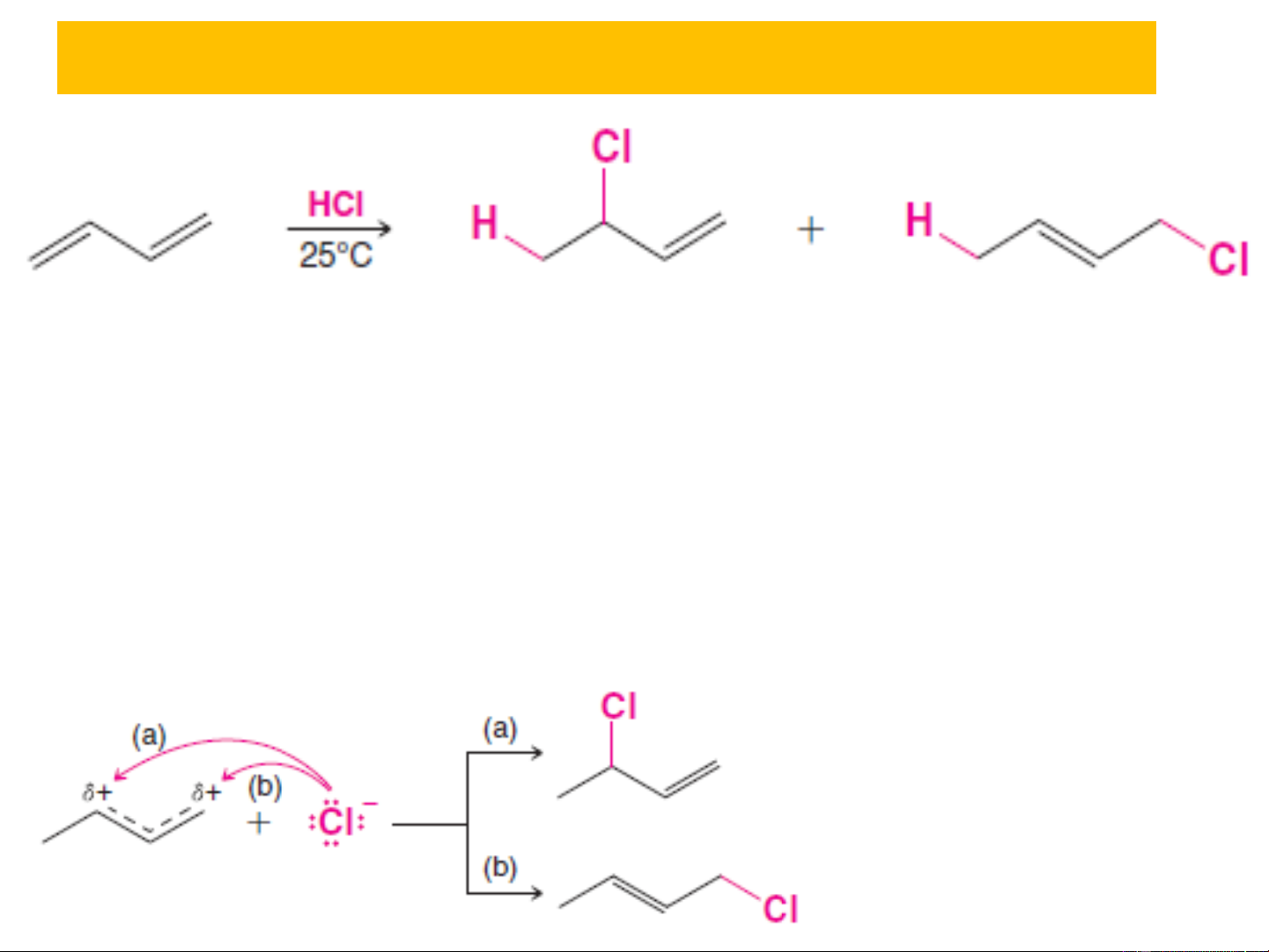
3.1. Phản ứng cộng ❖ Cộng HCl: AE Cơ chế: Sản phẩm cộng 1,2 78% Sản phẩm cộng 1,4 22%
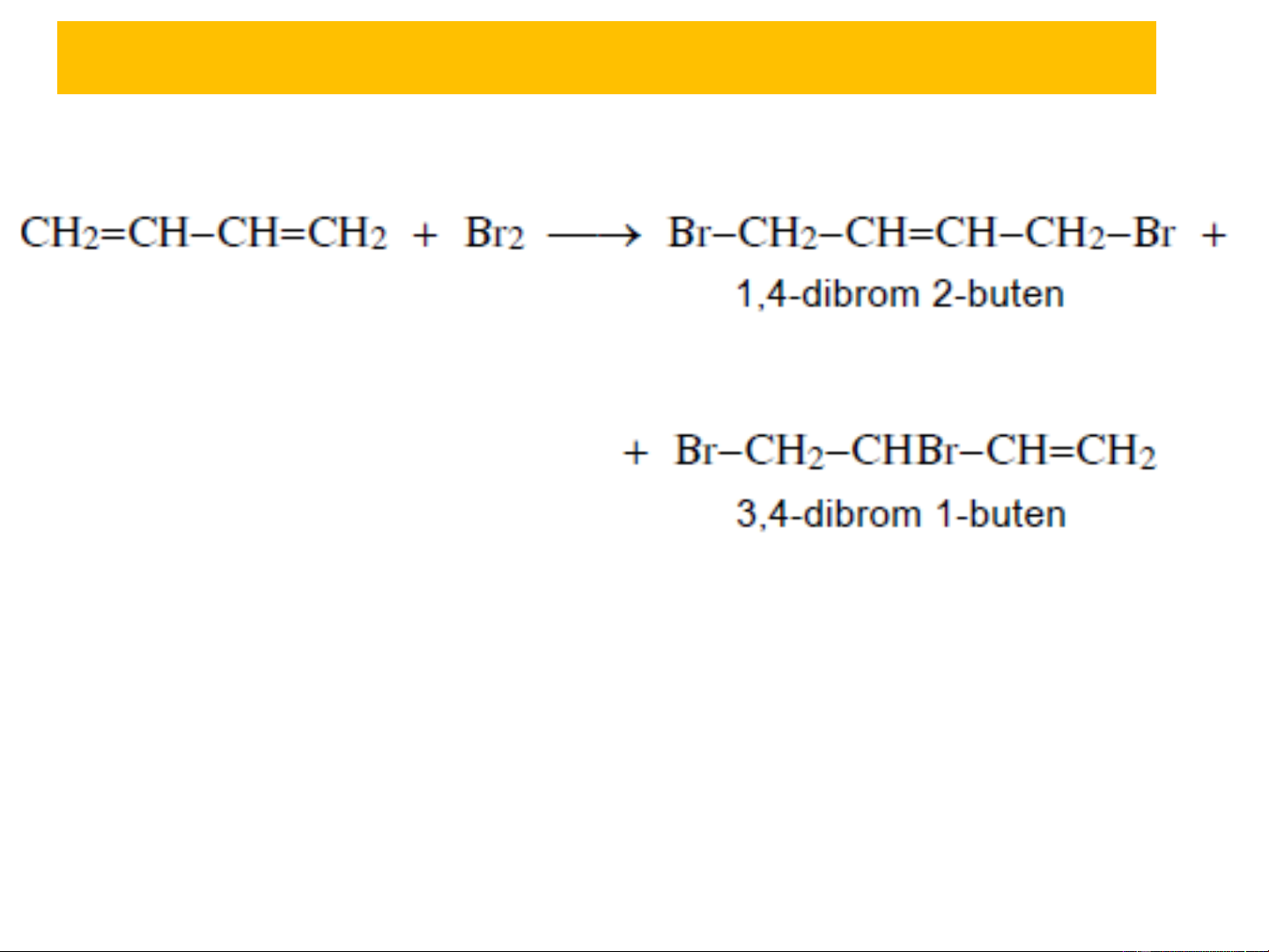
3.1. Phản ứng cộng ❖ Cộng HBr, Br : A 2 E Sản phẩm cộng 1,4 Sản phẩm cộng 1,2
Tỷ lệ sản phẩm cộng 1,2 và cộng 1,4 phụ thuộc vào điều
kiện phản ứng, to, dung môi phân cực hay không phân
cực, thời gian phản ứng…
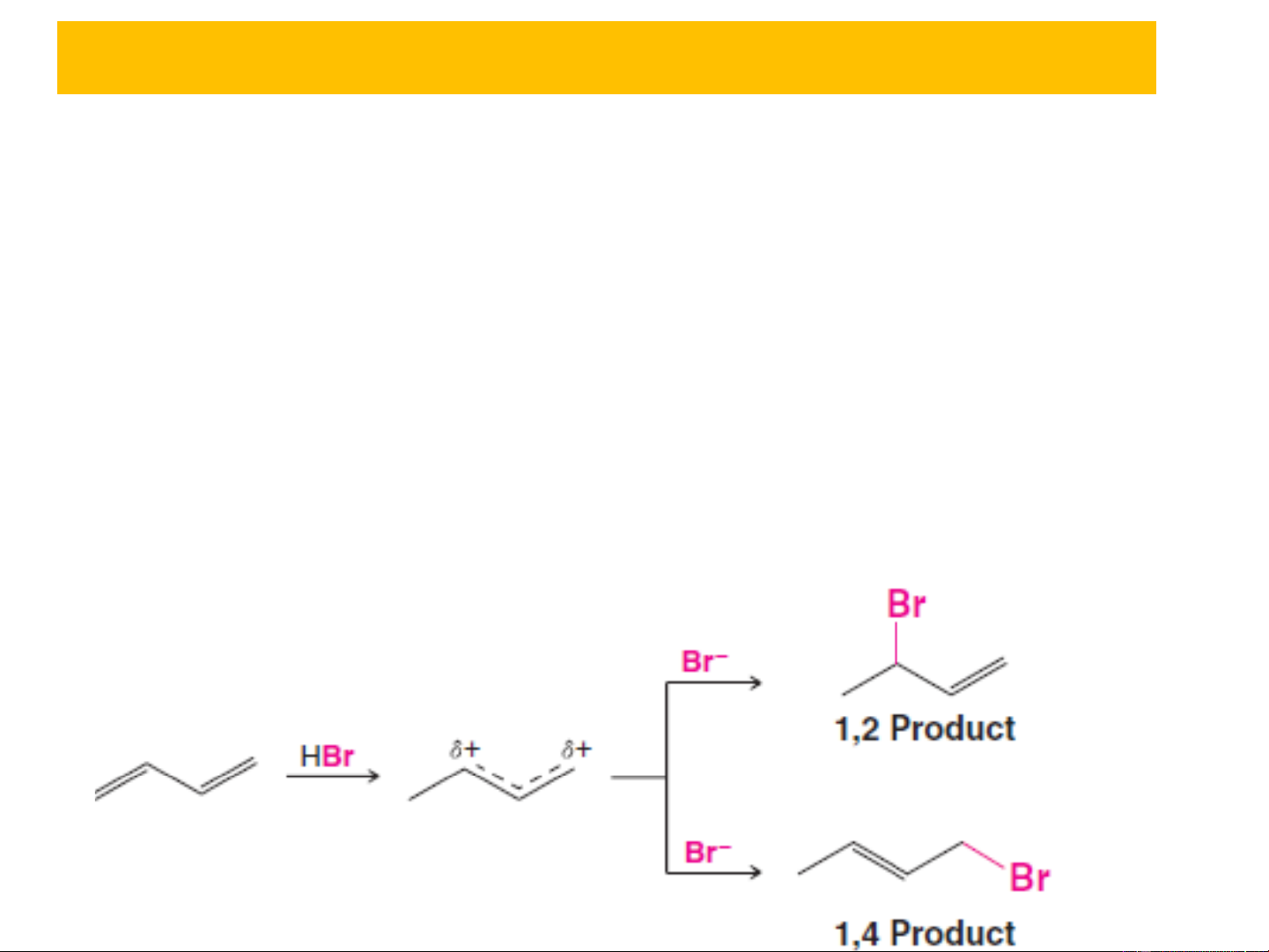
3.1. Phản ứng cộng ❖ Cộng HBr, Br : A 2 E Sản phẩm cộng 1,2 Sản phẩm cộng 1,4
3.1. Phản ứng cộng ❖ Cộng HBr, Br : A 2 E
3.1. Phản ứng cộng ❖ Cộng HBr, Br : A 2 E
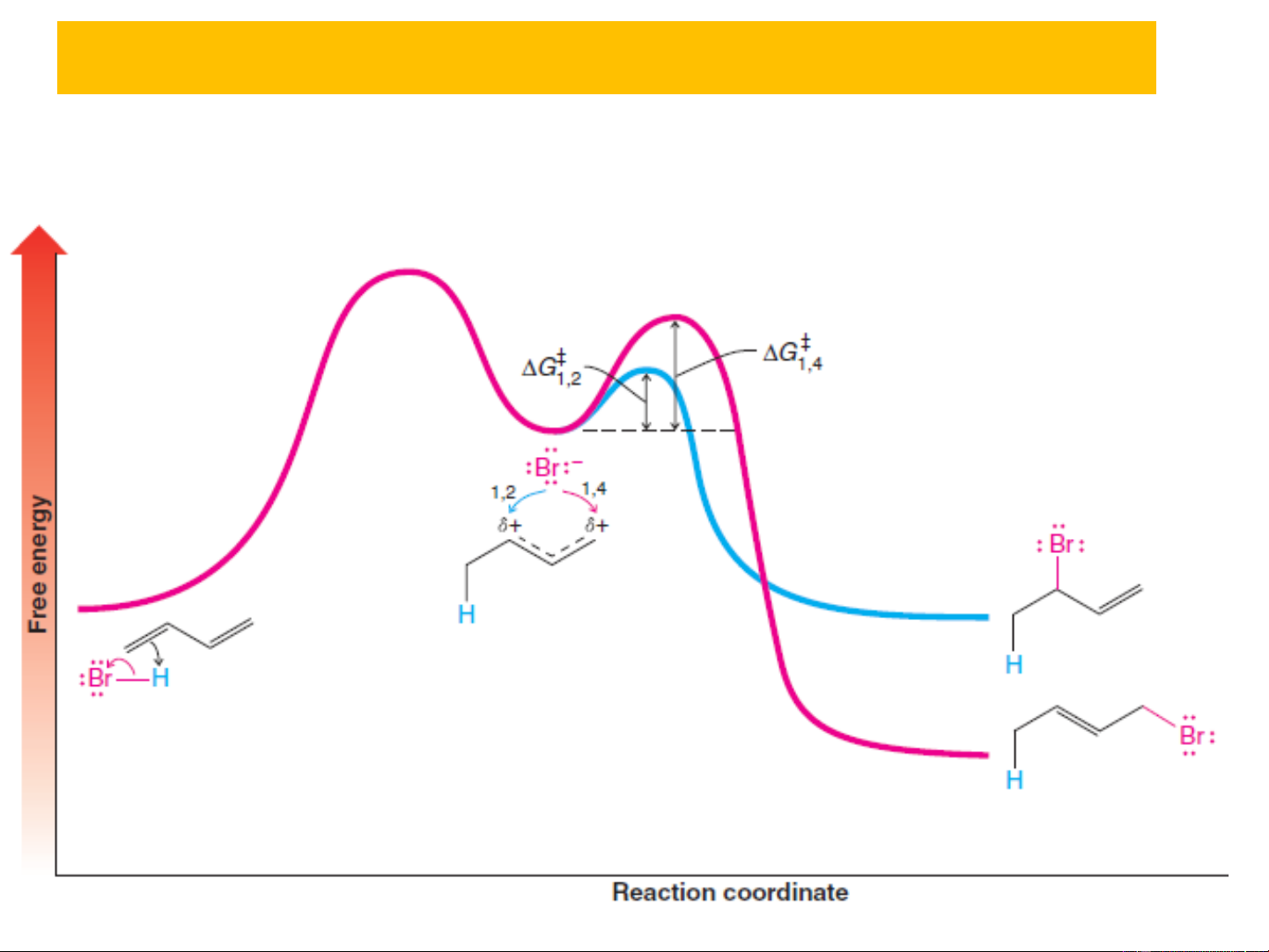
+) Trong môi trường phân cực:
→ Ở to rất thấp thì sản phẩm 1,2 là chủ yếu do về
mặt động học, sản phẩm 1,2 tạo thành nhanh hơn và
năng lượng hoạt hóa sp 1,2 thấp hơn 1,4.
→ Ở to cao hơn, tỷ lệ sản phẩm 1,4 càng tăng do
về mặt nhiệt động sản phẩm 1,4 bền hơn sản phẩm
1,2 → Sản phẩm 1,2 tạo thành sẽ chuyển dần sang sản phẩm 1,4.
+) Trong môi trường ít phân cực hay không phân cực : do
trong môi trường này không tạo được khả năng tách dị ly mà
chỉ ở dạng Br+-Br- và khi phản ứng với butadien-1,3 thì cộng hợp 1,2 là chủ yếu
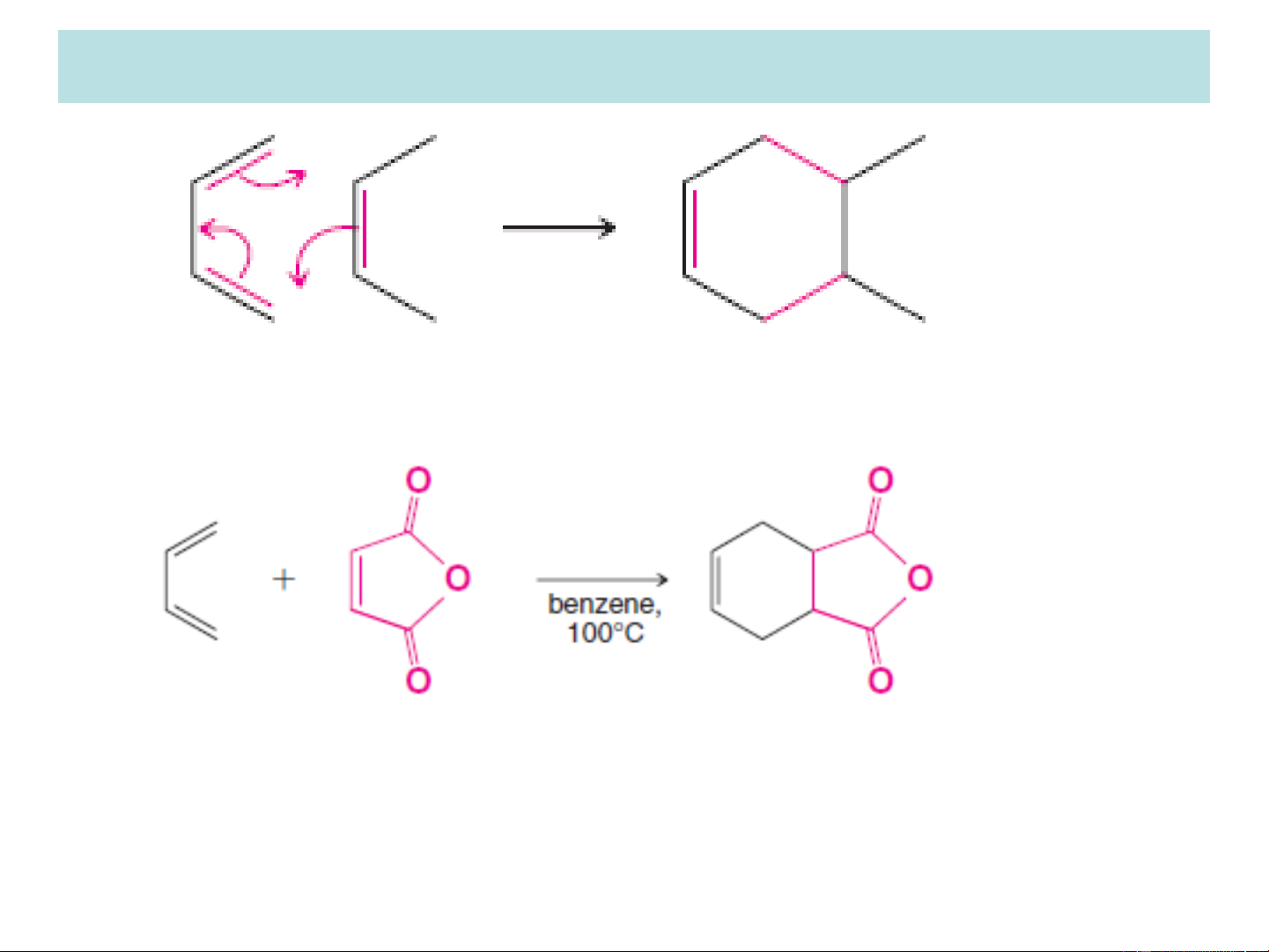
3.2. Phản ứng cộng 1,4 đóng vòng: Diels-Alder dien dienophil
Sản phẩm cộng 1,4 đóng vòng
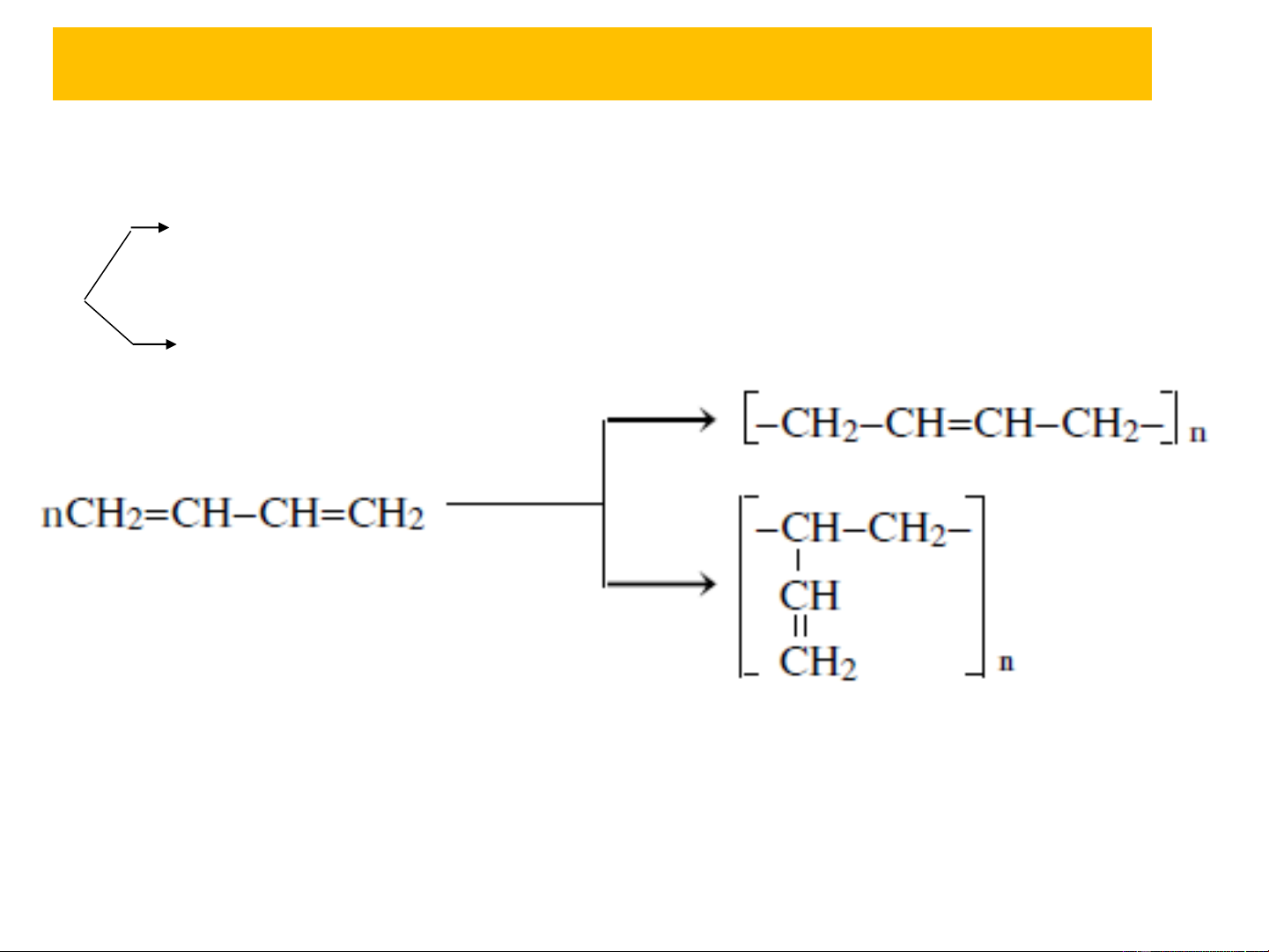
3.3. Phản ứng trùng hợp
+) Xảy ra theo cơ chế gốc hay cơ chế ion
Hợp chất cơ kim, R-li+→ cơ chế ion – anion, sp 1,4
Na, perooxit → cơ chế gốc → sp hỗn hợp 1,2 và 1,4 Na, 8at
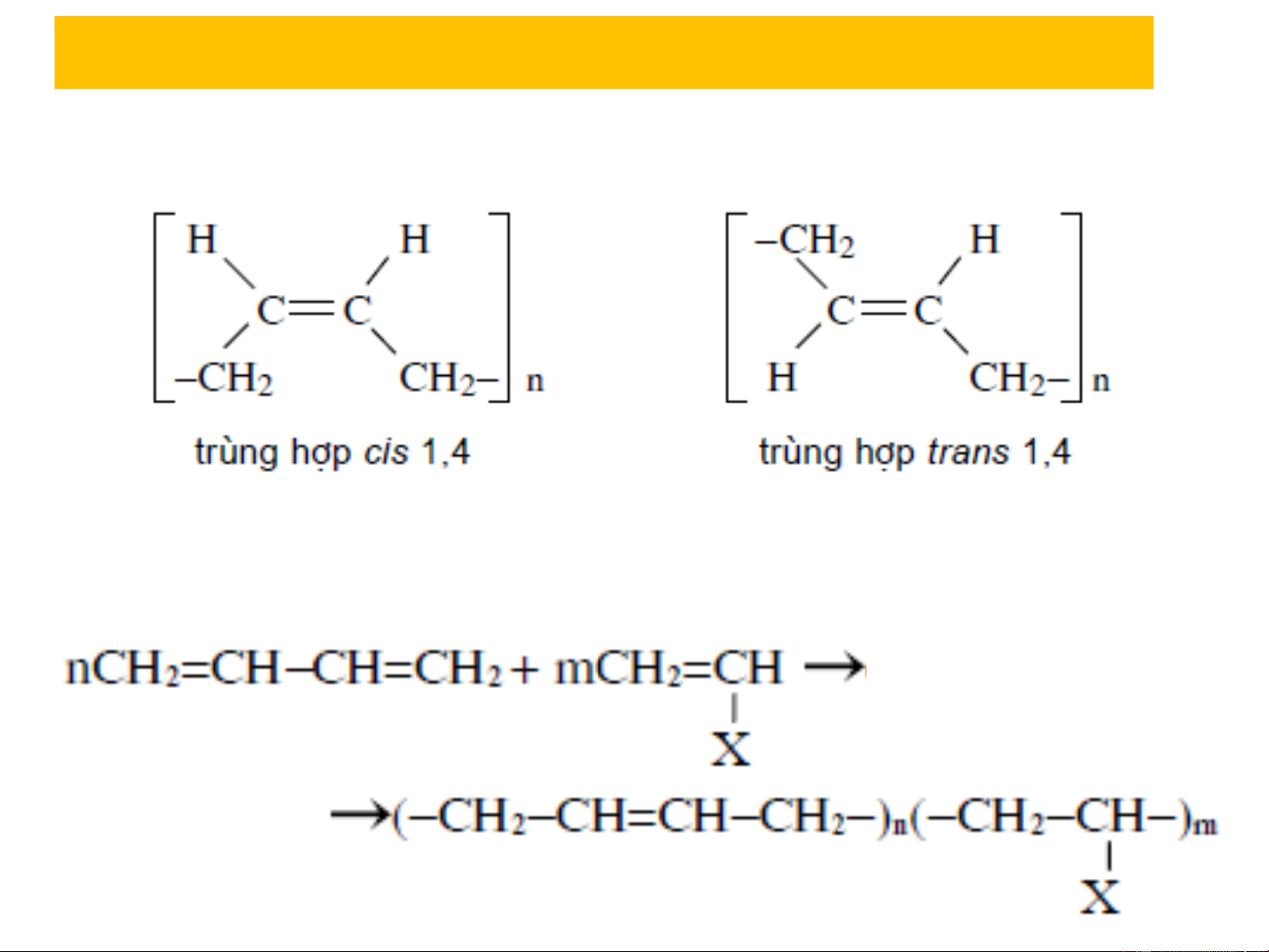
3.3. Phản ứng trùng hợp
quá trình trùng hợp 1,4 có thể xảy ra hai khả năng trùng
hợp cis- hoặc trans-
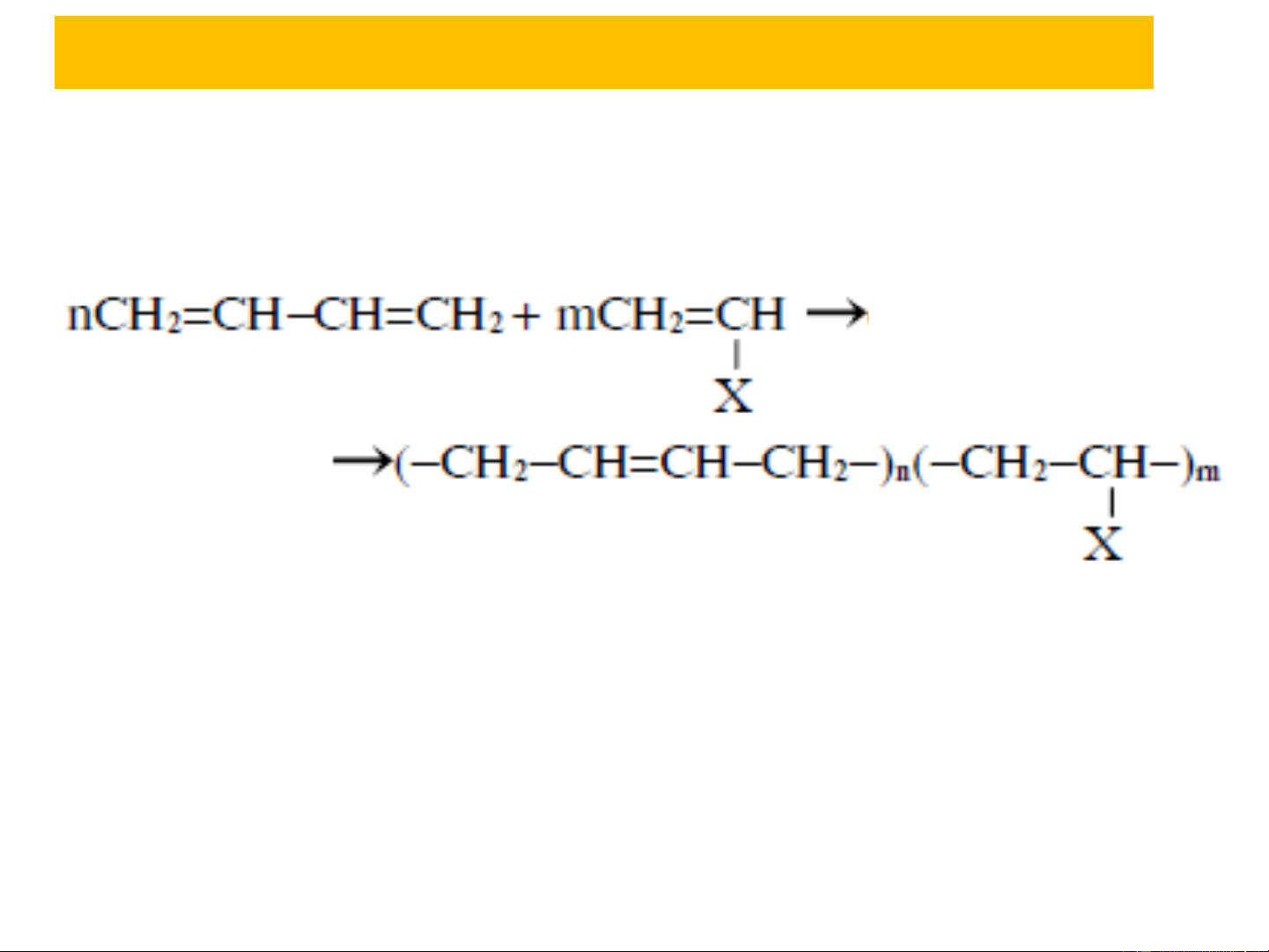
Butadien có khả năng đồng trùng hợp với rất nhiều monome
khác như stryren (C H −CH=CH ), acronitril (CH =CH−CN) 6 5 2 2 Na, 8at X = C −
6H5 , −CN
3.3. Phản ứng trùng hợp
Butadien có khả năng đồng trùng hợp với rất nhiều monome
khác như stryren (C H −CH=CH ), acronitril (CH =CH−CN) 6 5 2 2 Na, 8at




