

Preview text:
lOMoAR cPSD| 59416725 BÀI 6
HYDRO - OXY - LƯU HUỲNH (H2 – O2 - S) (Phân nhóm VIA)
Họ tên sinh viên: Tạ Quỳnh Mai KMnO4 0.1M vào ống Đánh Lớp: K16-KTHH giá kết quả Nhóm: 2 Chữ ký của giáo viên
Viết phương trình phản ứng và
giải thích hiện tượng, tính toán kết
quả (nếu có) Phương trình phản ứng:
Thí Quan sát hiện tượng nghiệm số
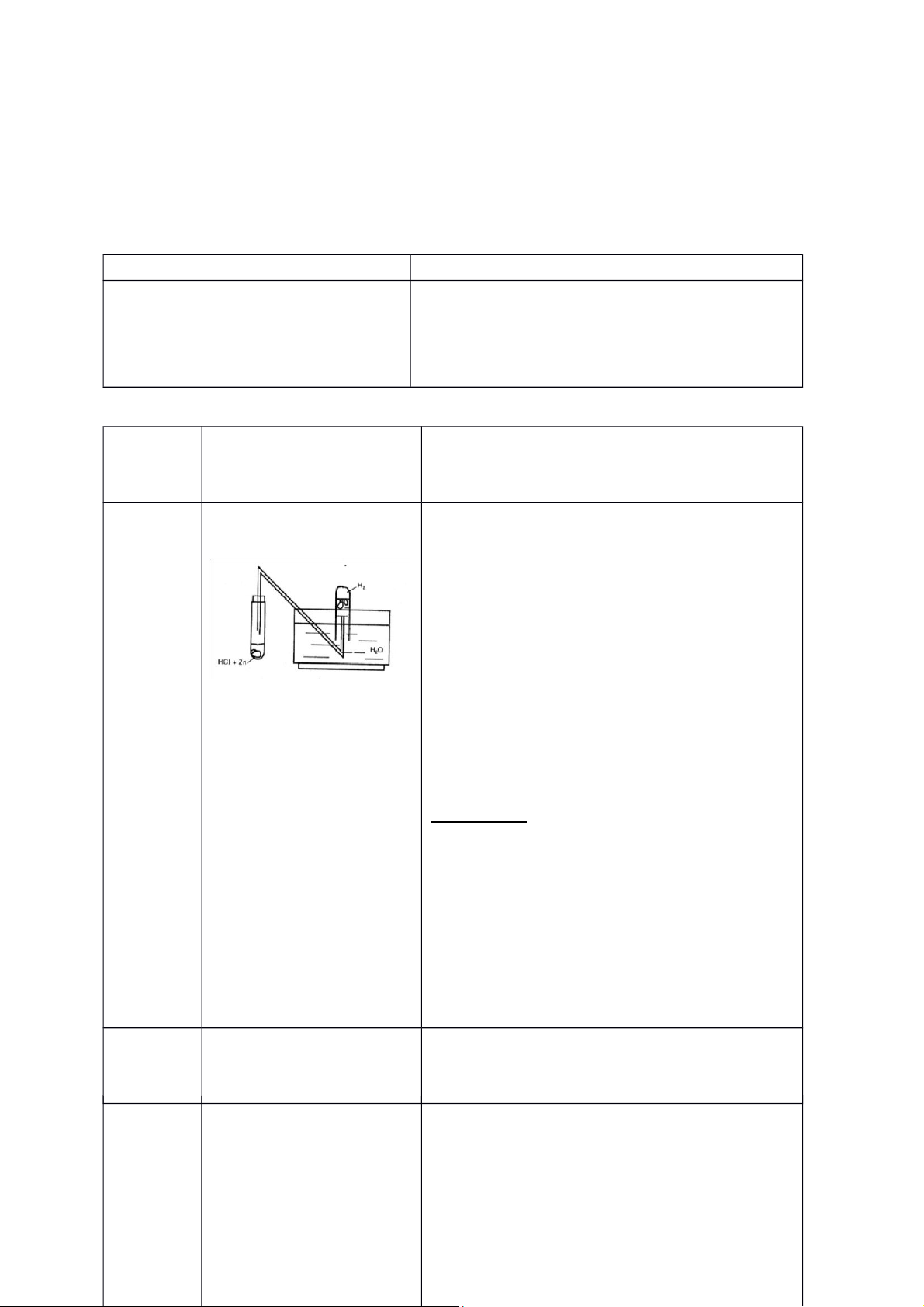
Thí Lắp dụng cụ như hình nghiệm Zn + 2HCl → ZnCl 2 + H2
sau: số 1: Điều chế hydro
Do hydro tác dụng với oxi có lẫn trong
ống nghiệm và trong hệ thống dẫn khí nên
có tiếng nổ. Ban đầu lượng oxi nhiều hơn nên có tiếng nổ lớn.
Kẽm tan dần, có sủi bọt 2H khí rất mãnh liệt và 2 + O2 → 2H2O sinh nhiều nhiệt.
Hơi nước tạo thành gặp thủy tinh lạnh nên
Châm lửa đốt khí hydro ngưng tụ.
thoát ra ở đầu ống dẫn Kết Luận: nghe có tiếng nổ nhẹ.
Có thể điều chế hydro bằng cách cho
Ngọn lửa màu vàng, kim loại mạnh tác dụng với axid mạnh. đồng thời tỏa nhiều
Khí hydro tác dụng với oxi tạo thành
nhiệt. Lấy thành phễu nước và sinh nhiệt mạnh. Khi hydro tác
thủy khô chà lên ngọn dụng với khí oxi với tỉ lệ thích hợp sẽ cho
lửa thấy có hơi nước nghe tiếng nổ. đọng trên thành phễu.
Thí Cho 8ml dung dịch nghiệm H
Hydro vào ống 2 là hydro phân tử
2SO4 10% + 2 ml dd số 2 : không có tính khử mạnh nên không tác
Hoạt tính nghiệm. Lắc kỹ rồi dụng với KMnO4. Dung dịch nhạt màu của chia
đều 3 ống nghiệm một ít là do trong dung dịch khí còn tồn hydro Ống 1: Dùng
làm ống tại nguyên tử hydro mới sinh chưa kết phân tử chuẩn. hợp thành phân
Downloaded by Bin1 Chan (chanbintp1@gmail.com) lOMoAR cPSD| 59416725
tử. và hydro Ống 2: Cho luồng khí nguyên hydro thu được ở thí Khí sinh ra là
do hydro nguyên tử tử nghiệm trên lội qua, chưa phản ứng kết hợp thành hydro
phân màu của dung dịch tử. Hydro mới sinh là hydro nguyên tử, nhạt dần nhưng
không có tính khử mạnh nên phản ứng với mất. KMnO4 làm mất màu dung dịch. Zn + H
Ống 3: Cho vào vài hạt 5[H] + MnO - 2SO44 → ZnSO + 3H+ → Mn 4 + 2[H]2+ + 4H O₂
kẽm. Kẽm tan, xuất Kết luận : Hydro nguyên tử có tính hiện bọt
khi dung dịch nhạt màu rồi trở thành khử mạnh hơn hydro phân tử. trong suốt.
Thí Trộn đều 4g KClO3 + 2KClO nghiệm 1g MnO 3 → 2KCl + 3O2 2 bằng cối và
MnO2 là chất xúc tác số 3: chày sứ, cho vào ống Kết luận: Điều chế nghiệm thật
khô. Lắp oxy hệ thống thu khí như hình sau: KClO3 dễ bị nhiệt phân khi có
chất xúc tác thích hợp tạo ra O 2 Đun nóng ống nghiệm và thu khí thoát ra trong
một ống nghiệm lớp chứa
đầy nước úp ngược trong chậu nước.
Thí a. Dùng thìa kim loại Lưu huỳnh tác dụng với khí nghiệm lấy một ít lưu
huỳnh oxy cho ngọn lửa màu xanh và số 4: rồi đốt cháy. Cho vào phát nhiều
nhiệt và tạo SO2 có tính chất miệng ống nghiệm mùi hắc và một lượng rất bé SO3.
của oxy chứa oxy thì ngọn lửa bùng lên và có màu S + O lam nhạt. Tạo 2 → SO2 thành S + O chất khi có mùi hắc. 2 → SO3
Ở nhiệt độ cao, Cacbon có
b. Làm lại thí nghiệm tính khử mạnh nên khi gặp Oxy trên thay lưu
huỳnh sẽ phản ứng mãnh liệt bằng đốm than ta thấy C + O2 →CO2
đốm than bừng sáng . - Lớp màu đen là do đồng bị c. Nung đỏ sợi
dây đồng đưa vào ống oxy hóa bởi oxy tạo oxit đồng. nghiệm chứa khí Oxi lOMoAR cPSD| 59416725 ta thấy dây đồng đen 2Cu + O2 → 2CuO lại. Kết luận :
Oxy là chất oxi hóa mạnh (đặc biệt ở
nhiệt độ cao), dễ oxi hóa kim loại và phi
kim tạo oxit. Oxy duy trì và kích thích sự cháy.
Thí a. Tính oxi hóa của nghiệm
H2O2 : Cho vào ống số 5: nghiệm 3-5 giọt KI a. Tính
0.5N rồi nhỏ thêm 2-3 chất
giọt H2O2 3% + vài H2O2
+ 2 H+ + 2 (I)- → I H 2N. Dung
2 + 2 H2 2O2 giọt H2SO4 O dịch có màu vàng chuyển sang nâu đất và làm xanh hồ tinh bột.
I2 sinh ra làm xanh hồ tinh b. Phân huỷ
H2O2 Cho bột. Màu nâu đất của dung dịch vào ống nghiệm 10 là
do I2 tạo phức với giọt H2O2 bỏ thêm 1 KI dư. lượng MnO2. Dung b.
dịch sủi bọt khí mạnh.
Đưa đóm than vào gần MnO2 làm xúc tác cho quá trình
ta thấy đóm than sáng phân huỷ H2O2 hơn.
Chứng tỏ đó là H2O2 ⟶ H2O + O2 khí Oxy.
Kết luận : H2O2là chất oxi hoá mạnh và không bền. Thí Cho vào chén sứ 1g
nghiệm lưu huỳnh, đun sôi. Khói trắng là lưu huỳnh bị bốc hơi. số 6 : Dùng kẹp đưa sợi dây Phản
đồng vào miệng chén. Cu + S → CuS ứng giữa Sợi dây đồng chuyển S và Cu sang màu đen. Kết luận:
Lưu huỳnh có tính chất oxi hóa mạnh ở nhiệt
độ cao. Lưu huỳnh đóng vai trò chất oxi hóa trong phản ứng trên Thí Cho vào 2 ống lOMoAR cPSD| 59416725 nghiệm nghiệm, mỗi ống 2 8MnO - 2- 4 + 5S2O3 + 14H+ → 8Mn2+
7: Tính giọt dung dịch + khử của Na2S2O3 0.5N. tiosunfat
Ống 1: thêm từng giọt 10 SO2 + 7H2O hỗn hợp dung dịch KMnO 2- 4
0.5N và S2O3 + H+ → SO2 + H2O + S H 2N (tỉ lệ 1:2). 2SO4
Hiện tượng. Phản ứng S sinh ra làm đục dung dịch. xảy
ra nhanh làm mất màu thuốc tím.Sau 2I 2- 2 + 2S2O3 → 4I- + S
một thời gian thì dung dịch bị đục. 4O6 Ống 2: thêm từng giọt S 2-
2O3 + 5 H2O + 4 Br2 → 8 (Br)- iốt. hiện tượng:
màu + 10 H+ + 2 SO 2- 4 tím than của I 2-
2 mất dần đến không màu.Thay S2O3 + 4 Cl2 + 5 H2O → 2 SO 2- 4 I2 bằng Cl2
hoặc + 8 Cl- + 10 H+
Br2.Màu vàng lục của khí Clo và màu đỏ của Brom mất màu
Thiosunfat có tính khử mạnh và dễ phân
hủy trong môi trường axit tạo lưu huỳnh.




