

Preview text:
lOMoAR cPSD| 45148588
NHÓM IIA: CÁC KIM LOẠI KIỀM THỔ Be Mg Ca Sr Ba Ra
1, Vì sao gọi các kim loại nhóm IIA là kim loại kiềm thổ? Tính chất đặc trưng
của kim loại kiềm thổ?
-Nhóm IIA được gọi là kiềm thổ vì :
Chúng có tính chất trung gian giữa các chất kiềm (oxide của các kim loại kiềm) và
oxide cuả các kim loại đất hiếm như xeri (Ce), erbi (Er)…
Các oxide của chúng có nhiệt độ nóng chảy cao, độ tan bé, khi tan trong nước tạo dung dịch kiềm.
- Tính chất đặc trưng của kim loại kiềm thổ:
Kim loại kiềm thổ có cấu hình electron lớp ngoài cùng là ns2 dễ nhường 2e thể hiện tính khử mạnh
Trong các hợp chất thì các kim loại kiềm thổ có hóa trị +2
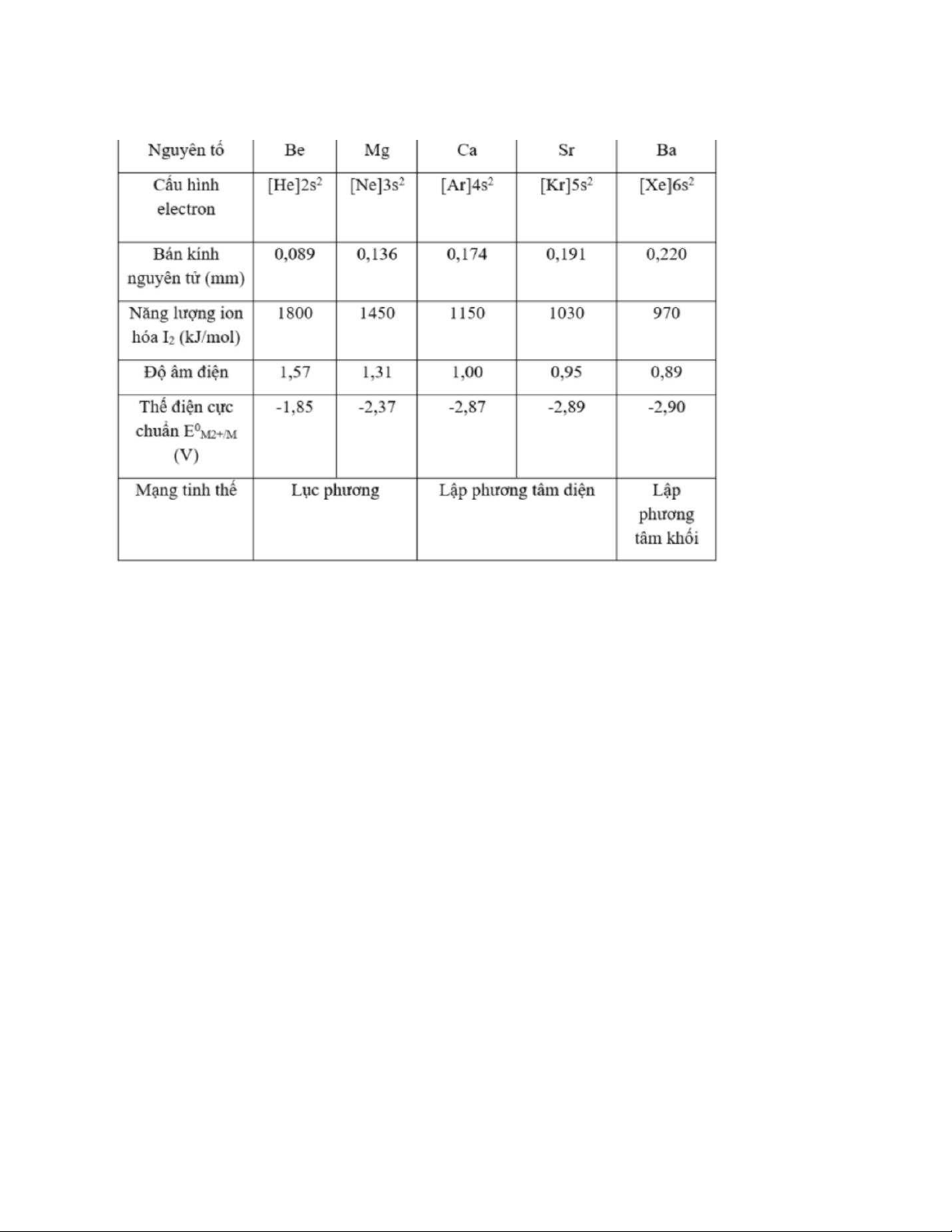
Đi từ trên xuống kích thước nguyên tử và kích thước ion tăng dần nên năng lượng
ion hóa và độ âm điện giảm, tính khử tăng dần từ Be đến Ba lOMoAR cPSD| 45148588
Kim loại kiềm thổ có tính dẫn điện, dẫn nhiệt tốt, độ cứng giảm dần từ Be đến Ba
2, Dựa vào tính chất nguyên tử của nhóm IIA, giải thích: a, giải thích
Năng lượng ion hóa thứ nhất I1 là năng lượng cần thiết để loại bỏ electron đầu tiên
từ nguyên tử trung tính, tạo ra ion M+
Năng lượng ion hóa thứ hai I2 là năng lượng cần thiết để loại bỏ electron thứ hai từ
ion M+ đã tạo thành, tạo ra ion M2+
Việc năng lượng ion hóa thứ hai cao hơn năng lượng ion hóa thứ nhất cho thấy các
kim loại kiềm thổ dễ tạo ion M+. Nhưng trên thực tế, nhiều phản ứng được thực
hiện ở trong dung dịch cho nên nhiệt hidro hóa rất âm của các ion M2+ đủ bù cho
năng lượng ion hóa cao làm cho kim loại kiềm thổ dễ mất hai electron hóa trị làm
cho chúng biến thành ion M2+ lOMoAR cPSD| 45148588 b, So Sánh
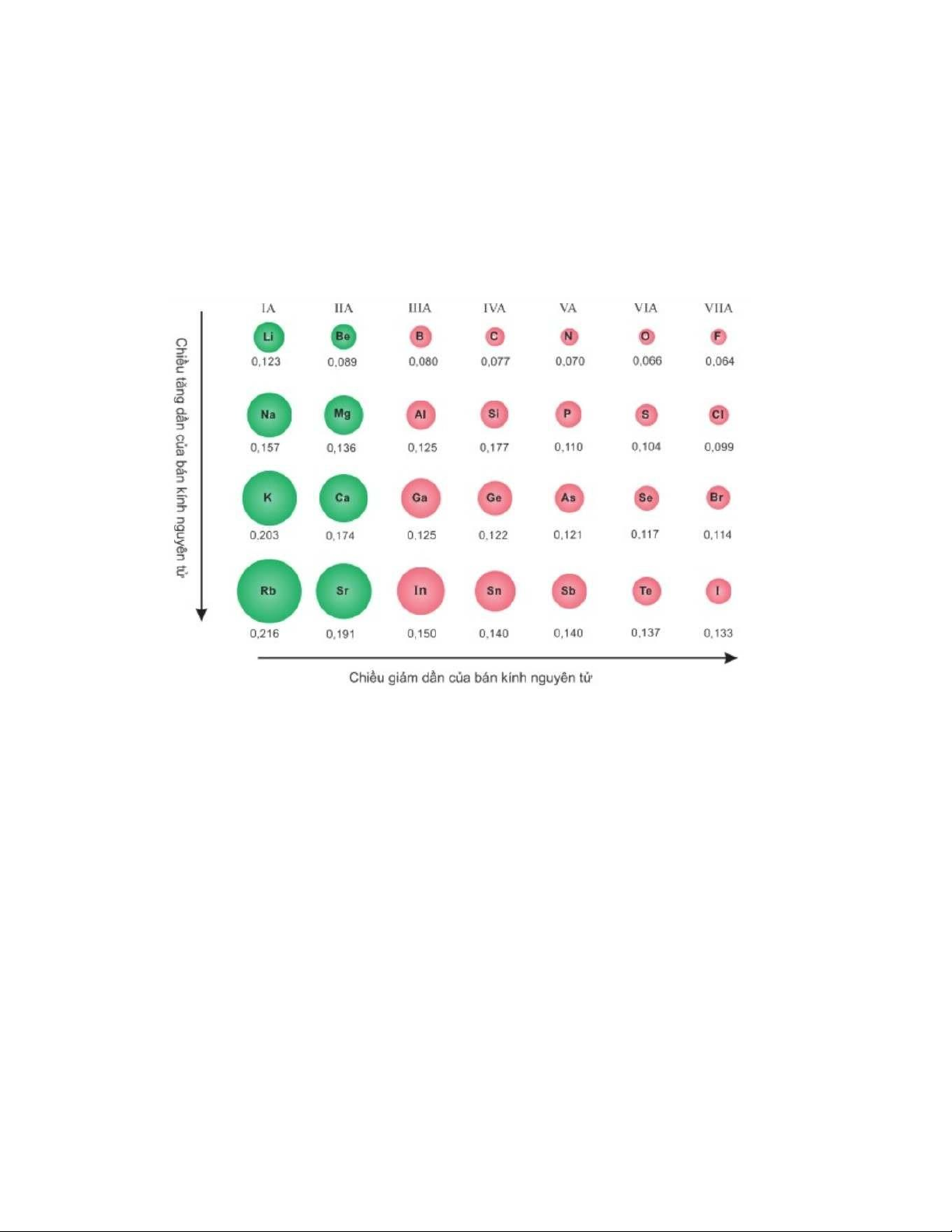
- Bán kính nguyên tử tăng dần từ Ba đến Re
Vì : số lớp electron tăng khi đi từ trên xuống dưới trong bảng tuần hoàn làm
cho bán kính nguyên tử tăng
- Năng lượng ion hóa giảm dần từ Be đến Ra
Vì : khi bán kính nguyên tử tăng, electron xa hạt nhân hơn do đó dễ bị loại bỏ năng lượng hơn
- Độ âm điện giảm dần từ Ba đến Ra
Vì: nguyên tử có bán kính lớn sẽ có độ âm điện thấp hơn vì lực hút giữa hạt
nhân và electron xa hơn sẽ yếu đi 3, Nội dung a, Tính chất vật lí - Các kim loại lOMoAR cPSD| 45148588 nhóm IIA đều có màu bạc hay xám nhạt, trong không khí Be và Mg giữ đc tính ánh kim còn các kim loại khác mất ánh kim nhanh chóng
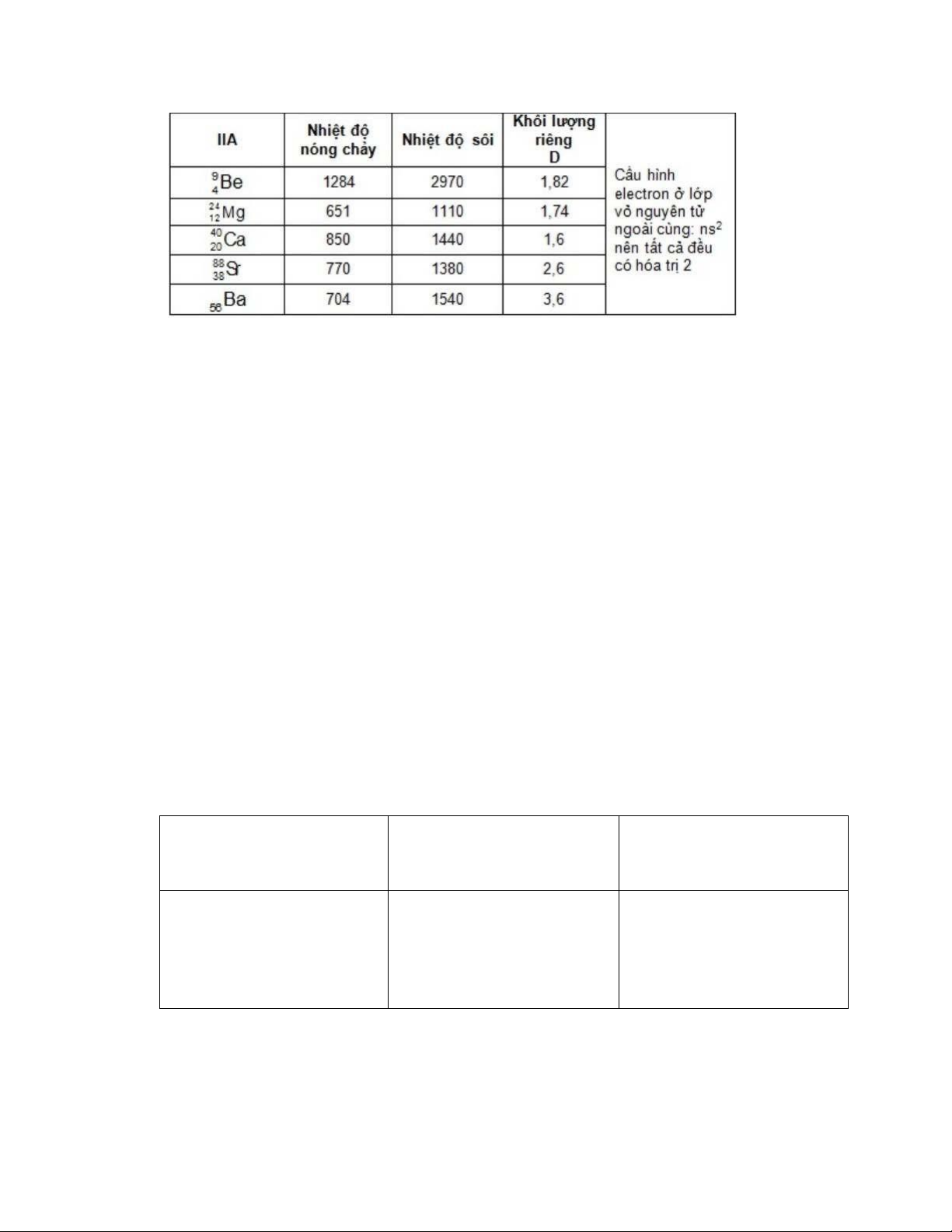
- Kim loại kiềm thổ có nhiệt độ nóng chảy, nhiệt độ sôi, tỉ khối cao hơn so với kim loại kiềm lOMoAR cPSD| 45148588
- Độ cứng của chúng lớn, trong đó Be cứng nhất có thể rạch được thủy tinh,
Mg hơi mềm và có thể kéo sợi, Ca khá cứng, Ba và Sr chỉ hơi cứng hơn chì
- Trừ Be và Mg, các kim loại nhóm IIA khác và hợp chất dễ bay hơi của
chúng cũng nhuốm màu ngọn lửa
- Ca: đỏ da cam, Sr: đỏ son, Ba: lục hơi vàng, Ra: đỏ thẩm
b, Nhận xét : Các tính chất vật lí của kim loại kiềm thổ có sự biến đổi một cách tuần hoàn bởi vì:
+ Bán kính nguyên tử tăng dần từ Be đến Ra
+ Nhiệt độ nóng chảy và nhiệt độ sôi có xu hướng giảm dần từ Be đến Ra
+ Độ cứng giảm từ Be đến Ra
C, So sánh các tính chất vật lí của kim loại kiềm thổ và kim loại kiềm ta thấy như sau: Nội dung Kim loại kiềm(ns1) Kim loại kiềm thổ(ns2) Bán kính nguyên tử Có bán kính lớn hơn Có bán kính nhỏ hơn trong cùng 1 chu kì trong cùng 1 chu kì lOMoAR cPSD| 45148588 Độ cứng Rất mềm có thể cắt Cứng hơn kim loại được bằng dao kiềm
Nhiệt độ nóng chảy và Thấp hơn Cao hơn nhiệt độ sôi Khối lượng riêng Thấp hơn Cao hơn