Preview text:
6.1. Phản ứng : NO(k) + 1/2O2 (k) = NO2 (k) thực hiện trong bình kín có thể tích không ổi. Nên hệ phản ứng là hệ kín.
Các chất trong phản ứng ều là chất khí nên hệ phản ứng là hệ ồng thể.
Do phản ứng tỏa nhiệt (H0298 < 0) nên nhiệt ộ sẽ tăng trong quá trình phản ứng. Sau phản ứng, hệ ược ưa về nhiệt ộ ban ầu, nên ể giảm nhiệt ộ hệ phải trao ổi nhiệt bên ngoài. Vậy hệ phản ứng không là hệ cô lập.
Kết luận: Hệ phản ứng là hệ kín và ồng thể. Đáp án b
6.2. Hệ kín là hệ chỉ có thể trao ổi năng lượng (nhiệt, công) mà không trao ổi chất với môi trường bên ngoài. Đáp án d
6.3
1.Khí quyển là hệ ồng thể chứ không là hệ ồng nhất vì áp suất khí quyển thay ổi từ từ và liên tục theo ộ cao. Ý 1 sai
- Dung dịch NaCl là hệ ồng thể và ồng nhất vì thành phần tính chất như nhau tại mọi iểm trong hệ. Ý 2 úng.
- Benzen là chất lỏng không cực, nước là chất lỏng có cực nên chúng không tan vào nhau tách làm hai pha: Benzen ở phía trên, nước ở dưới, tạo thành hệ dị thể.Ý 3 úng.
4.Trong quá trình nung vôi, do có ống khói nên khí CO2 và nhiệt sẽ trao ổi bên ngoài môi trường. Cho nên, hệ phản ứng là hệ hở. Ý 4 úng.
5.Phản ứng trung hòa thực hiện trong nhiệt lượng kế nên hệ không trao ổi năng lượng và chất với môi trường bên ngoài → hệ cô lập. Ý 5 úng.
Đáp án c
6.4
Các hàm trạng thái: Entanpi, nhiệt ộ, áp suất, nội năng, nhiệt dung ẳng áp (Cp=f(T)), nhiệt dung ẳng tích (Cv=f(T)) .
Hàm quá trình : Nhiệt và công.
Đáp án c
6.5. Nhiệt ộ là hàm trạng thái có thuộc tính cường ộ. Đáp án a.
Nội năng, thể tích là hàm trạng thái có thuộc tính dung ộ.
Công chống áp suất ngoài là hàm quá trình.
6.6. Biểu thức nguyên lí I của nhiệt ộng học: Q = U + A Hay U = Q - A
Khi hệ i từ trạng thái I (nội năng U1) ến trạng thái II (nội năng U2 ) bằng những ường i khác nhau:
Đường i 1: Nhiệt và công mà hệ trao ổi với môi trường là Q1 và A1.
U = U2 – U1 = Q1 - A1
Đường i 2: Nhiệt và công mà hệ trao ổi với môi trường là Q2 và A2.
U = U2 – U1 = Q2 – A2
Đường i 3: Nhiệt và công mà hệ trao ổi với môi trường là Q3 và A3.
U = U2 – U1 = Q3 – A3
Hay U = U2 – U1 = Q1 - A1 = Q2 – A2 = Q3 – A3
Cho nên biến thiên nội năng U không thay ổi khi thực hiện bằng những ường i khác nhau và luôn bằng Qi – Ai theo ịnh luật bảo toàn năng lượng. Đáp án d.
6.7
Một hệ biến ổi từ trạng thái 1 ến trạng thái 2 trong iều kiện ẳng áp:
Qp = H = U + A
Vì H < 0 và U < 0 nên công A có thể dương hay âm. Đáp án là d
6.8
Một hệ hấp thu nhiệt lượng nên Q = +300kJ ( theo quy ước hệ nhận nhiệt thì Q>0) Nội năng tăng nên U= +250kJ .
Ta có: Q = U + A → A = 300-250 = 50 [kJ] > 0 nên hệ sinh công.
Đáp án b 6.9
Trong một chu trình thì trạng thái cuối của hệ trùng trạng thái ban ầu.
Nên nội năng ầu U1 bằng nội năng cuối U2 → U = U2 – U1 = 0
Ta có : Q = U + A → Q = A
Công mà hệ nhận A = -2kcal (công mà hệ nhận thì qui ước A< 0) Nhiệt mà hệ trao ổi với môi trường Q = -2kcal. Đáp án a.
6.10
- Công thức tính công dãn nở của quá trình ẳng nhiệt, ẳng áp: A = n.R.T chỉ úng cho hệ khí lí tưởng . Ý 1 sai.
- Trong trường hợp tổng quát: Q = U + A(dãn nở) + A’( công có ích) trong ó A’≥ 0.
Vì quá trình ẳng tích V= 0 → A(dãn nở) = 0 → Qv = U + A’
Nên khi cung cấp cho hệ ẳng tích một nhiệt lượng Qv >0 thì toàn bộ lượng nhiệt này không chỉ làm tăng nội năng (U > 0) mà còn có khả năng sinh công có ích (A’≥ 0). Phát biểu 2 không chính xác.
- Trong quá trình phản ứng, hệ chỉ thực hiện công chống áp suất ngoài (công dãn nở) tức công có ích A’=0.
Ta có : Qpư = U + A
Xét phản ứng ở iều kiện ẳng áp, ẳng nhiệt:
aA + bB = cC + dD U1, V1 ,T U2 , V2 ,T
A = P. V = P.(V2 – V1) ; U = U2 - U1
Qp = U + A = (U2 - U1) + P.(V2 – V1) = ( U2 + PV2) - ( U1 + PV1) = H2 – H1 =Hp
Vậy hiệu ứng nhiệt của phản ứng hóa học ở iều kiện ẳng áp bằng biến thiên entanpi . Ý 3 úng.
Đáp án d
6.11. Công dãn nở thuận nghịch 5 mol khí lý tưởng:
n = 5mol; R= 8,314J/mol.K; T = 298K; P1= 10atm; P2=1atm.
2 2
1 1 1 p2 V V |
Đáp án a 6.12
Trong iều kiện ẳng tích nên V = 0 → A(dãn nở)= 0.
Phản ứng phát nhiệt nên : Qv < 0
→ Qv = Uv + A = Uv < 0 Đáp án d.
6.13
Phản ứng : A (r ) + 2B (k ) = C(k) + 2D (k)
Có n = 3-2 = 1[mol] > 0 → n.R.T > 0
Phản ứng phát nhiệt nên Qp = H < 0
Vì chất khí xem là khí lý tưởng nên A= P. V = n.R.T
Qp = H = U + n.R.T
Vì H < 0 và n.R.T > 0 nên U > H Đáp án câu c.
6.14
Phản ứng : C2H5OH(lỏng) + 3O2(k) = 2CO2 (k) + 3H2O(lỏng)
n = 2-3 = -1[mol] < 0
Vì chất khí xem là khí lý tưởng ta có:
Qp – Qv = ∆n.R.T = -1[mol].8,314[J/mol.K].298[k] = -2478[J] Vậy sự chênh lệch giữa Qp và Qv là 2478J. Đáp án b
6.15
H0298 của phản ứng hóa học là biến thiên của hàm trạng thái nên chỉ phụ thuộc vào bản chất và trạng thái của chất ầu và sản phẩm, không phụ thuộc vào ường i nên không phụ thuộc nhiệt ộ lúc diễn ra phản ứng. Ý a,b,d sai.
Vì H là thông số dung ộ nên H0298 phụ thuộc vào cách thiết lập các hệ số tỉ lượng trong phương trình phản ứng. Ý c úng. Đáp án c
6.16
Hiệu ứng nhiệt tạo thành tiêu chuẩn khí CO2 là biến thiên entanpi của phản ứng:
C(graphit) + O2(k) = CO2(k) ; nhiệt ộ T tùy ý, C(gr) nguyên chất bền ở 1atm và nhiệt ộ T, áp suất riêng phần của các khí O2 và CO2 là 1 atm. Nên ta có: a. Đúng
b. Sai vì C(kim cương)
c,d. Cả hai ý ều sai, vì áp suất chung Pchung = PO2 + P CO 2 = 1 atm Đáp án a
6.17
Xét phản ứng ốt cháy Mg(r) ( hay phản ứng tạo thành MgO(r)) :
Mg ( r ) + 1/2O2 (k) = MgO(r) ; (H0298)tt MgO(r ) = (H0298 )c Mg(r)
3 g Mg → Q = -76 kJ
24g Mg ( 1mol Mg) → (H0298)tt MgO(r ) = ?
(H0298)tt MgO(r ) = 24.(-76) /3 = -608 [kJ/mol] → Đáp án b
6.18
Xét phản ứng ở iều kiện tiêu chuẩn 250C:
H2(k) +1/2O2(k) = H2O(lỏng) (1) ; (H0298)pư = -241,84kJ < 0
- Phản ứng này là phản ứng ốt cháy H2 nên (H0298)cH2 = -241,84 kJ/mol. Ý 1 úng
- Phản ứng này là phản ứng tạo thành nước lỏng nhưng ý 2 cho là phản ứng tạo thành hơi nước nên sai.
- Ý 3 úng.
- Để xác ịnh năng lượng liên kết ta phải xét phản ứng sau:
H-O-H (khí) = 2H(khí) + O(khí) (2) ; H0298 = 2Elk (O-H)
Trong khi ó ý 4 tính Elk (O-H) bằng cách ổi chiều phản ứng (1) như sau:
H –O –H (lỏng) = H2(k) +1/2O2(k) (3) ; H0298 = +241,84 kJ =2Elk(O-H)
→ Elk(O-H) = ½( 241,84) = 120,92 kJ/mol
Cách tính này là sai vì phản ứng (3) không giống phản ứng (2). Đáp án c
6.19
Phản ứng phân hủy là phản ứng nghịch của phản ứng tạo thành.
Nên (H0298)phủy = - (H0298)tt
Chất dễ bị phân hủy là chất có nhiệt phân hủy thấp nhất (âm nhất) tức có nhiệt tạo thành dương nhất. Vậy C2H2 là chất dễ phân hủy nhất trong các chất ã cho. Đáp án d
6.20
Phản ứng ốt cháy ở iều kiện chuẩn 250C thì sản phẩm cháy gồm C và O phải là khí CO2 , H và O phải là H2O lỏng.
- Sản phẩm là CO nên sai.
- H2O (khí) nên sai.
- Ý 3 úng. Đáp án a
6.21 Năng lượng liên kết là năng lượng cần tiêu tốn ể phá hủy 1 mol liên kết ể tạo thành các nguyên tử tự do (các chất trong phản ứng ở thể khí) . Đơn vị là kJ/1mol liên kết
Ví dụ: H-H(k) = 2H(k) H0298= EH-H > 0
CH4(k) = 4H(k) + C(k) H0298 = 4 EC-H > 0
Liên kết H-H C-H C-C
Elk [kJ/mol] 435,5 412,9 347,3
Các giá trị Elk này chênh lệch không quá nhiều. a.Xét phản ứng tạo thành CH4(k):
H
C(gr) + 2H-H(k) = H - C - H (k) (4) ; (H0298)tt CH4
H
Thiết lập các phản ứng trung gian:
C(gr) = C(Khí) (1) ; (H0298)thăng hoa C > 0
2H-H (k) = 4H(k) (2) ; 2. EH-H > 0 C(khí) + 4H(k) = CH4(k) (3) ; - 4EC-H < 0
(1) + (2) +(3) = (4) nên ta có:
(H0298)tt CH4 = (H0298)thăng hoa C + 2EH-H - 4EC-H < 0 Ở ây ta thấy có 3 giá trị dương trừ cho 4 giá trị dương.
Tương tự xét phản ứng tạo thành C2H6 (k):
2C(gr) + 3H2 (k) = CH3 – CH3 (k)
(H0298)tt C2H6 = 2(H0298)thăng hoa C + 3EH-H - 6EC-H - EC-C < 0 Ở ây ta thấy có 5 giá trị dương trừ 7 giá trị dương Tương tự xét phản ứng tạo thành C3H8 (k):
3C(gr) + 4H2 (k) = CH3 – CH2 – CH3 (k)
(H0298)ttC3H8 = 3(H0298)thăng hoa C + 4EH-H - 8EC-H - 2EC-C < 0 Ở ây ta thấy có 7 giá trị dương trừ 10 giá trị dương.
Cùng dãy ồng ẳng, khi hợp chất hữu cơ có khối lượng tăng thì số liên kết cộng hóa trị tạo thành trong hợp chất tăng theo nên nhiệt tạo thành sẽ càng âm hay trị số tuyệt ối của nhiệt tạo thành càng tăng.
Ví dụ: Các ồng ẳng ankan (khí) : CH4 C2H6 C3H8 (H0298)tt [kJ/mol] -74,8 -84,7 -103,8 a. Ý a úng.
b.Phản ứng ốt cháy là phản ứng tỏa nhiệt.
Cùng dãy ồng ẳng, khi các hợp chất hữu cơ có khối lượng tăng tức số C và H tham gia vào pư cháy tăng sẽ tạo nhiều CO2 và H2O tức nhiệt ốt cháy sẽ càng âm hay trị số tuyệt ối của nhiệt ốt cháy càng tăng. Ý b sai.
Ví dụ: Các ồng ẳng ankan (khí) : CH4 C2H6 C3H8 (H0298)cháy [kJ/mol] -890,35 -1559,8 -2220,03 c. Trong cùng iều kiện: H(khí) > H(lỏng) > H(rắn) Xét các quá trình chuyển pha:
Rắn → lỏng (1) ; H1 (nóng chảy) = H(lỏng) – H(rắn) > 0 lỏng → Khí (2) ; H2 (bay hơi) = H(khí) – H(lỏng) > 0
Rắn → Khí (3) ; H3 (thăng hoa) = H(khí) – H(rắn) > 0 Vì (3) = (1) + (2) nên ta có:
H3 (thăng hoa) >0 = H1 (nóng chảy) >0 +H2 (bay hơi) >0
→ H3 (thăng hoa) > > H1 (nóng chảy) . Ý c úng
d. Nhiệt hòa tan của một chất phụ thuộc vào bản chất và lượng dung môi. Khi lượng dung môi dư thì nhiệt hòa tan không thay ổi.
Ví dụ: Nhiệt hòa tan của 1 mol H2SO4(lỏng) trong dung môi nước ở 250C.
Lượng dung môi 1mol H2O 100molH2O ∞H2O
(H0298)hòa tan [kJ/mol] -28,05 -73,32 -95,18
Ý d úng. Đáp án b 6.22
1. Nhiệt tạo thành tiêu chuẩn của mọi ơn chất bền nhất ở iều kiện chuẩn ược qui ước bằng không.
Ví dụ : Ở iều kiện chuẩn 250C thì I2 bền nhất là trạng thái rắn.
Nên (H0298)tt (I2(rắn)) = 0 , còn (H0298)tt (I2(khí)) = 62,43kJ/mol≠0 → Ý 1 sai
2.Nhiệt cháy tiêu chuẩn ược tính cho 1 mol chất phản ứng với khí O2 cho các oxyt cao bền ở iều kiện phản ứng có giá trị không ổi. Ý 2 úng. 3. Nhiệt hòa tan của một chất phụ thuộc vào bản chất và lượng dung môi. → Ý 3 sai
4. Quá trình chuyển pha là quá trình trong ó một chất chuyển từ một trạng thái tập họp này sang một trạng thái tập họp khác. Quá trình chuyển pha có thể là:
thăng hoa, bay hơi, nóng chảy, biến ổi a hình.....
Hiệu ứng nhiệt của quá trình chuyển pha gọi là nhiệt chuyển pha.
Nhiệt chuyển pha tiêu chuẩn của 1 chất ược tính cho 1 mol chất chuyển pha nên có giá trị không ổi. Ý 4 úng.
Ví dụ: Quá trình thăng hoa iot: I2(rắn) = I2(khí) ; H0298 = 62,44 kJ/mol Đáp án c
6.23
Phản ứng tạo thành khí CO2 cũng là phản ứng ốt cháy C(gr): C(gr) + O2(k) = CO2(k) ; (H0298)tt CO2(k) = (H0298)c C(gr)
33 gCO2 → Qpư = -70,9kcal
44g CO2 (1mol CO2) → (H0298)tt CO 2 = -70,9.44/33 = - 94,5 [kJ/mol] Đáp án c.
6.24
Phản ứng : N2(k) + O2(k) = 2NO(k) ; H0298 = 180,8 kJ
2 mol NO(k) → Q = 180,8 kJ
1 mol NO(k) → Q = 180,8/2 = 90,4 kJ > 0 phản ứng thu nhiệt. Đáp án c. 6.25
1.Phản ứng có H >0 nên phản ứng thu nhiệt. Ý 1 úng
2.H là biến thiên hàm trạng thái chỉ phụ thuộc vào bản chất trạng thái ầu và cuối không phụ thuộc ường i nên không ánh giá ược tốc ộ phản ứng.Ý 2 sai.
3.H xét chiều phản ứng ở nhiệt ộ thấp. Nhưng bài tập không cho biết nhiệt ộ
nên không kết luận khả năng tự phát của phản ứng.Ý 3 sai Đáp án b 6.26
Phát biểu chính xác và ầy ủ ở áp án a.
6.27
- H của phản ứng hóa học không cho biết ược mức ộ diễn ra của quá trình ( hiệu suất phản ứng). Ý a sai.
- H là biến thiên của hàm trạng thái (entanpi) nên không phụ thuộc vào quá trình. Ý b úng. Đáp án b
- H chỉ xét chiều phản ứng ở nhiệt ộ thấp. Ý c sai
- S mới ặc trưng cho ộ hỗn loạn của quá trình . Ý d sai.
6.28 Ta có: C → A ; H1 D → C ; H2
B → D ; -H3
Suy ra: B → A ; H0 = H1 + H2 - H3
Đáp án c
6.29 Tính H của phản ứng: S(r) + O2(k) = SO2(k)
Biến ổi các phản ứng sau: Phản ứng (1) ổi chiều và chia 2 cho cả hai vế ể có 1 mol SO2 bên vế phải của pư, khớp với phản ứng cần tính H. Phản ứng (2) chia 2 cho cả 2 vế ể có 1mol S bên vế trái, khớp với phản ứng cần tính H.
SO3(k) = SO2(k) + 1/2O2(k) ; H1’ = 196/2
S(r) + 3/2O2(k) = SO3(k) ; H2’= -790/2 Cộng hai phản ứng trên ta ược phản ứng:
S(r) + O2(k) = SO2(k) ; H =H1’ + H2’ = (196/2) +(-790/2)= -297[kJ] Đáp án a
6.30.
Để tính hiệu ứng nhiệt của phản ứng: A + B = E + F
Ta lấy pứ (1) cộng với phản ứng (2) ổi chiều. Đáp án a
6.31. Tính H0298 của phản ứng: FeO(r) + H2 (k) = Fe(r) + H2O(k)
FeO(r) + CO(k) = Fe(r) + CO2(k) (1) ; H0298 = -18,2kJ
Phản ứng (1)giử nguyên vì có 1mol FeO bên trái khớp với phản ứng cần tính H.
CO2(k) = CO (k) + 1/2O2(k) (2) ; H0298 = 566,0/2 kJ
Biến ổi ta có phản ứng (2) nhằm loại CO và CO2 của pư (1)
H2(k) + 1/2O2(k) = H2O (k) (3) ; ( H0298 )tt H2O(k) = -241,8kJ
Phản ứng tạo thành H2O(k) (3) giử nguyên vì có 1mol H2 bên trái khớp với phản ứng cần tính H.
Cộng (1) + (2) + (3) ta ược phản ứng :
FeO(r) + H2 (k) = Fe(r) + H2O(k) ; H0298 = -18,2+(566,0/2) - 241,8 = 23[kJ]
Đáp án b
6.32 Đáp án d ( nội dung ý 3 không học)
6.33
Tính H0298 của pư : 2NH3(k) + 5/2O2(k) = 2NO(k) + 3H2O(k)
(H0298)tt[kJ/mol] -46,3 0 90,4 -241,8
(H0298)pư = [2.90,4 + 3.(-241,8)] – [2.(-46,3)] = -452[kJ ] < 0 → pư tỏa nhiệt.
Đáp án a
6.34 Tính (H0298)c CH4(k) của phản ứng: CH4(k) + 2O2(k) = CO2(k) + 2H2O(l)
(H0298)tt[kJ/mol] -74,85 0 -393,51 - 285,84
Tính nhiệt phản ứng trên theo nhiệt tạo thành thì ta lấy tổng nhiệt tạo thành sản phẩm trừ tổng nhiệt tạo thành chất ầu . Đáp án b
6.35
Tính (H0298)tt CH3OH(lỏng) của phản ứng: C(gr) +2H2(k) + 1/2O2(k) = CH3OH(lỏng) (4) Ta biến ổi các phản ứng:
C(gr) + O2(k) = CO2(k) (1) ; H01 = -94kcal
Phản ứng (1) giử nguyên vì có 1mol C(gr) bên trái giống pư (4)
2H2(k) + O2(k) = 2H2O(lỏng) (2) ; H02 = -68,5.2 kcal
Nhân 2 cho hai vế ta có pứ (2) ể có 2 mol H2 bên trái giống phản ứng (4)
CO2(k) + H2O(lỏng) = CH3OH(lỏng) + 3/2O2(k) (3); H03 = 171kcal
Đảo chiều ta có pứ (3) ể có 1 mol CH3OH bên phải giống pư (4)
Cộng (1) với (2) với (3) ta ược phản ứng (4) nên
(H0298)tt CH3OH(lỏng) = -94 – (68,5.2) +171 = -60 [kcal] Đáp án c
6.36
Ở iều kiện chuẩn số mol khí than ướt : 112 [lít] /22,4[ lít/mol] = 5mol
Khí than ướt là hỗn hợp ồng thể tích của H2 và CO nên mỗi khí có 2,5mol.
(Qcháy) khí than ướt = (Qcháy) H2 + (Qcháy)CO
Phản ứng cháy 1mol khí H2 (cũng là phản ứng tạo thành 1 mol nước lỏng):
H2(k) + 1/2O2(k) = H2O(lỏng) ; (H0298)c H2 = (H0298)tt H2O = - 285,8 kJ/mol
Nhiệt ốt cháy 2,5mol khí H2 : (Qcháy) H2 = 2,5.(-285,8) [kJ]
Phản ứng ốt cháy 1 mol khí CO: CO(k) + 1/2O2(k) = CO2(k)
(H0298)tt[kJ/mol] -110,5 -393,5
Nhiệt ốt cháy 2,5mol khí CO : (Qcháy) CO = 2,5.[ -393,5 - (-110,5)]
Tính (Qcháy) khí than ướt = (Qcháy) H2 + (Qcháy)CO = - 1422 [kJ ]
Đáp án a
6.37
Tính nhiệt tạo thành tiêu chuẩn ở 250C của MgCO3(r) từ phản ứng:
Mg(r) + C(gr) + 3/2O2(k) = MgCO3(r) (4); (H0298)tt MgCO3(r)
Ta có : C(gr) + O2(k) = CO2(k) (1); H0298 = -393,5 kJ
Mg(r) + 1/2O2(k) = MgO(r) (2) ; H0298 = -1203,6/2kJ
MgO(r) + CO2(k) = MgCO3(r) (3) ; H0298 = -117,7kJ
(4) = (1) + (2) + (3) nên (H0298)tt MgCO3(r) = -393,5+(-1203,6/2) -117,7 = -1112,7kJ Đáp án c
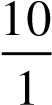 A=pdV =nRT dV nRT= lnV2 =nRT ln p1 = 58,314298ln( ) = 28524[ ]J = 28,5[kJ]
A=pdV =nRT dV nRT= lnV2 =nRT ln p1 = 58,314298ln( ) = 28524[ ]J = 28,5[kJ]