









Preview text:
lOMoARcP SD| 59062 190 lOMoARcP SD| 59062190
BÀI 5: PHƯƠNG PHÁP ĐỊNH LƯỢNG BẰNG BẠC
Định lượng NaCl, AgNO3, KSCN bằng phương pháp kết tủa I/ Chuẩn bị 1. Hóa chất
- Dung dịch gốc NaCl 0,0500N - Dung dịch AgNO3
- Dung dịch KSCN - Dung dịch HNO3 đặc
- Dung dịch NaCl - Chỉ thị K2CrO4: 5%, phèn sắt g amoni 10% 2. Dụng cụ - Buret - Cốc có mỏ
- Bình định mức - Bóp cao su - Giay lọc - Bình nón
Thí nghiệm 1: Pha dung dịch gốc NaCl 0.0500 N
Số gam NaCl cần để pha 100,00 ml dung dịch NaCl 0,0500 N n m CM =V ; n = M
→ m = M(g/mol). CM(mol/L). V(L)
mNaCl = 58,44. 0,05. 0,1 = 0,2922 (g)
Pha trong nước cho đủ 100,0 ml = 0,1 L
Thí nghiệm 2. Xác định nồng độ AgNO3 theo phương pháp Mohr 1. Quy trình tiến hành
- Cho dung dịch AgNO3 cần xác định nồng độ lên trên buret.
- Lấy chính xác 10,00 ml dung dịch NaCl 0,0500 N vừa pha trên,
cho vào bình nón, thêm 20ml nước cất, 5 giọt chỉ thị K2CrO4 5%.
- Nhỏ từ từ dung dịch AgNO3 xuống tới khi xuất hiện màu hồng nhạt. 2. Kết quả 3 kết quả: V= 9,60 ml lOMoARcP SD| 59062 190 V= 9,75 ml V = 9,70 ml Vtrung bình = 9,68 ml 3. Tính toán ● Ta có: VAgNO3 = 9,68 ml
Theo quy tắc đương lượng: NA.VA=NB.VB V NaCl. N NaCl 0,05.10 → NAgNO3= V AgNO3 = 9,68 = 0,0517 N
Vậy nồng độ N của dung dịch AgNO 3 là: 0,0521 N
Thí nghiệm 3 : Định lượng KSCN bằng AgNO3 1. Quy trình tiến hành:
- Cho dung dịch cần xác định nồng độ lên buret
- Lấy chính xác 10ml dung dịch AgNO3 vừa xác định nồng độ ở trên
vào bình nón. Thêm 2,0ml HNO3 đặc: 2,0 ml chỉ thị Fe2(SO4)3
10% (hoặc phèn sắt amoni 10%).
- Nhỏ từ từ KSCN cho tới khi xuất hiện màu đỏ. Ghi V(ml) [KSCN]
Định lượng KSCN bằng dung dịch AgNO3 chuẩn với chỉ thị Fe3+
Ag+ + SCN- → AgSCN (tr ng)ắ Fe3+ +
SCN-dư → Fe(SCN)2+ (đỏ máu) 2. Kết quả:
3 kết quả VKSCN: V= 11,75 ml V= 11,85 ml V= 11,80 ml lOMoARcP SD| 59062 190 Vtrung bình = 11,80 ml 3. Tính toán:
Ta có nồng độ N của dung dịch AgNO3 là: 0,0521 N ● V= 11,75 ml
Theo quy tắc đương lượng: NA.VA=NB.VB V AgNO3.N AgNO3 0,05.10 → NKSCN= V KSCN = 11,75 = 0,0425 N
Vậy nồng độ N của dung dịch KSCN là: 0,0425 N
Thí nghiệm 4: Định lượng clorid theo phương pháp Volhard 1. Quy trình tiến hành
Cho dung dịch KSCN vừa xác định nồng độ ở trên lên buret.
Lấy bình định mức 100,00 ml. Cho chính xác 10,00 ml dung dịch NaCl
cần định lượng, chính xác 20,00 ml AgNO3 vừa xác định nồng độ ở trên,
1,0 ml HNO3 đặc. Thêm nước cất cho đủ 100,00 ml. Lắc đều, để lắng.
Lọc 2 lần giấy lọc (nước lọc phải trong). Lấy nước lọc.
Lấy chính xác 30,00 ml nước lọc vào bình nón to, thêm 3,0 ml HNO3 đặc,
3,0 ml chỉ thị Fe2(SO4)3 10% ( hoặc phèn sắt amoni 10%)
Nhỏ từ từ KSCN xuống cho tới khi xuất hiện màu đỏ nhạt. 2. Kết quả 3 kết quả: V= 3,80 ml V= 4,00 ml V= 3,85 ml Vtrung bình = 3,88 ml lOMoARcP SD| 59062 190 3. Tính toán ● Ta có: VKSCN = 3,88 ml
Dùng Ag+ thừa để kết tủa hết Cl-: Ag+ + Cl- → AgCl (tr ng)ắ
Ag+dư + SCN- → AgSCN (tr ng)ắ
Fe3+ + SCN-dư → Fe(SCN)2+ (đỏ máu)
Gọi x là nồng độ mol/l của NaCl
Ban đầu: 10ml NaCl x (M) + 20 ml [AgNO3] → định mức thành 100ml
Lượng thừa AgNO3 là: 20.[AgNO3] - 10.x
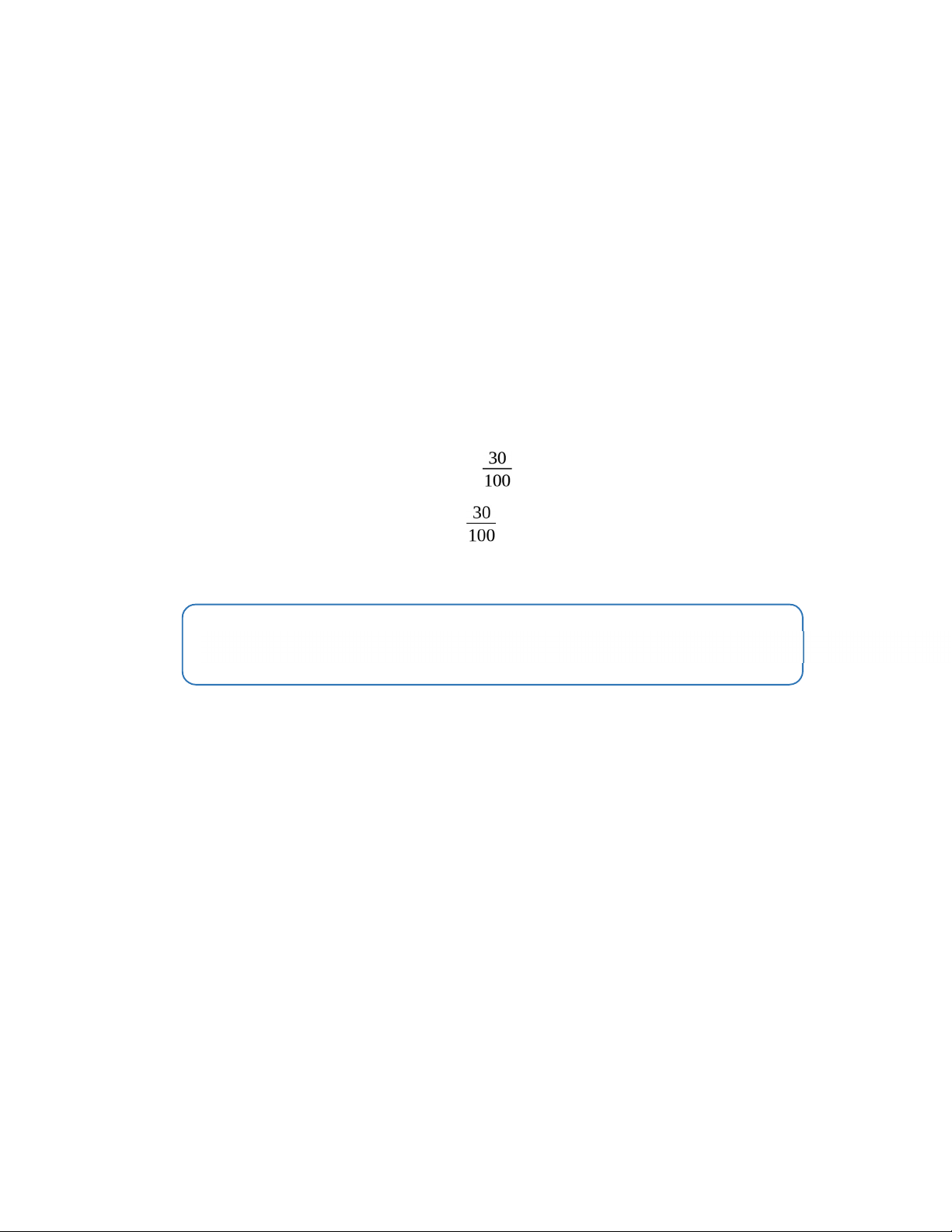
Chỉ lấy 30ml đem định lượng với SCN- nên: (20.[AgNO3] - 10.x). = VSCN- .[SCN-] (20.0,0521 -10.x).
= 3,88. 0,0425 → x = 0,0492 (mol/L)
Đổi ra: 0,0492. 58,44 = 2,8752 (g/L)
Vậy nồng độ P g/l của dung dịch NaCl cần định lượng là: 2,9434 (g/L) CÂU HỎI LƯỢNG GIÁ
1. Nêu nguyên tắc của phương pháp định lượng bạc theo phương pháp Mohr
- Trong môi trường trung tính, kết tủa ion Cl- bằng dung dịch AgNO3 theo phảnứng:
𝐴𝑔+ + 𝐶𝑙- → 𝐴𝑔𝐶𝑙 ↓
- Chỉ thị dùng là dung dịch K2CrO4, một giọt thừa Ag+ sẽ cho kết tủa Ag2CrO4
2𝐴𝑔+ + 𝐶𝑟𝑂42- → 𝐴𝑔2𝐶𝑟𝑂4 ↓ (nâu đỏ)
- Vì môi trường phải trung tính nên: nếu dung dịch acid phải trung hoà NaHCO3
bằng CaCO3 (cho thừa CaCO3, đem đuổi CO2, để nguội). Dung dịch kiềm phải
trung hoà bằng HNO3, khi pha dung dịch AgNO3 không được thêm HNO3.
2. Nêu nguyên tắc của phương pháp định lượng bạc theo phương pháp Volhard?
- Dùng Ag+ thừa để kết tủa hết Cl-:
g 𝐴𝑔+ + 𝐶𝑙- → 𝐴𝑔𝐶𝑙 ↓
- Lượng Ag+ thừa được định lượng bằng KSCN với chỉ thị Fe3+ lOMoARcP SD| 59062190 Ag+ + SCN- → AgSCN
(trắng) - Nhận ra điểm
kết thúc khi dung dịch xuất hiện màu đỏ: Fe3+ + SCN-dư → FeSCN+ (đỏ)
3. Có thể định lượng bạc theo phương pháp Mohr ở trong môi trường acid
hoặc môi trường kiềm được không? Tại sao?
- Không thể định lượng bằng Bạc theo phương pháp Mohr ở trong môi trường acid hoặc kiềm vì:
+ Phương pháp Mohr dựa trên phản ứng: 𝐴𝑔+ + 𝐶𝑙- → 𝐴𝑔𝐶𝑙 ↓
+ Phương pháp Mohr yêu cầu pH từ 6,5 đến 9,5 để đảm bảo phản ứng xảy ra chính xác.
+ Trong môi trường acid thì nồng độ ion giảm đi nhiều do tham gia phản ứng,
tạo với Ag+ kết tủa đỏ tan trong acid: H+ + CrO42- ⬄ HCrO4 2HCrO - 2- 4 ⬄ CrO7 + H2O
+ Do đó sẽ quan sát sự chuyển màu ở sau và xa điểm tương đương (sai số lớn).
• Môi trường acid yếu: Phương pháp Mohr không phù hợp với môi trường acid
mạnh vì ion Cl- (chloride) sẽ bị oxy hóa thành Cl2 (khí clo).
+ Ngược lại, trong môi trường kiềm mạnh, phương pháp Mohr cũng không phù
hợp vì tạo thành oxit và hydroxyd bạc, làm giảm độ chính xác: Ag+ + OH- → AgOH ⬇ 2AgOH → Ag2O + H2O
4. Tại sao phải lọc bỏ kết tủa AgCl khi định lượng theo phương pháp Volhard?
- Nếu không lọc tủa AgCl thì các ion SCN- sẽ phản ứng với AgCl : AgCl + SCN- ⬄ AgSCN + Cl
Vì vậy rất khó nhận ra điểm cuối chuẩn độ, vì màu đỏ sẽ xuất hiện do tạo thành
Fe(SCN)3 nhanh chóng mất đi do phản ứng trao đổi :
Fe(SCN)3 + 3AgCl ⬄ Fe3+ + 3Cl- + 3AgSCN
- Muốn có màu đỏ bền của phức sunfocyanid với Fe3+ ta cần phải tiếp tục
choSCN- nữa và mắc sai số. Do đó để tránh hiện tượng này, chúng ta phải lọc
bỏ tủa AgCl khi định lượng theo phương pháp Volhard.
- Mặt khác, việc lọc tủa AgCl sẽ dễ dàng theo dõi sự thay đổi màu sắc: dung
dịch trở nên trong suốt hơn, giúp việc quan sát màu sắc của chỉ thị dễ dàng và chính xác hơn.
5. Giải thích các quy trình định lượng trên?
- Định lượng AgNO3 theo phương pháp Mohr: Chuẩn độ AgNO3 trực tiếp bằng
Cl- với sự có mặt của K2CrO4. Khi Cl- tác dụng hết với Ag+, Ag+ dư sẽ tác dụng với CrO 2-
4 tạo thành kết tủa màu nâu đỏ, chỉ điểm kết thúc quá trình chuẩn độ. - lOMoARcP SD| 59062190
Định lượng clorid theo phương pháp Volhard: Sử dụng Ag+ dư để tạo thành kết
tủa hết với Cl-, sau đó lọc lấy dung dịch trong chứa lượng Ag+ còn lại. Tiếp tục
dùng lượng KSCN dư phản ứng hết với lượng Ag+ còn lại. Khi hết Ag+ KSCN
dư phản ứng với Fe3+ tạo thành phức chất có màu đỏ tại điểm kết thúc chuẩn độ.
6. Các định lượng trên cần chú ý điều gì?
- Phản ứng kết tủa phải xảy ra hoàn toàn (Tích số tan < 10-10)
- Kết tủa phải thực tế không tan và phản ứng phải diễn ra theo tỷ lượng nhất định.
- Phản ứng xảy ra phải nhanh, không có hiện tượng tạo thành dung dịch quá bãohòa.
- Phản ứng phải chọc lọc, các hiện tượng hấp phụ, cộng kết không làm sai kết quả phân tích.
- Có thể xác định điểm tương đương.
- Một số lưu ý khi định lượng bạc bằng phương pháp Mohr:
+ Đảm bảo pH mẫu thử từ 6,5 đến 9,5.
+ Sử dụng nước cất để pha loãng dung dịch.
+Tránh ánh sáng trực tiếp và nhiệt độ cao.
+ Kiểm tra độ chính xác bằng cách sử dụng dung dịch chuẩn bạc.
- Một số lưu ý khi định lượng bạc bằng phương pháp Volhard:
+ Sử dụng nước cất để pha loãng dung dịch. + Tránh nhiễm bẩn.
+ Kiểm tra độ chính xác bằng dung dịch chuẩn bạc.
+ Thực hiện phép đo lặp lại để đảm bảo độ chính xác.
7. Tính các kết quả trong trường hợp thể tích buret chuẩn độ hết 8,00 ml
Xác định nồng độ AgNO theo phương pháp Mohr: V = 8,00 ml 3 AgNO3
Theo quy tắc đương lượng: N .V =N .V A A B B VNaCL. NNaCl 0,05.10.0,001 → N = AgNO3 VAgNO3 = 8,00.0,001 = 0,0625 N
Định lượng clorid theo phương pháp Volhard: V = 8,00 ml KSCN
Dùng Ag+ thừa để kết tủa hết Cl-: Ag+ + Cl- → AgCl (trắng) Ag+ + SCN- → AgSCN dư (trắng) Fe3+ + SCN- → Fe(SCN)2+ dư (đỏ máu)
Gọi x là nồng độ mol/L của NaCl
Ban đầu: 10ml NaCl x (M) + 20 ml [AgNO ] → định mức thành 100ml 3 lOMoARcP SD| 59062190
Lượng thừa AgNO là: 20.[AgNO ] - 10.x 3 3
Chỉ lấy 30ml đem định lượng với SCN- nên:
(20.[AgNO ] - 10.x).30100 = V .[SCN 3 SCN- -]
⬄ (20.0,0625 -10.x).30100 = 8.0,0781 → x= 0,04125 (mol/l)
Đổi ra: 0,04125. 203,61= 8,399 (g/l)
Định lượng KSCN bằng AgNO 3 V = 8,00 ml KSCN KSCN + AgNO → AgSCN + KNO 3 3 (trắng) Fe3+ + SCN- → Fe(SCN)2+ dư (đỏ)
Theo quy tắc đương lượng: N .V =N .V A A B B V AgNO3.N AgNO3 0,0625.10.0,001 → N = KSCN VKSCN = 8,00.0,001 = 0,0781 N 8.
Trong định lượng bạc theo phương pháp Mohr, tại sao trong dung dịch
đồng thời có Cl- và CrO42- , tại sao Ag+ có sự ưu tiên phản ứng với Cl- trước? AgCl ⇌ Ag+ + Cl- T =[Ag AgCl +][Cl-]=1.8.10-10 = 1,34.10-5 Ag CrO 2 4 ⇌ 2 Ag+ + CrO 42- T =[Ag Ag2CrO4 +][CrO42-]=1,1.10-1 = 6,5.10-5
Độ tan của AgCl thấp hơn Ag CrO nên phản ứng đầu xảy ra trước. 2 4 9.
Trong định lượng SCN-, vì sao SCN- ưu tiên phản ứng với Ag+ trước rồi
mới tạo phức với Fe3+? -
AgSCN có Ksp rất nhỏ (8,74.10-13), nghĩa là nó rất ít tan trong dung dịch.
Khi có mặt SCN-, Ag+ sẽ ngay lập tức kết hợp để tạo tủa AgSCN. -
Ag+ có khả năng tạo phức mạnh hơn với SCN- so với Fe3+.Sau khi tất cả
Ag+ đã phản ứng hết thì phần dư SCN- mới kết hợp với Fe3+ để tạo thành phức
Fe(SCN)2+ màu đỏ để giúp xác định điểm cuối chuẩn độ. lOMoARcP SD| 59062190 -
SCN- chọn lọc Ag+ hơn Fe3+ do kích thước và điện tích của ion Ag+ phù hợphơn với SCN-. -
Phản ứng giữa SCN- và Ag+ xảy ra trong môi trường acid (pH 2-3), trong
khi phản ứng với Fe3+ yêu cầu pH cao hơn.
BÀI 6: PHƯƠNG PHÁP COMPLEXON
Định lượng EDTA, Mg2+, Ca2+ bằng phương pháp tạo phức I/Chu n b ẩ ị 1. Hóa chất
- MgO - Dung dịch HCl đặc
- Dung dịch Complexon III - Dung dịch đệm amoni
- Dung dịch hỗn hợp Mg2+ và Ca2+ - Dung dịch NaOH 10,0%
- Chỉ thị: ĐenericromT, murexit 2. Dụng cụ - Buret - Cốc có mỏ
- Bình định mức - Bóp cao su - Bình nón
Thí nghiệm 1: Xác định nồng độ EDTA 1. Quy trình tiến hành
- Pha dung dịch 0,1000 M MgCl2 từ MgO: cân chính xác 0,4052 g
MgO hòa tan trong một ít HCl đặc, sau khi tan hết, thêm nước đủ 100,00 ml.
- Cho dung dịch complexon III lên trên buret.
- Lấy chính xác 10,00 ml MgCl2 vào bình nón, thêm 5,00 ml dung
dịch đệm, 0,10 g (cỡ bằng hạt đậu xanh) hỗn hợp chỉ thị ĐenericromT , 20 ml nước.
- Nhỏ dung dịch complexon III xuống cho đến khi dung dịch chuyển
màu đỏ sang xanh hoàn toàn. Ghi Vml EDTA
- Tính nồng độ CM của dung dịch EDTA 2. Kết quả: lOMoARcP SD| 59062190
3 kết quả V ml EDTA: V= 14,40 ml V= 14,50 ml V= 14,45 ml Vtrung bình = 14,45 ml 3. Tính toán:
Ta có nMgCl2 =CMgCl2 . VMgCl2= 0,1 . 0,01= 0,001 (mol) Mg2+ + HInd2- ↔ MgInd- + H+ Mg2+ + HY3- ↔ MgY2- + H+ 0,001 0,001 ● V= 14,45 ml nEDTA 0,001 -> CM=VEDTA= 14,40.0,001=0,069 (M)
Vậy nồng độ của dung dịch EDTA là: 0,069M
Thí nghiệm 2: Xác định độ cứng của nước 1. Quy trình n hành ế
- Cho dung dịch complexon III lên buret
- Lấy chính xác 20,00 ml nước cần xác định vào bình nón, thêm 5,00
ml dung dịch đệm 0,10g hỗn hợp chỉ thị ĐenericromT
- Nhỏ complexon III tới cho đến khi dung dịch chuyển sang xanh hoàn toàn. 2. Kết quả
3 kết quả V ml EDTA: V= 5,40 ml V= 5,30 ml V= 5,60 ml Vtrung bình = 5,43 ml 3. Tính toán ● V=5,43 ml lOMoARcP SD| 59062 190
HY3- + MgInd- ↔ MgY2- + HInd2-(xanh)
- Kết quả thí nghiệm, ta có: VEDTA= 5,43 mL.
- Độ cứng của nước theo mg CaO/1L nước: CEDTA.VEDTA. ĐCaO.1000 0,0686.5,43.56.1000 CaO(mg/L) = Vmẫu = 20 = 1042,994 mg/L
Vậy độ cứng của nước là 1037,232 mg/L hay 1037,232 dH
Thí nghiệm 3: Định lượng hỗn hợp Mg2+ và Ca2+ 1. Quy trình tiến hành
- Bước 1: Xác định tổng trong môi trường pH=9-10 với chỉ thị ETOO và dung dịch chuẩn Trilon B
- Bước 2: Xác định nồng độ trong hỗn hợp ở môi trường pH=12 dùng chỉ thị murexit
+ Dùng pipet lấy chính xác 20,00 ml dung dịch cần xác định vào bình nón,
thêm vào đó 4,00 ml dung dịch NaOH 10,0% và 1 ít chỉ thị murexit (1%
trong KCl rắn), dung dịch có màu đỏ gạch.
+ Từ buret thêm từng giọt dung dịch EDTA đã biết trước nồng độ cho đến
khi dung dịch có màu tím hoa cà. 2. Kết quả
Bước 1: 3 kết quả: V= 14,90 ml V= 14,90 ml V= 14,80 ml Vtrung bình = 14,87 ml
Bước 2: 3 kết quả: V=7,80 ml V=7,90 ml V=7,80 ml Vtrung bình’ = 7,83 ml 3. Tính toán lOMoARcP SD| 59062 190
● V1= 14,87 ml và V’=7,83 ml
Trong môi trường pH = 9 – 10, v i ch th ETOO:ớ ỉ ị Me2+ + H2Y2- → MeY2- + 2H+
Ta chu n đ đẩộ ược V1 = 14,87 ml [Ca2+,Mg2+] =
C❑EDTAV.mẫuVEDTA =0,06920.14,87= 0,051 M
Trong môi trường pH >= 12, v i ch th murexit:ớ ỉ ị Mg2+ + 2OH- → Mg(OH)2 Ca2+ + H2Y2- → CaY2- + 2H+
Ta chu n đ đẩộ ược V’ = 7,83 mL. [Ca2+] =
C❑EDTAV.mẫuVEDTA =0,06920.7,83= 0,027 M
Suy ra [Mg2+] = 0,051 - 0,027 = 0,024 M
Vậy nồng độ Ca 2+ là 0,027M
nồng độ Mg 2+ là 0,024M CÂU HỎI LƯỢNG GIÁ
Câu 1: Nguyên tắc của phương pháp định lượng bằng complexon
- Là phương pháp định lượng dựa trên phản ứng tạo thành hợp chất nội phức
của nhiều ion kim loại với một 1 số thuốc thử hữu cơ là là các acid amin,
polycarboxylic và các dẫn chất của chúng gọi là các complexon. Hay dùng
nhất là acid etyl diamin tetra acetic (EDTA) ký hiệu là H4Y Muối đinatri của
EDTA kí hiệu là Na2H2Y có tên thông dụng là complexon III
- Phản ứng tạo phức giữa EDTA với các ion kim loại có thể biểu diễn bởi các phương trình sau:
Mn+ +H2Y2- = M Y(n-4) + 2H+ ở pH = 4-6
Mn++HY3- = M Y(n-4) + H+ ở pH = 7-10
- Để nhận ra điểm tương đương, ta dùng các chất chỉ thị kim loại như:
Đenericrom T. Murexit ... đó là những chất hữu cơ có khả năng tạo phức thuận
nghịch với ion kim loại và màu của chúng khi chưa tạo phức (màu ở dạng tự
do) khác với màu của dạng đã tạo phức với ion kim loại:
Mn+ + Indm- <—> MInd(n-m)+ (màu 1) (màu 2) lOMoARcP SD| 59062190
Đồng thời phức của chỉ thị với kim loại không bền bằng phức của complexon
với kim loại, nghĩa là phản ứng sau xảy ra được:
MInd(n-m)+ + HY3– <—>MY(n-4) + Indm- + H+
- Vì dung dịch nước của chất chỉ thị chóng hỏng nên thực tế thường dùng hỗn
hợp rắn của chất chỉ thị trong đó có 1 phần chất chỉ thị với 200 đến 500 phần
NaCl trộn đều tán nhỏ.
Cơ chế chuyển màu của chỉ thị trong phép chuẩn độ trên
Trong phép chuẩn độ trên, chỉ thị ĐenericromT được sử dụng. Chỉ thị này thay
đổi màu sắc tùy thuộc vào trạng thái liên kết với ion kim loại.
*Các giai đoạn và cơ chế:
- Ban đầu (trước khi thêm EDTA): Ion Mg² từ dung dịch MgCl liên kết với ⁺ ₂
chỉ thị, tạo phức [Mg-Chỉ thị], có màu đỏ cam.
- Trong quá trình chuẩn độ: Khi EDTA được thêm vào, EDTA có ái lực mạnh
hơn với ion Mg² so với chỉ thị. Do đó, EDTA tách Mg² khỏi phức chỉ thị:⁺ ⁺
[Mg-Ch th ]+EDTA→[Mg-EDTA]+Ch th t doỉ ị ỉ ị ự
- Kết thúc (sau điểm tương đương): Sau khi toàn bộ ion Mg² đã phản ứng với ⁺
EDTA, chỉ thị tồn tại ở dạng tự do. Dạng tự do của chỉ thị có màu xanh lam.
Câu 2: Hãy nêu các chất gốc có thể dùng trong phương pháp complexon?
- EDTA (dạng tinh khiết hoặc muối dinatri của nó).
- MgCl2 , ZnSO4 để xác định lại nồng độ EDTA
Câu 3: Trình bày nguyên tắc định lượng hỗn hợp Ca2+ và Mg2+
* Nguyên tắc định lượng hỗn hợp Ca2+ và Mg2+ Trong môi trường
pH = 9 – 10, với chỉ thị ETOO: Me2+ + H2Y2- → MeY2- + 2H+
Trong môi trường pH >= 12, với chỉ thị murexit: Mg2+ + 2OH- → Mg(OH)2 Ca2+ + H2Y2- → CaY2- + 2H+
* Nguyên tắc xác định Ca2+
Định lượng Ca2+ bằng complexon III với chỉ thị Murexit
Tiến hành định lượng trong môi trường kiềm (pH >= 12), khi ấy Murexit ở dưới
dạng H3Ind2- có màu tím tạo phức với ion Ca2+ thành CaH2Ind- có màu đỏ sang tím:
CaH2Ind- + HY3- → CaY2- + H3Ind2- (Đỏ) (tím)
Câu 4: Tại sao các thí nghiệm trên cần phải chuẩn độ cho đến khi dung
dịch chuyển sang xanh hoàn toàn lOMoARcP SD| 59062190
Lý do cần chuẩn độ đến khi dung dịch chuyển xanh hoàn toàn:
- Đảm bảo đạt điểm tương đương: Màu xanh lam hoàn toàn của chỉ thị tự do
cho biết toàn bộ ion Mg2+ đã phản ứng với EDTA, và không còn
[MgĐenericrom T] trong dung dịch.
- Tránh sai số: Nếu dừng chuẩn độ trước khi màu xanh lam xuất hiện hoàn
toàn,một phần Mg2+vẫn còn liên kết với chỉ thị. Điều này làm cho thể tích
EDTA được ghi nhận nhỏ hơn thực tế, dẫn đến sai số khi tính nồng độ hoặc lượng ion kim loại.
Câu 5: Cho biết các yếu tố ảnh hưởng và cách loại trừ của phép định lượng hỗn hợp Ca2+ và Mg2+?
- pH không ổn định → Dùng dung dịch đệm
- Nồng độ chỉ thị không đúng → Chuẩn bị chỉ thị theo tỷ lệ chính xác.
- Tạp chất trong mẫu nước → Lọc sạch trước khi định lượng.
Câu 6: Trong thí nghiệm xác định nồng độ EDTA cần chú ý gì? - Điều
chỉnh môi trường đến pH thích hợp (đối với Mg2+ dùng hệ đệm amoni giữ pH =
8-9), thêm chỉ thị Đenericrom T, chỉ thị ở pH này dưới dạng Hind- (có màu
xanh) tạo phức với Mg2+ thành phức với MgInd- có màu đỏ vang: Mg2+ + HInd2- → MgInd- + H+ (đỏ vang)
- Khi thêm complexon III vào, lúc đầu sẽ phản ứng với Mg2+ tự do: Mg2+ + HY3- → MgY2- + H+
- Sau đó nhận ra điểm tương đương khi có dư HY3-:
HY3- + MgInd2- → MgY2- + HInd2- (xanh)
Màu sẽ chuyển từ đỏ vang sang xanh hoàn toàn.
Câu 7 :Tính các kết quả trong trường hợp thể tích buret chuẩn độ hết 8,00 ml:
7.1 Xác định nồng độ EDTA:
n(EDTA)=n(Mg2+)=CM.V=0,1.0,1=0,001mol
CM(EDTA)=nEDTA/VEDTA=0,001/(8.10-3)=0,125 M
7.2. Xác định độ cứng của nước:
HY3- + MgInd- ↔ MgY2- + HInd2-(xanh) -
Kết quả thí nghiệm, ta có: VEDTA= 8,00 mL.
- Độ cứng của nước theo mg CaO/1L nước:
CaO(mg/L) = CEDTA . VEDTA . ĐCaO . 1000/Vmẫu
= 0,125. 8,00 . 56 . 1000/20 = 2800mg/L
→ Vậy độ cứng của nước là 2800mg/L hay 2800॰dH. lOMoARcP SD| 59062190
7.3. Định lượng hỗn hợp Ca2+ và Mg2+:
Kết quả thí nghiệm, ta có: V1 = 15,05 mL; V2 = 7,90 mL.
Trong môi trường pH = 9 – 10, với chỉ thị ETOO: Me2+ + H2Y2- → MeY2- + 2H+
Ta chuẩn độ được V1 = 15,05 mL.
[Ca2+,Mg2+] = CEDTA . VEDTA Vmẫu = 0,07018 . 15,0520 = 0,05281 M
Trong môi trường pH >= 12, với chỉ thị murexit: Mg2+ + 2OH- → Mg(OH)2 Ca2+ + H2Y2- → CaY2- + 2H+
Ta chuẩn độ được V2 = 7,90 mL.
[Ca2+] = CEDTA . VEDTA Vmẫu = 0,07018 . 7,9020 = 0,02772 M
Câu 8: EDTA có sự ưu tiên phản ứng với Ca2+ và Mg2+ không, nếu có thì phản
ứng với cation nào trước?
- Có. EDTA ưu tiên phản ứng với Ca2+ trước vì phức của EDTA với Ca2+ bền hơn phức với Mg2+.
Câu 9: Mg(OH)2 thường có màu gì, trong thí nghiệm xuất hiện màu gì? Tại sao?
- Mg(OH)2 thường có màu trắng đục trong thí nghiệm xuất hiện màu hồng sữa
vì Mg2+ kết tủa không hoàn toàn, một phần tạo phức với murexit nên tạo ra màu hồng sữa.
Câu 10: Có nên tách lọc tách Mg(OH)2 ↓ ra khỏi dung dịch cần xác định nồng
độ không? Trường hợp trong bài không tách Mg(OH)2 ↓ thì có ảnh hưởng
đến quá trình chuẩn độ không?
*Không cần tách Mg(OH)2 ra khỏi dung dịch, với điều kiện pH của dung dịch
được điều chỉnh đúng cách. Điều này là do:
- Tại pH thích hợp (~10): Mg(OH)2 có độ tan đủ để cung cấp một lượng nhỏ
Mg2+ vào dung dịch. Lượng ion Mg2+ này là cần thiết cho quá trình chuẩn độ với
EDTA. Mg(OH)2 không kết tủa hoàn toàn mà tồn tại ở trạng thái cân bằng, do
đó, vẫn có thể chuẩn độ được bằng EDTA.
- Nếu tách Mg(OH)2: Việc tách Mg(OH)2 ra khỏi dung dịch sẽ làm mất đi nguồn
cung cấp ion Mg2+, dẫn đến việc không thể thực hiện phép chuẩn độ. Do đó,
không cần tách Mg(OH)2 trong thí nghiệm chuẩn độ EDTA này.
*Ảnh hưởng nếu không tách Mg(OH)2:
Nếu không tách Mg(OH)2, cần lưu ý một số điểm sau để đảm bảo quá trình
chuẩn độ không bị ảnh hưởng: lOMoARcP SD| 59062190
- Cân bằng ion Mg2+: Ở pH > 10, lượng Mg2+ tự do trong dung dịch sẽ giảm do
Mg(OH)2 có xu hướng kết tủa. Điều này có thể gây khó khăn trong chuẩn độ,
vì nồng độ Mg2+ không còn chính xác như ban đầu.
- Dung dịch đệm pH: Việc sử dụng dung dịch đệm (thường là amoniac và
NH4Cl) ở pH khoảng 10 là rất quan trọng. Ở pH này:
+ Mg(OH)2 không kết tủa hoàn toàn.
+ EDTA tồn tại ở dạng hoạt động (EDTA4−)
+ Quá trình chuẩn độ diễn ra chính xác và không bị ảnh hưởng bởi sự tạo tủa của Mg(OH)2.
- Ảnh hưởng nếu pH không kiểm soát:
+ Nếu pH quá cao (>10,5), Mg(OH)2 kết tủa hoàn toàn, làm giảm lượng ion
Mg2+ trong dung dịch, dẫn đến kết quả chuẩn độ không chính xác (thể
tích EDTA sẽ thấp hơn thực tế).
+ Nếu pH quá thấp (<9), chỉ thị và EDTA không hoạt động hiệu quả, gây khó
khăn trong việc xác định điểm tương đương.




