






Preview text:
BÁO CÁO THỰC HÀNH HOÁ PHÂN TÍCH 2
Lớp:
DUOC21A
Nhóm:
02
- Tổ:
01
Thành viên:
1
.Trương Khánh Huyền
2
.Trần Thị Khánh Huyền
.Lê Phạm Thanh Huyền
3
4
.Bùi Duy Khánh
5
.Võ Thị Nhã Khánh
.Ngô Kỳ
6
7
.Hoàng Thị Thanh Lam
8
.Trịnh Thị Mai Linh
9
.Tôn Thất Trí Lực
10
.Nguyễn Thị Lường
11
.Hà Thị Diệu Ly
12
.Trần Thị Hải Lý
13
.Lê Thị Mùi
14
.Lê Thị Ái Ngọc (DUOC19-24A, học lại
)
Ngày 16 tháng 05 năm 2023
Ghi chú
Điểm
Nhận xét của giảng viên
BÀI 6: CHUẨN ĐỘ AXIT H3PO4 BẰNG DUNG DỊCH NaOH THEO
PHƯƠNG PHÁP ĐO THẾ
I. Mục tiêu:
- Trình bày được bản chất của phép đo pH bằng phương pháp đo thế và phương pháp chuẩn độ đo thế .
- Thực hành được động tác đo pH. Đo đạt sai số không quá ±0,2 đơn vị pH. - Làm được phép chuẩn độ đo thế. II. Cơ sở lý thuyết
Phương pháp đo điện thế
- Là phương pháp chuẩn độ mà điểm kết thúc được xác định bằng sự thay đổi đột ngột về điện thế của hỗn hợp dung dịch chuẩn độ.
- Bản chất của phương pháp: Đo suất điện động của một pin tạo bởi một điện cực có thể thay đổi phụ thuộc và nồng độ ion chất cần xác định và một điện cực có thể không thay đổi, cả hai điện cực đều được nhúng vào điện cực nghiên cứu.
E = Echỉ thị - Eso sánh
- Trong bài này, ta sử dụng:
Điện cực chỉ thị: điện cực thuỷ tinh đo pH
Điện cực so sánh: Ag/AgCl
- Chuẩn bị
- Hóa chất
- Dung địch đệm pH = 7,0; pH = 4,0; pH = 10,0 - Dung dịch cần định lượng (H3PO4).
- Chỉ thị màu vạn năng.
- Dung dịch NaOH 0,1N.
- Dụng cụ
- Máy đo pH | - Máy khuấy từ |
- Que khuấy | - Cốc để dung dịch |
- Burret
- Điện cực thủy tinh, Ag/AgCl (hoặc điện cực tổ hợp)
- Quy trình thực hành
- Đo pH:
- Hiệu chuẩn máy pH SENSION + pH3:
- Bật máy
 .
. - Hiệu chỉnh máy:
- Bật máy
+ Bước 1: Chuẩn bị các dung dịch hiệu chỉnh.
+ Bước 2: Bấm  ⇨ chọn pH.
⇨ chọn pH.
+ Bước 3: Rửa điện cực bằng nước cất (lau khô sạch), nhúng vào dung dịch hiệu chỉnh 1 (pH=4,01).
+ Bước 4: Bấm  (để hiệu chuẩn 1).
(để hiệu chuẩn 1).
+ Bước 5: Hiệu chỉnh dung dịch pH=7: tiến hành như Bước 2 và Bước3.
- Đo pH và mV:
+ Bước 1: Rửa điện cực bằng nước cất (lau khô sạch), nhúng vào dung dịch đo.
+ Bước 2: Bấm nút pH hoặc mV.
Chú ý: Mỗi khi thay dung dịch đo phải dùng bình phun nước cất rửa sạch cực, lau khô bằng giấy sạch mịn và mềm.
- Kết quả hiệu chuẩn:
Kết quả hiệu chuẩn máy cũ (pH SENSION + pH3): Đo pH dung dịch: pH=4 và 7.

Ta có:
Thế bất đối của màng: Asym = -3 mV ()
Hiệu suất máy H = 98% nằm trong khoảng cho phép (90% - 110%)
Máy đạt yêu cầu theo giới hạn đã cho Kết quả hiệu chuẩn máy mới:
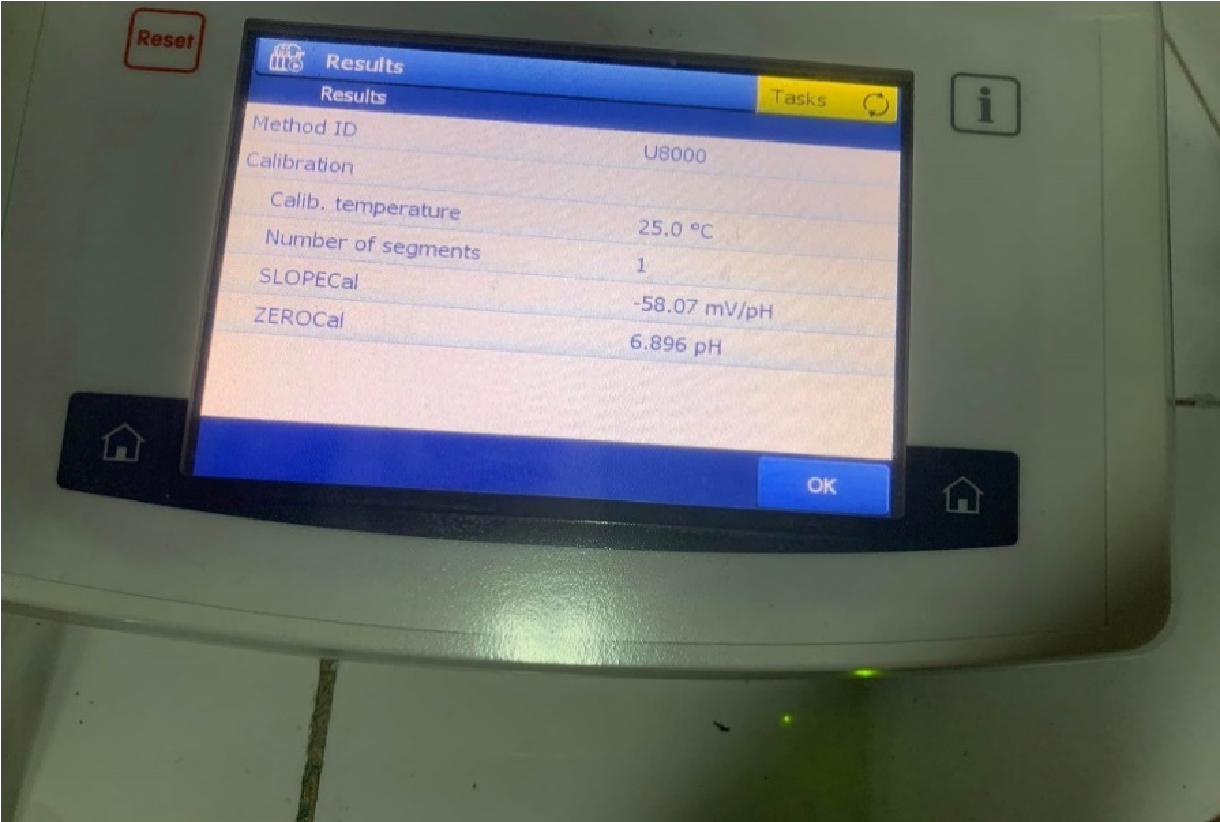
Ta có:
ZEROCal = 6.896 pH (
Máy đạt yêu cầu theo giới hạn đã cho
2. Chuẩn độ acid H3PO4 bằng dung dịch NaOH theo phương pháp đo thế Quy trình:
- Lấy chính xác 10,00 ml H3PO4 cần định lượng cho vào cốc 250ml đặt trên máy khuấy từ. Thêm que khuấy lắp điện cực và nối với máy (chú ý điện cực để cách đáy cốc khoảng 2cm tránh que khuấy chạy làm vỡ cực). Thêm nước cất cho ngập điện cực. Đổ dung dịch NaOH 0,1N lên trên buret gắn trên máy chuẩn độ.
- Bật máy đo ở chế độ đo thế E (mV) (hoặc đo pH). Ghi giá trị thế E (hoặc pH) ban đầu.
- Chuẩn độ sơ bộ: Bật máy khuấy từ, nhỏ NaOH 0,1N từ trên buret xuống, sau mỗi lần thêm 1ml NaOH 0,1N (ΔV=1 ml), tắt máy khuấy (hoặc hệ thống khuấy sẽ có chế độ tự tắt), ghi thế E hoặc pH. Theo dõi cho đến khi có 2 bước nhảy thế, ghi nhớ thể tích NaOH 0,1N tương ứng với lân cận 2 điểm này (điểm tương đương).
- Chuẩn độ chính xác: Lặp lại động tác chuẩn độ trên, nhưng với lưu ý rằng ở lân cận 2 điểm tương đương thăm dò qua chuẩn độ trên, ta cho NaOH 0,1N xuống với ΔV=0,1 ml lại tắt máy khuấy và ghi giá trị thế E hoặc pH của dung dịch.
Kết quả:
Phương pháp điểm Phương pháp đạo hàm Phương pháp đạo hàm uốn bậc 1 bậc 2
VNaOH pH NaOH NaOH
(mL) (mL) (mL)
0 2.288
0.001 2.276 -12 0.0005
0.006 2.27 -1.2 0.0035 3600 0.002
0.011 2.266 -0.8 0.0085 80 0.006
0.023 2.264 -0.166666667 0.017 74.50980392 0.01275
0.053 2.263 -0.033333333 0.038 6.349206349 0.0275
0.128 2.267 0.053333333 0.0905 1.650793651 0.06425
0.316 2.282 0.079787234 0.222 0.201170348 0.15625
0.786 2.333 0.108510638 0.551 0.08730518 0.3865
1.286 2.4 0.134 1.036 0.052555385 0.7935
 1.786 2.477 0.154 1.536 0.04 1.286 2.286 2.564 0.174 2.036 0.04 1.786 2.786 2.674 0.22 2.536 0.092 2.286 3.286 2.809 0.27 3.036 0.1 2.786 3.786 2.996 0.374 3.536 0.208 3.286 4.286 3.3 0.608 4.036 0.468 3.786
1.786 2.477 0.154 1.536 0.04 1.286 2.286 2.564 0.174 2.036 0.04 1.786 2.786 2.674 0.22 2.536 0.092 2.286 3.286 2.809 0.27 3.036 0.1 2.786 3.786 2.996 0.374 3.536 0.208 3.286 4.286 3.3 0.608 4.036 0.468 3.786
4.516 3.555 1.108695652 4.401 1.37176891 4.2185
4.619 3.739 1.786407767 4.5675 4.070343032 4.48425 4.69 3.925 2.61971831 4.6545 9.578282102 4.611
4.774 4.14 3.981481481 4.717 21.78821075 4.68575
4.778 4.333 5.676470588 4.761 38.5224797 4.739
4.803 4.517 7.36 4.7905 57.06879362 4.77575 4.825 4.681 7.454545455 4.814 4.023210832 4.80225
4.852 4.884 7.518518519 4.8385 2.611145468 4.82625
4.88 5.053 6.035714286 4.866 -53.92015392 4.85225
4.922 5.239 4.428571429 4.901 -45.91836735 4.8835
4.986 5.445 3.21875 4.954 -22.82681941 4.9275
5.074 5.644 2.261363636 5.03 -12.597189 4.992
5.204 5.849 1.576923077 5.139 -6.279271188 5.0845 5.392 6.054 1.090425532 5.298 -3.059732987 5.2185
5.666 6.261 0.755474453 5.529 -1.450004673 5.4135
6.06 6.478 0.550761421 5.863 -0.612913267 5.696
6.56 6.687 0.418 6.31 -0.297005417 6.0865
 7.06 6.862 0.35 6.81 -0.136 6.56 7.56 7.027 0.33 7.31 -0.04 7.06 8.06 7.19 0.326 7.81 -0.008 7.56 8.56 7.366 0.352 8.31 0.052 8.06 9.06 7.572 0.412 8.81 0.12 8.56
7.06 6.862 0.35 6.81 -0.136 6.56 7.56 7.027 0.33 7.31 -0.04 7.06 8.06 7.19 0.326 7.81 -0.008 7.56 8.56 7.366 0.352 8.31 0.052 8.06 9.06 7.572 0.412 8.81 0.12 8.56
9.56 7.854 0.564 9.31 0.304 9.06
9.829 8.081 0.843866171 9.6945 0.727870406 9.50225
9.991 8.284 1.25308642 9.91 1.898933869 9.80225
10.103 8.48 1.75 10.047 3.627106425 9.9785
10.188 8.679 2.341176471 10.1455 6.00179158 10.09625 10.254 8.88 3.045454545 10.221 9.328186422 10.18325 10.307 9.06 3.396226415 10.2805 5.89532554 10.25075
10.361 9.236 3.259259259 10.334 -2.560133754 10.30725
10.427 9.429 2.924242424 10.394 -5.583613917 10.364
10.506 9.672 3.075949367 10.4665 2.092509556 10.43025
10.603 9.83 1.628865979 10.5545 -16.44412941 10.5105
10.722 10.031 1.68907563 10.6625 0.557496767 10.6085
10.873 10.238 1.370860927 10.7975 -2.357145949 10.73
11.059 10.438 1.075268817 10.966 -1.754255845 10.88175
11.305 10.642 0.829268293 11.182 -1.138891317 11.074
11.627 10.832 0.590062112 11.466 -0.842275285 11.324 Phương pháp điểm uốn:
0
2
4
6
8
10
12
14
0
2
4
6
8
10
12
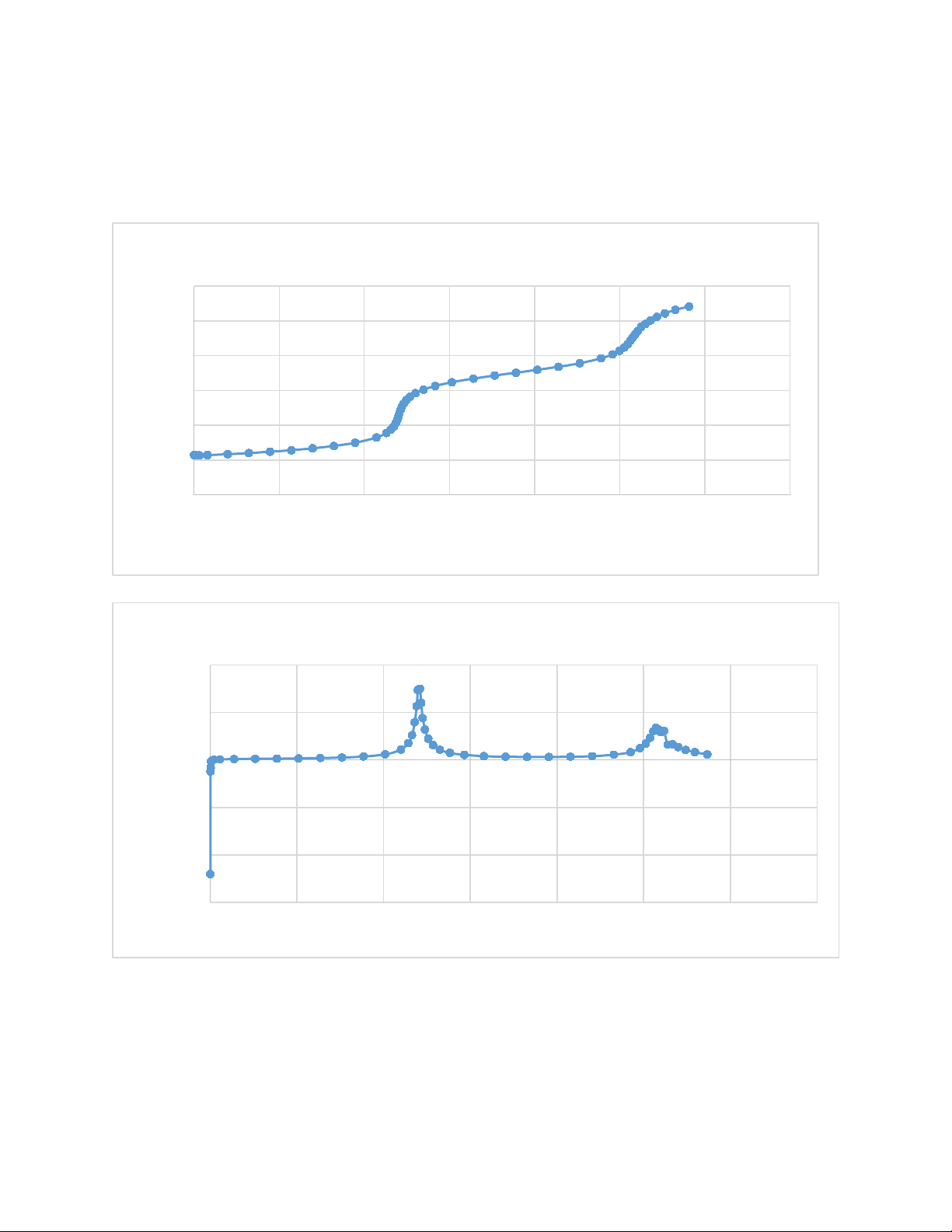
ĐỒ THỊ ĐIỂM UỐN
VNaOH (mL)
pH
Phương pháp đạo hàm bậc 1:
14
10
8
6
4
2
12
0
-15
-10
-5
0
5
10
7.52
3.08
ĐỒ THỊ ĐẠO HÀM BẬC 1
pH/V
Phương pháp đạo hàm bậc 2:
ĐỒ THỊ ĐẠO HÀM BẬC 2 12 / ^ ^ ^^ 10 8 6 4 2 0 0 2 4 6 8 10 12 |
Ta có:
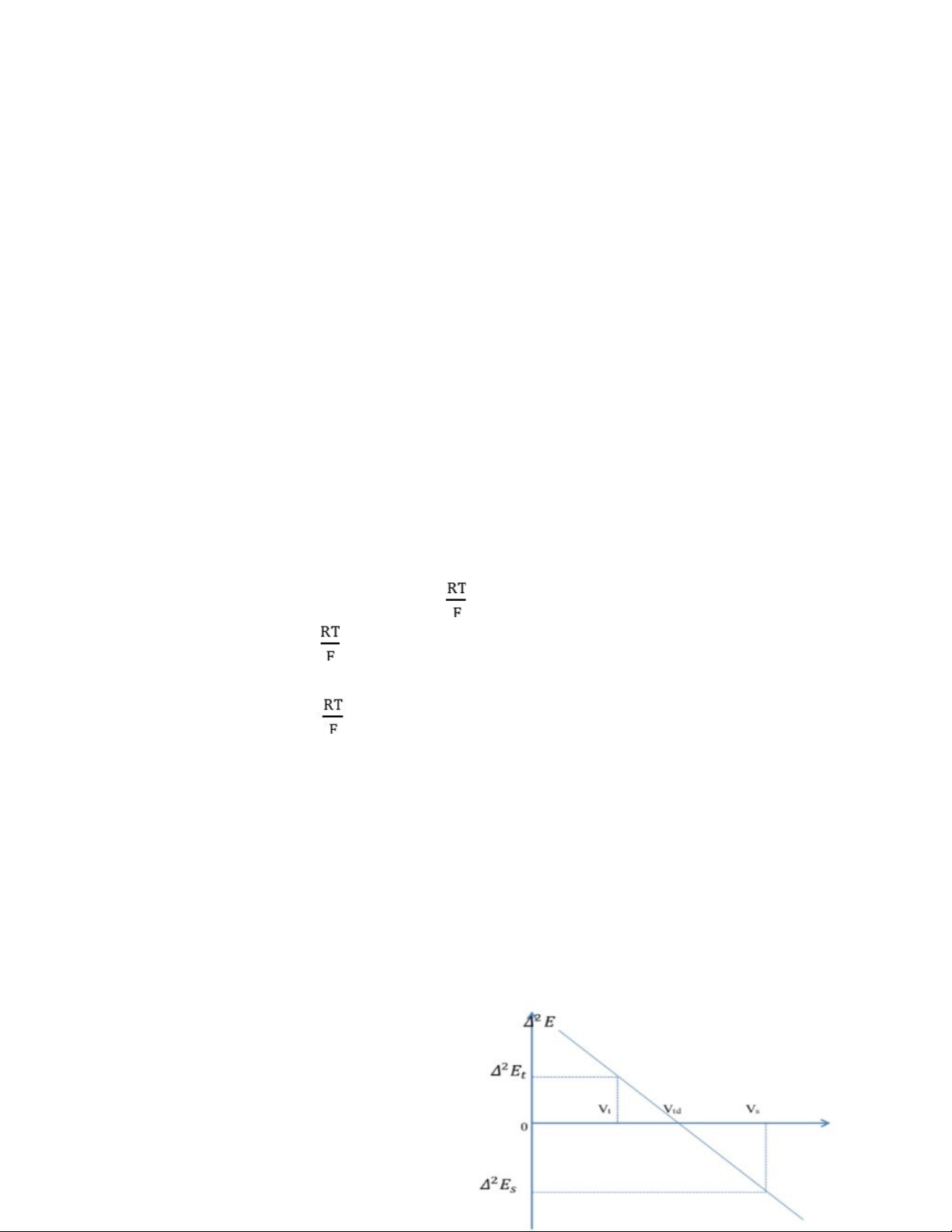
- Vt1 = 4.82625 (mL) ; Vs1 = 4.85225 (mL)
Vtđ1 = Vt1 + = 4.82625 +
= 4.824926845 (mL)
- Vt2 = 10.43025 (mL); Vs2 = 10.5105 (mL)
Vtđ2 = Vt2 + = 10.43025 +
= 10.41854931 (mL)
Định luật đương lượng: CN (NaOH).VNaOH = CN (H3PO4).VH3PO4
CN (H3PO4) = =
= 0.2083709862
CM (H3PO4) = =
= 0.1041854931 (mol/L)
3. Câu hỏi lượng giá
Câu 1. Nêu nguyên tắc của phương pháp đo pH của bằng đo thế:
- Dùng điện cực chỉ thị là thủy tinh đo pH, điện cực khí hidro.... Điện cực so sánh là calomen hay Ag/AgCl. Để cho gọn có thể dùng điện cực tổ hợp là điện cực kép gồm một điện cực chỉ thị và một điện cực so sánh (thường hay dùng thủy tinh + calomen; thủy tinh + Ag/AgCl; kim loại quý + calomen). Khi nhúng các cực này vào dung dịch đo có pH trong khoảng 0 < pH < 12 thì quan hệ giữa thế của cực chỉ thị và pH là tuyến tính chỉ phụ thuộc vào nhiệt độ theo phương trình:
E = E°H2 + 2,303.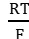 . log aH+
. log aH+
= E°H2 + 2,303. 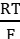 . pH
. pH
(Trong đó: E°H2 = const, phụ thuộc nhiệt độ và bản chất mỗi điện cực; ở 25 °C
trị số 2.303.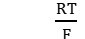 = 59,16 mV)
= 59,16 mV)
- Vì vậy khi sử dụng máy đo thế (pH metre) có thể xác định được pH của dung dịch cần thử.
Câu 2. Nguyên tắc của phương pháp chuẩn độ đo thế:
- Thực chất của phương pháp đo thế là đo suất điện động của một pin tạo bởi một điện cực có thể thay đổi phụ thuộc và nồng độ ion chất cần xác định (gọi là điện cực chỉ thị) và một điện cực có thể không thay đổi (gọi là điện cực so sánh), cả hai điện cực đều được nhúng vào điện cực nghiên cứu:
E = Echỉ thị - Eso sánh
 Vì vậy nếu tìm được điện cực chỉ thị cho một ion (chất) nào đó, chúng ta có thể xác định được nồng độ của nó bằng phương pháp đo thế tùy theo hai kỹ thuật thực hiện sau:
Vì vậy nếu tìm được điện cực chỉ thị cho một ion (chất) nào đó, chúng ta có thể xác định được nồng độ của nó bằng phương pháp đo thế tùy theo hai kỹ thuật thực hiện sau:- Tiến hành đo thế các dung dịch chuẩn và dung dịch cần xác định rồi từ đósuy ra nồng độ ion cần xác định theo phương pháp so sánh, đường chuẩn...: điển hình cho kỹ thuật này trong phân tích là đo pH, đo pM (M là ion nào đó).
- Tiến hành đo thế của dung dịch trong quá trình chuẩn độ, từ đó suy ra điểmtương đương để tính toán nồng độ dung dịch, gọi là phương pháp chuẩn độ đo thế.
Câu 3. Trình bày cách tính kết quả của phương pháp chuẩn độ đo thế:
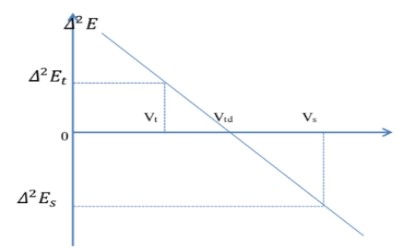
- Sau khi tìm được Vtđ bằng phương pháp điểm uốn, đạo hàm bậc 1, đạo hàm bậc 2, tính kết quả như phương pháp chuẩn độ thông thường
- Ta có V tương đương theo đạo hàm bậc hai:
Vtđ = Vt +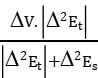
- Trong đó:
- Vt là thể tích dung dịch NaOH 0,1N ứng với giá trị D2E trên đường kiền kề với giá trị D2E âm.
là 2 giá trị D2E dương, âm liền kề.
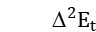
và
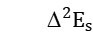
- Từ thể tích Vtđ tính nồng độ CM của dung dịch H3PO4.
Câu 4. Thế nào là điện cực chỉ thị, điện cực so sánh. Cho thí dụ:
- Điện cực chỉ thị: là một trong hai điện cực trong đó thế đáp ứng thay đổi theo sự thay đổi của chất phân tích. Có nhiều loại điện cực chỉ thị chúng ta có thể sử dụng để xác định điểm cuối của phép chuẩn độ chiết áp F Thí dụ: Điện cực màng lỏng, điển cực chỉ thị oxi hóa khử ...
- Điện cực so sánh: điện cực trong đó thế điện cực không thay đổi, không phụ thuộc vào thành phần dung dịch đo và đã được cá định theo thế của điện cực chuẩn
F Thí dụ: Điện cực Hydro chuẩn, điện cực Calomel ...




