








Preview text:
LỚP: DCQ2018
NHÓM THỰC TẬP: CHIỀU THỨ TƯ – NHÓM 4
TỔ THỰC TẬP : 02
SINH VIÊN: NGUYỄN THỊ YẾN MY
TRẦN GIA LINH
TRẦN KHÁNH LINH (03/02/2000)
Báo cáo thực tập Hóa Hữu Cơ
Bài 1:
KHẢO SÁT NHÓM CHỨC HỮU CƠ
- Nguyên tắc.
Mỗi loại nhóm chức hữu cơ có một số phản ứng hóa học đặc trưng, dựa vào những phản ứng này, có thể phân biệt sự có mật của các nhóm chức trong hợp chất hữu cơ cần khảo sát.
- Tiến hành.
- CHỨC HYDROXYL.
- Nhóm –OH của alcol:
- Phản ứng với thuốc thử Lucas:
- Nhóm –OH của alcol:
- Dựa vào phản ứng thế nhân của dẫn xuất halogen với alcol để phân biệt alcol bậc I, bậc II và bậc III. Thuốc thử Lucas là dung dịch ZnCl2 trong HCl đậm đặc. ZnCl2 ở đây đóng vai trò xúc tác.
- Phản ứng này xảy ra rất nhanh đối với alcol bậc III, tạo thành alkyl clorid. Sản phẩm tạo thành sẽ có hiện tượng phân lớp so với hỗn hợp dung dịch ban đầu.
- Alcol bậc II phản ứng rất chậm, phải đun nóng mới phản ứng, alcol bậc I khó phản ứng.
Thí nghiệm: Cho vào 3 ống nghiệm:
Ống 1: 1 ml n-butanol
Ống 2: 1 ml sec-butanol
Ống 3: 1 ml tert-butanol
Sau đó cho 1 ml thuốc thử Lucas dọc theo thành mỗi ống nghiệm trên. Để yên, không lắc. (Nếu phản ứng chậm xảy ra, cho vào bể cách thủy vài phút.)
Kết quả:
Ống 3:
Ống 1 và ống 2
Phương trình phản ứng:
Khảo sát phản ứng của alcol bậc II và bậc III với HCl.
Cho vào 2 ống nghiệm:
Ống 1: 1 ml sec-butanol
Ống 2: 1 ml tert-butanol
Sau đó, thêm vào mỗi ống 1 ml HCl đậm đặc, ta sẽ thấy trong 1 dung dịch vẫn trong suốt, còn ống 2 phản ứng lập tức.
Giải thích:
Phương trình:
- Phản ứng oxy hóa:
- Phản ứng oxy háo alcol xảy ra dễ dàng. Alcol bậc I bị oxy hóa cho ra aldehyd và thành acid nếu chất oxy hóa mạnh như KMnO4, K2Cr2O7/H2SO4.
- Alcol bậc II bị oxy hóa cho ra ceton tương ứng.
- Alcol bậc III khó bị oxy hóa (trong môi trường acid với chất oxy hóa mạnh, alcol nậc III mới bị oxy háo cho ra hỗn hợp ceton và acid).
Thí nghiệm:
Phản ứng oxy hóa alcol ở các môi trường khác nhau. Lấy 3 ống nghiệm cho vào mỗi ống 1 ml ethanol, sau đó tiếp tục thêm:
Ống 1: 1 giọt H2SO4 10% + 1 giọt KMnO4 loãng, lắc đều sẽ thấy mất màu KMnO4.
Giải thích:
Phương trình:
Ống 2: 2-3 giọt NaOH 10% + 1 giọt KMnO4 loãng, lắc đều sẽ thấy xuất hiện màu xanh không bền của Mn+6.
Giải thích:
Phương trình:
Ống 3: 5 giọt KMnO4 loãng, đun cách thủy một lúc sẽ thấy xuất hiện kết tủa màu đen của MnO2.
Giải thích: Vì trong môi trường trung tính Mn+7 🡪 Mn+4
Phương trình:
Các phản ứng trên dễ bị oxy hóa thành CH3COOH vì CH3CHO là chất khử dễ bị oxy hóa bới KMnO4 dư.
- Nhóm –OH của phenol:
Tất cả các phenol ở dạng tinh khiết thì không màu, nhưng để lâu ngoài không khí thường bị oxy hóa nên có màu nâu sẫm. Các phenol đều có mùi đặc biệt.
- Phản ứng màu đặc trưng với FeCl3.
Các phenol tác dụng với FeCl3 sẽ cho những phức chất có màu.
Đây là phản ứng đặc trưng của nhóm enol
Thí nghiệm:
Cho vào 1 ống nghiệm lần lượt các chất sau.
Ống 1: 1 ml nước + 1 giọt phenol + 1 giọt FeCl3 1%. Lắc nhẹ
Quan sát:
Phương trình:
Ống 2: 1 ml acid salicylic 0,2% + 1 giọt FeCl3 1%. Lắc nhẹ
Quan sát:
Phương trình:
Ống 3: Ít mảnh β-naphtol + 2 ml nước, đun nóng trên đèn cồn cho tan + 1 giọt FeCl3. Quan sát:
Phương trình:
- Phản ứng Liebermann
Phản ứng chỉ đặc trưng cho các phenol không có nhóm thế ở vị trí ortho và para. Phản ứng Libermann dựa vào sự hình thành dẫn xuất p-nitrosophenol màu xanh, chất này kết hợp thêm 1 phân tử phenol để cho indophenol màu đỏ và khi kiềm hóa lại cho anion indophenolat có màu xanh.
Thí nghiệm:
Cho vào ống nghiệm sạch 0,5 ml dung dịch NaNO2 10%, thêm 1 giọt phenol, lắc đều cho tan. Cho vào 2 giọt H2SO4 đậm đặc ngay trên thành ống nghiệm sẽ thấy màu xanh xuất hiện và nhanh chóng chuyển sang màu đỏ sậm. Kiềm hóa bằng dung dịch NaOH 10% cho đến khi màu xanh tái xuất hiện.
Phương trình:
- CHỨC CARBONYL
- Phản ứng phân biệt nhóm C=O
- Chú ý: với aldehyd và ceton nào không tan trong nước, phải hòa tan trước trong 0,5 ml ethanol trước khi làm phản ứng.
*Phản ứng với 2,4-dinitrophenylhydrazin:
Aldehyd và ceton phản ứng với thuốc thử 2,4-dinitrophenylhydrazin cho ra 2,4-dinitrophenylhydrazol là chất kết tinh rất bền và có dung điểm cao.
Thí nghiệm:
Thuốc thử 2,4-dinitrophenylhydrazin có 2 loại:
Loại A: dùng cho aldehyd và ceton dễ tan trong nước/
Loại B: dùng cho aldehyd và cetone không tan trong nước như benzaldehyd, acetophenon.
Ống 1: 3 giọt formaldehyde + 5 giọt thuốc thử loại A và làm lạnh (formaldehyde tan trong nước).
Quan sát:
Phương trình:
Ống 2: 3 giọt aceton + 5 giọt thuốc thử loại A và làm lạnh (aceton tan trong nước).
Quan sát:
Phương trình:
Ống 3: 3 giọt benzaldehyd + 0,5ml ethanol + 5 giọt thuốc thử loại B và làm lạnh (benzaldehyd không tan trong nước).
Quan sát:
Phương trình:
Ống 4: 3 giọt ethylmethylcetone + 0,5ml ethanol + 5 giọt thuốc thử loại B và làm lạnh (ethylmethylcetone không tan trong nước).
Quan sát:
Phương trình:
- Phân biệt aldehyd và acetone:
- Với thuốc thử Schiff:
- Phân biệt aldehyd và acetone:
Thuốc thử Schiff là dung dịch acid fuschin sulphurơ không màu. Khi cho aldehyd tác dụng với thuốc thử Schiff, dung dịch sẽ có màu hồng của fuschin được giải phóng.
Ceton không cho phản ứng với thuốc thử Schiff.
Thí nghiệm:
Ống 1: 1 giọt HCHO + 1 ml nước + vài giọt thuốc thử Schiff, lắc đều.
Quan sát:
Ống 2: 1 giọt Aceton + 1 ml nước + vài giọt thuốc thử Schiff, lắc đều.
Quan sát:
Ống 3: 1 giọt benzaldehyd cho từ từ và lắc + 1 giọt ethanol + vài giọt thuốc thử Schiff, lắc đều.
Quan sát:
Ống 4: 1 giọt ethylmethylcetone + 1 giọt ethanol + vài giọt thuốc thử Schiff, lắc đều.
Quan sát: Dung dịch trong suốt, không màu.
- Thuốc thử Tollens:
Thuốc thử Tollens là dung dịch AgOH/NH4OH. Trong dung dịch này Ag tồn tại dưới dạng ion phức [Ag(NH3)2]+. Những chất khử mạnh sẽ biến ion này thành Ag kim loại, nếu ống nghiệm sạch sẽ tạo lớp gương bám vào thành ống ngiệm. Nếu ống nghiệm không sạch, Ag kim loại sẽ dưới dạng màu xám đen.
Thí nghiệm:
*Điều chế thuốc thử Tollens.
Thêm từng giọt NH3 đậm đặc vào 1 ml dung dịch AgNO3 5% đến khi tủa hiện ra lại tan mất. Sau đó thêm 1 giọt NaOH 10%. Nếu có kết tủa thì thêm NH3 cho tan. Dung dịch điều chế xong phải dùng ngay.
Phương trình:
Ống 1: Lăn ống nghiệm cho thuốc thử Tollens dính đều trên thành ống nghiệm, thêm formaldehyde
Quan sát:
Phương trình:
Ống 2: Lăn ống nghiệm cho thuốc thử Tollens dính đều trên thành ống nghiệm, thêm 2 giọt aceton
Quan sát:
Ống 3: Lăn ống nghiệm cho thuốc thử Tollens dính đều trên thành ống nghiệm, thêm benzaldehyd ( do bezaldehyd không tan trong nước, lăn ống nghiệm trong bể cách thủy)
Quan sát:
Phương trình:
Ống 4: Lăn ống nghiệm cho thuốc thử Tollens dính đều trên thành ống nghiệm, thêm ethylmethylcetone
Quan sát:
- Với thuốc thử Fehling:
Thuốc thử Fehling là dung dịch CuSO4 trong môi trường kiềm được ổn định bằng muối tartrat. Có thể xem như dung dịch chưa Cu(OH)2, chất này dễ bị oxy hóa bởi aldehyd để cho Cu2O màu đỏ gạch.
Thí nghiệm:
*Điều chế thuốc thử Fehling.
Lấy 4 ml dung dịch Fehling A (CuSO4 màu xanh) và 4 ml dung dịch Fehling B ( dung dịch tartrat kép na, K trong NaOH không màu) trộn đều, ta được thuốc thử Fehling màu xanh da trời.
Ống 1: 10 giọt HCHO + 2 ml thuốc thử Fehling.
Quan sát:
Phương trình:
Ống 2: 10 giọt Aceton + 2 ml thuốc thử Fehling.
Quan sát:
Ống 3: 10 giọt Benzaldehyd + 2 ml thuốc thử Fehling, đun cách thủy khoảng 35-40 phút.
Quan sát
Ống 4: 10 giọt Ethylmethylcetone + 2 ml thuốc thử Fehling, đun cách thủy.
Quan sát:
- Phản ứng đặc biệt của methylcetone ( phản ứng iodoform).
Những methylceton 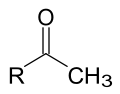 đều có phản ứng với iod trong môi trường kiểm để cho iodoform kết tinh màu vàng, có mùi đặc biệt.
đều có phản ứng với iod trong môi trường kiểm để cho iodoform kết tinh màu vàng, có mùi đặc biệt.
Thí nghiệm:
Ống 1: Hòa tan 2 giọt formaldehyde + 1 ml nước + 1 ml dung dịch NaOH 10%, cho từng giọt KI.
Quan sát: .
Ống 2: Hòa tan 2 giọt Acetone + 1 ml nước + 1 ml dung dịch NaOH 10%, cho từng giọt KI.
Quan sát:
Ống 3: Hòa tan 2 giọt Benzaldehyd + 1 ml nước + 1 ml dung dịch NaOH 10%, cho từng giọt KI.
Quan sát:
Ống 4: Hòa tan 2 giọt Ethylmethylceton + 1 ml nước + 1 ml dung dịch NaOH 10%, cho từng giọt KI.
Quan sát: .
- CHỨC AMIN
- Phản ứng với acid nitro.
- Amin bậc I:
- Phản ứng với acid nitro.
Amin bậc I cho hợp chất diazoic không bền ngay cả ở nhiệt độ thấp, sau đó giải phóng nito và alcol.
Amin thơm bậc I cũng cho diazoic, nhưng chất này bền ở nhiệt độ thấp và chỉ bị phân hủy khi đun nóng. Hợp chất diazoic này có thể kết hợp với phenol trong môi trường kiềm hay amin trong môi trường acid để cho phẩm màu azoic.
Thí nghiệm:
Hòa tan 5 giọt aniline trong 2 ml HCl 2N. làm lạnh trong nước đá. Cho từ từ 2 ml NaNO2 10%. Lắc đều và chia dung dịch muối diazonium mới tạo thành ra làm 2 phần, giữ lạnh.
Phần 1: Đun nóng đến 500C ( cách thủy ) sẽ thấy khí nitơ bay ra và sau cùng nhận thấy có mùi phenol còn lại trong ống nghiệm.
Giai thích:
Phần 2: Cho vài mảnh β-naphtol và 1 ml NaOH 10% vào một ống nghiệm khác, lắc đều cho tan rồi cho vào dung dịch muối diazonium còn lại sẽ được phẩm màu da cam.
Giai thích:
- Amin bậc II:
Với acid nitro sẽ cho nitrosamine có màu vàng.
Thí nghiệm:
Hòa tan 0,1 gam diphenylamine trong 0,5 ml ethanol, lắc đều, thêm 0,5 ml HCl đậm đặc, làm lạnh trong nước đá. Cho từ từ dung dịch NaNO2 cho đến khi ống nghiệm chuyển từ màu xanh sang dung dịch vàng nhạt trong suốt ( có những giọt dầu màu vàng).
- Amin bậc III:
Amin bậc III không cho phản ứng với HNO2
Những amin thơi vị trí para còn trống như N,N-diethylanilin sẽ phản ứng với HNO2 để cho p-nitrosoamin có màu:
Thí nghiệm:
Hòa tan 3 giọt N,N-dimethylanilin trong 1 ml HCl 2 N, làm lạnh, thêm từ từ 1 ml NaNO2 10%. Màu đỏ sậm sẽ xuất hiện, để yên khoảng 5 phút trong nước đá. Thêm NaOH loãng vào sẽ có kết tủa xanh của p-nitrosodimethylanilin.
- Phản ứng tạo sản phẩm rắn của amin:
- Acyl hóa
- Phản ứng tạo sản phẩm rắn của amin:
Amin bậc I và bậc II phản ứng dễ dàng với anhydride acid để cho amid. Amin bậc III không phản ứng. Dùng phản ứng này để tách amin bậc III khỏi hỗn hợp amin bậc I và II.
Thí nghiệm:
Cho 3 giọt aniline vào ống nghiệm chứa sẵn 10 giọt anhydride acetic, đun cách thủy trong 5 phút. Thêm 5ml nước cất, lắc đều và làm lạnh. Quan sát kết tủa thấy kết tủa trắng hình vảy óng ánh.
- Với acid piric
Amin bậc III phản ứng với acid picric để cho sản phẩm có điểm nóng chảy xác định, phản ứng này rất tiện lợi để xác định các amin bậc III.
Thí nghiệm:
Cho 2 ml dung dịch acid piric bão hòa trrong ethanol vào ống nghiệm. Thêm 1 giọt N,N-dimethylanilin. Lắc đều, pha loãng với 5 ml nước cất. Đặt ống nghiệm vào nước đá để picrat dimethylanilin kết tinh.




