


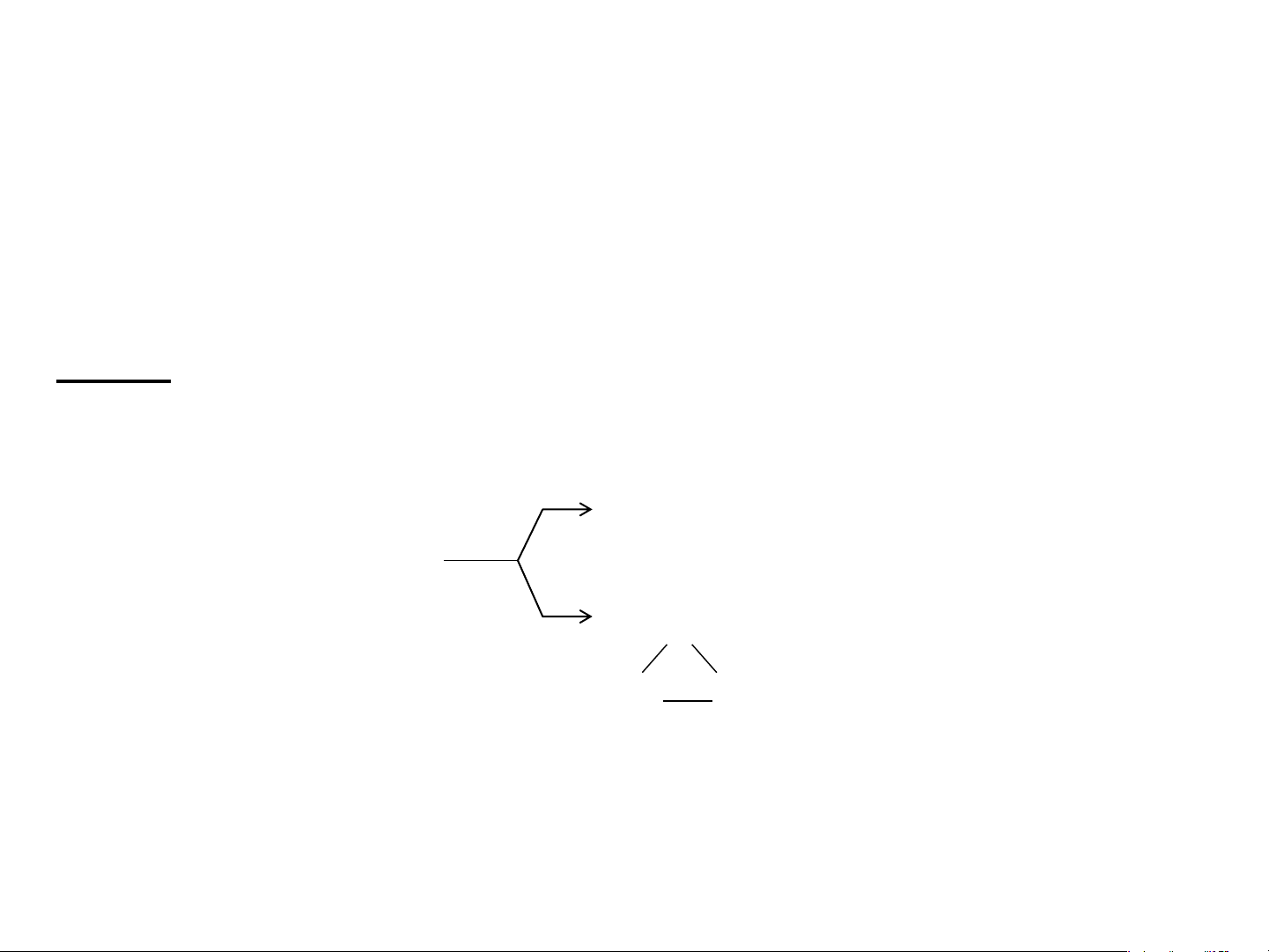





Preview text:
CÁC KHÁI NIỆM CƠ BẢN TRONG HÓA HỌC HỮU CƠ 2
CÁC KHÁI NIỆM CƠ BẢN 1. Đồng đẳng ❖
Các hợp chất hữu cơ có cùng nhóm chức, có cấu tạo hóa học
tương tự nhau nhưng hơn kém nhau một hay nhiều nhóm
metylen (-CH -) là các chất đồng đẳng với nhau. 2 ❖
Các hợp chất đồng đẳng với nhau tạo thành một dãy đồng đẳng.
Ví dụ: Dãy đồng đẳng của hydrocacbon no. CH4 CH Metan 4 C2H6 CH Etan 3 CH3 C3H8 CH CH Propan 3 CH2 3 C4H10 CH CH Butan 3 CH2 2 CH3 ………… CnH2n+2
Do có cấu tạo hóa học tương tự nhau nên các hợp chất
trong cùng một dãy đồng đẳng có tính chất tương tự nhau.
CÁC KHÁI NIỆM CƠ BẢN 2. Đồng phân
Các hợp chất hữu cơ có cùng công thức phân tử nhưng khác
nhau về công thức cấu tạo, trật tự sắp xếp, bản chất liên kết
giữa các nguyên tử trong phân tử, cấu tạo nhóm chức là các
chất đồng phân với nhau.
Các chất đồng phân với nhau tuy có cùng
công thức phân tử nhưng cấu tạo hóa học
khác nhau nên chúng là các chất khác nhau
và có tính chất (hóa học, vật lý) khác nhau.
❖ Phân loại đồng phân gồm 2 loại: đồng phân cấu tạo và đồng phân không gian.
2.1 Đồng phân cấu tạo (structural isomers)
• Đồng phân mạch cacbon: là đồng phân tạo thành do sự
sắp xếp khác nhau của mạch cacbon. Ví dụ: C H
có hai đồng phân mạch cacbon: 4 10 H H H H H H H H C C C C H H C C C H H H H H H H H C H H
2.1 Đồng phân cấu tạo (structural isomers)
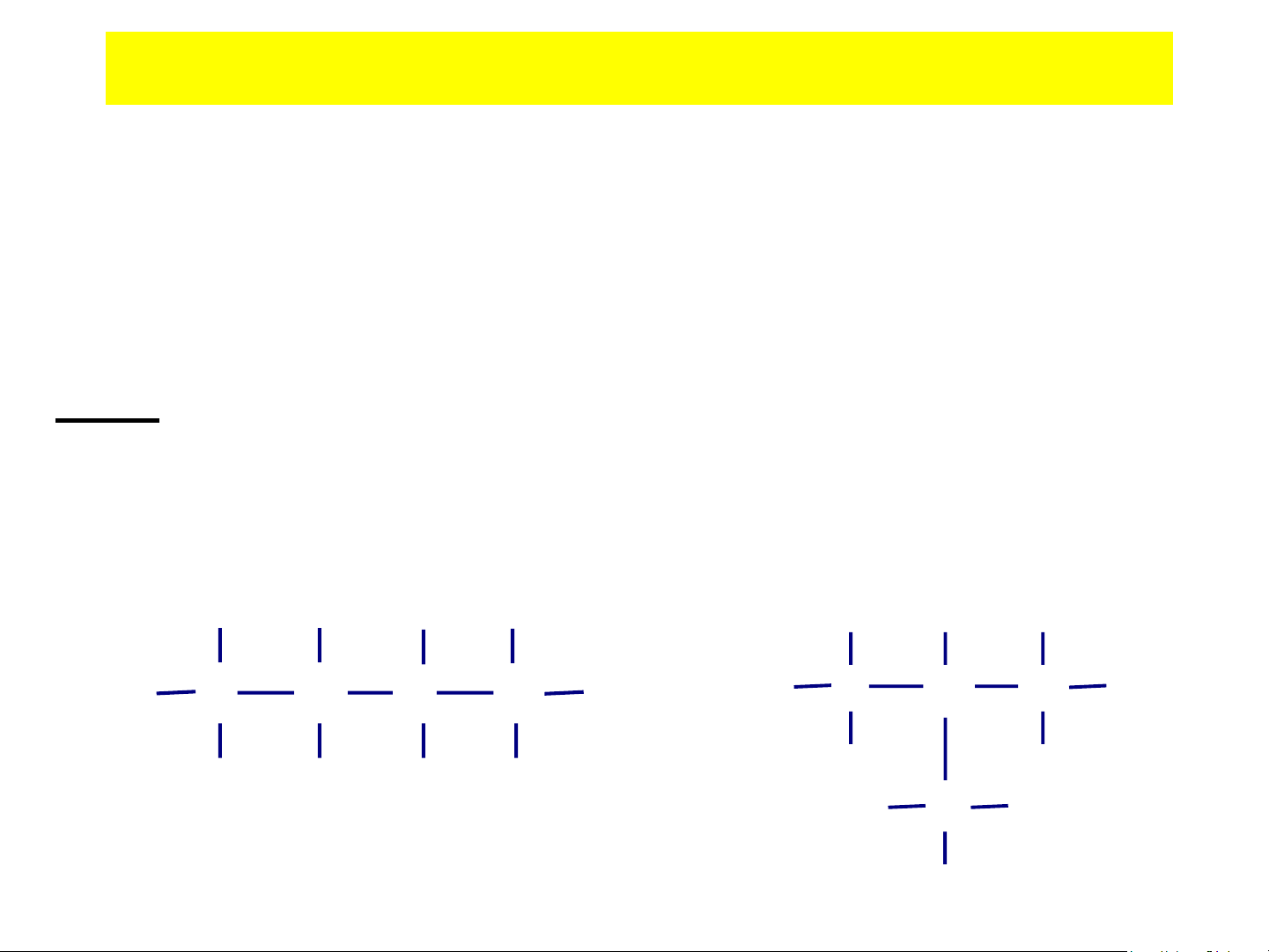
• Đồng phân vị trí: là đồng phân tạo thành do thay
đổi vị trí của liên kết bội hoặc nhóm chức. Ví dụ:
- C H có hai đồng phân vị trí do thay đổi vị trí của 4 8 liên kết đôiH H H H 1 2 2 3 H C C C C H H C C C C H H H H H H H H H - ddiNitrobenzen NO2 NO NO 2 2 NO2 [C H (NO ) ] 6 4 2 2 NO2 NO2 ortho- meta- para-
2.1 Đồng phân cấu tạo (structural isomers)
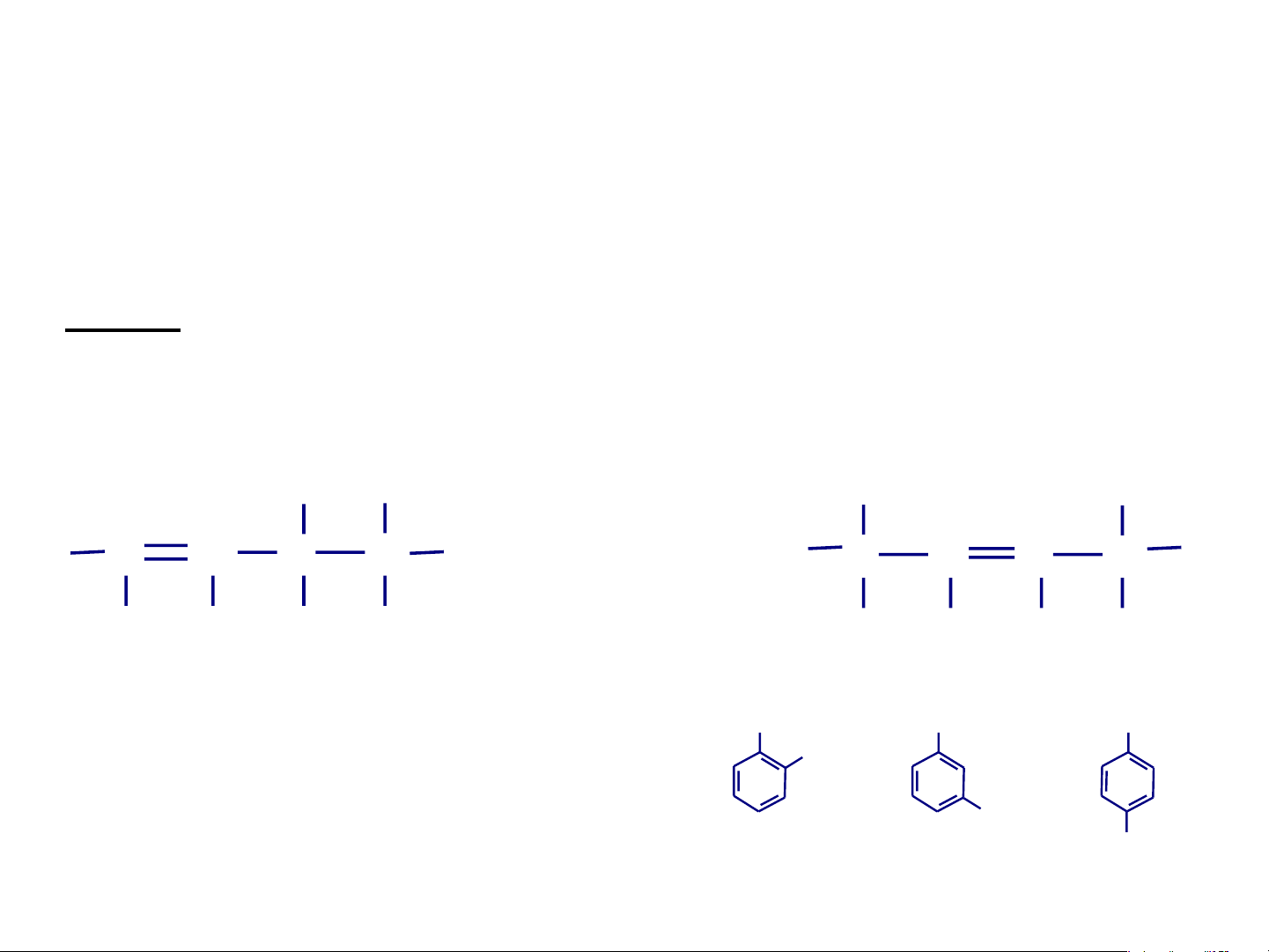
• Đồng phân liên kết: Các đồng phân có kiểu liên
kết trong phân tử khác nhau Ví dụ: - C H có hai đồng phân 3 6 CH – CH = CH 3 2 Liên kết đôi, mạch hở C H 3 6 CH2
Liên kết đơn, mạch vòng no CH CH 2 2
2.1 Đồng phân cấu tạo (structural isomers)
• Đồng phân nhóm chức: là đồng phân có cùng
thành phần nhưng có các nhóm chức khác nhau. Ví dụ:
C H O có hai đồng phân nhóm chức 3 6 : O CH3 C CH3 CH3 CH C 2 H O nhóm chức andehit nhóm chức xeton
2.2. Đồng phân không gian/đồng phân lập thể (stereoisomers)
Đồng phân không gian hay đồng phân lập thể là đồng phân
có cùng cấu tạo nhưng khác nhau về sự phân bố trong
không gian của các nguyên tử hay nhóm nguyên tử. Đồng phân cấu dạng Đồng phân hình học Đồng phân cấu hình Đồng phân quang học
Xem thêm tài liệu Hóa học lập thể
Đồng phân không gian
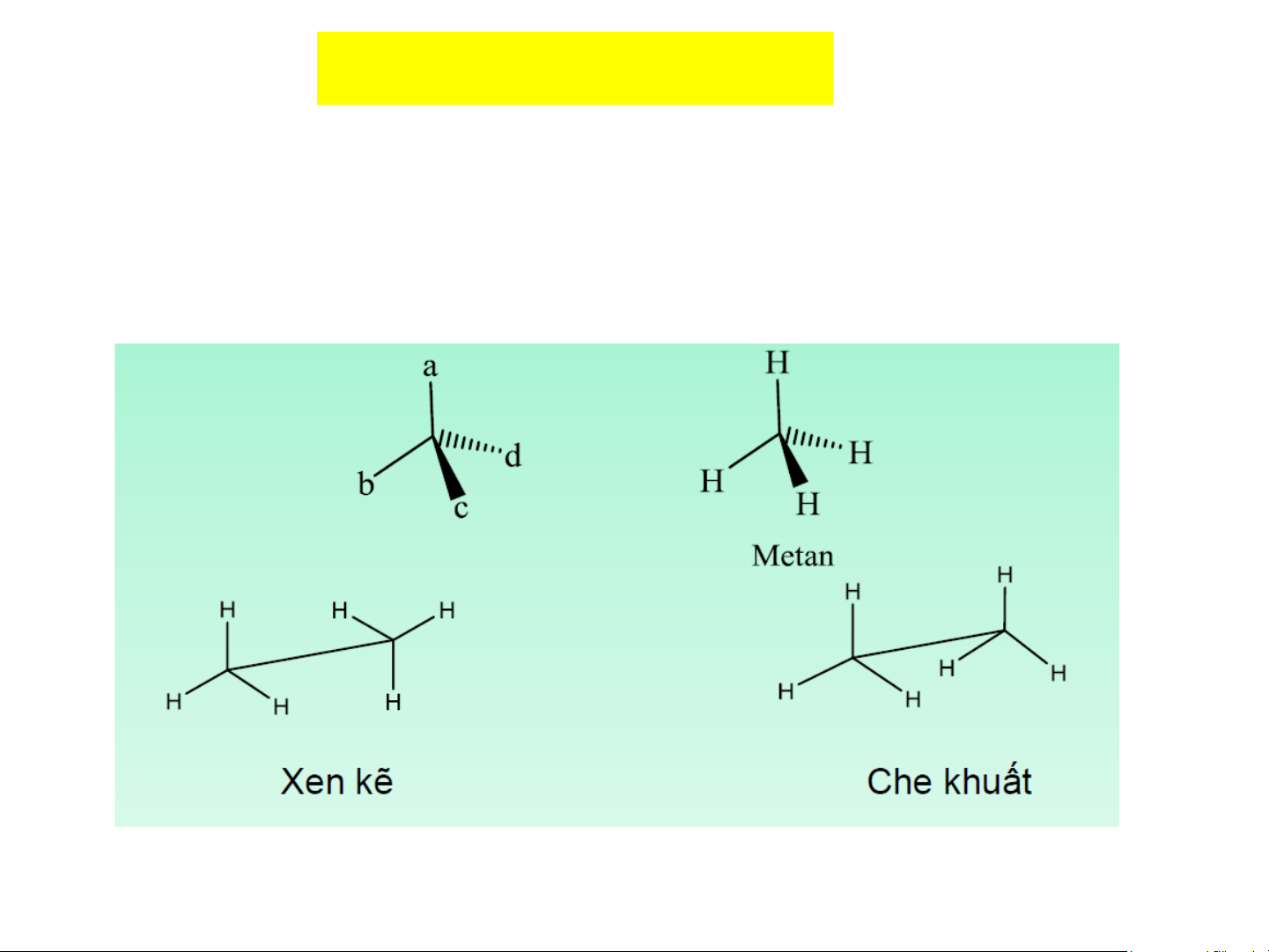
Cách biểu diễn cấu trúc không gian của phân tử
Công thức phối cảnh: 10
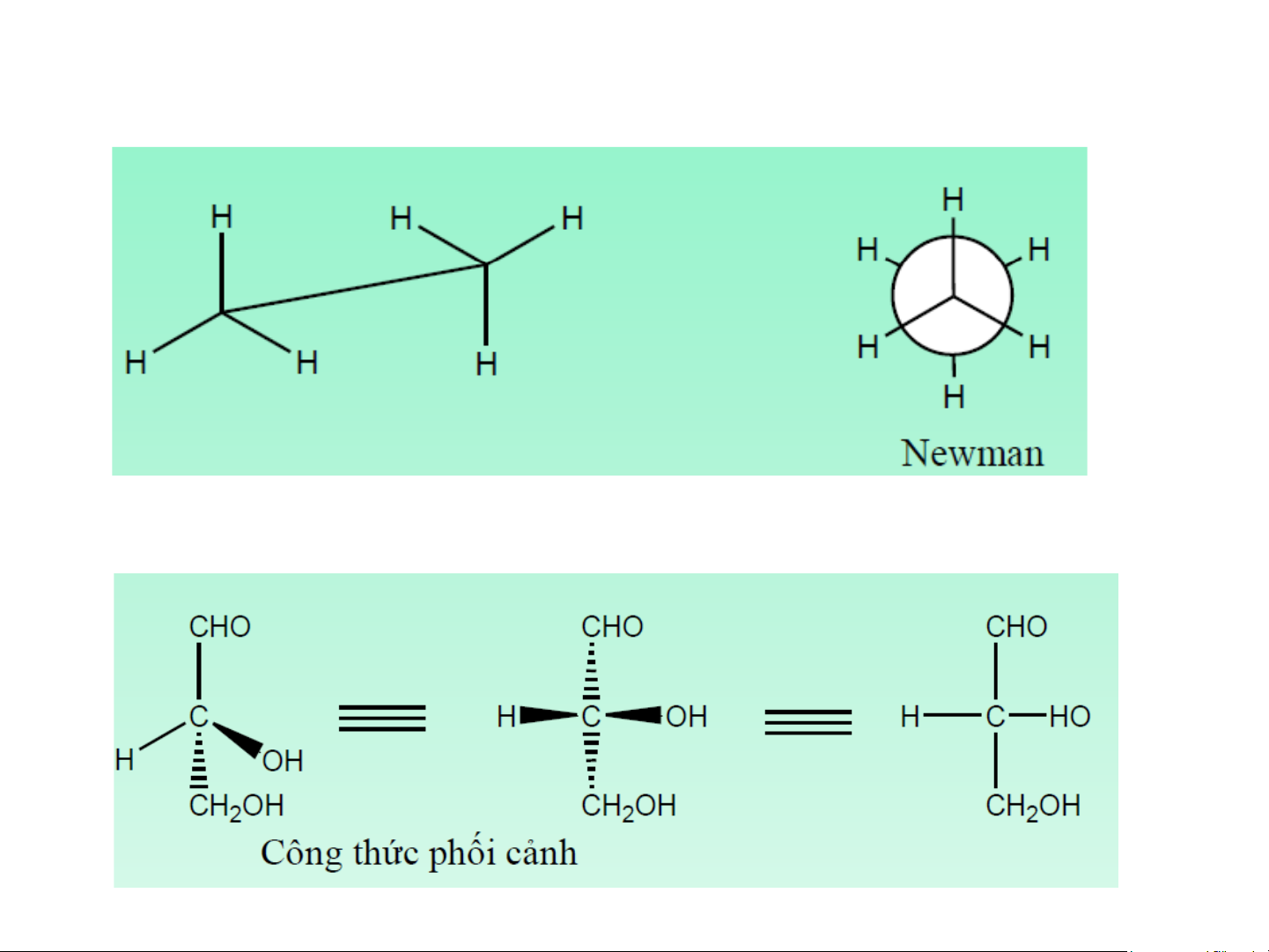
Công thức chiếu Niumen (newman)
Công thức Fisơ (Fischer) (Fischer) 11
Đồng phân hình học (geometric isomers)
❖ Đồng phân hình học là hai hợp chất có các
nguyên tử hay nhóm nguyên tử giống nhau về bản
chất và số lượng nhưng có sự phân bố khác nhau
các nguyên tử/nhóm nguyên tử qua phần cứng
nhắc của phân tử (mặt phẳng liên kết p (đối với
liên kết bội) hoặc mặt phẳng vòng (đối với vòng no))
Đồng phân hình học (geometric isomers)
❖ Đồng phân hình học là hai hợp chất có các nguyên tử hay nhóm nguyên tử giống nhau về
bản chất và số lượng nhưng có sự phân bố khác nhau các nguyên tử/nhóm nguyên tử qua
phần cứng nhắc của phân tử (mặt phẳng liên kết p (đối với liên kết bội) hoặc mặt phẳng vòng (đối với vòng no)) ❖ Điều kiện:
- Cần: có bộ phận cứng nhắc trong phân tử (liên kết đôi: C=C,
C=N, N=N. hoặc vòng no) làm cản trở sự quay tự do của các nhóm thế
- Đủ: Hai nguyên tử hoặc nhóm nguyên tử liên kết với bộ phân
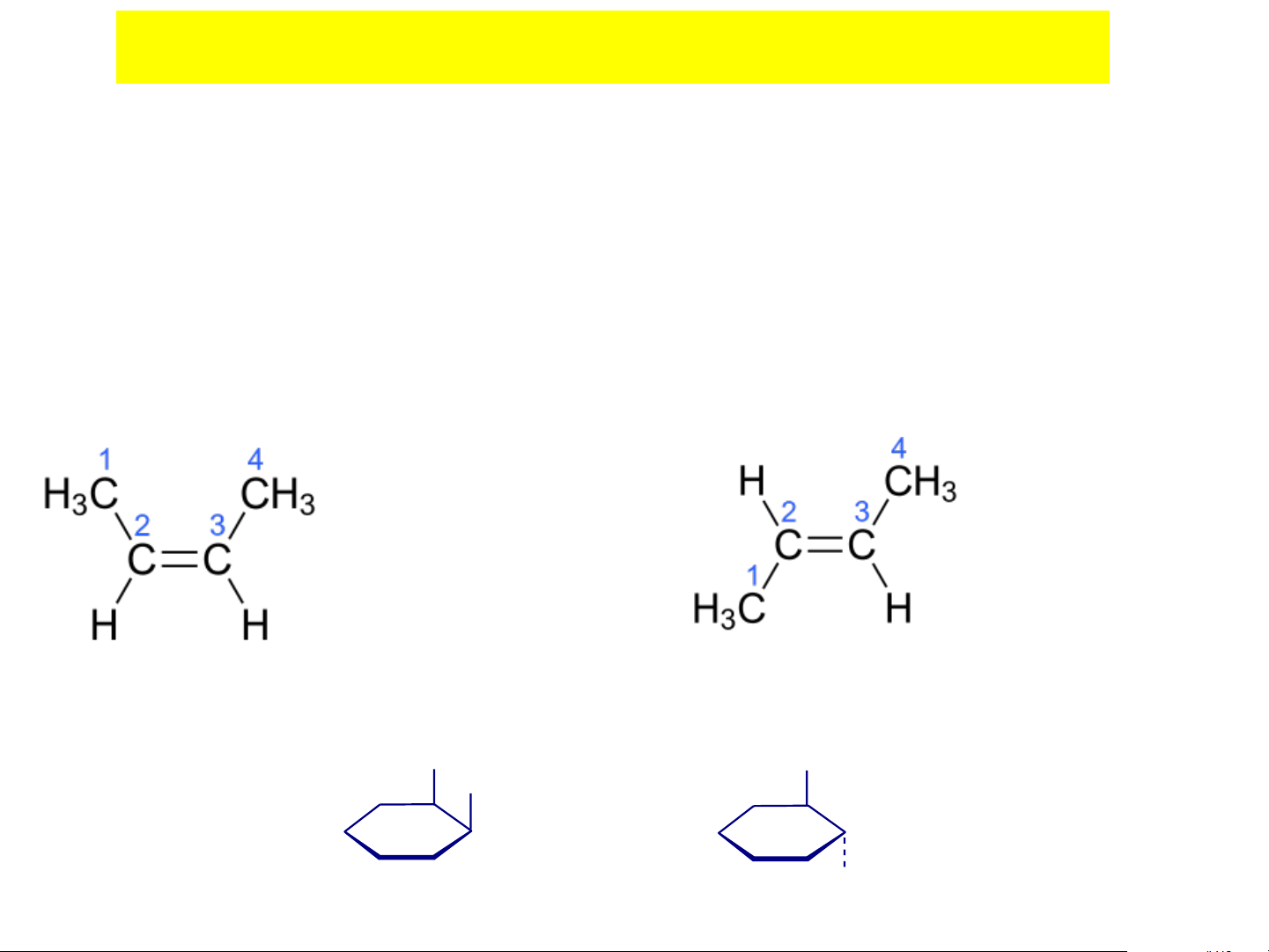
cứng nhắc phải có khác nhau ❖ Phân loại: - Hệ Cis-trans - Hệ Z-E
Đồng phân hình học (geometric isomers) -
Hệ Cis-trans (cấu hình tương đối):
• Đồng phân cis có các nhóm thế tương đương
(cồng kềnh như nhau) nằm cùng phía với mặt
phẳng liên kết p hoặc vòng.
• Đồng phân trans có các nhóm thế tương đương nằm khác phía.
• Phân tử abC=Cde, trong đó a b ; d e ,
nhưng a hay b có thể giống d hay e a a a b C C (a b C C ) b b b a §ång ph©n cis §ång ph©n trans
Đồng phân hình học (geometric isomers) -
Hệ Cis-trans (cấu hình tương đối): •
Đồng phân cis có các nhóm thế tương đương (cồng kềnh như nhau) nằm cùng
phía với mặt phẳng liên kết p hoặc vòng. •
Đồng phân trans có các nhóm thế tương đương nằm khác phía. Ví dụ:
- Buten có hai đồng phân hình học cis-2-buten trans-2-buten
- Dicloxyclohexan có hai đồng phân hình học Cl Cl Cl Cl
cis-1,2-Dicloxyclohexan
trans-1,2-Dicloxyclohexan
Đồng phân hình học (geometric isomers) -
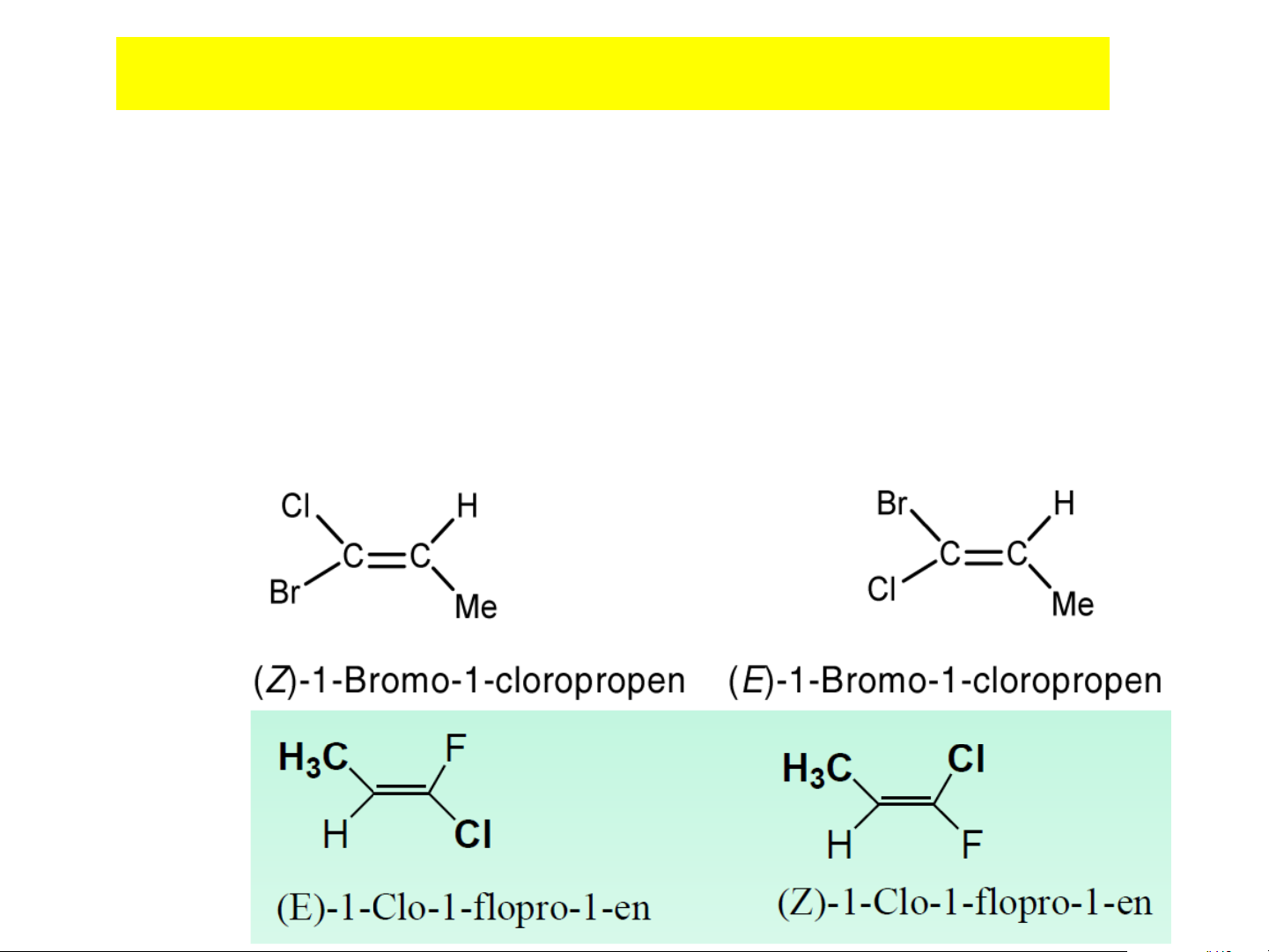
Hệ Z-E (cấu hình tuyệt đối):
• Áp dụng qui tắc Cahn-Ingold-Prelog: Dựa vào sự ưu tiên
trên số thứ tự Z trong HTTH. Các nhóm thế có số thứ tự cao
hơn thì có độ ưu tiên (độ hơn cấp) lớn hơn
• Đồng phân nào có hai nhóm ưu tiên lớn nằm về một bên của
mặt phẳng qui chiếu là : Z, ngược lại khác phía là E. • Ví dụ:
Tính chất của các đồng phân hình học:
+ Các đồng phân trans thường bền hơn các đồng phân cis
+ Nhiệt độ nóng chảy (mp) của đồng phân cis thường
thấp hơn đồng phân trans.
+ Nhiệt độ sôi (bp) của đồng phân cis thường cao
hơn đồng phân trans.
+ Tỷ trọng và chiết xuất của đồng phân cis thường
lớn hơn các đồng phân trans.
+ Hoạt tính của đồng phân hình học có thể khác nhau
Đồng phân quang học
❖ Đồng phân quang học: là những đồng phân có sự
sắp xếp khác nhau trong không gian của các nhóm thế
xung quanh nguyên tử cacbon bất đối (là nguyên tử
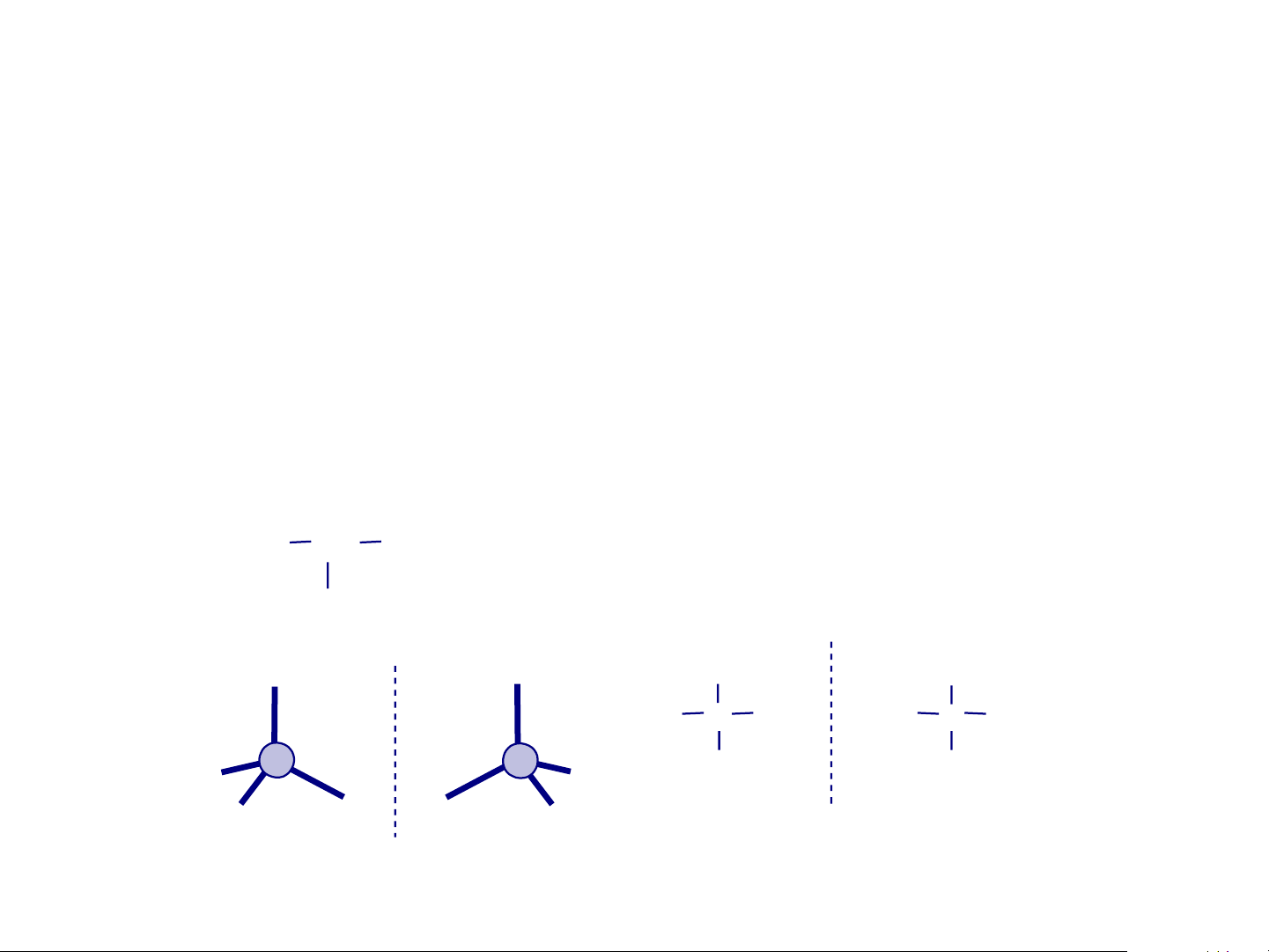
cacbon liên kết với 4 nguyên tử hoặc nhóm nguyên tử khác nhau, kí hiệu C*) a b c d
Giả sử: a > b > c > d a a
❖ Điều kiện: phân tử phải có yếu C* C*
tố không trùng vật ảnh (chirality) d b d b -
có 1 hoặc nhiều C bất đối c c -
hoặc phân tử bất đối xứng Mặt phẳng gương
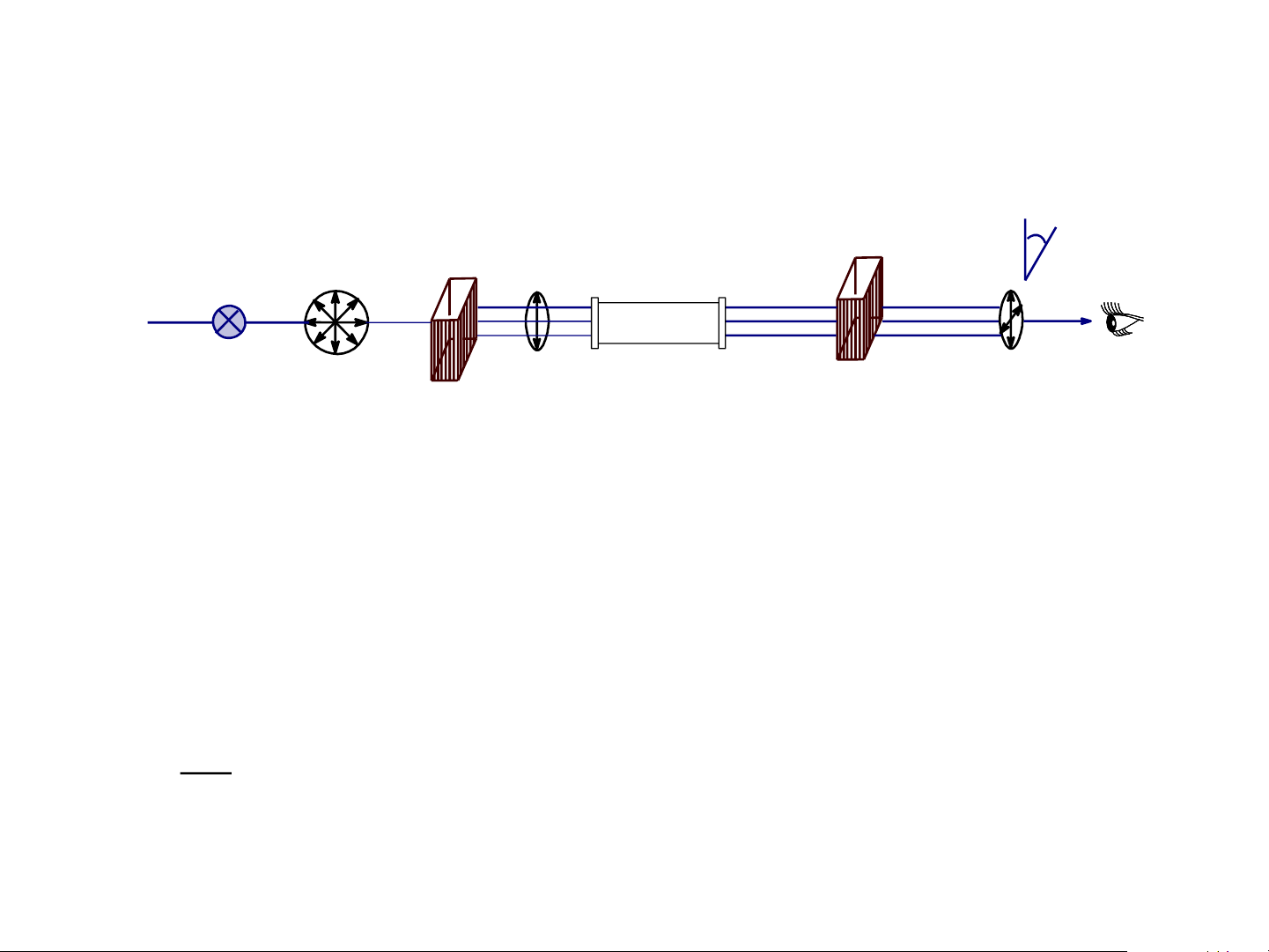
Tính chất hoạt động quang học hay tính quang hoạt là tính
chất quay mặt phẳng của ánh sáng phân cực một góc a
nào đó (quay sang phải hoặc sang trái). ¸ ¸ nh s¸ng nh s¸ng th-êng ph©n cùc th¼ng Nguån s¸ng Nicon èng kh¶o s¸t Nicon Gãc quay cña ¸nh s¸ng ph©n cùc ph©n tÝch ph©n cùc th¼ng
Tính quang hoạt được xác định bằng độ quay cực riêng theo công thức:
[]: độ quay cực riêng; t: nhiệt độ;
: góc quay mặt phẳng phân cực đọc trên phân cực kế; t [ ] =
: độ dài sóng (thường là độ dài sóng ánh sáng D của natri, l = 589,3 nm); l c .
l: độ dài ống đựng chất khảo sát (dm);
c: nồng độ của chất đo (số gam chất trong 100 ml dung dịch)
• Các đồng phân quang học đối xứng với
nhau qua mặt phẳng gương nhưng không
trùng khít lên nhau, được gọi là các chất
đối quang (làm quay mặt phẳng phân cực
của ánh sáng theo 2 góc có vị trí số tuyệt
đối bằng nhau và ngược chiều nhau) CH * 3 CH COOH OH Axit lactic COOH HOOC COOH COOH H C OH HO C H C C CH H H 3 CH3 OH HO H3C CH3 Axit (-) lactic Axit (+) lactic (sang trái) (sang phải)




