




Preview text:
Chương 4
Acid-Base trong Hóa Hữu cơ
4.1. Quan điểm cổ điển (Arenius): acid H+, base OH-
4.2. Thuyết acid-base của Bronsted & Lowry
1. Định nghĩa
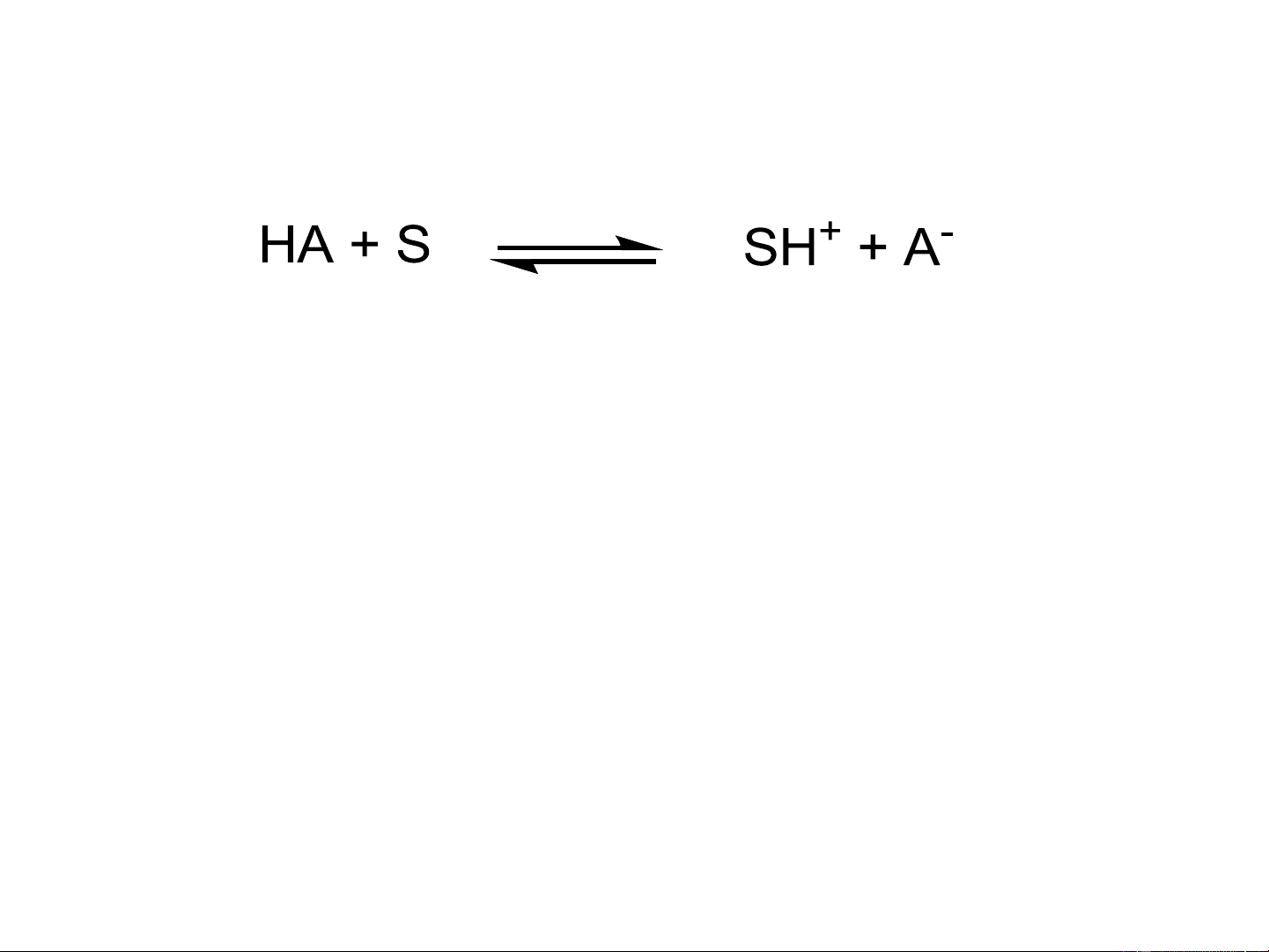
- Acid: Có khả năng cho proton (H+) (proton donor)
- Base: Có khả năng kết hợp proton (proton acceptor)
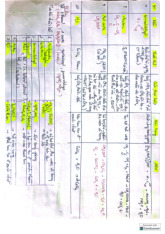
HA + B A- + BH+ a1 b2 b1 a2
HA/A-, BH+/B: cặp acid/base liên hợp Một số ví dụ HCl + H O Cl- + H O+ 2 3 HCOOH + OH- HCOO- + H O 2 CH NO + OH- -CH -NO + H O 3 2 2 2 2 C H OH + H O C H O- + H O 2 5 2 2 5 3 HSO - + NH SO 2- + NH + 4 3 4 4 H O+ + OH- 2H O 3 2 a1 b2 b1 a2
Cặp acid/base liên hợp: HCOOH/HCOO-, C H OH/C H O-, 6 5 6 5
CH NO /-CH NO , C H OH/C H O-,….. 3 2 2 2 2 5 2 5 K .K = 10-14 a b
Acid: Pt trung hòa, cation, anion,
Base: Pt trung hòa, anion
2. Phân loại dung môi, ảnh hưởng của dung môi đến lực acid, base
CH COOH + H O CH COO- + H O+ 3 2 3 3 acid
H SO + CH COOH CH C+(OH) + HSO - 2 4 3 3 2 4 base
a. Các loại dung môi
+ Dung môi trơ (phi proton): Benzen, n-hexan, cloroform,…
+ Dung môi lưỡng tính (amphi proton): H O, ancol, nitril, aceton,… 2
+ Dung môi base (protonphil): NH lỏng, amin, pyridin,…. 3
+ Dung môi acid (protogenic): CH COOH, H SO , ….. 3 2 4
b. Ảnh hưởng của dung môi đến lực acid-base
Ái lực của acid HA phụ thuộc vào khả năng nhận H+ của dung môi S
CH COOH + H O CH COO- + H O+ 3 2 3 3 Acid yếu/H O 2
CH COOH + NH CH COO- + NH + 3 3 3 4 Acid mạnh/NH3
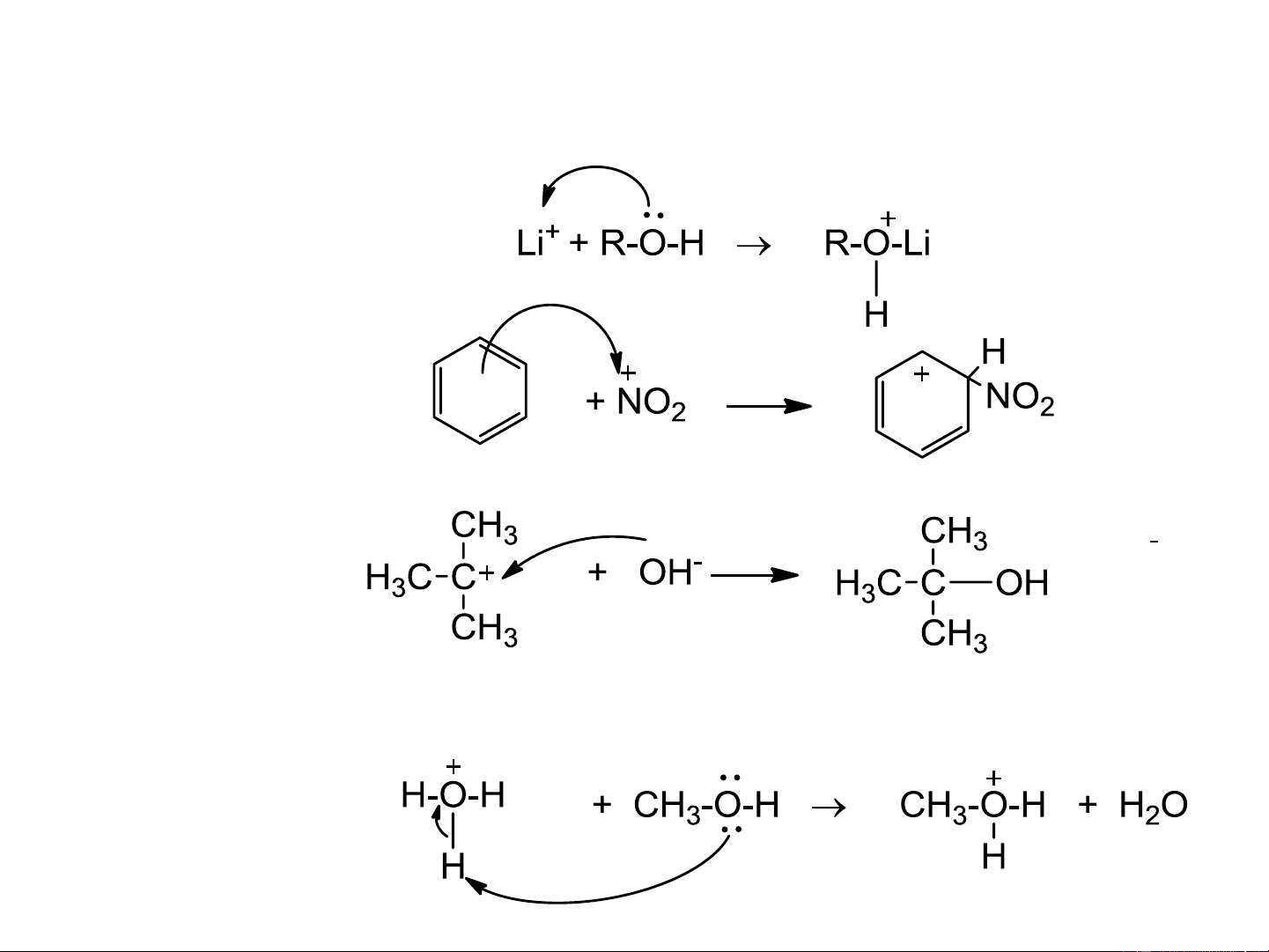
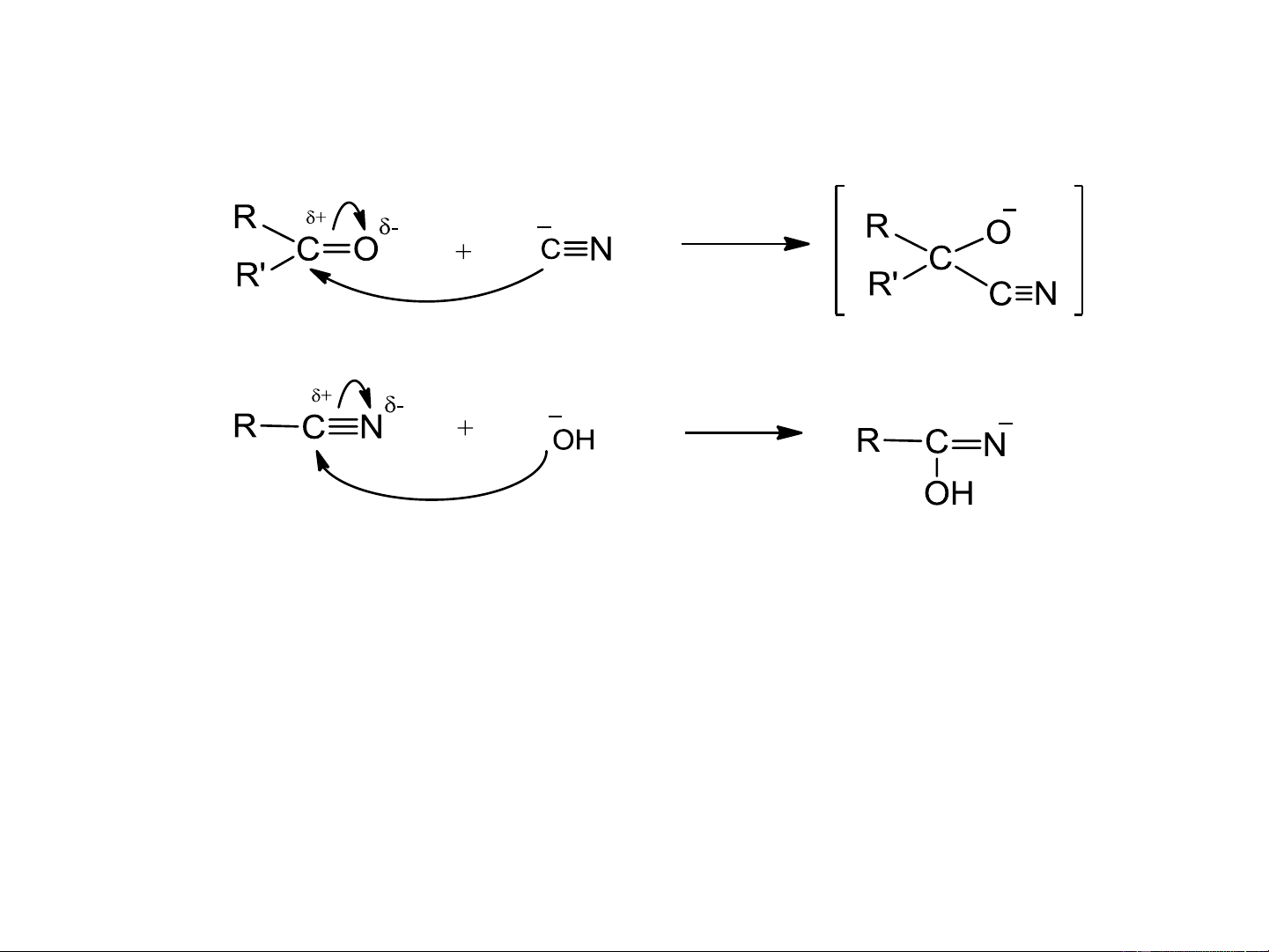
4.3. Thuyết acid – base của Lewis
1. Định nghĩa -
Acid: Nhận cặp e chưa sử dụng của base để tạo liên kết cộng hóa trị -
Base: Có cặp e chưa sử dụng có khả năng cho đi (electron-pair donors ) 2. Acid Lewis
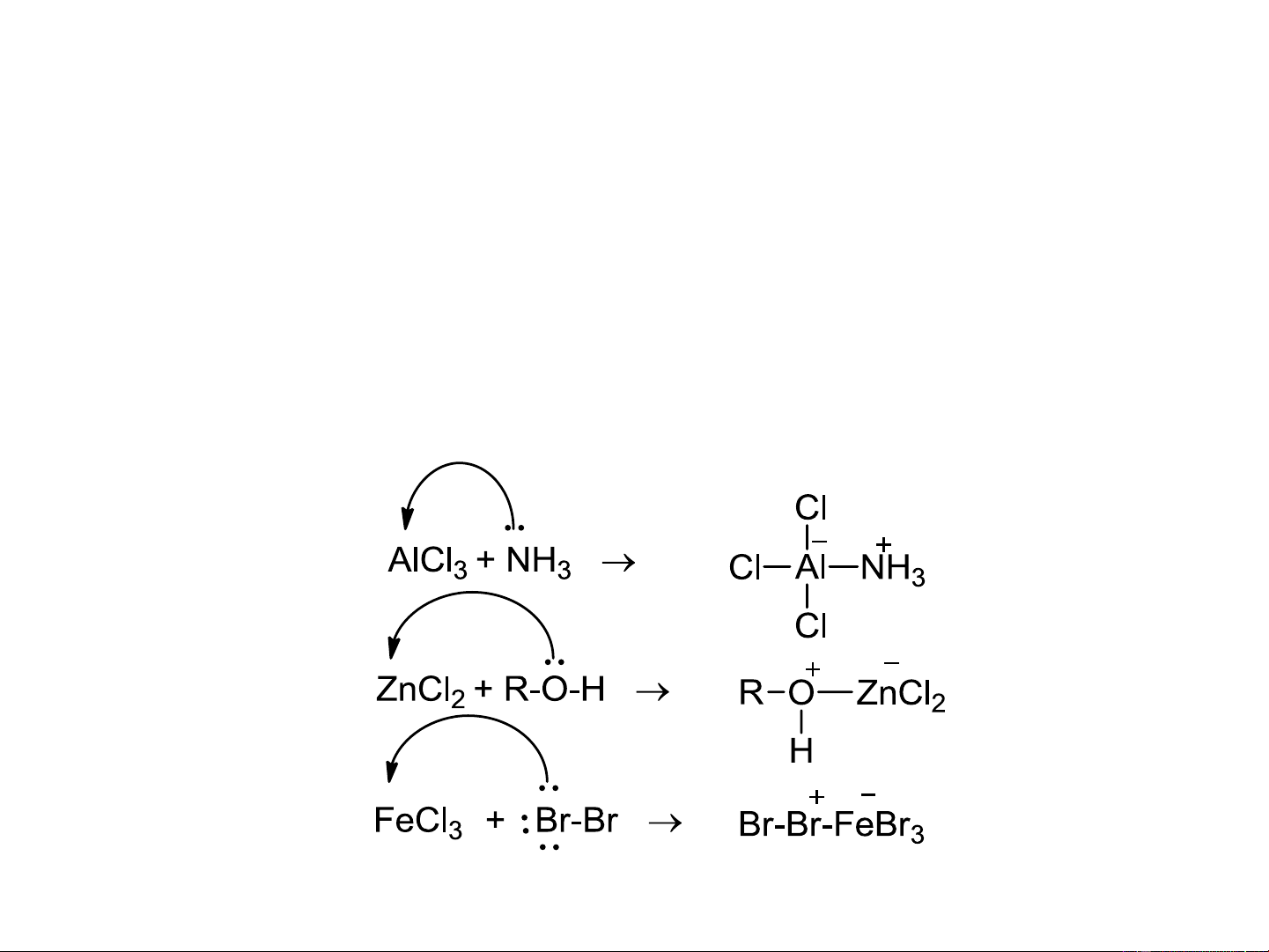
a. Nguyên tử trung tâm có quỹ đạo trống: BF , FeCl , AlCl , SO , ZnCl …. 3 3 3 3 2 Một số ví dụ acid base b.
Các cation: H+, Ag+, NO +, Cl+, cacbocation, …. 2 Một số ví dụ
c. Các liên kết đôi, liên kết ba phân cực: >C=O, -CN, -N=O,….
d. Các nguyên tử trung hòa có 6e lớp ngoài cùng: Oxi
e. Các chất mà lớp e ngoài cùng của nguyên tử trung tâm có
thể mở rộng: SnCl4
3. Base Lewis: là những anion hay phân tử trung hòa
Chú ý: - Tác nhân nucleophil: Base Lewis
- Tác nhân electrophil: Acid Lewis
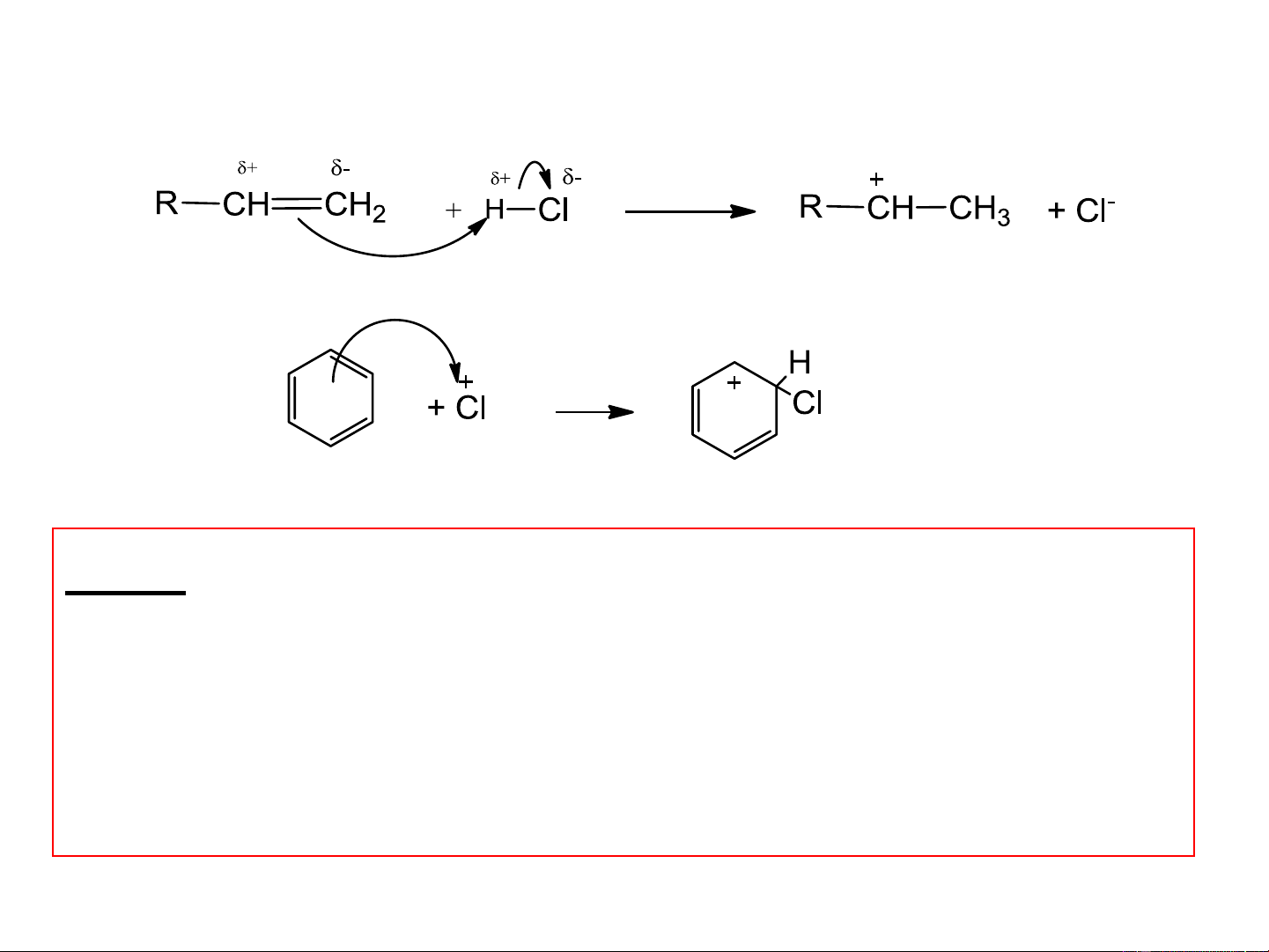
Các phản ứng hữu cơ như S , A , A , …. Có thể coi là quá trình E N E tương tác acid – base.
4. So sánh độ mạnh của acid-base
(độ electrophil và nucleophil) Hằng số acid (Ka) HA + H O A- + H O+ Ka 2 3
Ka = ([H O+].[A-])/[HA] (25oC) 3
PKa = -logKa; Pka càng lớn, acid càng yếu CH COOH CF COOH HCl 3 3 Pka 4,75 0 -7 acid yếu acid mạnh Lưu ý:
Cặp acid/base liên hợp: acid mạnh/base yếu và ngược lại
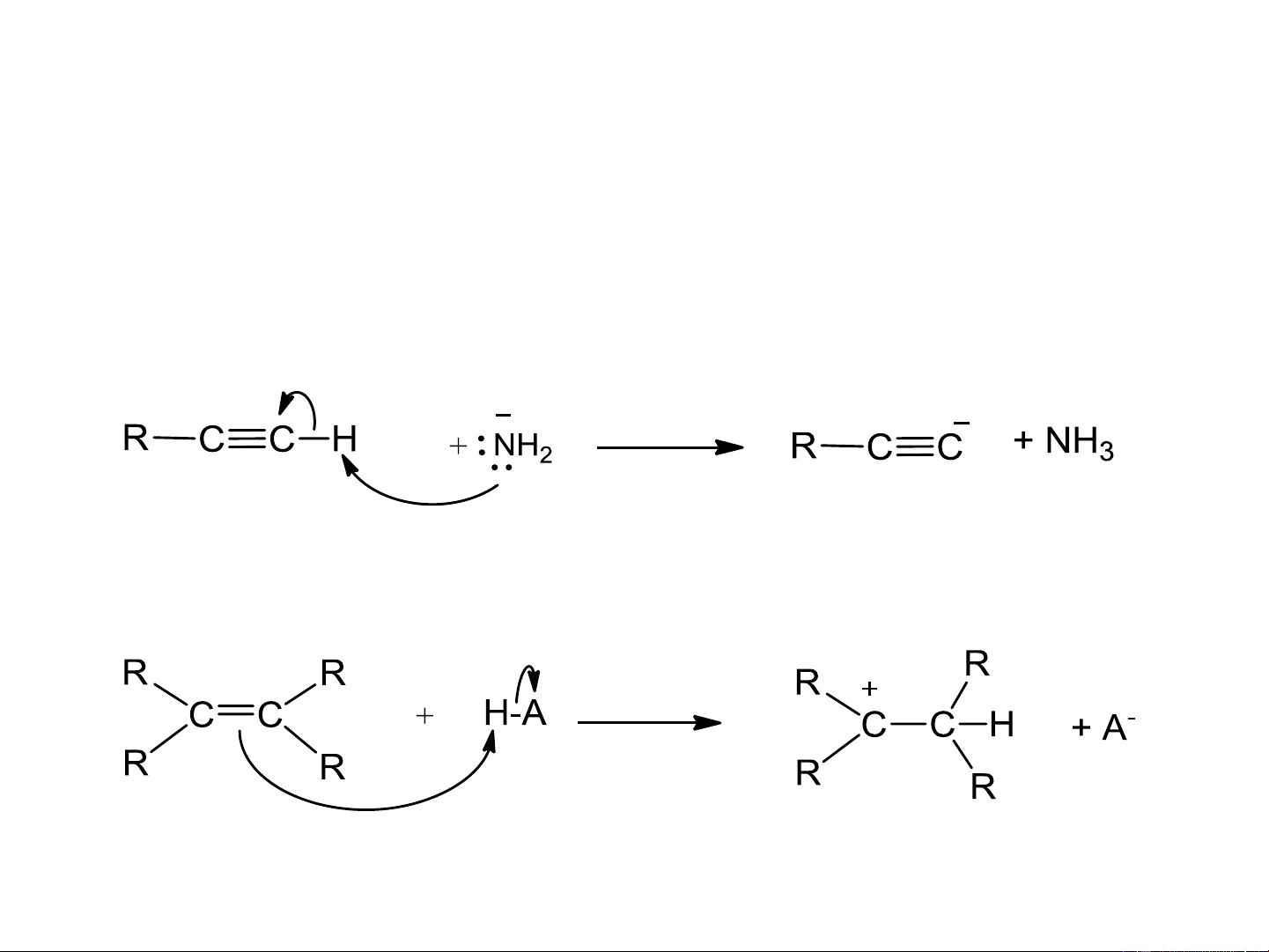
Acid mạnh hơn + base mạnh hơn acid yếu hơn + base yếu hơn Cacbon lai hóa H-CC-H CH =CH CH -CH 2 2 3 3 Pka 25 44 50 Pka = 25 Pka = 38 Acid mạnh hơn Acid yếu hơn Anken acid Cabocation Base base mạnh hơn Acid yếu hơn yếu hơn
Bài hôm nay chớ để ngày mai!