




Preview text:
Chương 8 DẪN XUẤT HALOGEN (Alkyl halides) NỘI DUNG 8.1. Phân loại 8.2. Danh pháp
8.3. Tính chất vật lý
8.4. Các phương pháp điều chế
8.5. Tính chất hóa học 8.1. PHÂN LOẠI
Khái niệm: Là dẫn xuất của hydrocarbon khi thay thế nguyên tử H = halogen.
Phân loại: Dẫn xuất no, không no và thơm
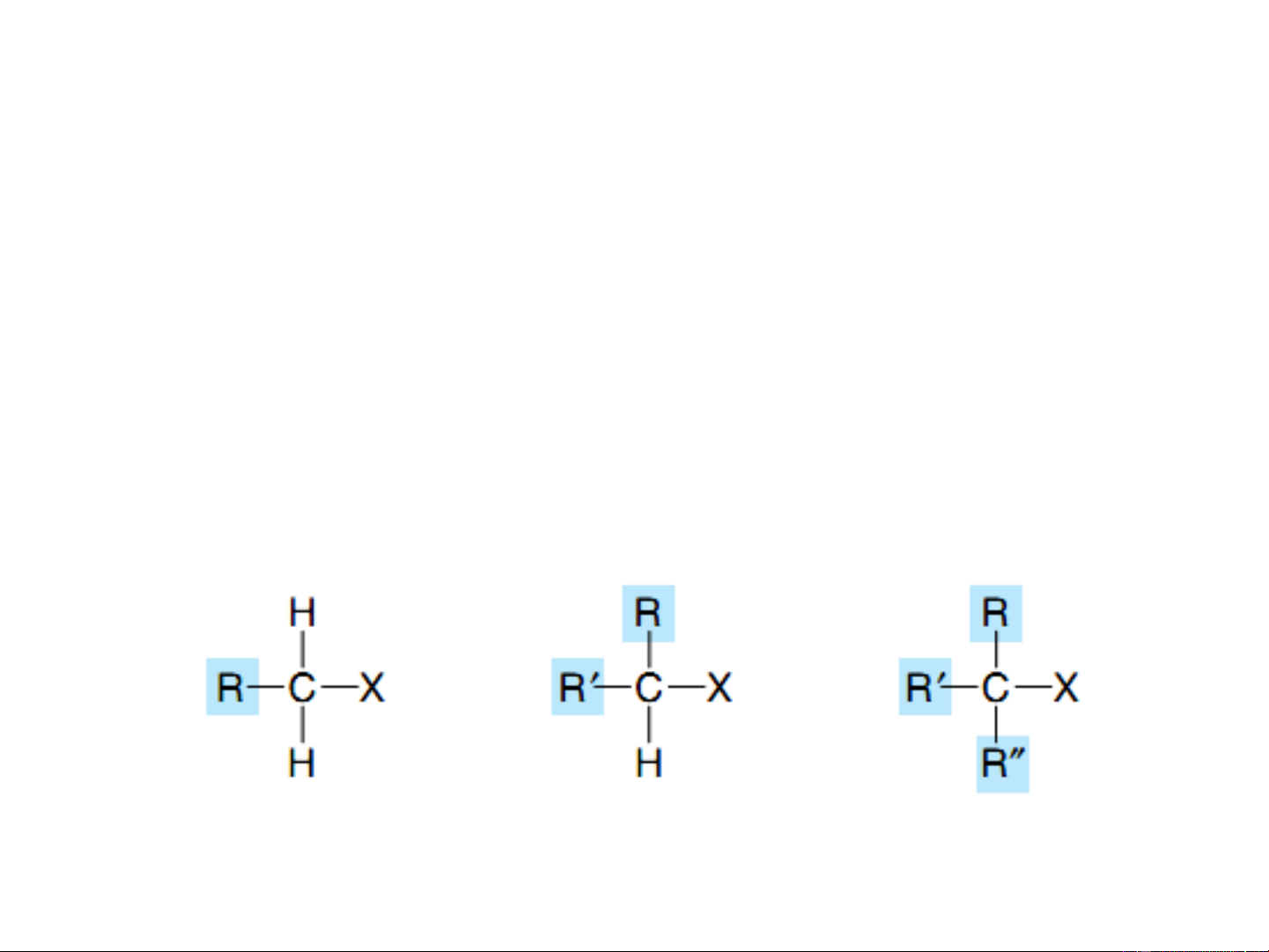
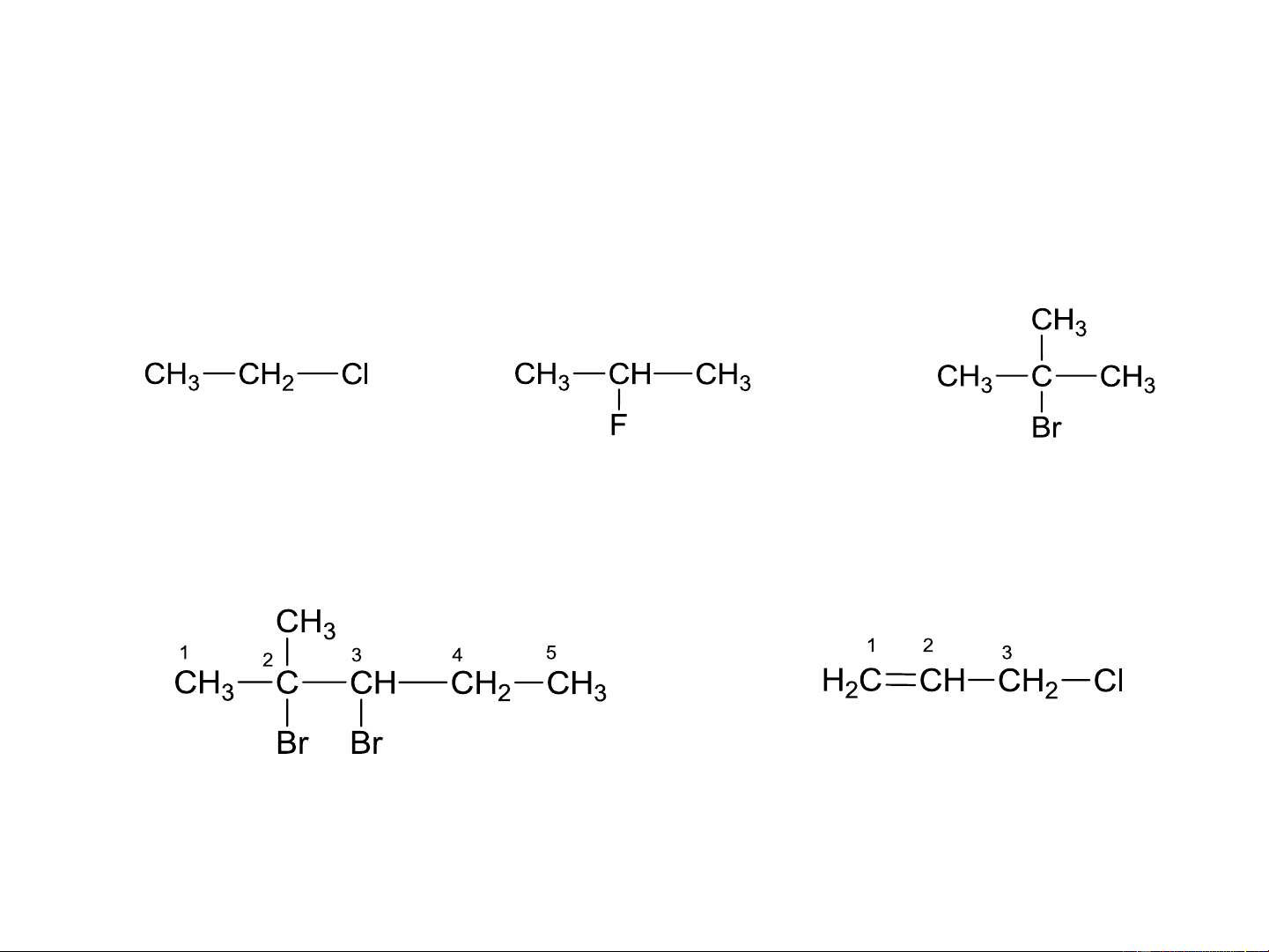
Dẫn xuất halogen ankan (ankylhalogenua): R-X (R- ankyl) 1o 2o 3o
Dẫn xuất halogen không no: Vinyl halogenua: CH =CH-X 2 Allyl hahogenua: CH =CH-CH -X 2 2
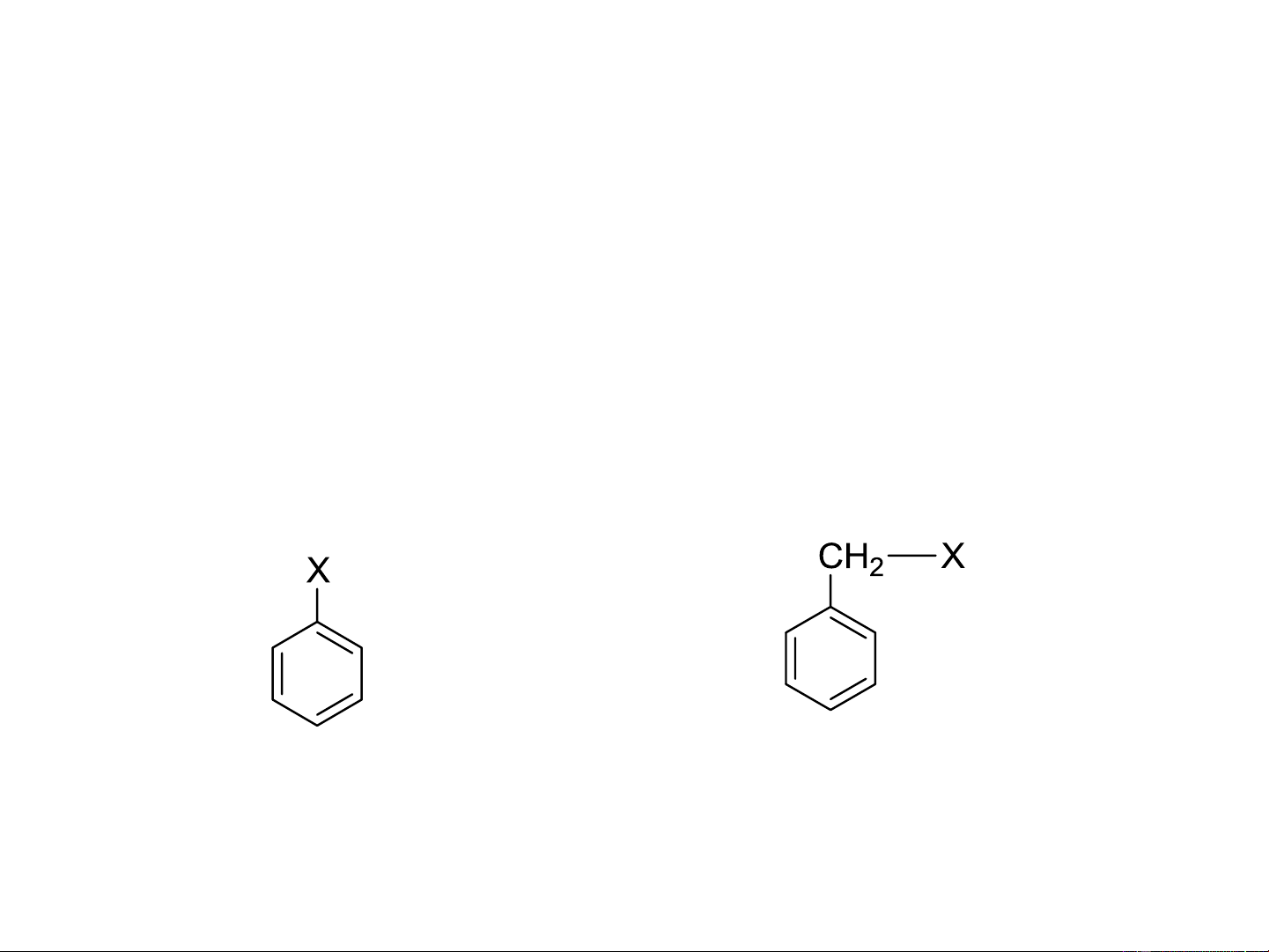
Dẫn xuất halogen thơm: Phenyl halogenua Benzyl halogenua 8.2. DANH PHÁP
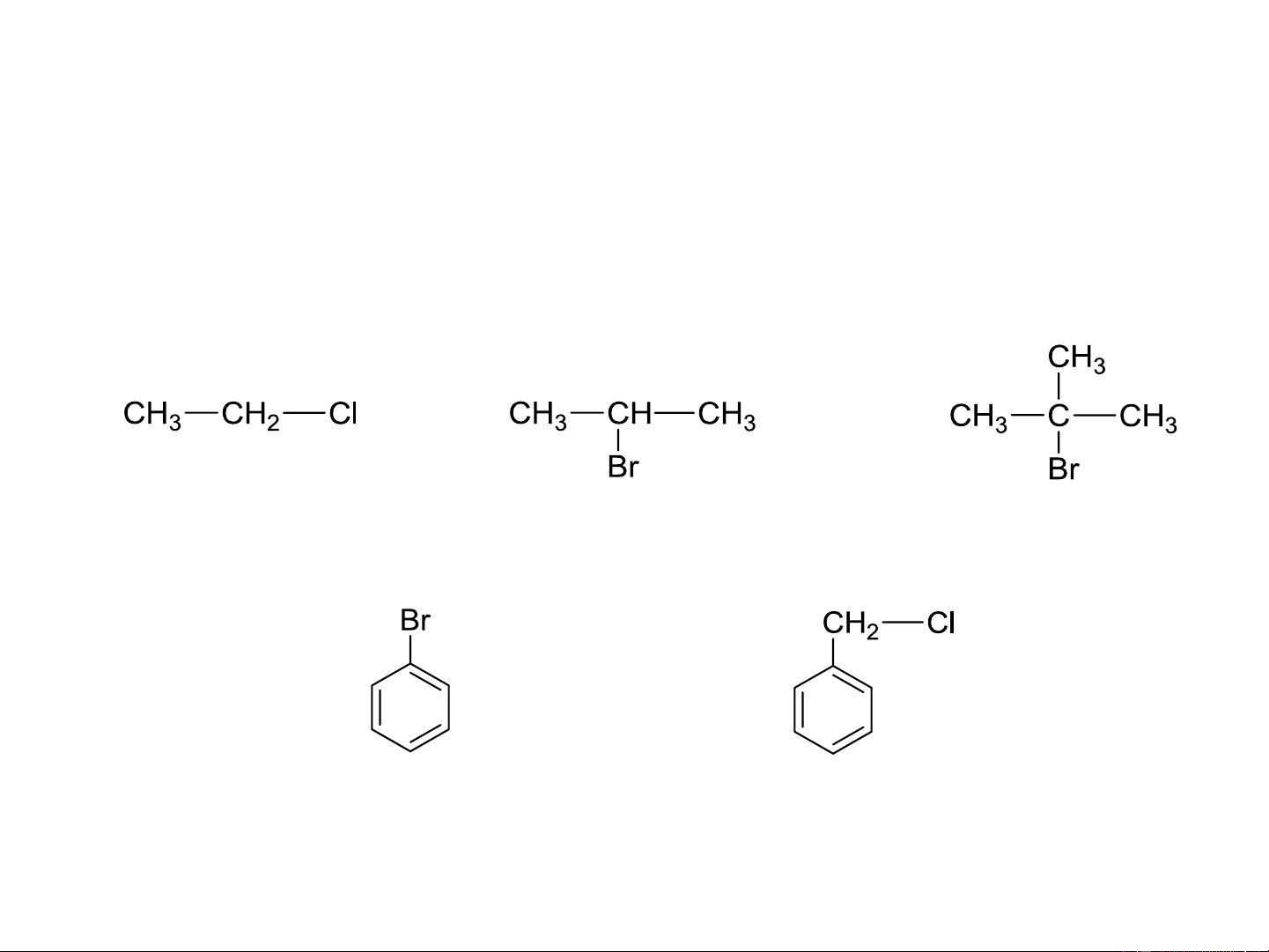
Tên thường: Tên gốc hydrocarbon + halogenua Ethyl clorua Isopropyl bromua
tert-Butyl bromua Phenyl bromua Benzyl clorua 8.2. DANH PHÁP
Tên IUPAC: Vị trí halogen + Tên halogen + tên RH cloethan 2-flopropan 2-brom-2-methylpropan
2,3-dibrom-2-methylpentan 3-clo-1-propen
8.3. Tính chất vật lý
8.4. Các phương pháp điều chế
8.4.1. Halogen hóa trực tiếp các hydrocarbon
8.4.2. Cộng HX vào liên kết bội
8.4.3. Tách loại HX từ dẫn xuất dihalogen
8.4.4. Điều chế dx halogen từ ancol
8.4.5. Điều chế dx halogen từ muối diazo thơm
8.4. CÁC PHƯƠNG PHÁP ĐiỀU CHẾ
8.4.1. Halogen hóa trực tiếp các hydrocarbon
a. Halogen hóa ankan: S R
b. Halogen hóa anken: A , S E R
c. Halogen hóa ankin: AE
d. Halogen hóa ankadien: A , cộng 1,2 và 1,4 E
e. Halogen hóa hydrocarbon thơm: S , S E R
Xem lại tính chất hóa học phần hydrocarbon
8.4.2. Cộng HX vào liên kết bội
a. Phản ứng cộng HX vào anken, ankin, ankadien
b. Phản ứng cộng HBr/peroxit vào anken, ankin
Xem lại các phản ứng và cơ chế A , A E R
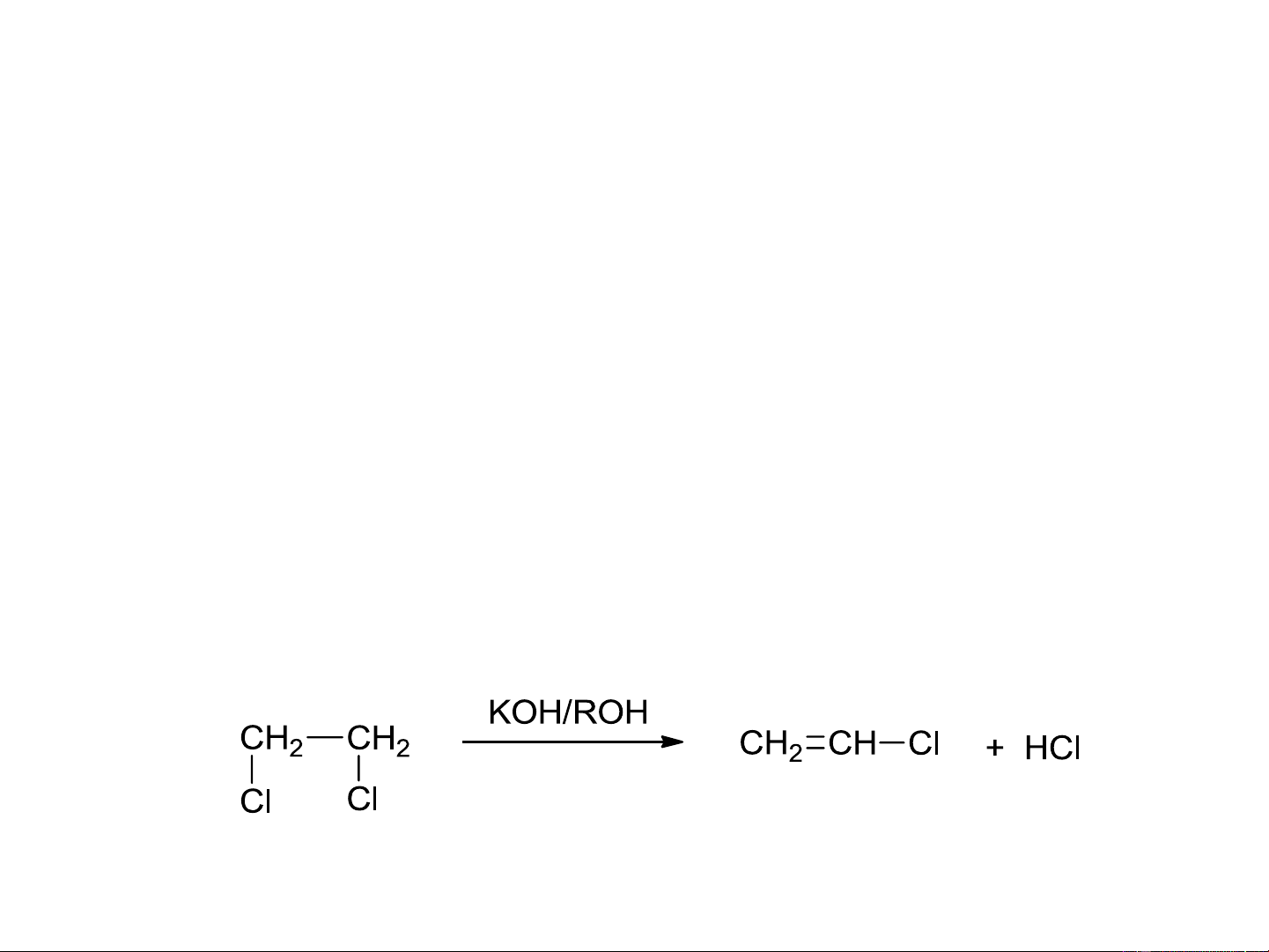
8.4.3. Tách loại HX từ dẫn xuất dihalogen
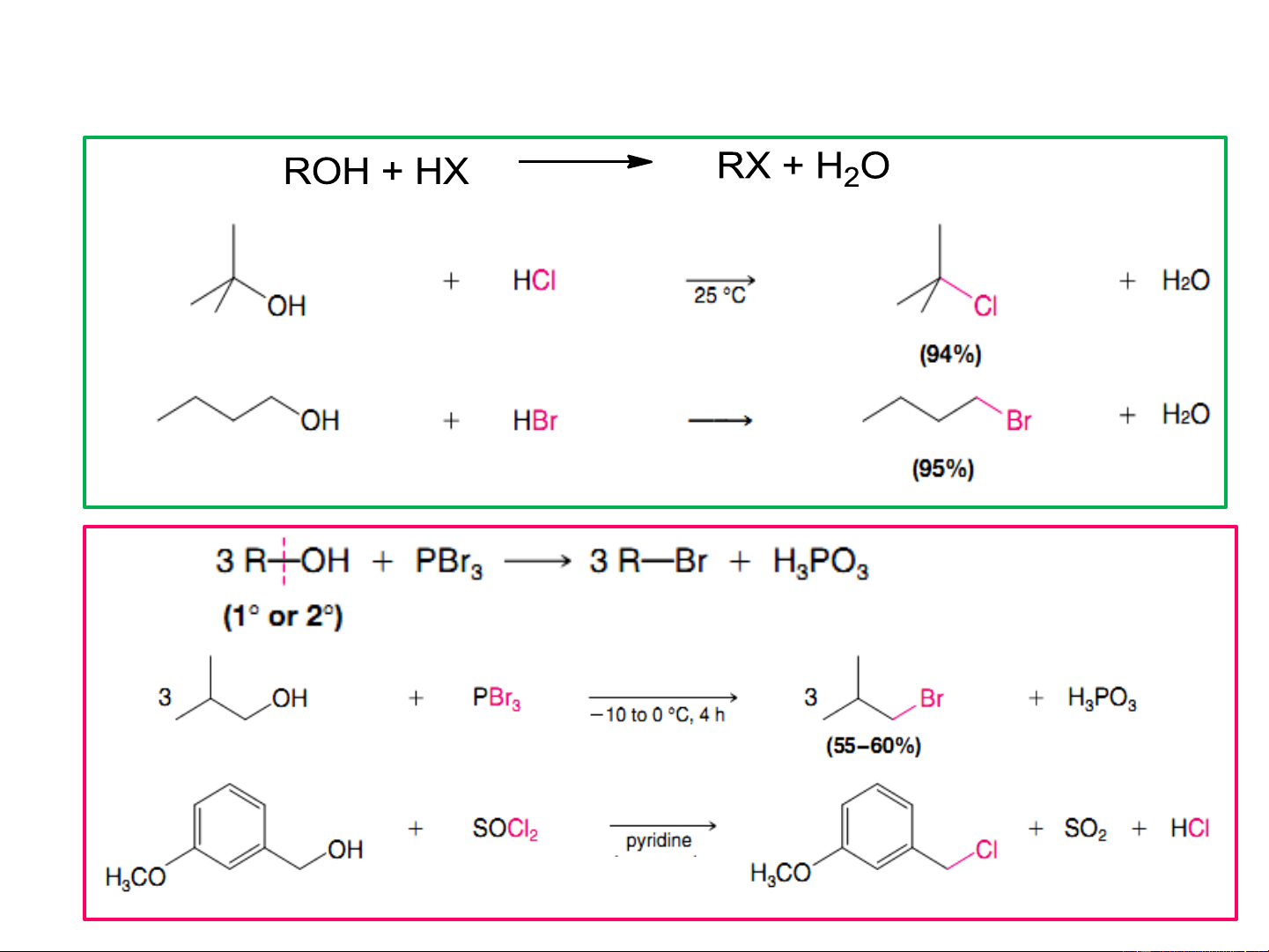
8.4.4. điều chế dẫn xuất halogen từ ancol (SOCl ) 2 thionylclorua
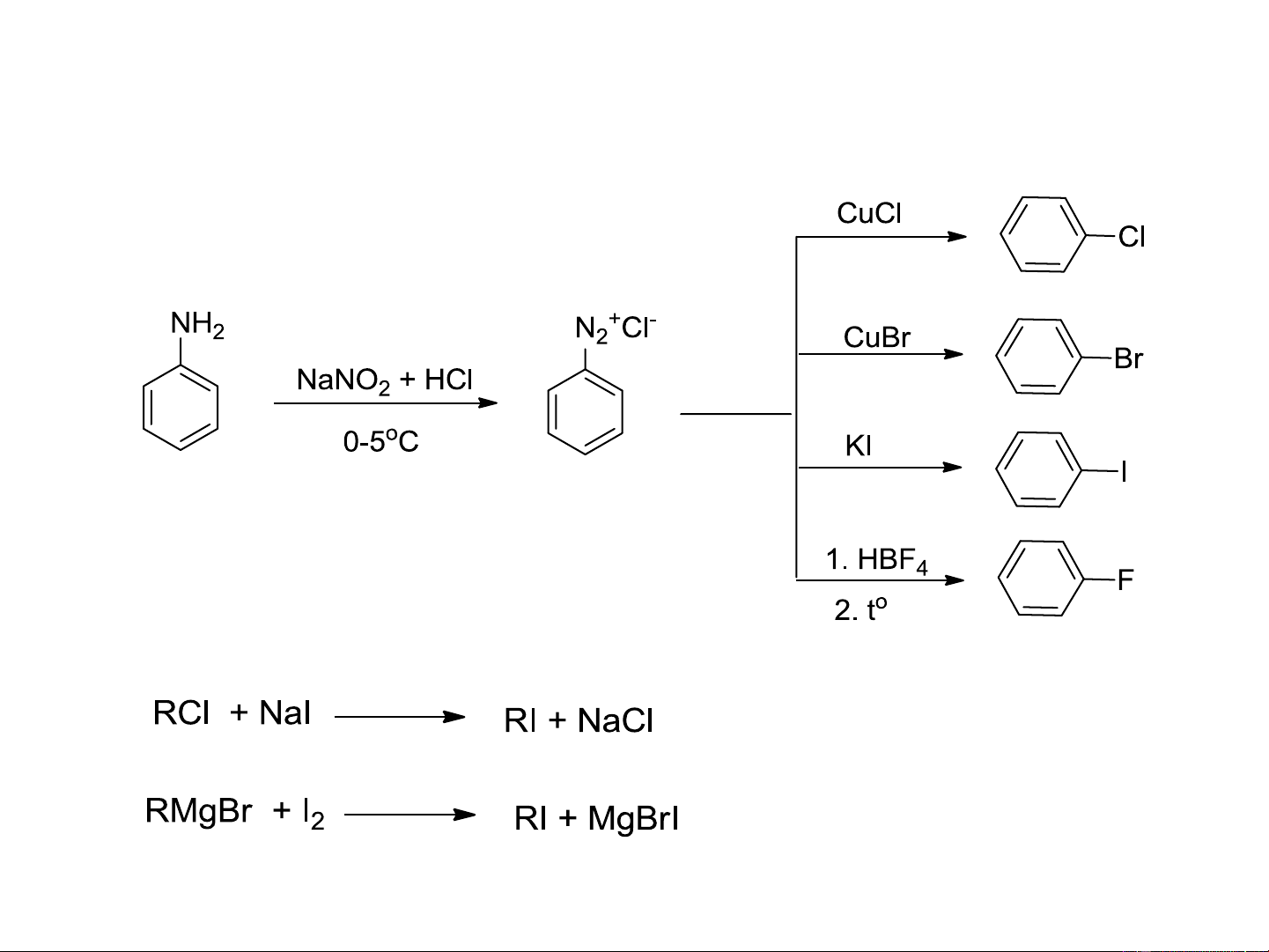
8.4.5. Điều chế dx halogen từ muối diazo thơm
8.5. Tính chất hóa học
8.5.1. Phản ứng thế nucleophil (S ) N
Phản ứng thế nucleophil đơn phân tử (S 1) N
Phản ứng thế nucleophil lưỡng phân tử (S 2) N
8.5.2. Phản ứng tách loại (E)
Phản ứng tách loại E1 và E2
8.5.3. Phản ứng với kim loại
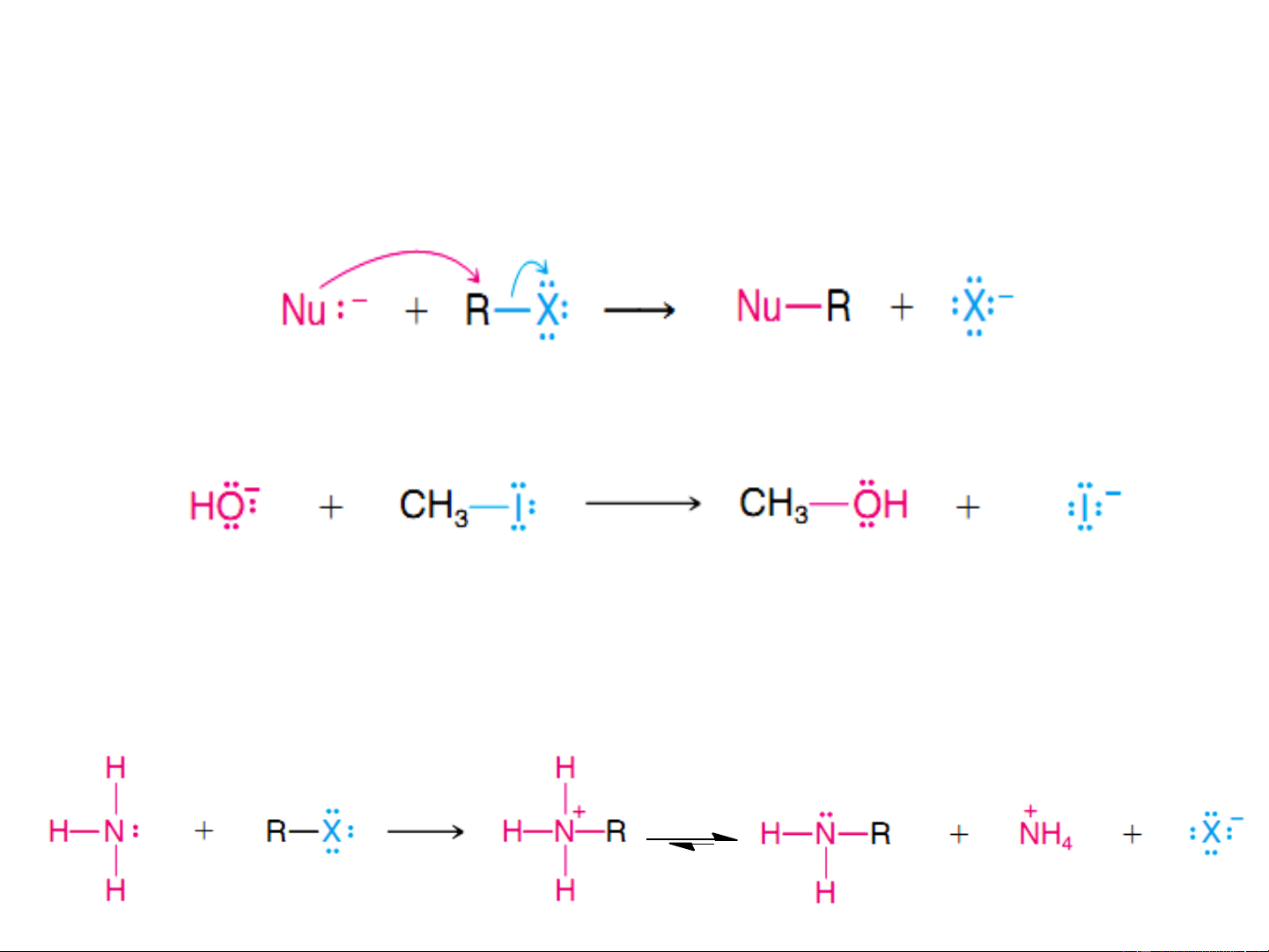
8.5.1.PHẢN ỨNG THẾ NUCLEOPHIL (S ) N
Phản ứng thay thế anion X- bằng các tác nhân nucleophil
Tác nhân nucleophil (Nu-) là các anion: OH-, OR-, CN-,…
Tác nhân nucleophil là phân tử trung hòa có cặp e tự do: NH , RNH , H O, ROH, …. 3 2 2 NH dư 3
Cơ chế phản ứng thế nucleophil
(Nucleophilic Substitution: S ) N
Tùy thuộc vào trạng thái chuyển tiếp (TTCT) của phản ứng:
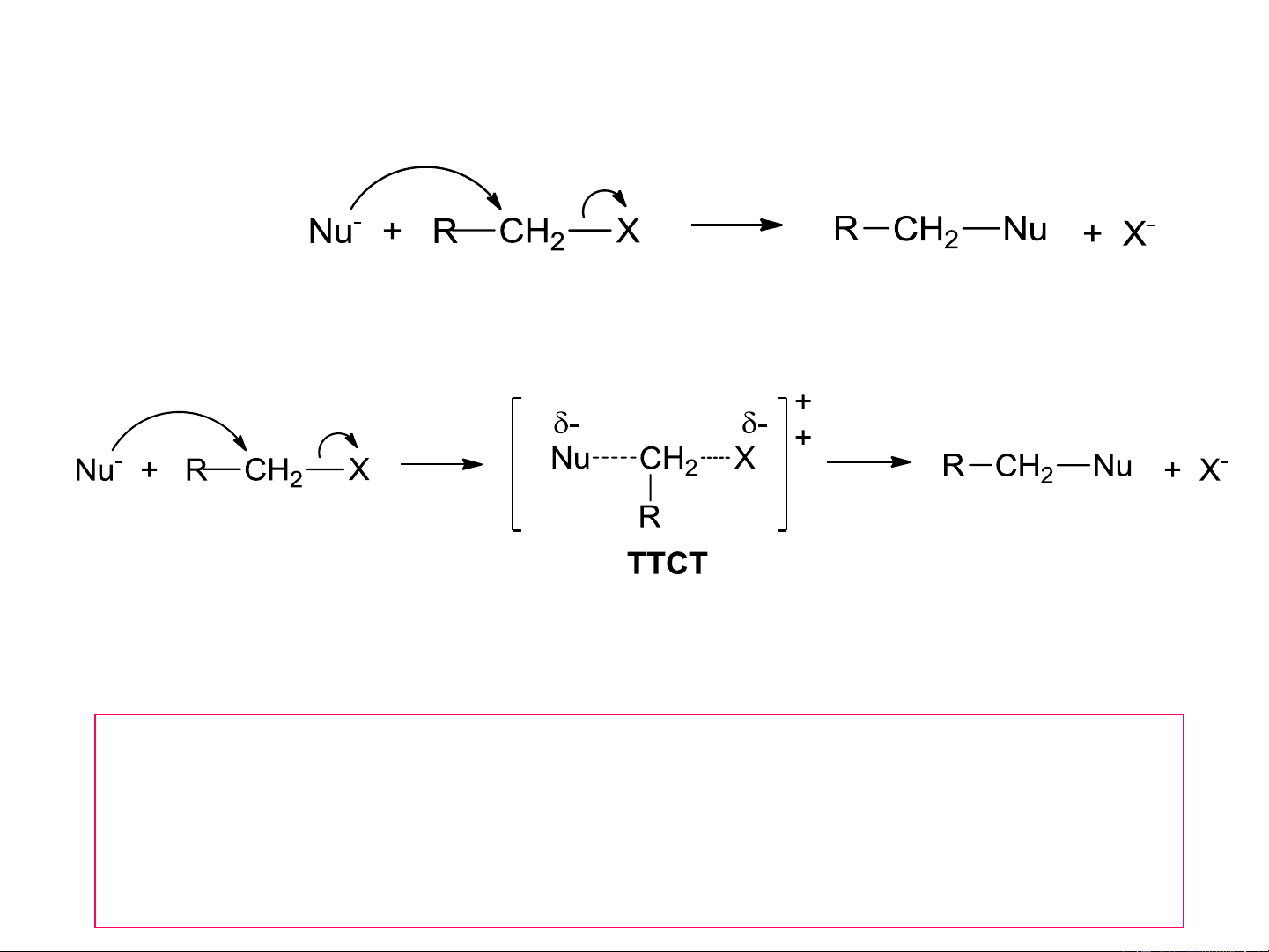
S 2: Phản ứng thế nucleophil lưỡng phân tử N
(Substitution Nucleophilic Bimolecular)
S 1: Phản ứng thế nucleophil đơn phân tử N
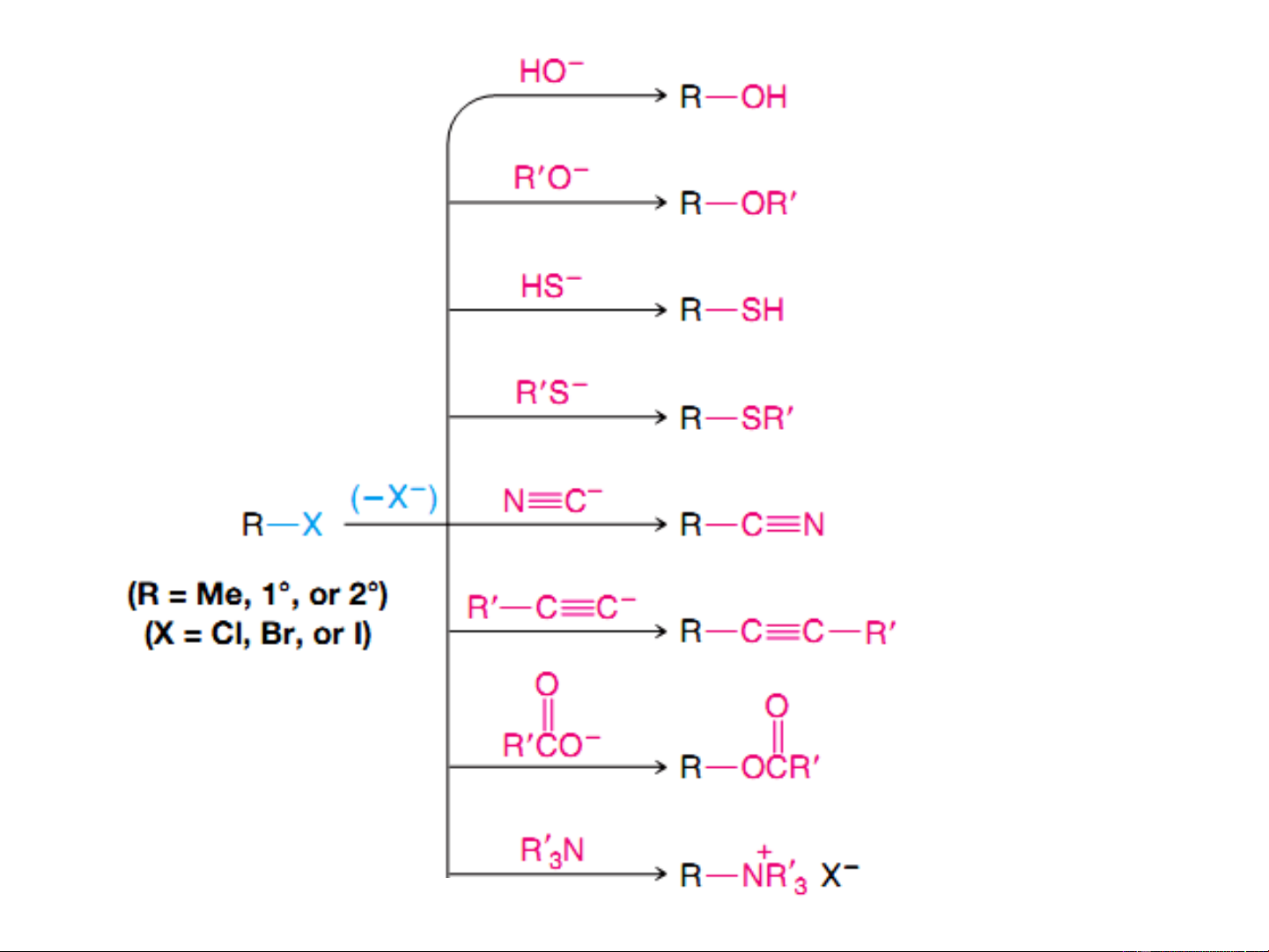
(Substitution Nucleophilic Unimolecular) ancol ete Phản ứng S 2 thiol N thioete nitril ankin este Muối amonium
i. Phản ứng thế theo cơ chế S 2 N Phản ứng: Cơ chế S 2 N
Phương trình tốc độ phản ứng v = k. [Nu-].[RX] Cơ chế S 2 N
Phản ứng 1 giai đoạn, qua trạng thái chuyển tiếp (TTCT),
phương trình tốc độ phản ứng bậc 2.
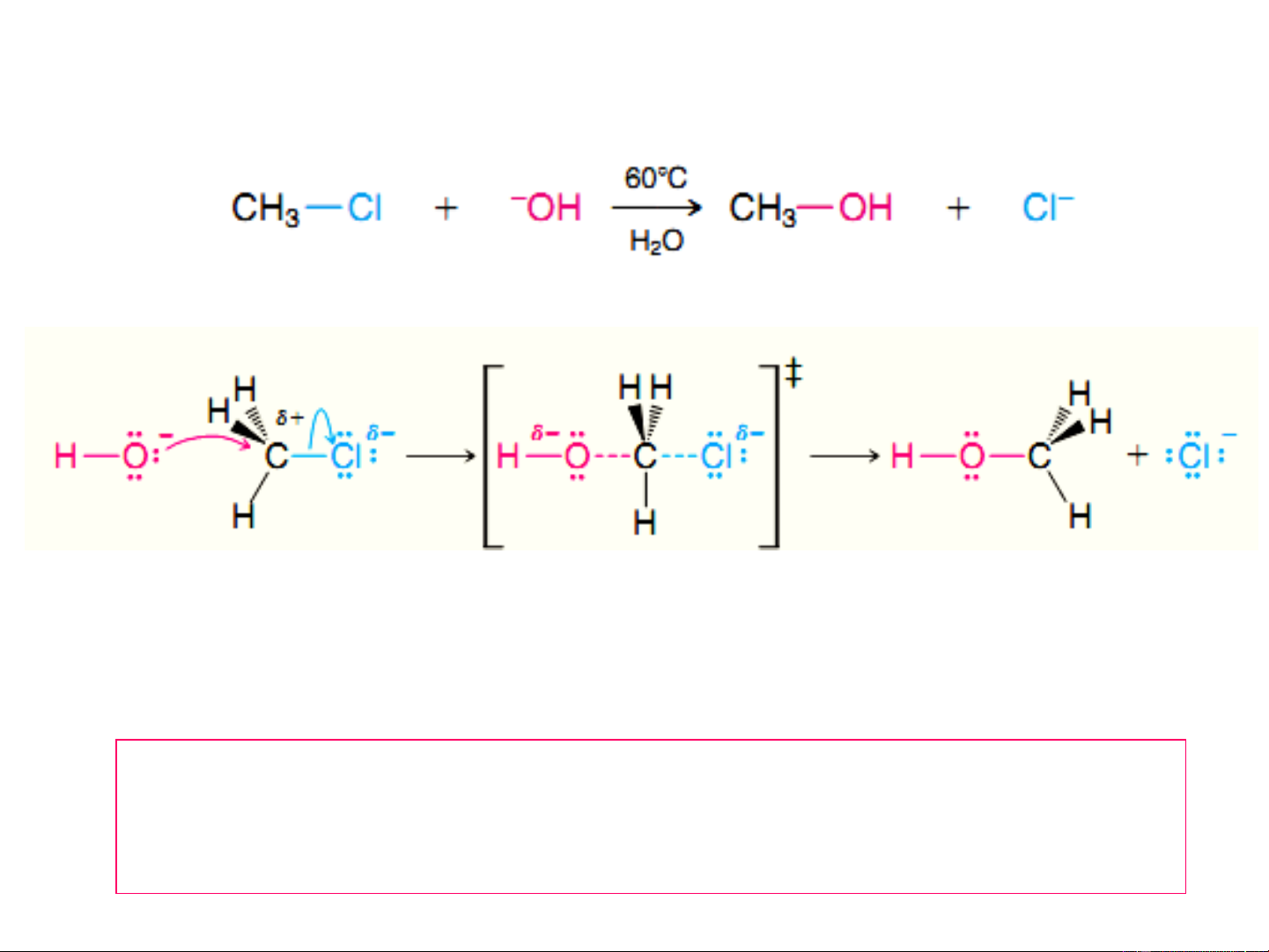
Phản ứng thủy phân CH Cl trong môi trường OH- 3 Cơ chế S 2 N TTCT V = k. [OH-]. [CH Cl] 3
S 2: - Ưu tiên dẫn xuất halogel bậc thấp (R-X bậc 1o). N
- Tác nhân Nu- mạnh, nồng độ cao.
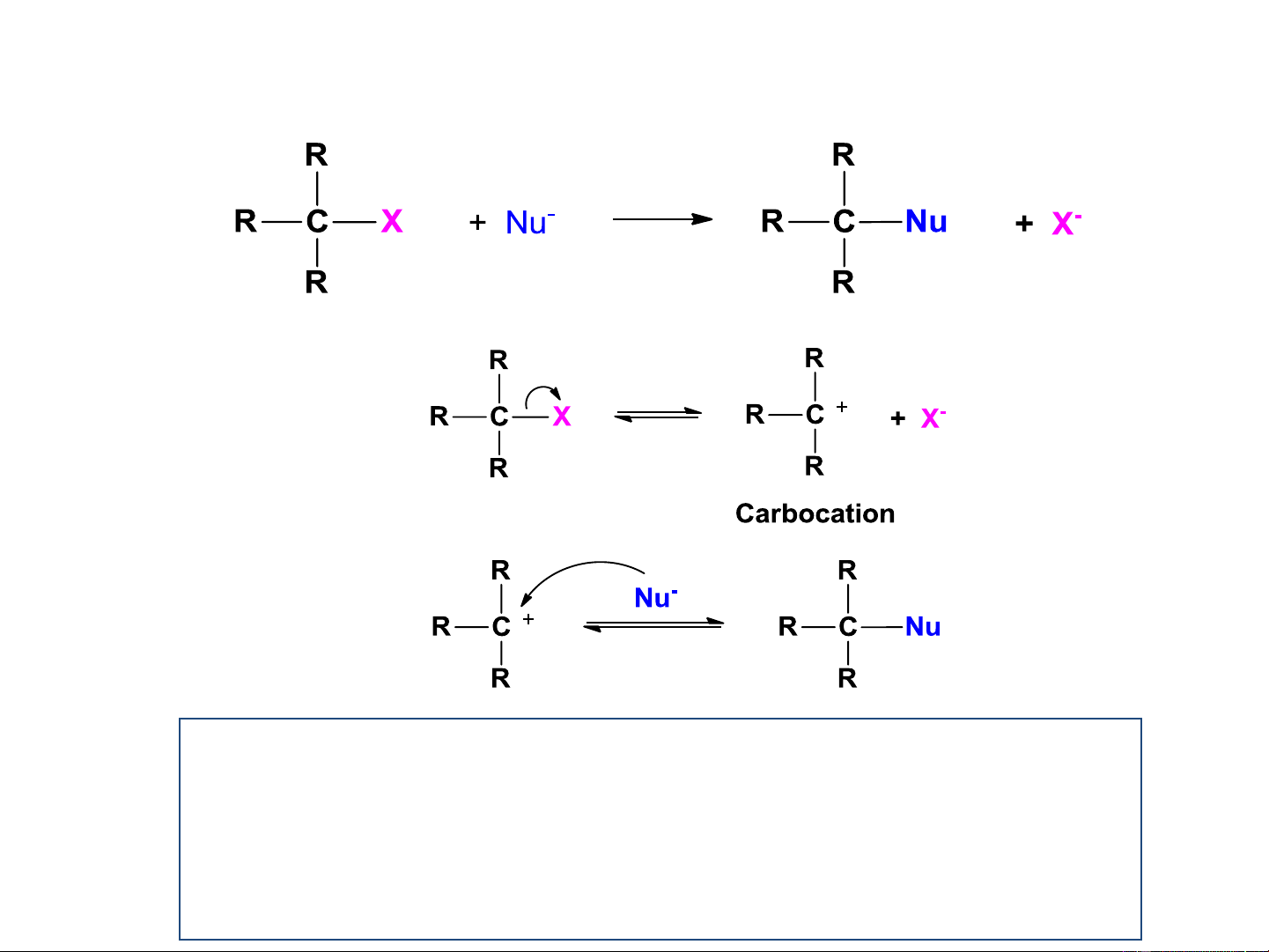
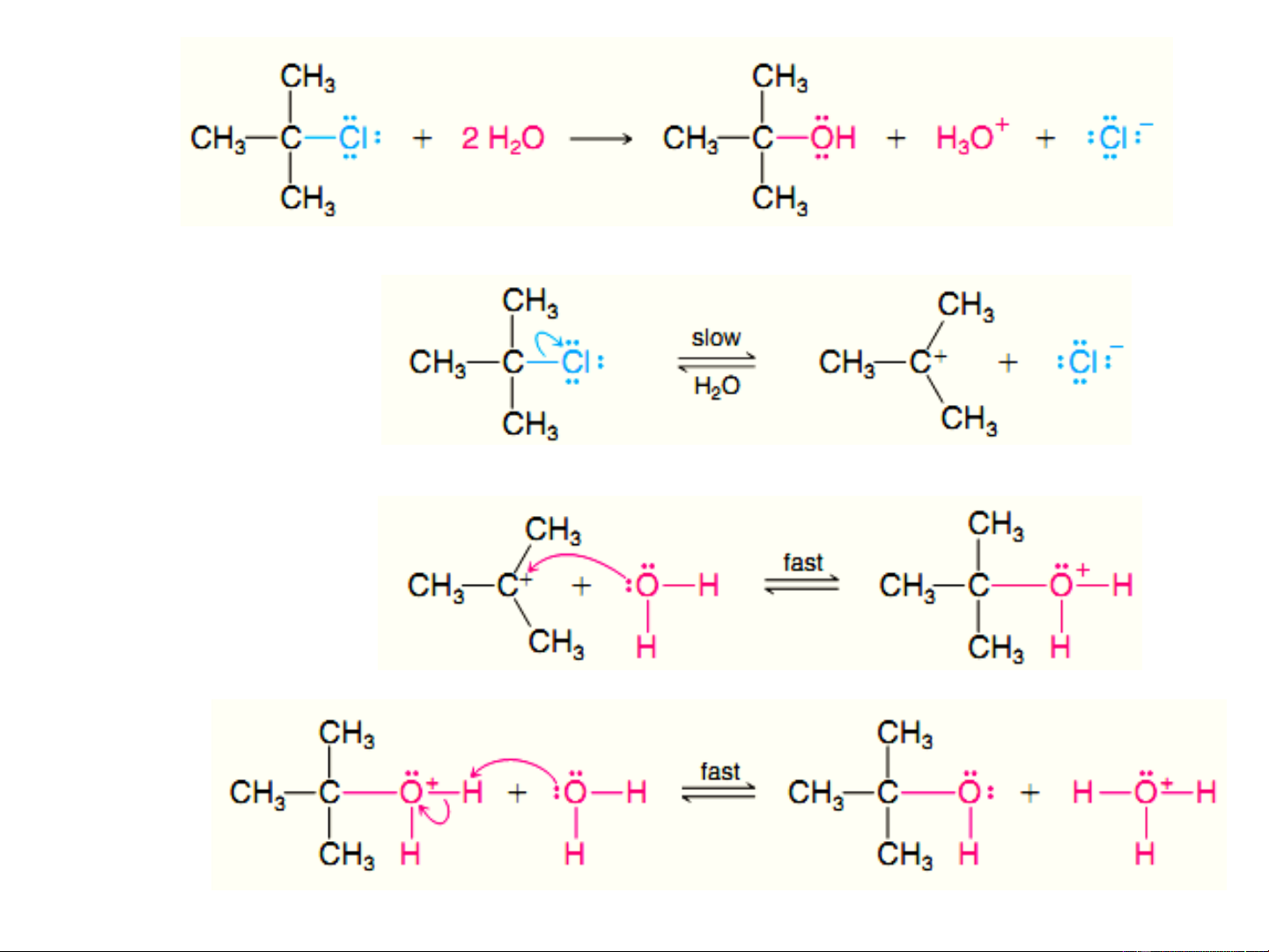
ii. Phản ứng thế theo cơ chế S 1 N Cơ chế S 1 N Chậm Giai đoạn 1: V= k. [R-X] Giai đoạn 2: Nhanh Cơ chế S 1 N
Phản ứng 2 giai đoạn, tạo SPTG là carbocation,
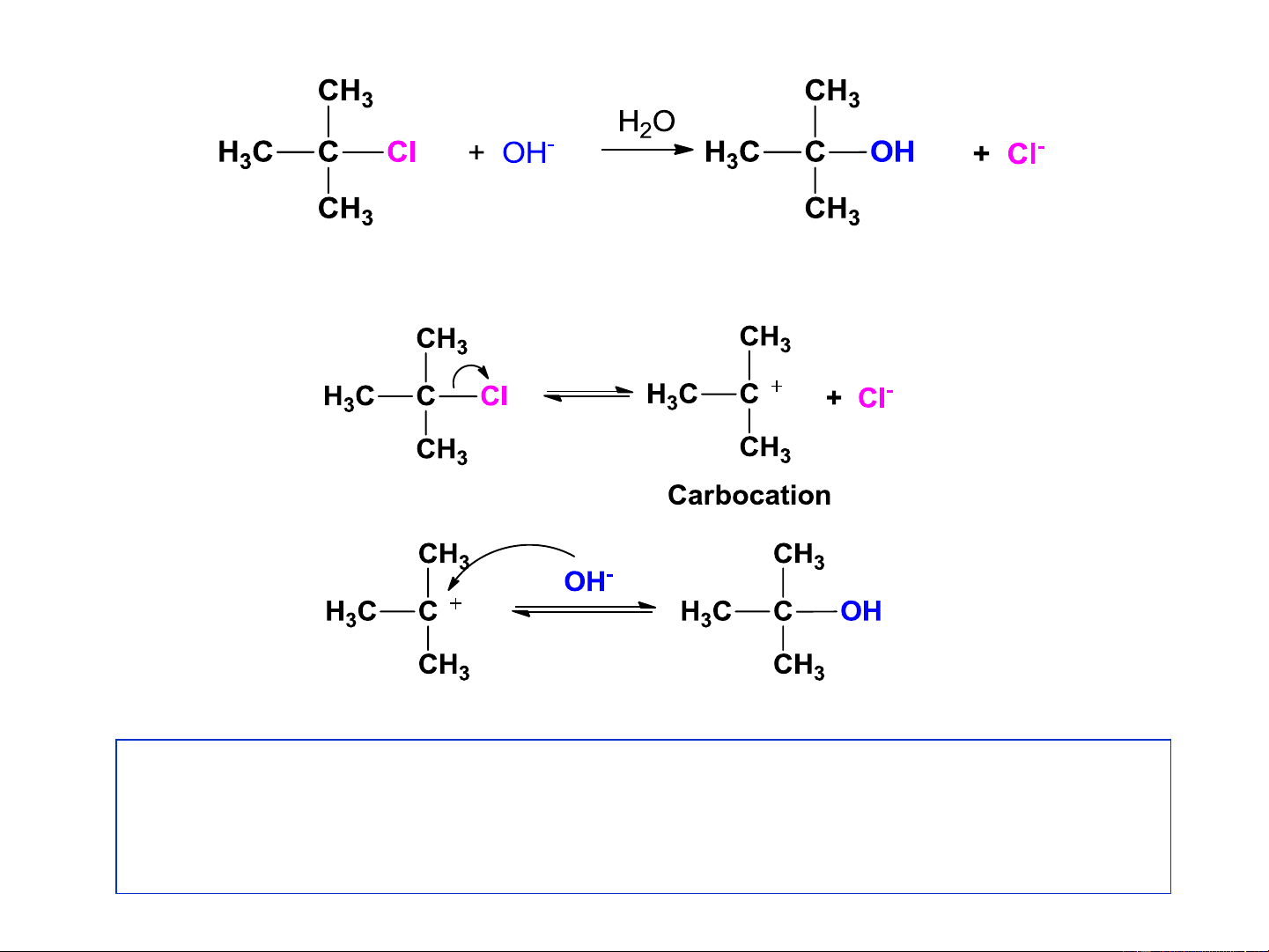
phương trình tốc độ phản ứng bậc 1. Cơ chế S 1 N Chậm V= k. [(CH ) CCl] 3 3 Nhanh
S 1: - Ưu tiên dẫn xuất halogel bậc cao (R-X bậc 3o). N
- Không phụ thuộc vào lực và nồng độ Nu- Cơ chế S 1 N Giai đoạn 1 Carbocation 3o Giai đoạn 2




