






Preview text:
DẪN XUẤT HALOGEN CỦA HYDROCACBON (1)
1. Khái niệm - phân loại
2. Danh pháp, đồng phân 3. Điều chế 1. KHÁI NIỆM
Khi thay thế một, hai hoặc nhiều nguyên tử
hydro trong phân tử hydrocacbon bằng nguyên
tử halogen, ta được dẫn xuất halogen.
R−X Ar-X (X = F, Cl, Br, I) ❖Phân loại + Theo gốc Hydrocacbon: Cl Br CH3 CH -CH -X Cl 3 2 halogen ankan
CHC−X Clobenzen Brombenzen 2-Clotoluen halogen ankin CH =CH-CH -OH 2 2 halogen thơm halogen anken 1. KHÁI NIỆM ❖ Phân loại + Theo số nhóm -X: - monohalogen:
CH −CH −CH X (1 nhãm X) 3 2 2 − - dihalogen: CH CH (2 nhãm X) 2 2 X X
- polyhalogen là những ancol có từ 3 nhóm X trở lên.
CH −CH−CH 2 2 (3 nhãm X) X X X
+ Một số loại halogen thông dụng
- Dẫn xuất mono halogen của hydrocacbon no dãy ankan:
Phân tử có 1 nhóm -X liên kết với gốc Ankyl: C H X (với n n 2n+1 ≥ 1) hay R-X
Ví dụ: CH X, C H X,... 3 2 5
- Dẫn xuất mono halogen của hydrocacbon chưa no: Phân
tử có 1 nhóm -X liên kết với nguyên tử cacbon no của gốc hydrocacbon không no.
Ví dụ: CH =CH-CH -X, CH =CH-X, ... 2 2 2
- Dẫn xuất mono halogen thơm: Phân tử có nhóm -X liên
kết với nguyên tử cacbon no của vòng benzen Ví dụ: C H -X 6 5
- Dẫn xuất dihalogen : Phân tử có 2 nhóm -X liên kết với gốc hydrocacbon:
Ví dụ: CH -CCl -CH 3 2 3
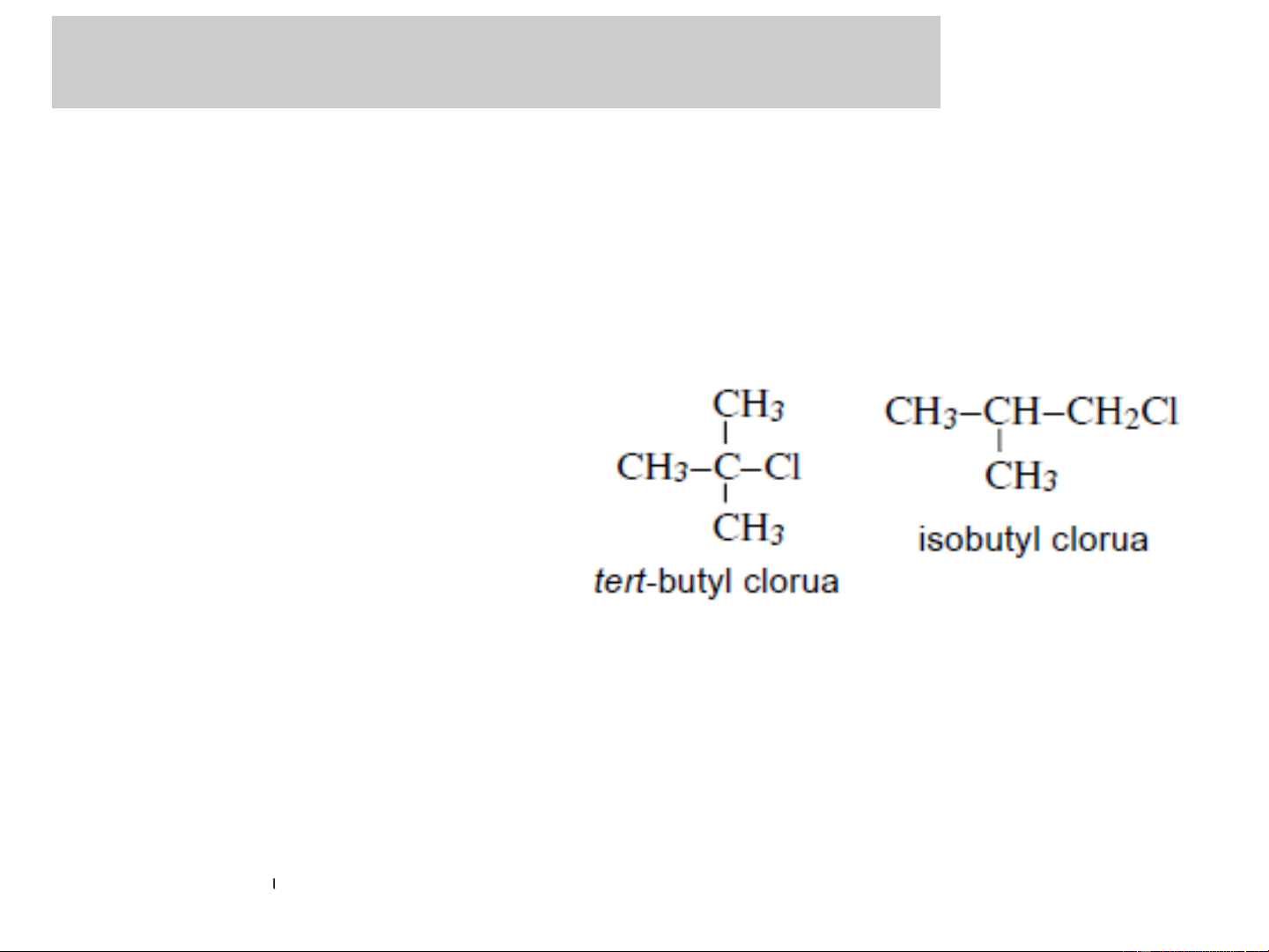
❖ Bậc của Dẫn xuất mono halogen: bằng bậc của nguyên
tử C liên kết với -X
CH −CH −CH −CH −Cl 3 2 2 2 Dẫn xuất halogen bậc 1
R−CHX−CH3 Dẫn xuất halogen bậc 3 Dẫn xuất halogen bậc 2
- Dẫn xuất mono halogen của hydrocacbon no dãy ankan:
Phân tử có 1 nhóm -X liên kết với gốc Ankyl: C H X (với n n 2n+1 ≥ 1) hay R-X
Ví dụ: CH X, C H X,... 3 2 5
2. DANH PHÁP - ĐỒNG PHÂN
DÉn xuÊt mono halogen ankan
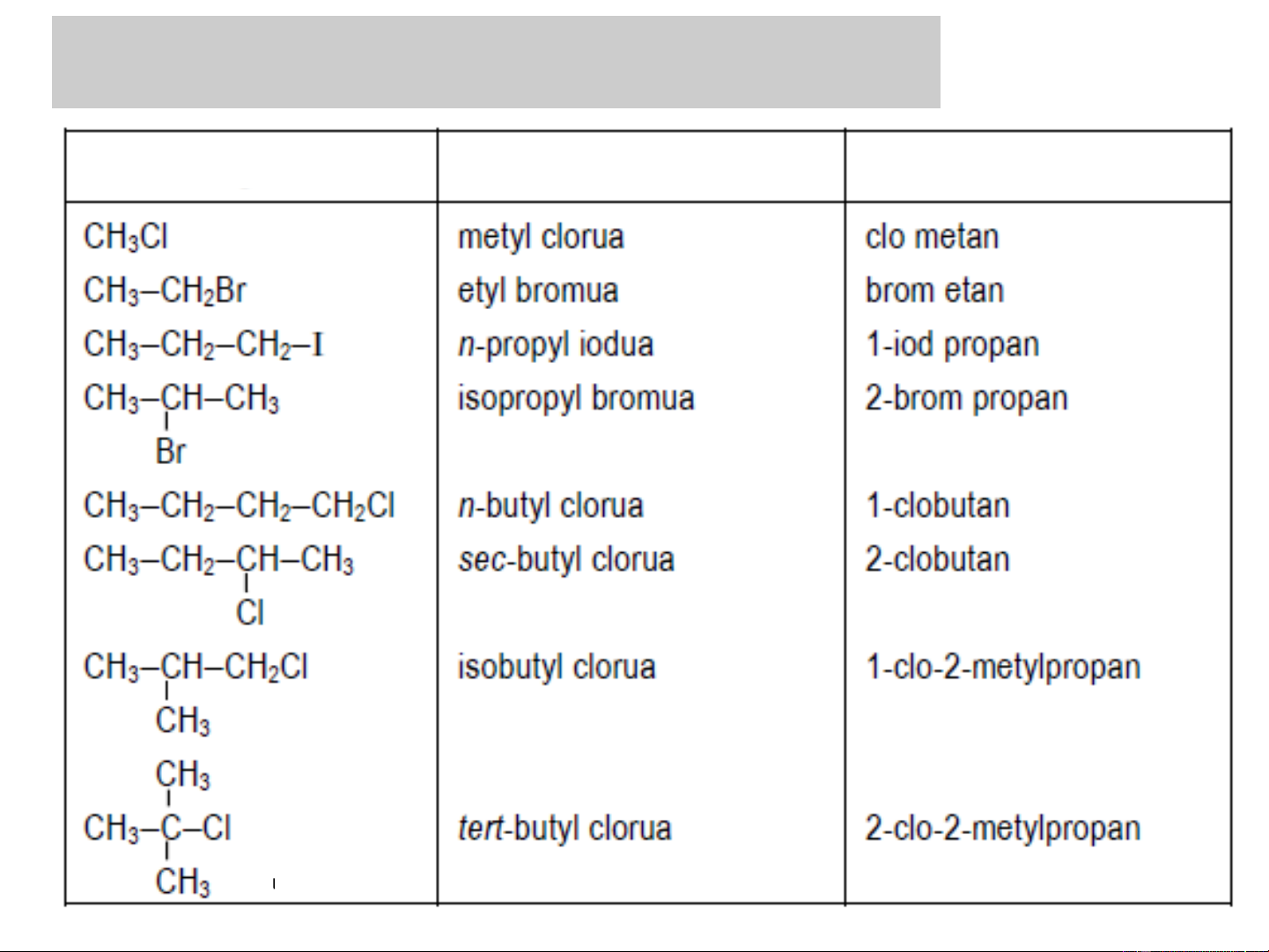
❖ Tên thông thường: tên của gốc hydrocacbon (ankyl)
+ “halogenua” tương ứng CH Cl metylclorua 3 C H Br etylbromua 2 5
❖Tên theo IUPAC: Cách gọi tên theo danh pháp quốc tế
dựa trên nguyên tắc coi nguyên tử halogen là nhóm thể của hydrocacbon.
Vị trí+tên của halogen + tên hydrocarbon tương ứng
CH −CH−CH 3 3 CH − 3 CH2Br brometan Br 2-brompropran
2. DANH PHÁP - ĐỒNG PHÂN Công thức Tên thông thường Tên IUPAC
2. DANH PHÁP - ĐỒNG PHÂN ❖Đồng phân
+ Đồng phân cấu tạo: đồng phân mạch, vị trí
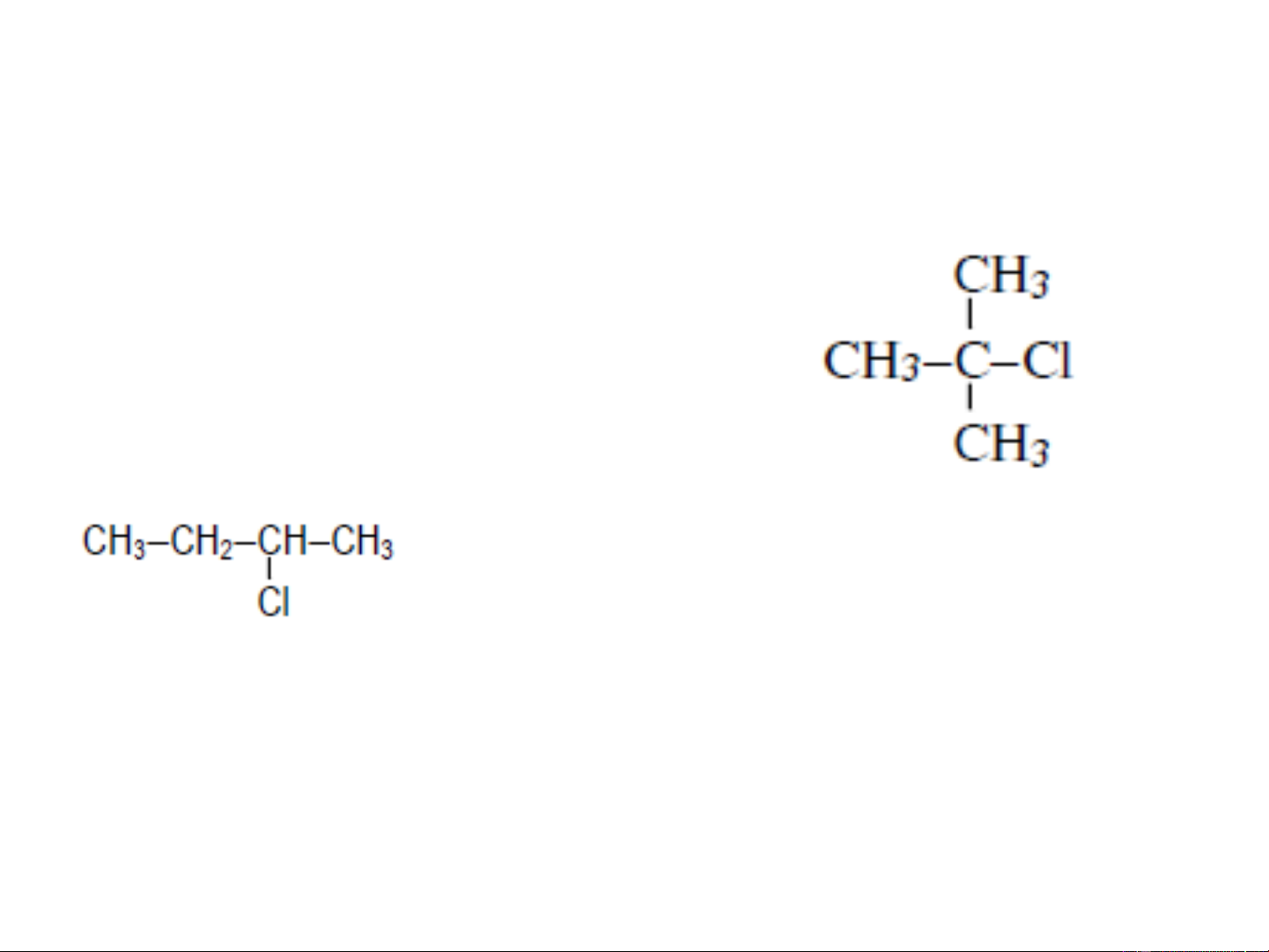
halogen, kiểu liên kết,... CH −CH −CH −CH −Cl 3 2 2 2 n-butyl clorua (1-clo butan) CH −CH −CHCl−CH 3 2 3 2-clo butan
+ Đồng phân lập thể: có đồng phân hình học cis-,
trans- (với hợp chất vòng) hoặc đồng phân quang
học khi có C bất đối (C >3)
3. ĐIỀU CHẾ DẪN XUẤT HALOGEN
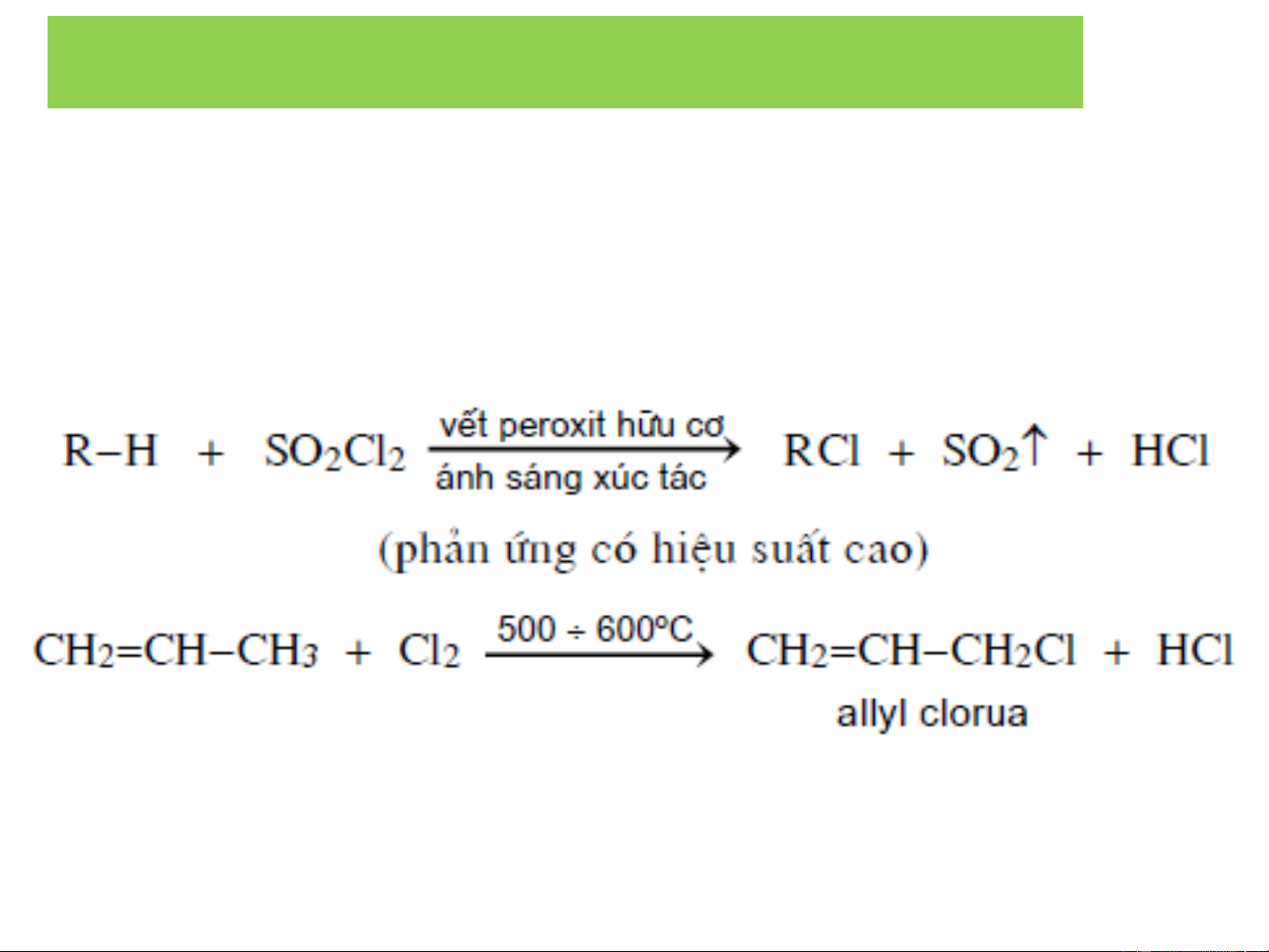
❖ Điều chế từ hydrocacbon:
- Phản ứng thế a/s X : Cl , Br 2 2 2 RH + X → RX + HX 2
3. ĐIỀU CHẾ DẪN XUẤT HALOGEN
❖ Điều chế từ hydrocacbon:
- Cộng hợp X , HX vào anken 2 R−CH=CH + HX ⎯→ R−CHX−CH 2 3 R-CH=CH + X → R-CHX-CH X 2 2 2 X : Cl , Br 2 2 2
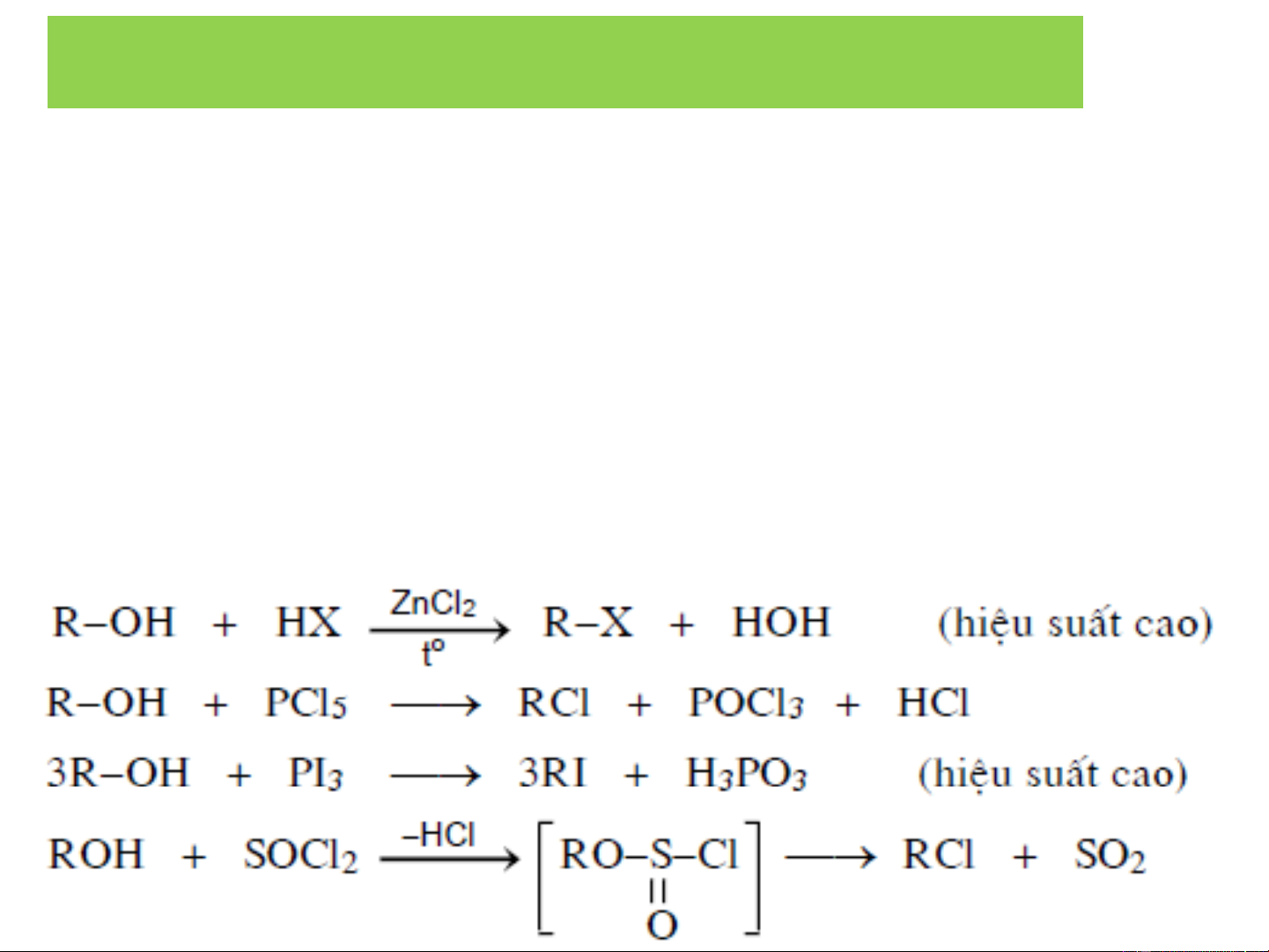
❖Tổng hợp từ ancol
3. ĐIỀU CHẾ DẪN XUẤT HALOGEN
❖ Dẫn xuất florua, iodua RI + AgF ⎯→ RF + AgI R−Cl + NaI ⎯→ RI + NaCl ete khan I2
R−Br + Mg ⎯→ R−Mg−Br ⎯→ RI + I−Mg−Br
❖ Qua hợp chất diazo BF − 4 Ar−F + N2 CuCl Ar−Br + N2 Ar N N X CuBr Ar−Cl + N2 KI Ar−I + N2 NỘI DUNG CẦN NHỚ
VỀ DẪN XUẤT HALOGEN CỦA HYDROCACBON (1)
1. Khái niệm, phân loại 2. Danh pháp, đồng phân
- Tên thông thường, tên IUPAC
- Đồng phân cấu tạo, đồng phân lập thể
3. Phương pháp Điều chế
- thế halogen vào ankan,aren, ancol - cộng vào anken,
- Qua hợp chất diazo
DẪN XUẤT HALOGEN CỦA HYDROCACBON (2)
DẪN XUẤT MONO HALOGEN CỦA ANKAN
1. Tính chất vật lý
2. Tính chất hóa học
1. TÍNH CHẤT VẬY LÝ
❖ Các dẫn xuất halogen thường là những hợp chất không
màu (trừ một số dẫn xuất iod)
❖ Một số hợp chất đầu dãy đồng đẳng như metylclorua, metylbromua, etylclorua là
những chất khí. Metyliodua,
etylbromua và các ankyl halogenua cao hơn là chất lỏng ❖ Nhiệt độ sôi
- Nhiệt độ sôi của dẫn xuất halogen chịu ảnh hưởng của cấu
tạo gốc hydrocacbon và bản chất nguyên tử halogen.
Nhiệt độ sôi của dẫn xuất halogen có cùng gốc hydrocacbon
giảm dần từ dẫn xuất iodua đến florua
R−I > R−Br > R−Cl > R−F
t : dẫn xuất bậc 1 > dẫn xuất bậc 2 > dẫn xuất bậc 3 sôi
❖ Các hợp chất ankylhalogenua có mùi đặc trưng, không tan
trong nước, tan trong dung môi hữu cơ, và bản thân chúng là
dung môi hoà tan tốt các chất hữu cơ.
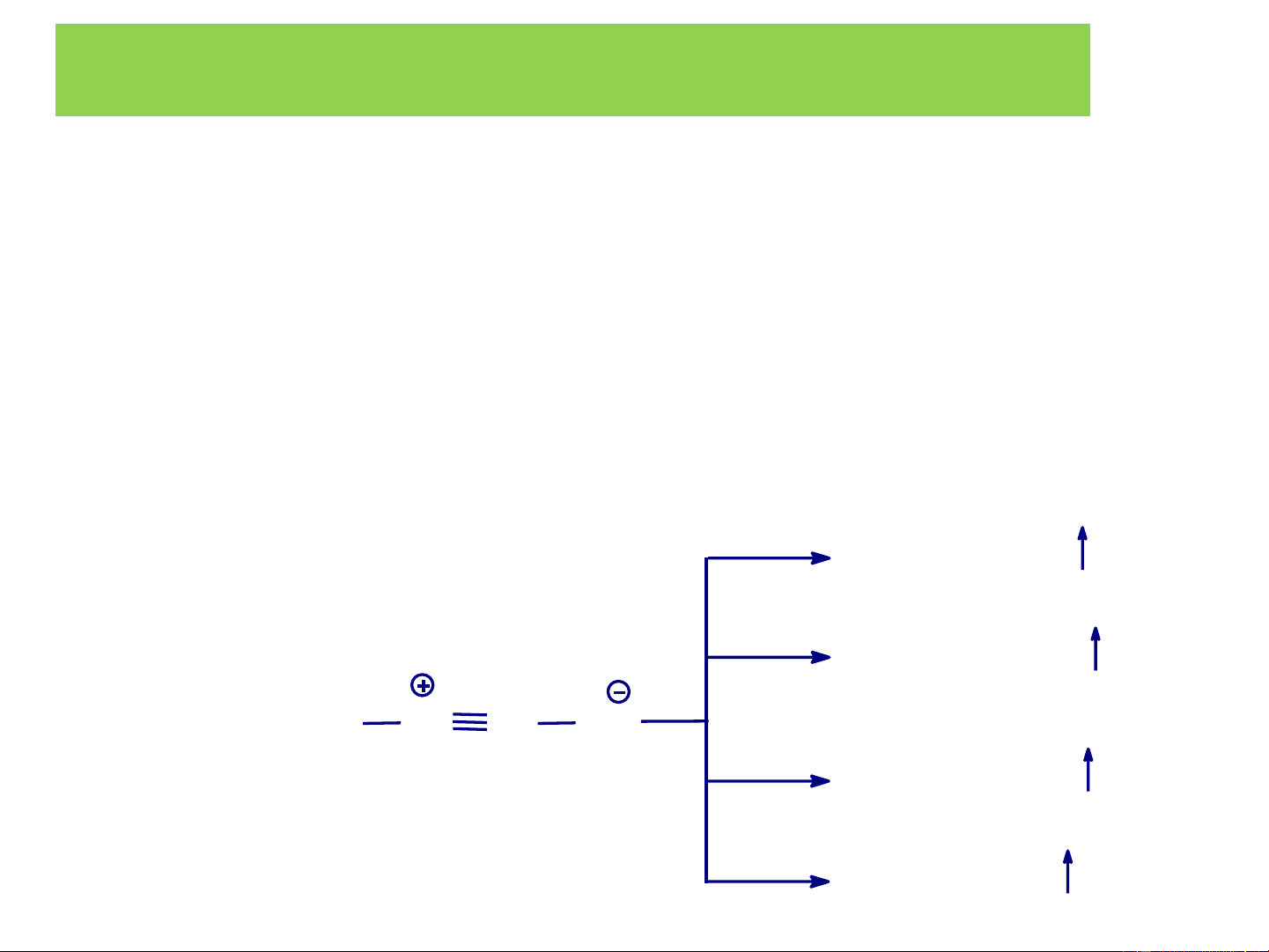
2. TÍNH CHẤT HÓA HỌC Nhận xét chung: δ+ δ- R-X
− C→C→X
Do nguyên tử halogen có độ âm điện δ+
lớn làm liên kết C−X phân cực mạnh H
về phía X nhất là khi gốc R thể hiện
hiệu ứng +I càng mạnh và halogen X
có hiệu ứng -I càng mạnh d
Khả năng phản ứng của R-X liên quan đến việc
đứt liên kết C – X (tách thành X- và R+ ) nên dễ
phản ứng thế Nucleophil - S . N
Ngoài ra, do hiệu ứng -I của nhóm X làm liên kết
C-H cũng bị phân cực nên liên kết C-H cũng có
khả năng tách H+ khi có mặt bazơ Z- tấn công.
Do đó hướng phản ứng chính: + Phản ứng thế SN
+ Phản ứng tách loại HX
+ Phản ứng với kim loại
Các dẫn xuất halogen được xếp vào loại hợp chất hữu cơ
có khả năng phản ứng cao. Chúng có thể tham gia nhiều
loại phản ứng và do đó có vai trò quan trọng trong lĩnh
vực tổng hợp các chất hữu cơ (thường là các sản phẩm trung gian).
2.1. Phản ứng thế SN
Là phản ứng thay thế anion X− bằng những tác
nhân nucleophyl khác. Tác nhân này có thể là anion
(OH-, CN-, RO- …) hoặc các phân tử trung hòa, có
cặp electron chưa chia ( :NH , R N: , …) 3 3
❖Sơ đồ tổng quát phản ứng thế nucleophyl RX + Y- RY + X- R- X + HY: RY + HX
Phản ứng thế nucleophyl thường tiến hành trong pha lỏng
(dung dịch ) vì về mặt nhiệt động khó tiến hành trong pha
khí do năng lượng để phân ly dị ly RX là lớn VD : CH Cl CH + + Cl- ∆H=227(k cal/mol) 3 khí 3
Phản ứng thế S có hai loại S 1 S 2 N N và N
2.1. Phản ứng thế SN
Phản ứng thế S điển hình: N + Phản ứng thủy phân
RX + HOH ⎯→ ROH + HX
RX + KOH ⎯→ ROH + KX
+ Phản ứng với ancolat R’ONa tạo ete (tổng hợp Willamsion)
RX + R’O−Na+ ⎯→ ROR’ + Na+X− (hiệu suất cao)
RX + ArO−Na+ ⎯→ ROAr + Na+X− (hiệu suất cao)
+ Phản ứng với natri axetylenua tạo ankyl cao hơn:
RX + HCC−Na+ ⎯→ R−CCH + Na+X− (hiệu suất cao)
RX + C H −CC−Na+ ⎯→ R−CC−C H + Na+X− 2 5 2 5
2.1. Phản ứng thế SN
Phản ứng thế S điển hình: N
+ Phản ứng với NaCN tạo dẫn xuất nitryl:
RX + Na+ + CN− ⎯→ R−CN + Na+X− (hiệu suất cao)
+ Phản ứng với muối của axit cacboxylic tạo este:
RX + R’COO−Na+ ⎯→ R'COOR + Na+X− (hiệu suất cao)
+ Phản ứng với amoniac NH tạo amin: 3 + NH + RX + RX + RX + R−X 3 R−NH2 R2NH R (−NH 3N R4NX− 4X) (−HX) (−HX) Ankylhalogenua Amin bËc 1 Amin bËc 2 Amin bËc 3 Muèi amoni bËc 4 + NH + RX + RX + RX + R−X 3 R−NH2 R2NH R (−NH 3N R4NX− 4X) (−HX) (−HX) Ankylhalogenua Amin bËc 1 Amin bËc 2 Amin bËc 3 Muèi amoni bËc 4
2.1. Phản ứng thế SN
Phản ứng thế S điển hình: N
+ Phản ứng với các tác nhân nucleophil: −CH(COOC H ) 2 5 2
trong phản ứng tổng hợp từ este dietyl malonat:
RX + [CH(COOC H ) ]−Na+ ⎯→ 2 5 2 ⎯→ R−CH(COOC H ) + NaX 2 5 2
+ Phản ứng với tác nhân nucleophil [CH COCHCOOC H ] 3 2 5
trong phản ứng tổng hợp từ este axetoaxetat etyl:
RX + [CH COCHCOOC H ]−Na+ ⎯→ 3 2 5
⎯→ CH CO−CH−COOC H + NaX 3 2 5 R