Preview text:
ĐỀ CƯƠNG DƯỢC LIỆU 2
2. Khái niệm, danh pháp, tính chất lý hóa chung của alkaloid. Phương trình phản ứng
củaalkaloid với TT Mayer, Bouchardat và Dragendorff 2.1. Khái niệm
Alkali (kiềm) + -oid (giống nhau) = nhóm chất có tính kiềm
Hợp chất hữu cơ chứa nhóm N Đa số có dị vòng Phản ứng kiềm
Thường gặp ở thực vật, đôi khi ở động vật
Dược lực tính rất mạnh 2.2. Danh pháp
Tên chi/loài + ine: papaverine, cocaine
Tên người tìm ra + ine: pelletierine, nicotine
Tác dụng sinh lý: morphine, emetine
Đặc tính vật lý: hygrine Tiền tố: - Nor: mất nhóm methyl
- Apo: loại 1 phân tử nước
- Iso-/pseudo-/neo-/epi-: các loại isomer của chất gốc - Enantiomer/ Diastereomer 2.3. Tính chất lý hóa
Thể chất: thường ở dạng rắn, ít khi ở dạng lỏng
Mùi vị: đa số không có mùi và có vị đắng; một số vị cay
Màu sắc: đa số không màu, một số ít có màu vàng Có hỗn hợp racemic
Độ tan: nói chung alkaloid base khó tan trong nước, dễ tan trong DMHC; alkaloid dạng
muối dễ tan trong nước, khó trong DMHC. Ngoại lệ: alkaloid base tan trong nước: cafeine,
nicotine; alkaloid dạng muối khó tan trong nước: quinine sulfate
Tính kiềm: làm xanh giấy quỳ, giải phóng dạng base bằng cách kiềm hóa, kết hợp với
kim loại nặng tạo muối phức
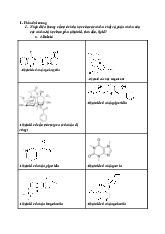
2.4. Phương trình phản ứng
Thuốc thử Mayer: Dung dịch KI/ HgCl2/ nước/ H+
Thuốc thử Bouchardat: dung dịch KI/I2
Thuốc thử Dragendorff: Dung dịch KI/ Bi(NO3)3/ nước/ acetic acid
3. Trình bày quy trình chiết xuất alkaloid bằng DMHC trong môi trường kiềm, chiết bằng
ddacid loãng trong cồn hoặc nước, và chiết bằng cồn. Giải thích ý nghĩa các bước 3.1. Môi trường kiềm
Tẩm bột dược liệu với dung dịch kiềm → giải phóng alkaloid tự do dạng base
Chiết bột dược liệu bằng DMHC thích hợp Cất thu hồi dung môi
Lắc dịch chiết với acid loãng →chuyển dạng alkaloid dạng muối
Gộp dịch chiết và kiềm hóa →alkaloid dạng base Lắc với DMHC
Làm khan và cất thu hồi dung môi → thu được alkaloid dạng base
3.2. Chiết bằng dd acid loãng trong cồn hoặc nước
Thấm ẩm bột dược liệu bằng dd acid loãng
Chiết bột dược liệu bằng dd acid loãng → chiết ra alkaloid dạng muối
Cất thu hồi dung môi (cồn), dùng ether để rửa tạp
Loại phần ether → kiềm hóa dd →alkaloid dạng base
Chiết bằng DMHC → cất thu hồi dung môi → alkaloid dạng base 3.3. Chiết bằng cồn
Alkaloid dạng muối tan tốt trong cồn
Quá trình chiết acid – base như các phương pháp khác
Nhược điểm: chiết bằng cồn ra nhiều tạp hơn
4. Phương pháp tinh chế alkaloid: phương pháp trao đổi ion, sắc ký cột, sắc ký lớp chế hóa.
4.1. Phương pháp trao đổi ion
Dựa vào sự trao đổi thuận nghịch giữa các ion trong dung dịch muối alkaloid và các ion
đã bị hấp phụ trên chất mang (nhựa trao đôi ion)
Các nhựa trao đổi ion được dùng là cationit và anionit.
Nhựa trao đổi ion không tan trong nước và DMHC Sử dụng cationit:
- Cat-.H+ + [BH]+Cl- → Cat-.[BH]+ + H+ +Cl-
- Nhựa cationit hấp thụ alkaloid tạo muối alkaloid, bị đẩy ra khi có dung dịch kiềm:
Cat-.[BH]+ + [NH4]+OH- →Cat-.[NH4]+ + B +H2O
- Alkaloid base không tan trong nước bị giữ lại cột và chiết ra bằng DMHC hoặc hỗn hợp
dung môi thích hợp Sử dụng anionit:
- Ani+.OH- + [BH]+Cl- → Ani+.Cl- + B + H2O
- Khi cho dung dịch muối alkaloid qua cột anionit, alkaloid được giải phóng ở dạng base
sau đó được chiết bằng DMHC hoặc hỗn hợp dung môi thích hợp 4.2. Sắc ký cột
Các thành phần alkaloid có độ hấp phụ khác nhau trên các chất hấp phụ.
Chất hấp phụ: silicagel, bột cellulose,…
Khi cho dịch chiết qua cột, phần trên tập trung chất hấp phụ mạnh, phần dưới tập trung chất hấp phụ kém.
Cần có hệ dung môi thích hợp để rửa giải alkaloid chạy trong cột.
4.3. Sắc ký lớp chế hóa
Dựa theo nguyên tắc sắc ký lớp mỏng, chấm dịch chiết đậm đặc alkaloid lên tấm kính
được tráng chất hấp phụ theo 1 đường thẳng
Khai triển bằng 1 hệ dung môi thích hợp, chất khác nhau tách ở vị trí khác nhau
Xác định vị trí alkaloid bằng ánh sáng tử ngoại
Cạo phần chất hấp phụ chứa alkaloid, chiết bằng DMHC hoặc hỗn hợp dung môi.
5. Phương pháp định lượng alkaloid: phương pháp cân, trung hòa, định lượng trong MTK, so màu 5.1. Phương pháp cân
Chiết alkaloid (pp acid – base) → cân khối lượng
- Tạo tủa với các thuốc thử →cân khối lượng
- Phạm vi: alkaloid có tính kiềm yếu
- Hạn chế: độ chính xác kém, lẫn nhiều tạp
5.2. Phương pháp trung hòa Chiết alkaloid ở dạng base
Định lượng bằng các acid mạnh (HCl, H2SO4 loãng; chỉ thị methl đỏ)
Phạm vi: alkaloid có tính kiềm mạnh
Hạn chế: độ chính xác kém (lẫn amin, amonic) nhiều alkaloid base không tan tốt trong nước
Cách loại bỏ sai số: loại bỏ chất béo (lắc DMHC); loại bỏ ammoniac bằng cách làm bay
hơi; loại bỏ chất màu (dùng than hoạt, chất hấp phụ màu)
5.3. Định lượng trong MTK Chiết alkaloid ở dạng base
Hòa tan trong acid acetic khan
Dùng HClO4 0,1N trong acid acetic để định lượng
Chỉ thị là tím tinh thể/ đo thế 5.4. So màu
Tạo ra dung dịch có màu = pứ HH, tác dụng trực tiếp với TT tạo ra màu
Tạo tủa với TT → hòa tan trong DMHC Dẫn xuất hóa alkaloid
6. Định nghĩa, thành phần cấu tạo, tính chất lý hóa, các phương pháp chế tạo và ứng dụng
củatinh dầu 6.1. Định nghĩa
Hỗn hợp của nhiều thành phần
Thường có mùi thơm, bay hơi ở nhiệt độ thường
Không tan trong nước, tan trong DMHC
Có thể điều chế từ thảo mộc bằng PP cất kéo hơi nước
6.2. Thành phần cấu tạo
Terpen (mono-, sesqui-): limonene – cam chanh, camphor – long não
Nhân thơm: anethole – quế, vanillin – vanilla Hợp chất chứa N, S 6.3. Tính chất lý hóa
Thể chất: đa số lỏng, một số ở thể rắn (methol, camphor, vanillin)
Màu sắc: đa số không màu hoặc vàng nhạt, càng để lâu càng sẫm lại
Mùi: đa số thơm dễ chịu, một số thì hắc, khó chịu
Vị: cay, một số có vị ngọt (quế, hồi)
Tỷ trọng: đa số <1, một số >1 (quế, hương nhu, đinh hương) Độ
tan: tan tốt trong cồn, DMHC; ít tan trong nước
Năng suất quay cực: tả truyền hoặc hữu tuyền
Chỉ số khúc xạ: 1,455 – 1,456
Độ ổn định: dễ bị oxy hóa thành các alcol, acid, aldehyde, ketone, peroxide; dễ trùng hợp
tạo thành nhựa 6.4. Phương pháp chế tạo
Cất kéo hơi nước: hỗn hợp hai chất lỏng bay hơi không trộn lẫn vào nhau; hỗn hợp sôi,
hơi nước kéo theo hơi tinh dầu. Chiết dung môi:
- Cồn/ dầu hỏa/ xăng CN
- Tinh dầu đạt chất lượng cao
- Concrete oil – (sáp/ chất màu) = absolute oil Chiết bằng CO2 siêu tới hạn: - CO2 siêu tới hạn
- Nhiệt độ chiết thấp hơi cất kéo hơi nước → thành phần không bị biến đổi
- Chất lượng tinh dầu cao (có nhiều TPHH hơn PP cất kéo hơi nước) PP ép lạnh:
- Giữ được nguyên vện mùi của nguyên liệu
- Thường áp dụng cho các dược liệu họ cam
PP ướp: sử dụng mỡ lợn để chiết lấy tinh dầu. Sau đó tách tinh dầu bằng alcol hoặc từ
dịch chiết alcol có thể điều chế thành dạng “Absolute oil”.
6.5. Ứng dụng của tinh dầu
Kỹ nghệ thực phẩm, hương liệu, mỹ phẩm
Làm thuốc: dựa vào tác dụng kích thích tiêu hóa, kháng khuẩn, kích thích thần kinh
YHCT: thuốc giải biểu, chữa cảm mạo/ thuốc ôn lý trừ hàn/ hành khí, huyết Cẩn
trọng khi sử dụng tinh dầu 7.
Trình bày phương pháp kiểm nghiệm tinh dầu và phát hiện tạp chất và chất giả mạo trongtinh dầu
7.1. Phương pháp kiểm nghiệm Sắc ký lớp mỏng:
Sắc ký khí – phổ khối:
- Phân tách bằng GC cho các peak, mỗi peak tương ứng với 1 chất
- Mỗi chất đều có phổ khối riêng
- Các phổ khối này sẽ được so sánh với thư viện phổ khối để định danh các chất
7.2. Phát hiện tạp chất và giả mạo Phát hiện tạp chất:
- Nước: CaCl2 khan → chảy, Cu2SO4 khan → màu xanh
- Ion kim loại nặng: lắc tinh dầu với nước + sục khí H2S → tủa đen Phát hiện chất giả mạo:
- Ethanol, glycerin: lắc với nước, quan sát sự thay đổi thể tích
- Ethanol: tạo iodoform (CHI3, mùi đặc trưng), nhỏ nước vào tinh dầu + lắc đều →đục
- Glycerin: bốc hơi tinh dầu đến cắn, thêm K2So4, đun có mùi của acrolein
- Dầu béo: nhỏ 1 giọt tinh dầu lên giấy mỏng, hơi khô → bóng mờ
- Tinh dầu khác: TLC hoặc GC - Sử dụng HPTLC và GC 8.
Trình bày định nghĩa, phân loại, thành phần cấu tạo, tính chất lý hóa, các phương
pháp chếtạo, công dụng của lipid 8.1. Định nghĩa:
Có TPCT thường ester của acid béo với các alcol
Không tan trong nước, tan trong dung môi hữu cơ
Không bay hơi, có độ nhớt cao 8.2. Phân loại theo alcol:
Glycerid: alcol là các glycerol
Cerid: alcol phân tử lượng cao Sterid: alcol là các sterol
Cyanolipid và sphingolipid: alcol chứa nhóm CN
8.3. Thành phần cấu tạo: glyceridLà ester của glycerol và acid béo
- Dầu: lỏng, chứa nhiều glycerid có acid béo chưa no
- Mỡ: rắn, đặc, chứa nhiều glycerid có acid béo no
- Trong dầu mỡ thường có vitamin, tinh dầu, chất màu, sterol
- Dầu mỡ thường kết hợp với albumin tạo nên nhu dịch lỏng; ở trong tế bào: dạng lỏng,
bị ép ra ngoài: dạng lỏng (dầu thầu dầu) hoặc rắn (bơ ca cao) Acid béo:
- Acid béo no: CH3(CH2)nCOOH; đa số có số C chẵn, hiếm khi lẻ (4 - 26 C)
- Acid béo chưa no: acid béo có liên kết đôi (CH=CH)
- Acid béo alcol: có nhóm OH
- Acid béo vòng 5 cạnh: có vòng cyclopenten
8.4. Tính chất vật lý Nhiệt độ nóng chảy:
- Acid béo no > acid béo chưa no
- Số liên kết đôi tăng thì nhiệt độ nc giảm - trans > cis
Trạng thái: ở 15 oC dầu (lỏng)/ mỡ (đặc)
Độ tan: không tan trong nước, ít tan trong cồn, tan trong dung môi hữu cơ Tỷ
trọng: nhẹ hơn nước (d<1)
Năng suất quay cực: thấp, trừ dầu có acid béo chứa oxy, acid béo vòng
Phân hủy ở nhiệt độ cao: glycerol thành acrolein (CH2=CH-CHO) có mùi khét
Phản ứng thủy phân: triglycerid tạo glycerol và acid béo
Phản ứng xà phòng hóa: triglycerid trong kiềm
Phản ứng hydrogen hóa: tạo thành mỡ Phản ứng halogen hóa
8.5. Phương pháp chế tạo
Chế tạo dầu mỡ thực vật → Phương pháp ép:
- Ép nóng hoặc ép nguội
- Lọc loại bã, ly tâm loại nước
- Dầu dùng trong ngành Dược: trung hòa acid béo tự do
• Phương pháp dùng dung môi
- Dung môi hữu cơ ít phân cực: benzen, ether dầu hỏa, henxan,..
- Sau khi chiết xong phải loại bỏ dung môi và tinh chế loại bỏ các tạp chất khác Chế tạo dầu mỡ động vật
• Phương pháp làm nóng chảy ướt
- Hơi nước/ hơi nóng đun với nguyên liệu
- Để lắng, chiết lớp mỡ ở trên
• Phương pháp làm nóng chảy khô
- Dùng ống dẫn hơi nước nóng vào các thùng đựng nguyên liệu
- Điều chế dầu mỡ ở nhiệt độ thấp 8.6. Công dụng
Bơ ca cao: tá dược thuốc đạn Lanolin:
- Tá dược thuốc mỡ, dễ hấp thụ qua da
- Chất nhũ hóa trong nhũ tương nước – dầu
- Pha chế thuốc mỡ có các hoạt chất tan trong nước 9.
Trình bày các phương pháp kiểm nghiệm lipid. Trình bày ý nghĩa của các chỉ số hóa
họctrong kiểm nghiệm lipid (chỉ số acid, ester, xà phòng, acetyl, iod)
9.1. Phương pháp kiểm nghiệm
Phương pháp cảm quang: quan sát màu sắc, thể chất, mùi vi,…
Xác định hằng số vật lý: độ tan, độ nhớt, độ sôi, tỷ trọng, năng suất quay cực,…
Xác định chỉ số hóa học: acid, este, xà phòng, acetyl, iod
Định tính các thành phần trong dầu mỡ: có thể dùng các phương pháp sắc ký để phân tích
thành phần cấu tạo của dầu mỡ như sắc ký lớp mỏng, sắc ký khí, sắc ký lỏng hiệu năng cao
Tìm các chất giả mạo: phân biệt dầu cá với dầu parafin. 9.2. Chỉ số
Chỉ số acid: số mg KOH cần thiết để trung hòa các acid tự do có trong 1 g dầu/ mỡ
Chỉ số ester: số mg KOH cần thiết để xà phòng hóa ester có trong 1 g dầu/ mỡ
Chỉ số xà phòng hóa: số mg KOH cần thiết để trung hòa các acid tự do và xà phòng hóa
ester có trong 1 g dầu/ mỡ Chỉ số acetyl:
- Số mg KOH cần thiết để trung hòa acid acetic được giải phóng sau khi thủy phân 1 g chế phẩm đã acetyl hóa
- Xác định các acid béo có nhóm -OH alcol Chỉ số iod:
- Số g halogen, tính theo iod, kết hợp với 100 g dầu mỡ
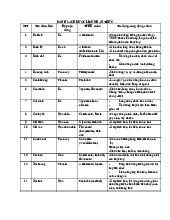
- Cho thông tin về liên kết đôi trong acid béo II. PHÂN DƯỢC LIỆU Tên khoa học: Họ: Bộ phận dùng: Đặc điểm: Thành phần hóa học: Tác dụng – công dụng: 1. Alkaloid Ma hoàng:
Tên khoa học: Ephedra spp. Họ: Ma hoàng - Ephedraceae
Bộ phận dùng: phần trên mặt đất Đặc điểm:
Thành phần hóa học: alkaloid (ephedrine, norephedrine, pseudoephedrine) Tác dụng – công dụng:
- giãn phế quản, giảm nhu động ruột và dạ dày, làm tim đập nhanh, co mạch ngoại vi,
tăng huyết áp; tác dụng hưng phấn vỏ não; tăng tiết mồ hôi rõ rệt
- chữa các bệnh sốt không ra mồ hôi, viêm phế quản, viêm phổi. hen suyễn, ho có đờm,
viêm thận, có tác dụng lợi tiểu Ích mẫu: Tên khoa học: Họ: Bộ phận dùng: Đặc điểm: Thành phần hóa học: Tác dụng – công dụng: Lựu: Tên khoa học: Họ: Bộ phận dùng: Đặc điểm: Thành phần hóa học: Tác dụng – công dụng: Cau:
Tên khoa học: Areca catechu Họ: Cau - Arecaceae Bộ
phận dùng: vỏ quả, hạt Đặc điểm:
Thành phần hóa học: alkaloid (arecolin), tanin Tác dụng – công dụng:
- Gây tăng tiết nước bọt, dịch tiêu hóa
- Liều nhỏ kích thích thần kinh, liều cao gây ngừng tim, liệt hô hấp
- Hạt cau chữa sán, chữa sốt rét
- Vỏ cau chữa thủy thững, bụng bang, tiểu tiện khô Cà độc dược:
Tên khoa học: Datura metel Họ: Cà – Solanaceae Bộ phận dùng: lá, hoa, hạt Đặc điểm:
Thành phần hóa học: alkaloid (scopolamine, hyoscyamine, atropine) Tác dụng – công dụng:
- Scopolamine: ức chế hệ cơ trơn và các tuyến tiết, làm giãn đồng tử; ức chế hệ TKTW
- Cà độc dược chữa ho, hen suyễn, giảm đau trong loét dạ dày, quặn ruột, chống say
sóng, buồn nôn khi đi tàu xe Bình vôi Tên khoa học: Họ: Bộ phận dùng: Đặc điểm: Thành phần hóa học: Tác dụng – công dụng: Hoàng liên:
Tên khoa học: Coptis sp. Họ: hoàng liên –
ranunsulaceae Bộ phận dùng: thân rễ Đặc điểm:
Thành phần hóa học: alkaloid (berberine) Tác dụng – công dụng:
- Chữa lỵ amip, lỵ trực khuẩn
- Chữa viêm dạ dày và ruột
- Chữa viêm tai giữa, đau mắt đỏ - Chiết xuất berberine - Vàng đắng