






Preview text:
HYDROCACBON THƠM (2)
(AROMATIC HYDROCARBONES)
1. Tính chất vật lý
2. Hóa tính benzen và đồng đẳng
1. TÍNH CHẤT VẬT LÝ
+ Hợp chất thơm có chứa vòng benzene:
- Hợp chất thơm dãy benzene: Benzen và các đồng đẳng có
mạch nhánh ngắn có dạng lỏng, rất ít tan hoặc không tan
trong nước, tan tốt trong các dung môi hữu cơ kém phân cực
- Hợp chất đa nhân thơm: thường ở dạng rắn
2. Hóa tính benzen và đồng đẳng
Theo cấu trúc hóa học của Benzen và các đồng
đẳng cho thấy các hướng phản ứng chính:
+ Benzen và các đồng đẳng có sự hình thành hệ thống
electron p là nguyên nhân làm cho có tính thơm đặc trưng
(dễ thế S , khó cộng, khó oxy hóa, phản ứng thế S có quy E E luật)
+ Ngoài ra còn có các phản ứng ở phần nhánh thế, phản ứng
cộng (phản ứng khử và cộng gốc tự do)
2. Hóa tính benzen và đồng đẳng
2.1. Phản ứng thế electrophil (S Ar) E
Đây là phản ứng đặc trưng quan trọng của vòng benzen. Nguyên
tử H trong benzen được thay thế bằng nguyên tử hoặc nhóm nguyên tử khác. X X+ hoÆc Xóc t¸c H+ hoÆc + + X Y H Y E - A H - A
Tác nhân electrophil là cation X+ hoặc phân tử phân cực X-Y, E-A Cơ chế phản ứng:
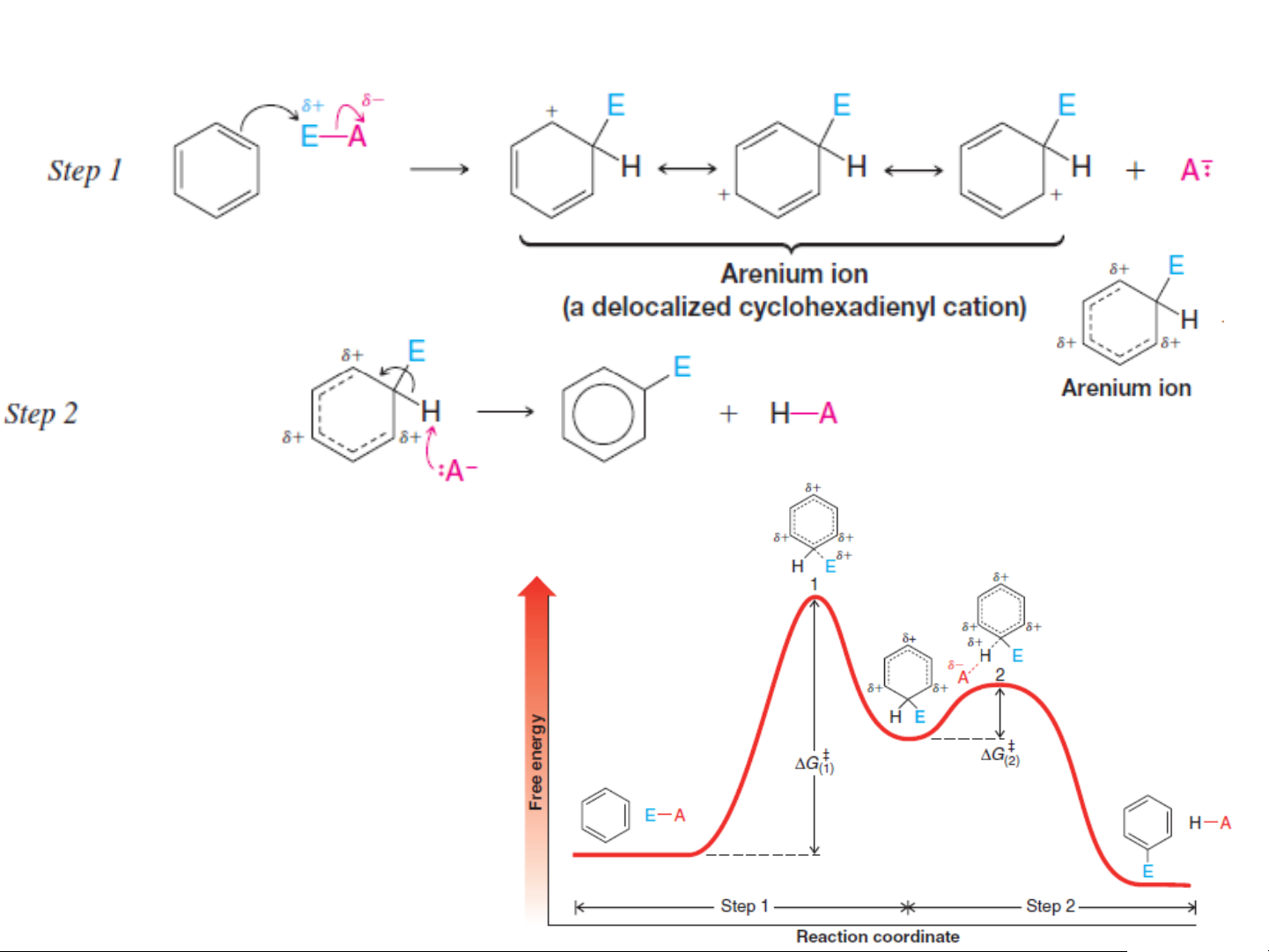
Phản ứng xảy ra theo các giai đoạn:
Giai đoạn đầu: Tác nhân electrophil tấn công vào hệ thống electron p của vòng thơm tạo
thành phức p1 (là trạng thái chuyển tiếp 1), tiếp đó phức p1 chuyển thành phức s.
Giai đoạn sau: Phức s là một cation không bền với 4 electron p giải toả trên 5 nguyên tử C,
nguyên tử C thứ sáu của vòng liên kết với X ở trạng thái lai hóa sp3. Phức s sẽ chuyển hóa theo 2 cách:
+ Cộng anion Y- để tạo thành sản phẩm cộng
+ chuyển sang phức phức p2 (là trạng thái chuyển tiếp 2) rất kém bền, tiếp đó phức p2 tách
proton H+ để tạo lại hệ thống electron p của vòng thơm và có sản phẩm thế ❖Cơ chế thế SE
Phản ứng sẽ ưu tiên theo hướng tách H+ để tạo thành sản phẩm thế
do thuận lợi hơn về mặt năng lượng. ❖Cơ chế thế SE Chậm nhanh Phức sigma
2. Hóa tính benzen và đồng đẳng
2.1. Phản ứng thế electrophil (S Ar) E
Các phản ứng thế S Ar phụ thuộc vào: E
+ Tính bazơ của vòng benzen (mật độ electron trong vòng);
+ Tính electrophil của tác nhân phản ứng;
+ Nói chung cần chất xúc tác (axit lewis) làm tăng quá trình
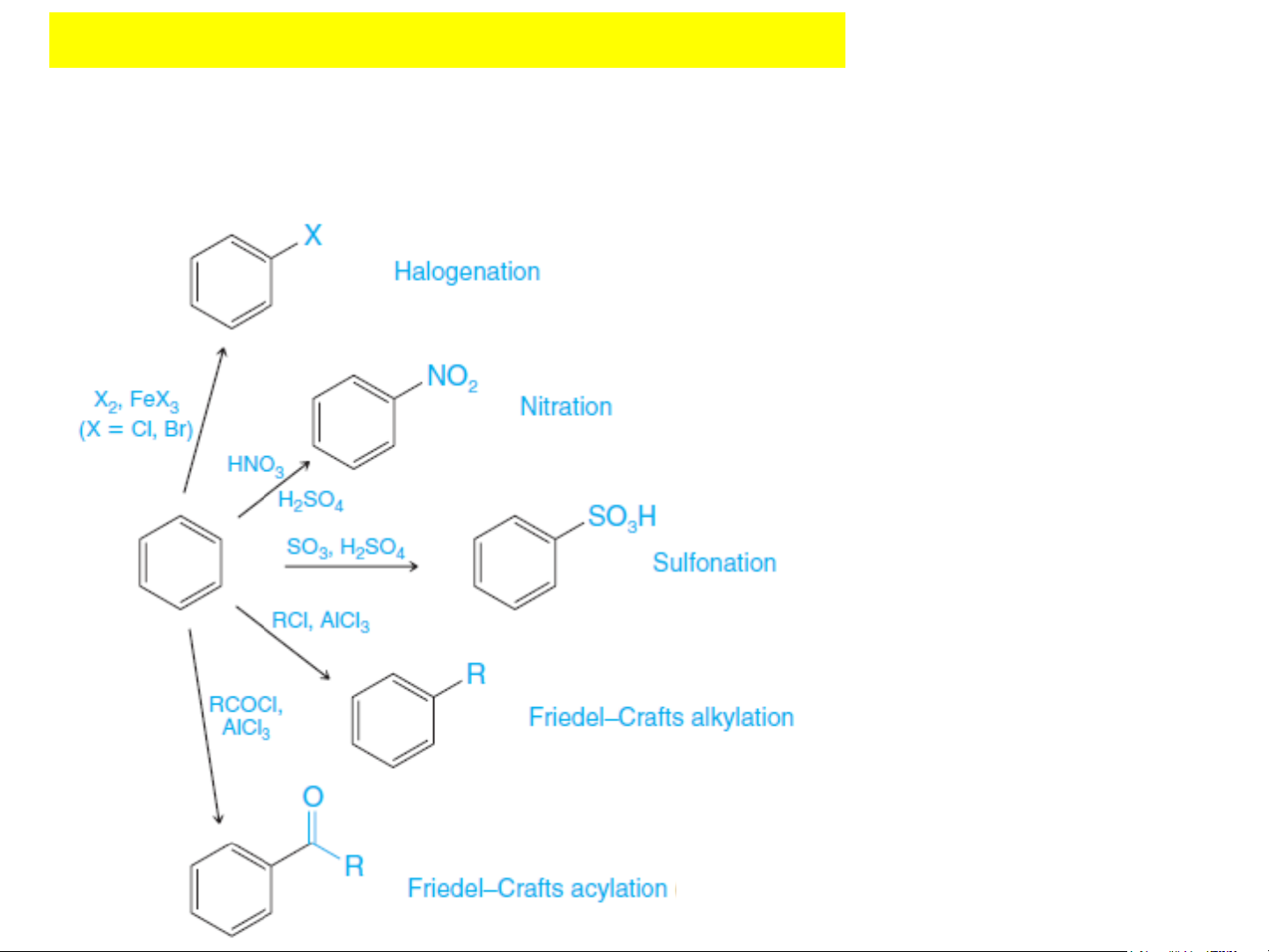
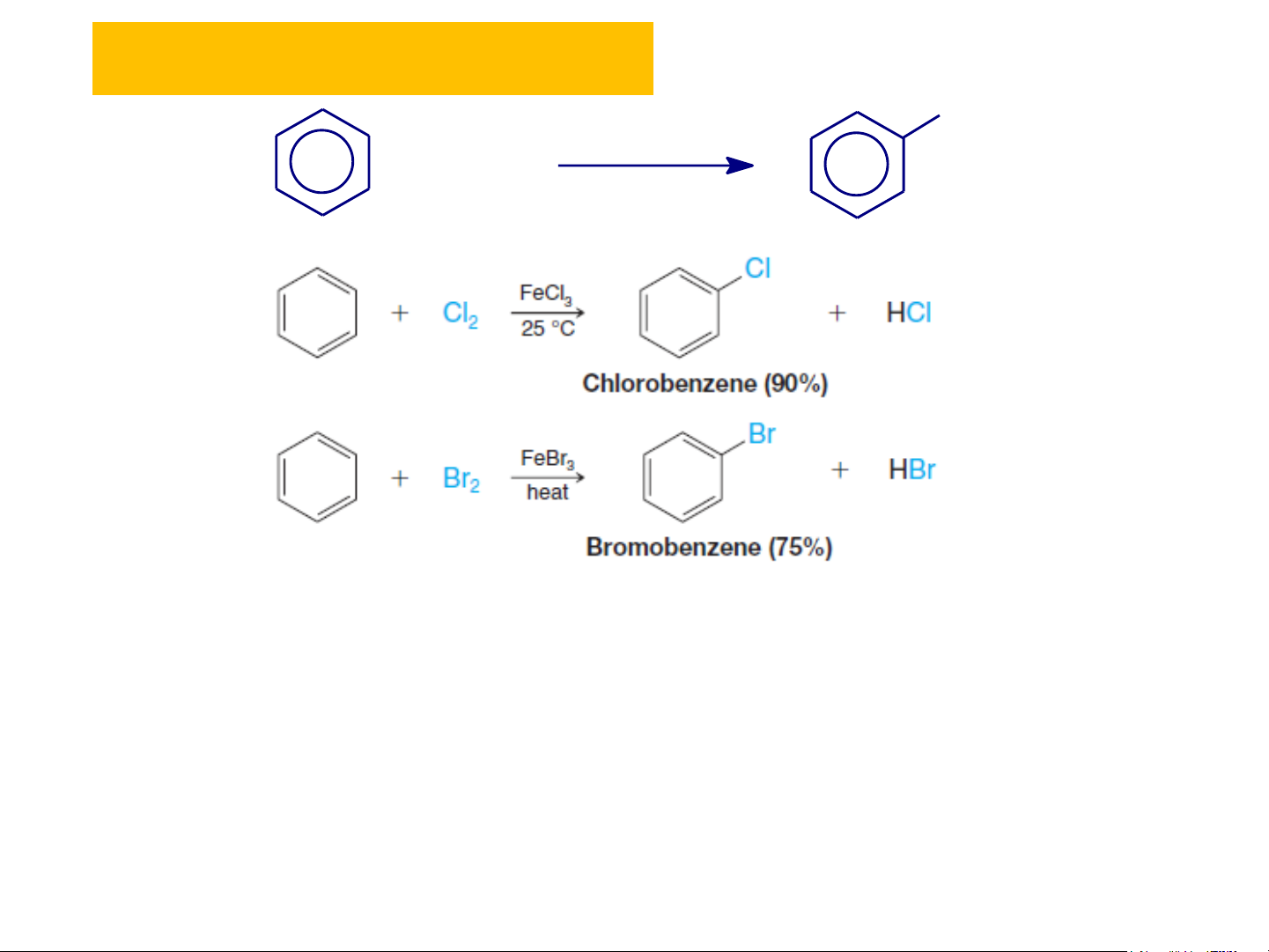
tạo tác nhân electrophil. Cl Cl + Cl + Cl2 2 + HCl + ( H a lo H g
Cl en hãa()Halogen hãa) AlCl AlCl3 3 Clobenzen Clobenzen 2. Hóa tính R + R benz X en R và đồng đẳng + RX
(Ankyl hãa theo Friedel-Craft) + HX + ( A n ky H l
X hãa theo Friedel-Craft) Al 2 X . AlX3
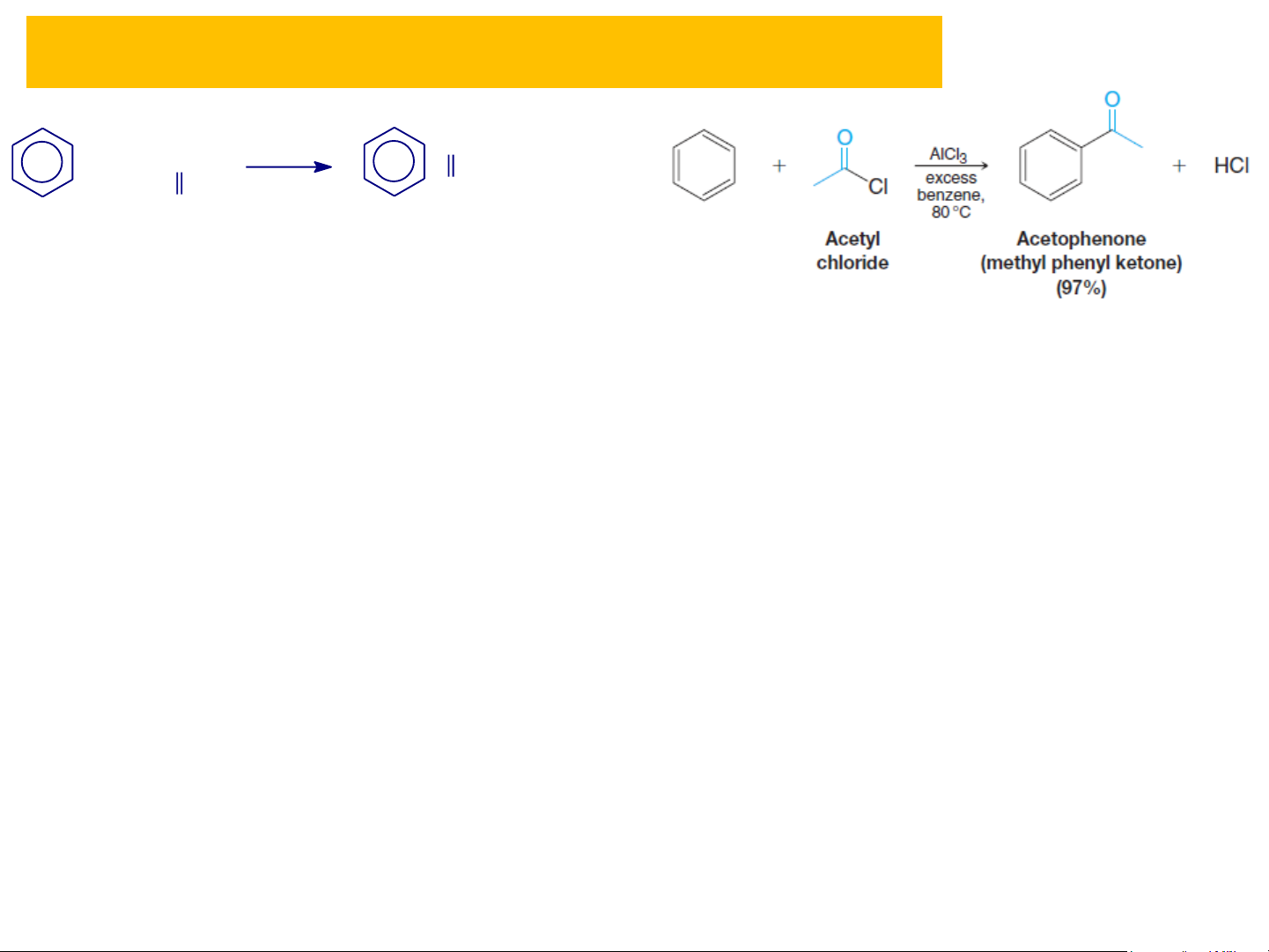
3 1. Phản ứng thế electrophil (S Ar) E Ankylbenzen Các ph Aản nkylứng benzecụ n thể: + RCOX + RCOX COR Cl COR hay (RCO) hay (RCO)2O + Cl 2O + HX
(Axyl hãa theo Friedel-Craft) 2
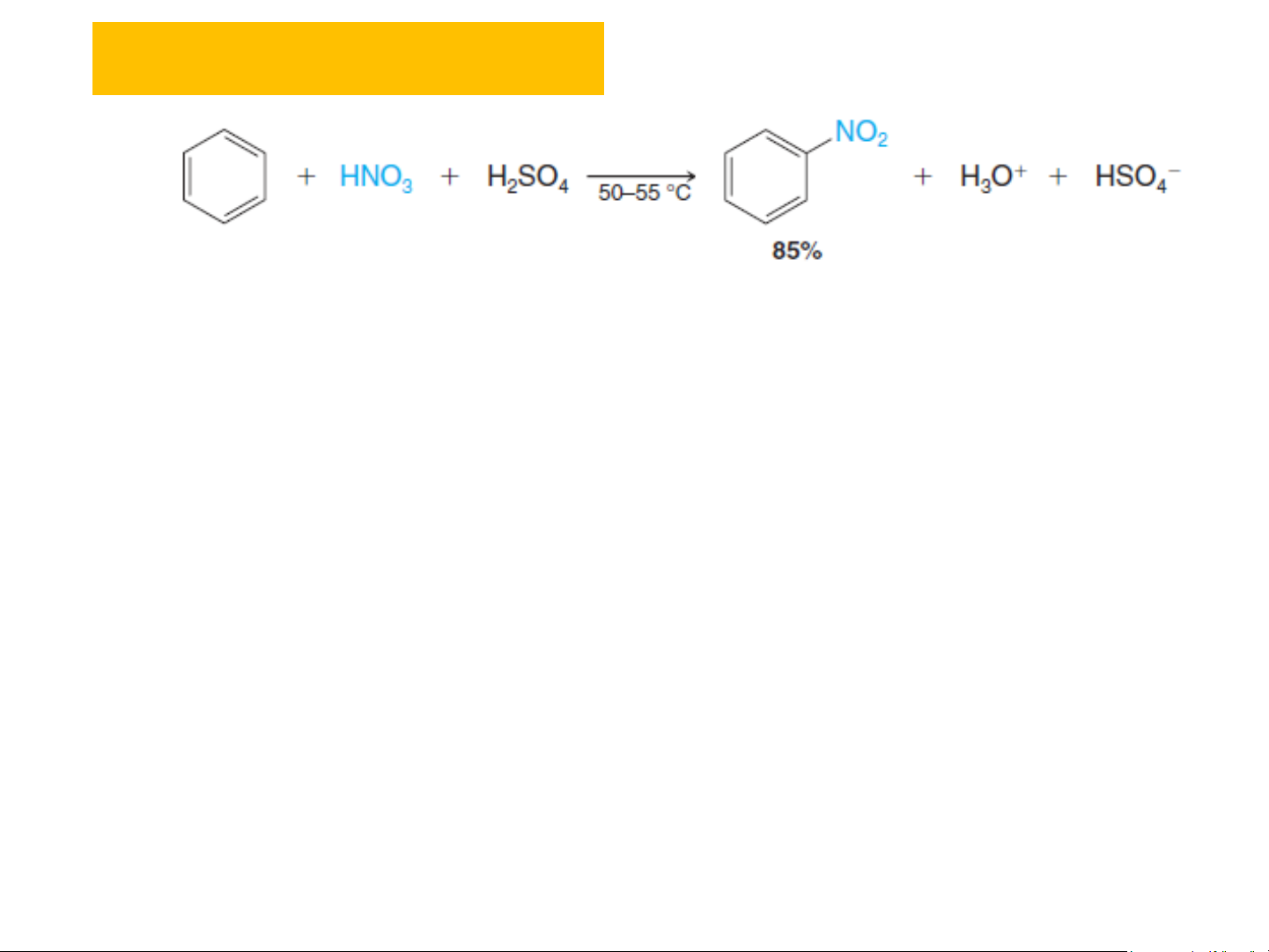
(Axyl hãa theo Friedel-Craft) AlX3 + H + C l HX (Halogen hãa) AlCl AlX3 3 Axylbenzen Benzen Benzen Axylbenzen Clobenzen NO NO2 2 + HNO + HNO3 3 R
(Nitro hãa) (Nitro hãa) + RX H H2SO4 2SO4 + HX
(Ankyl hãa theo Friedel-Craft) AlX3 Nitrobenzen Nitrobenzen Cl Cl + A Cl nkylbe 2 + n z Clen SO 2 SO 3H 3H + HSO + HCl + H ( C H l alogen hãa) 4 (Halogen hãa) + RCOX + HSO A 4 lCl3 Al C Cl O (Sunfo hãa) 3 R (Sunfo hãa) hay (RCO) h hay SO3 2O ay SO3 Clobenz + e n C l o H b X enzen
(Axyl hãa theo Friedel-Craft) AlX3 Axit benzen su A n xifto n b iec nzen sunfonic R R Benzen + A R x X ylbenzen + RX + HX (Ankyl h ( ã A a n t k h y e l o hã Fr a i e th d e el o - F Cr ri a e ft d ) el-Craft) NO + HX AlX 2 3 AlX + HNO 3 3 (Nitro hãa) H Ankylben A z n e k n ylbenzen 2SO4 + RCOX COR Nitrobe + nz R e C n OX COR hay (RCO h ) a 2 y O (RCO)2O SO + HX (Axyl hã ( a A t x h y e l o hã Fr a i e th d e el o - F Cr ri a e ft d ) el-Craft) 3H + HX + HSO AlX3 AlX 4 3 (Sunfo hãa) hay SO Benzen Be Axylbenzen 3 nzen Axylbenzen NO2 NO2 + H A Nxi O t ben 3 + ze H n N s O unfonic 3 (Nitro hã(N a) itro hãa) H2SO4 H2SO4 Nitroben N ze it n robenzen SO3H SO3H + HSO4 + HSO4 (Sunfo hã(S a u ) nfo hãa) hay SO3 hay SO3 Axit benz A e x n it s b u e n n f z o e ni n c sunfonic
❖Phản ứng halogen hóa X FeX + X 3 2 + HX hoÆc bét Fe Cơ chế phản ứng:
Dẫn xuất thế của flo, Iod thì phải đi
theo con đường qua muối diazoni.
❖ Phản ứng nitro hóa Nitrobenzen(e)
Tác nhân phản ứng: HNO3, hỗn hợp (HNO3 + H2SO4) đặc (95%), HNO3 + SO3,... Cơ chế phản ứng:
❖ Phản ứng sunfo hóa SO SO 3H 3H Hoặc to H2SO4 + H + SO 2SO4 + H2O 3 Benzen Axit sunfuric Axit benzen N-íc Benzen L-u huúnh Axit benzen sunfonic trioxit sunfonic
Cơ chế phản ứng: H - 2SO4 + H2SO4 SO3 + H2O+ + HSO4
❖ Phản ứng sunfo hóa
- Phản ứng sunfonic phải tiến hành rất cẩn thận vì làm
việc với axit đặc nóng, dễ nổ gây nguy hiểm
- Phản ứng sunfo hóa là phản ứng thuận nghịch. Do đó phản
ứng thuỷ phân axit benzensunfonic thực hiện dễ dàng với hơi nước quá nóng SO3H 180oC + H + H 2O 2SO4 Axit benzensunfonic Benzen
- Nhóm sunfo ở nhân thơm dễ trao đổi với các nhóm khác nên
các axit aren sunfonic thường là các chất trung gian trong Tổng hợp hữu cơ.
❖ Phản ứng ankyl hóa theo Friedel-Crafts R AlX + R - X 3 + H - X Benzen Ankylbenzen Cơ chế phản ứng: -
Trong phản ứng Friedel-Crafts thì tốc độ phản ứng sẽ tăng theo bậc của
gốc R trong ankyl halogenua R-X (bậc 1 < 2 < 3). -
Ankyl halogenua có cùng gốc R thì phản ứng sẽ tăng: Cl < Br < I do (I ). d -
Ngoài chất xúc tác là AlX còn có thể dùng BX . 3 3 -
Tác nhân ankyl hóa khác có thể dùng là ROH (xúc tác zeolit, AlX ) hoặc 3
R-CH=CH (xúc tác là Zeolit, ion H+) để sinh ra R+ 2
❖ Phản ứng axyl hóa theo Friedel-Crafts - C - R AlX3 + R - C - X + H - X O O Benzen Ankylarylxeton Cơ chế phản ứng:
2. Hóa tính benzen và đồng đẳng
2.2. Phản ứng cộng
Phản ứng cộng hợp vào vòng benzen khó xảy ra hơn so với các
hydrocacbon không no mạch hở
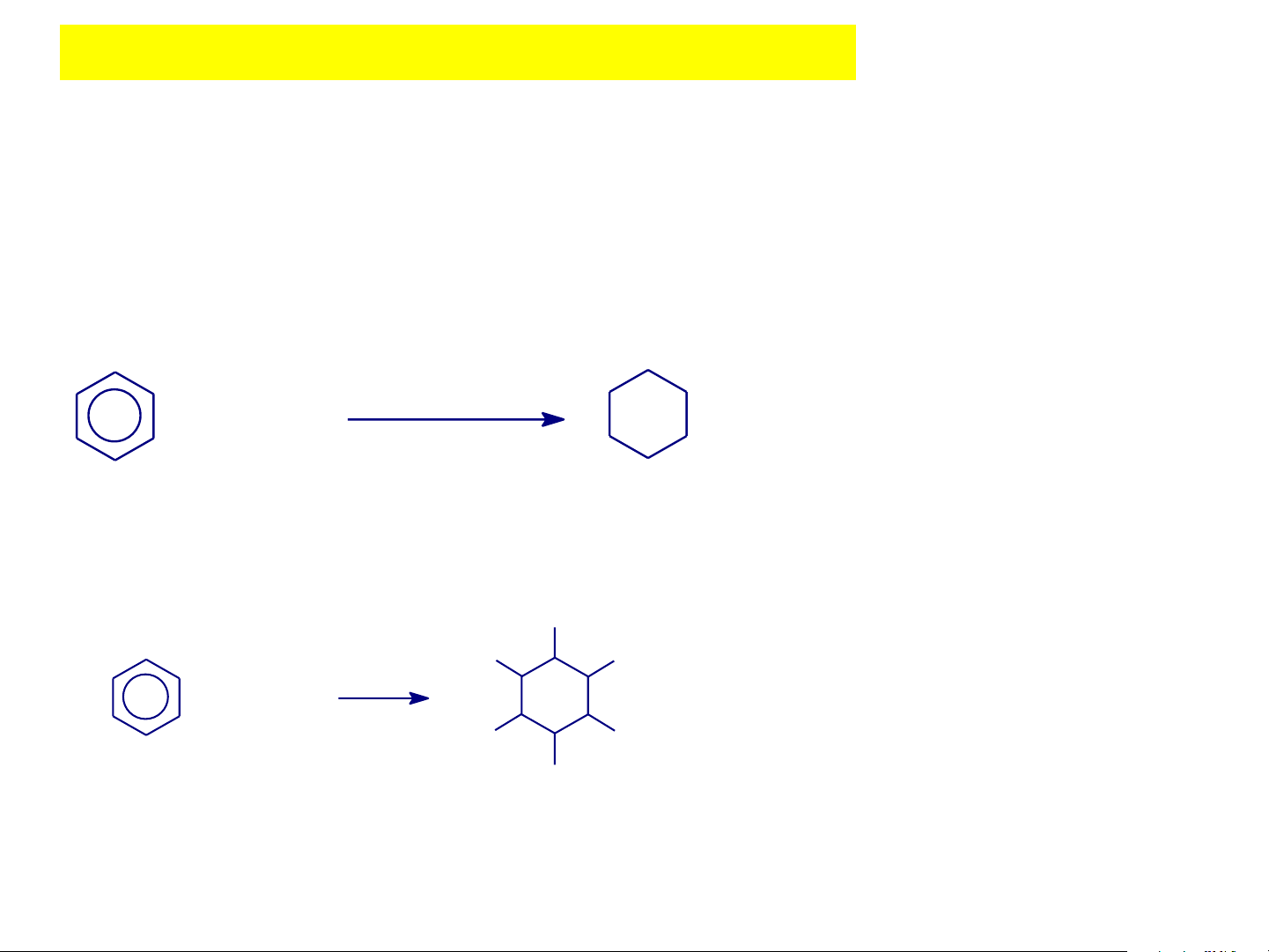
❖Cộng hợp hydro Ni, to Xyclohexan được dùng + H2 100oC,100 atm làm dung môi hoặc để điều chế axit picric Benzen Xyclohexan
❖Cộng hợp clo Cl Cl Cl h + 3Cl2 Cl Cl Cl Benzen Hexacloxyclohexan (Thuèc trõ s©u 6.6.6.)
Với các đồng đẳng của benzen, trong điều kiện cộng clo, xúc tác ánh sáng thì không xảy ra
phản ứng cộng mà xảy ra phản ứng thế gốc SRAr ở mạch nhánh
2. Hóa tính benzen và đồng đẳng
2.3. Phản ứng oxy hóa
Benzen và đồng đẳng rất bền với chất oxi hóa nên khó bị oxi
hóa ở điều kiện thường, chỉ bị oxi hóa ở nhiệt độ cao và có mặt chất xúc tác O
❖Oxi hóa benzen: V + 4O 2O5 2 O + 2CO2 + H2O 400-500oC O Benzen Anhydrit maleic
❖Oxi hóa các đồng đẳng của benzen
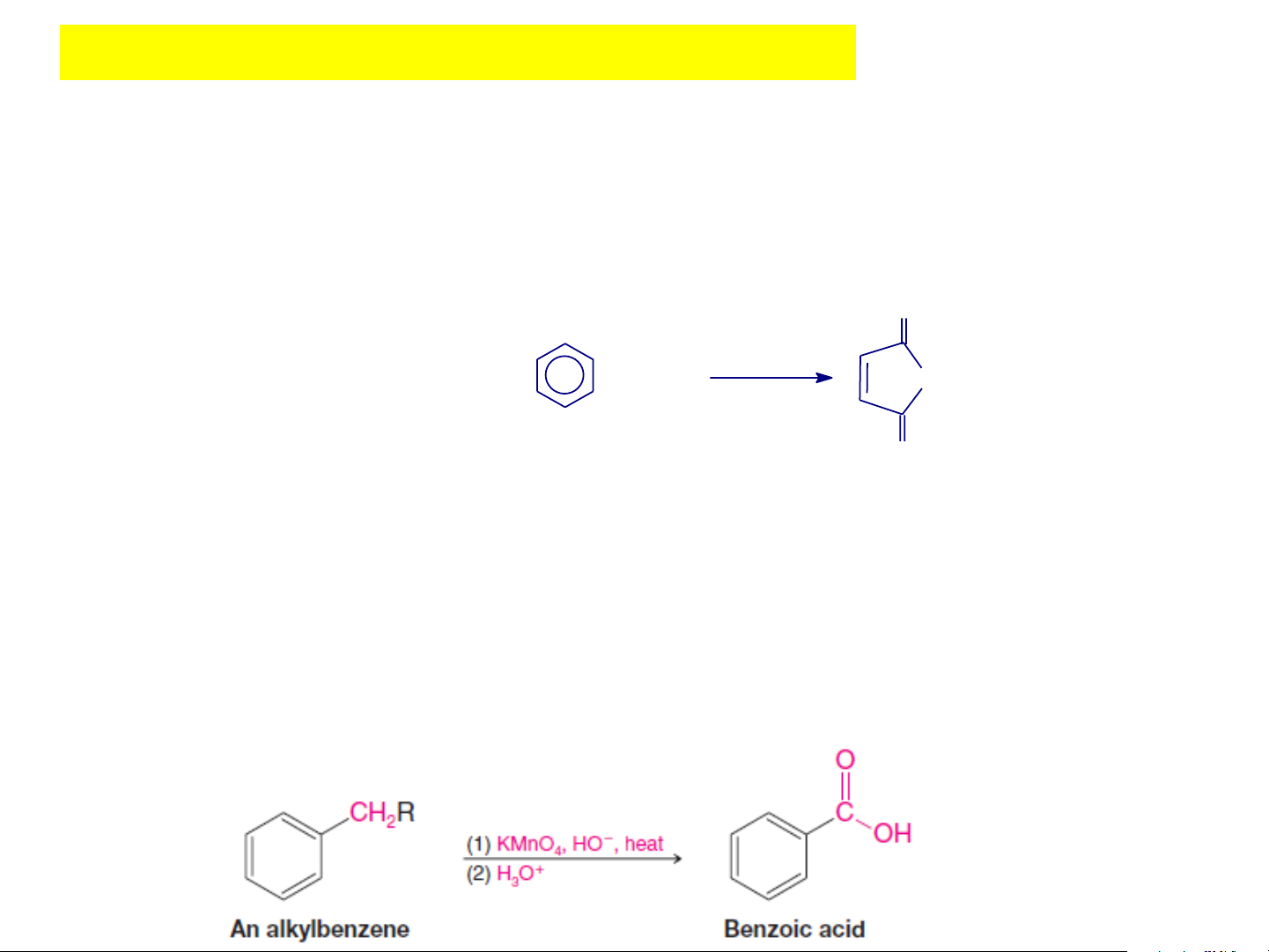
Các đồng đẳng của benzen dễ bị oxi hóa hơn benzen và chỉ
mạch nhánh bị oxi hóa và cho sản phẩm cuối cùng là axit thơm R COOH [O] (R: g èc ankyl) to Ankylbenzen Axit benzoic
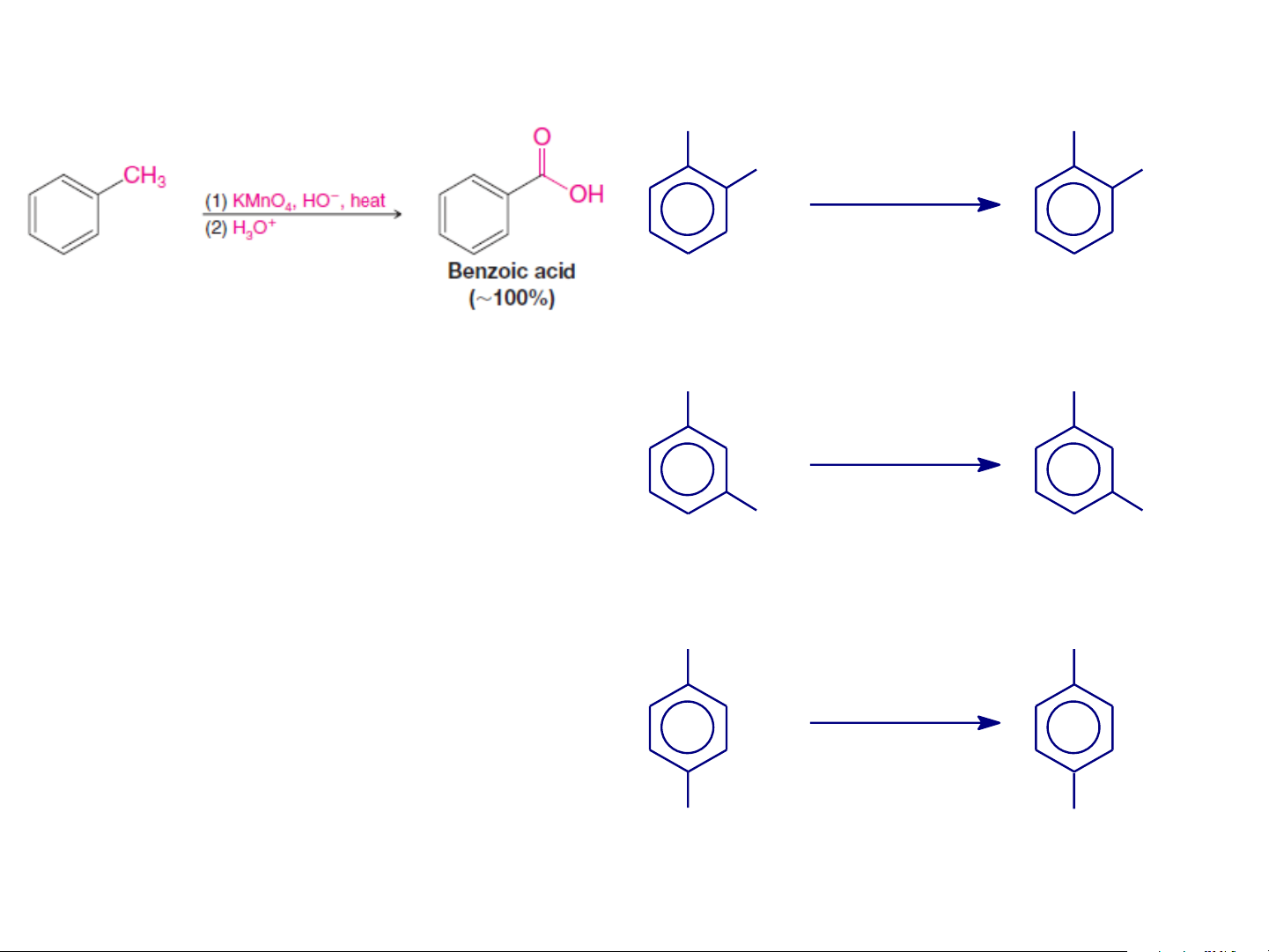
❖ PHẢN ỨNG OXY HÓA CH3 COOH CH3 COOH CH COOH 3 [O] [O] KMnO4/H+ to KMnO4/H+ to o-Xylen Axit phtalic Toluen Axit benzoic CH3 COOH [O] KMnO4/H+ CH to 3 COOH
Để hạn chế sản phẩm bị m-Xylen Axit isophtalic
oxy hóa sâu, có thể tiến CH3 COOH
hành trong môi trường kiềm [O]
hoặc trung tính sau đó axit KMnO4/H+ hóa để thu axit hữu cơ. to CH3 COOH p-Xylen Axit terephtalic
2. Hóa tính benzen và đồng đẳng
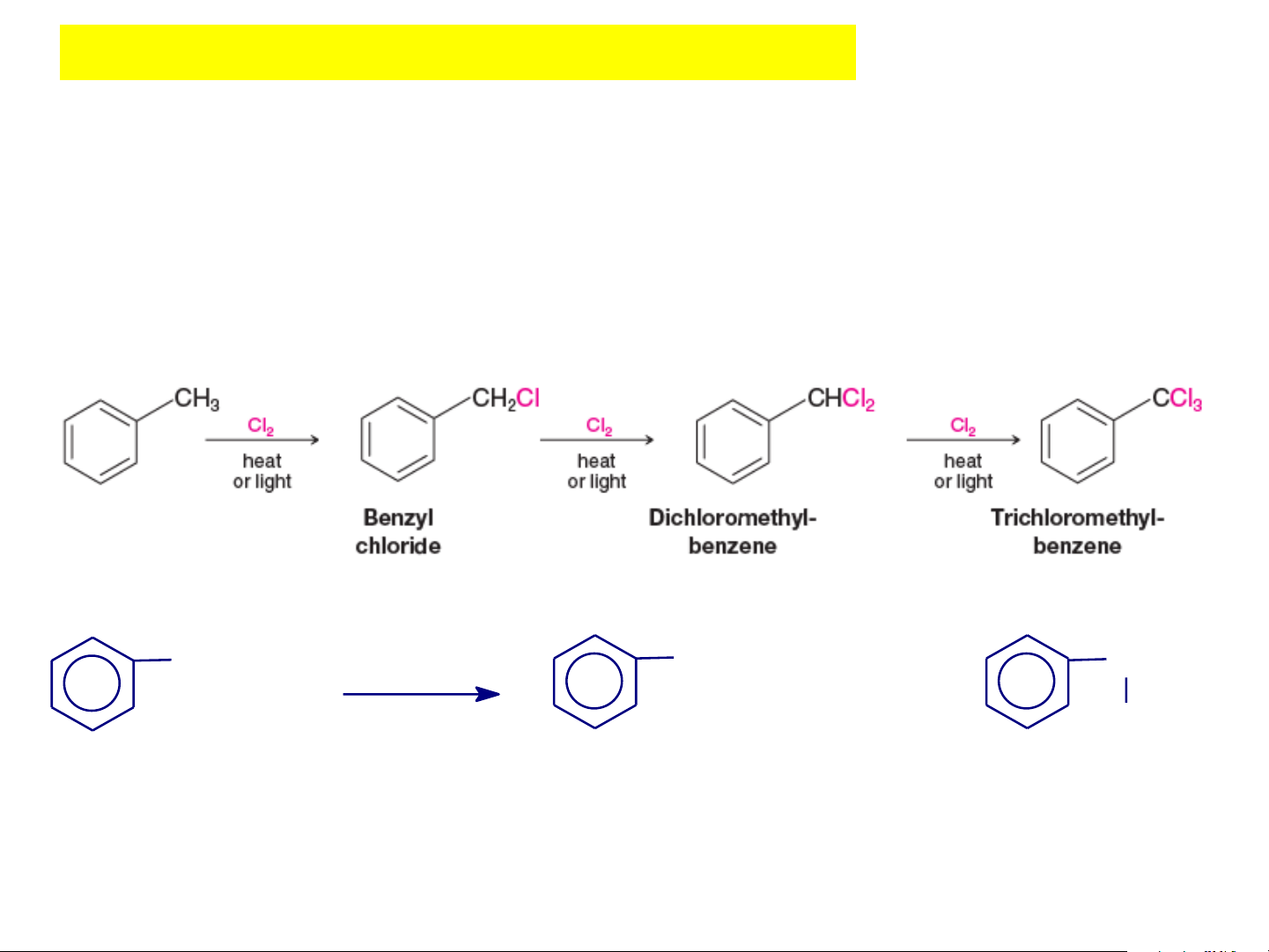
2.4. Phản ứng thế S Ar ở nhánh R
Với các đồng đẳng của benzen, trong điều kiện cộng clo, xúc
tác ánh sáng thì không xảy ra phản ứng cộng mà xảy ra ohản
ứng thế gốc S Ar ở mạch nhánh R + Cl2, CH - CH - CH - Cl - 2 CH3 50oC, h CH 2 2 CH3 + (- HCl) Cl Etylbenzen (9%) (91%)
Ưu tiên thế ở vị trí C của nhánh gần vòng thơm nhất do
hiệu ứng liên hợp làm bền gốc tự do trung gian. Nội dung cần nhớ HYDROCACBON THƠM (2)
(AROMATIC HYDROCARBONES) 1. Tính chất vật lý
2. Hóa tính benzen và đồng đẳng - Phản ứng thế SE -
Phản ứng ở phần nhánh - Phản ứng oxy hóa - Phản ứng cộng - ...




