





Preview text:
HYDROCACBON CHƯA NO,
CÓ 1 LIÊN KẾT BA: ANKIN 1. Khái niệm
2. Danh pháp, Đồng phân 3. Điều chế
4. Tính chất vật lý
5. Tính chất Hóa học 1. KHÁI NIỆM
Ankin (Dãy đồng đẳng axetylen) là hợp chất
hydrocacbon chưa no (không no) mạch hở mà
trong phân tử chứa 1 liên kết ba C≡C.
+ Công thức phân tử chung của ankin là C H với n 2 n 2n-2
Khi n = 2, ta có chất đầu tiên của dãy đồng
đẳng, gọi là axetylen C H , n = 3, được metyl 2 2
axetylen C H ,... nên dãy ankin còn gọi là dãy 3 4
đồng đẳng của axetylen.
2. DANH PHÁP - ĐỒNG PHÂN
❖ Cách gọi tên hợp lý: xuất phát từ axetylen Tên gốc hydrocacbon "axetylen" +
liên kết 2 bên -C≡C-
❖Cách gọi tên quốc tế IUPAC:
Tên quốc tế của các ankan tương ứng nhưng
đổi đuôi "an" thành "in"
- Xác định mạch chính: Đó là mạch chứa liên kết ba dài nhất
và có nhiều nhóm thế nhất (các nhánh phụ coi là nhóm thế)
- Đánh số mạch chính từ đầu gần liên kết ba hơn và sao cho
tổng số chỉ vị trí của nhánh (locant) là nhỏ nhất - Gọi tên: STT Tên vị trí liên tên ankin mạch nhóm thế + nhóm thế + + kết ba chính (đuôi in)
2. DANH PHÁP - ĐỒNG PHÂN 1 2 3 4 5 6 7
CH – C ≡ C – CH – CH – CH – CH 3 2 2 3
CH3 5-metyl-2-heptin Công thức Tên hợp lý Tên quốc tế IUPAC CHCH axetylen etin CHC−CH metyl axetylen propin 3 CHC−CH −CH etyl axetylen 1-butin 2 3 CH −CC−CH dimetyl axetylen 2-butin 3 3 CH −CC−CH −CH metyletyl axetylen 2-pentin 3 2 3 CH −CH(CH )−CCH
isopropyl axetylen 3-metyl-1-butin 3 3 CHC−CH −CH −CH propyl axetylen 1-pentin 2 2 3
2. DANH PHÁP - ĐỒNG PHÂN
- Các gốc hydrocacbon chứa liên kết ba gọi chung là ankinyl CHC− etinyl
CHC−CH −
propinyl (cßn gäi lµ propacgyl) 2 ❖Đồng phân
+ Đồng phân cấu tạo: đồng phân mạch, vị trí liên kết
ba, kiểu liên kết,...
+ Đồng phân lập thể: khi có C bất đối, liên kết ba
trong ankin không tạo ra đồng phân lập thể
3. PHƯƠNG PHÁP ĐIỀU CHẾ
❖ Điều chế axetylen:
+ Trong công nghiệp: 2 CH 1500ºC C H + 3H 4 2 2 2 Làm lạnh nhanh CaC
+ 2H O ⎯⎯→ HCCH + Ca(OH) 2 2 2 1500ºC
6CH4 + 4O2 ⎯→ CHCH + 8H2 + 3CO + CO2 + 3H2O Làm lạnh nhanh
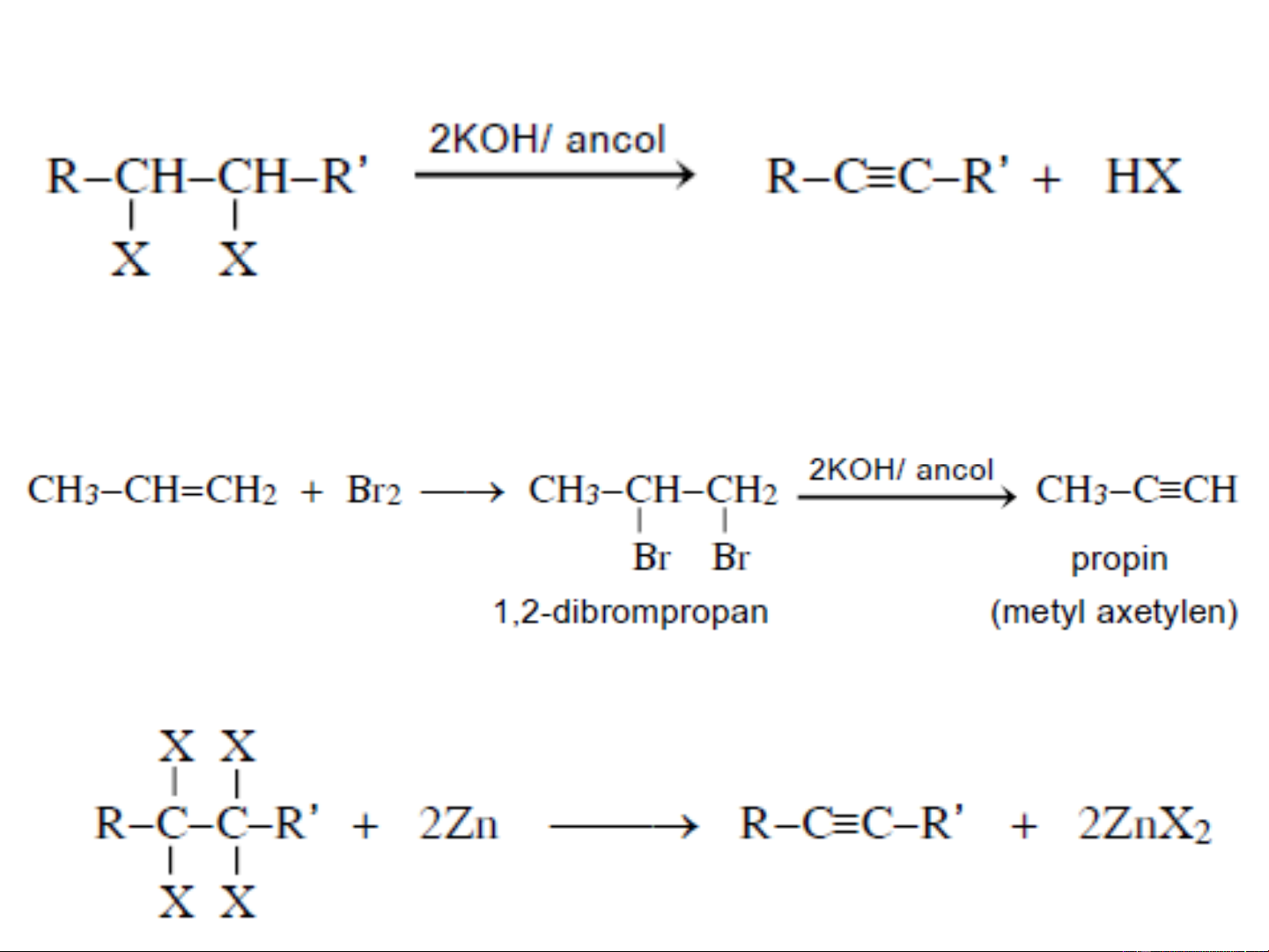
❖ Tách loại hydro halogenua (HX) của dẫn xuất
vic-dihalogen hoặc gem-dihalogen:
R−CH −CHX ⎯⎯→
R−CCH + HX 2 2 KOH/ancol
gem-dihalogen
3. PHƯƠNG PHÁP ĐIỀU CHẾ Vic-halogen
Nhờ phản ứng tách hai phân tử HX tạo ra liên kết ba, có thể
chuyển hoá liên kết đôi thành liên kết ba
❖ Đi từ dẫn xuất tetrahalogen:
3. PHƯƠNG PHÁP ĐIỀU CHẾ
❖ Đồng đẳng của axetylen:
Hoặc từ hợp chất cơ magie
R− C ≡CMgBr + R’X ⎯⎯→ R− C ≡ C− R’ + MgBrX
4. TÍNH CHẤT VẬT LÝ +) Trạng thái:
Các thành phần thấp (C2 - C4) trong dãy đồng đẳng
ankin là những chất khí không màu
Các đồng đẳng cao hơn là những chất lỏng hoặc rắn
+) tos : Các ankin có nhiệt độ sôi hơi cao hơn so với các anken và ankan tương ứng
+) Các ankin tan trong nước nhiều hơn các hydrocacbon khác.
+) Khối lượng riêng của các ankin cao hơn so với anken tương ứng.
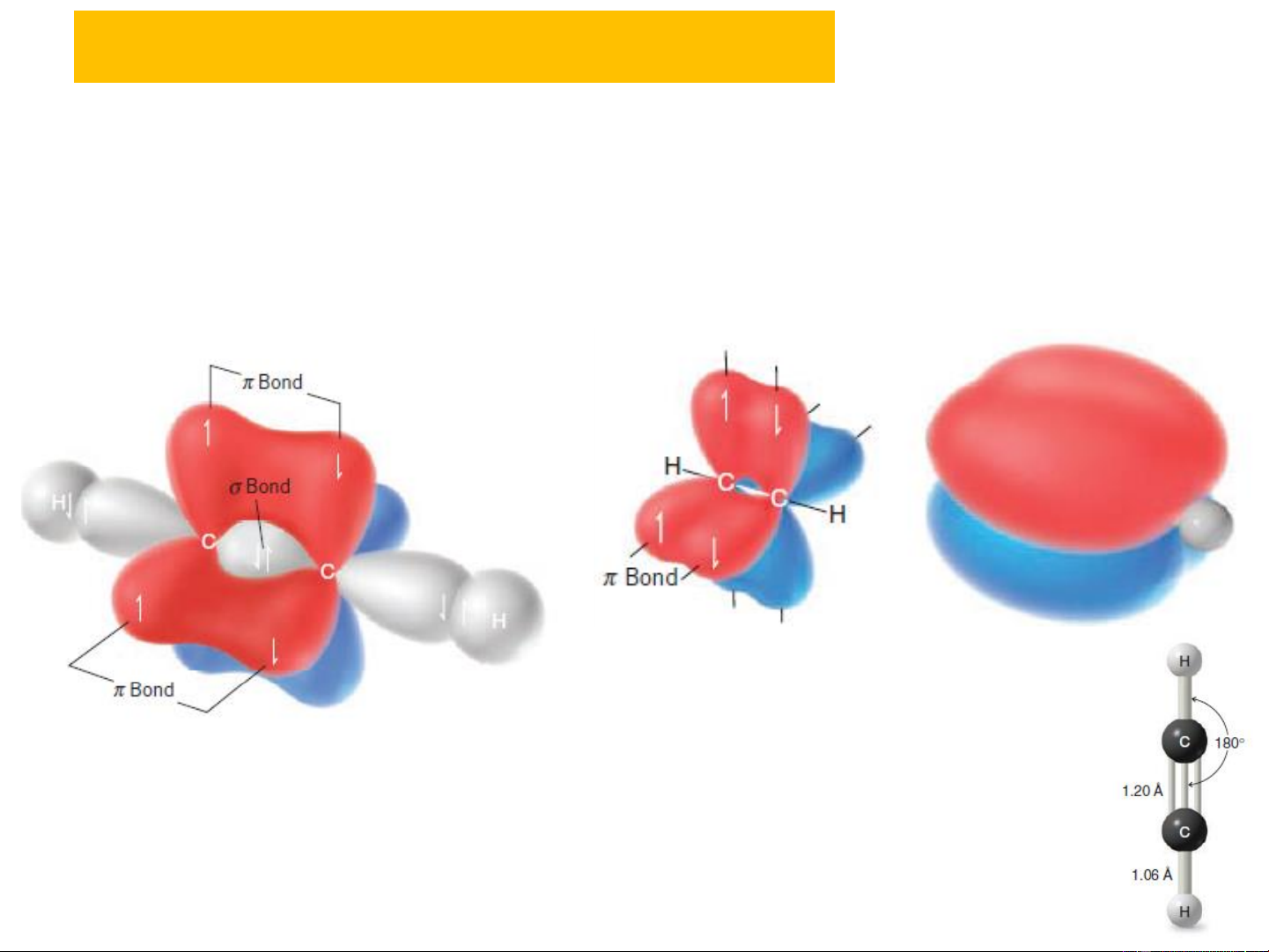
5. TÍNH CHẤT HÓA HỌC NHẬN XÉT CHUNG:
+ Nguyên tử C chứa liên kết đôi trong ankin ở trạng
thái lai hoá sp, mỗi C còn lại 2 orbital p chưa lai hóa. Các
orbital này sẽ xen phủ nhau tạo nên 2 orbital liên kết .
Ví dụ phân tử CH≡CH
+ do sự xen phủ bên của các orbital nên liên kết ba C≡C ngắn lại:
C – C: d = 1,54 Ao, C = C: d = 1,34 Ao, C≡C : d = 1,2 Ao
5. TÍNH CHẤT HÓA HỌC
+ So với ankan, anken thì orbital lai hóa của C trong C H có 2 2
thành phần e cao nhất mà đặc tính của e là có xu hướng thu s s
lại gần hạt nhân nguyên tử nên thành phần mây s càng cao thì
xu hướng electron thu về vùng giữa hai hạt nhân nguyên tử
C của nối ba nhiều hơn → ở vùng ngoài có mật độ e ít hơn →
điện tích hạt nhân ở vùng này ít được che chắn hơn nên khả
năng phản ứng A kém anken song lại xuất hiện một số E
phản ứng cộng nucleophyl
❖ Ở ankin-1 xuất hiện tính axit yếu R−C ≡ Cδ− ← Hδ+
Tính axit ở ankin-1 được giải thích là do thành phần
electron s cao nên e liên kết C−H bị lệch về phía hạt nhân
nguyên tử C làm H linh động và dễ bị tách ra. Mặt khác, do độ
âm điện của orbital lai hóa sp là lớn nhất (χ > χ > χ ) → cặp sp sp2 sp3
e liên kết C−H sẽ bị hút mạnh nhất → nguyên tử H dễ tách ra
dưới dạng H+ gây nên tính axit của ankin−1
Từ cấu trúc suy ra các hướng phản ứng chính
của hợp chất Ankin:
+ Phản ứng cộng AE vào liên kết C≡C + Phản ứng oxi hoá
+ Phản ứng trùng hợp
+ Phản ứng thế của ankin-1
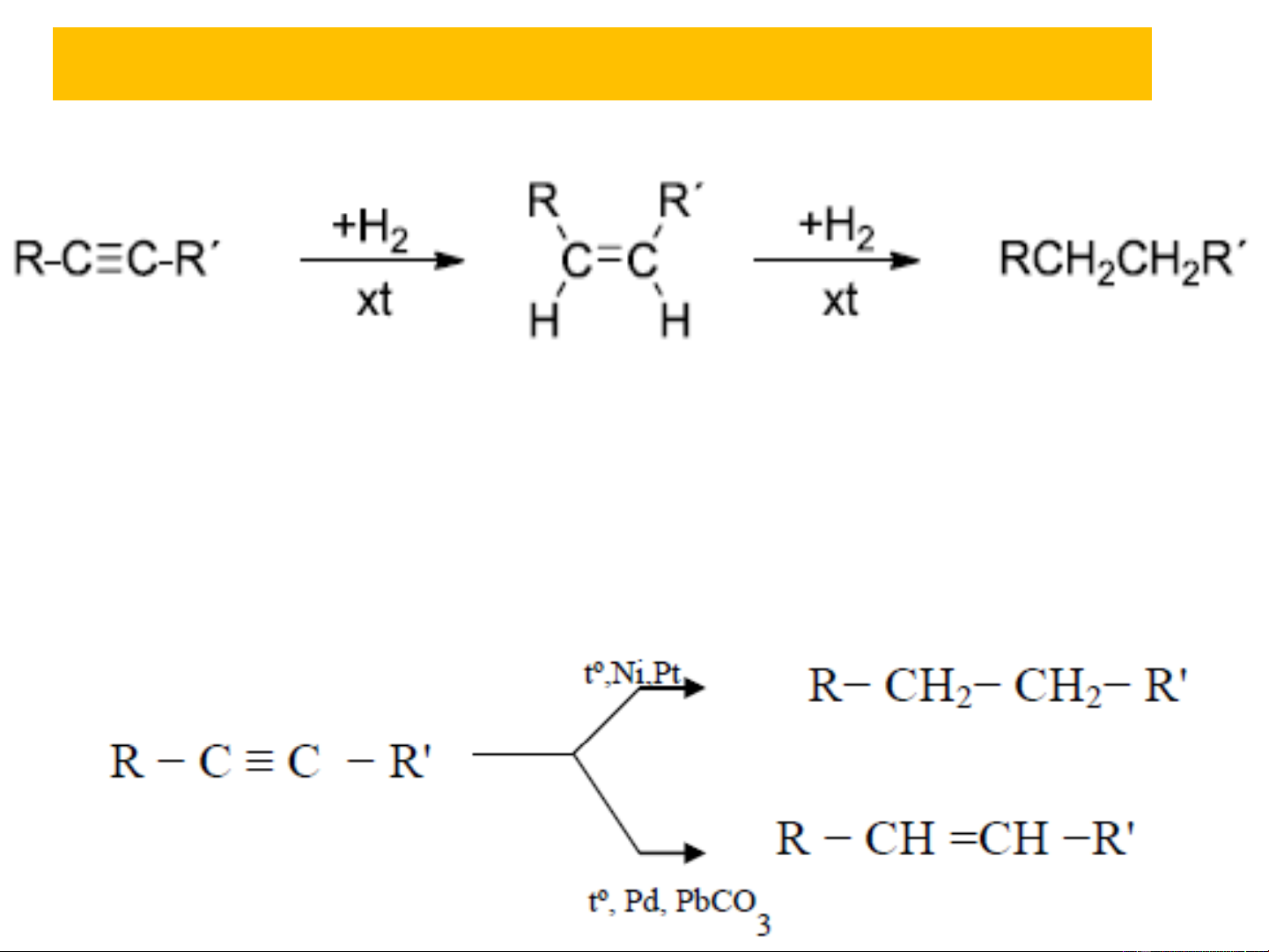
5.1. Phản ứng cộng 5.1.1. Cộng H2
+ Phản ứng theo kiểu cộng cis
+ Khi có xúc tác kim loại chuyển tiếp Ni, Pt hoặc Pd, ankin
cộng hiđro tạo ra anken, tiếp đó là ankan.Muốn phản ứng
dừng lại ở giai đoạn tạo cis-anken, người ta thường làm giảm
bớt hoạt tính xúc tác, ví dụ Pd tẩm PbCO , CaCO , ... 3 3
5.1. Phản ứng cộng
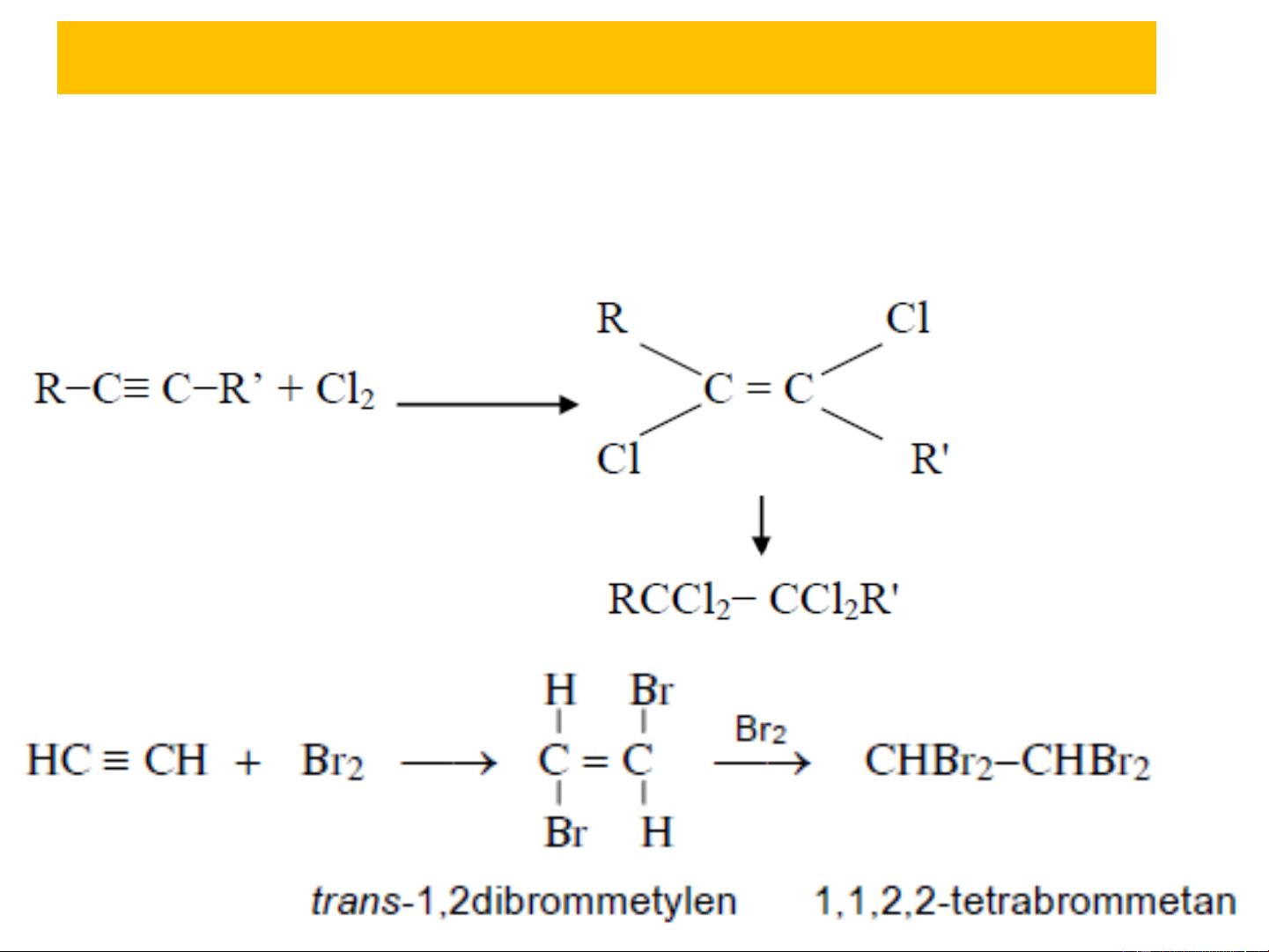
5.1.2. Phản ứng cộng electrophil AE
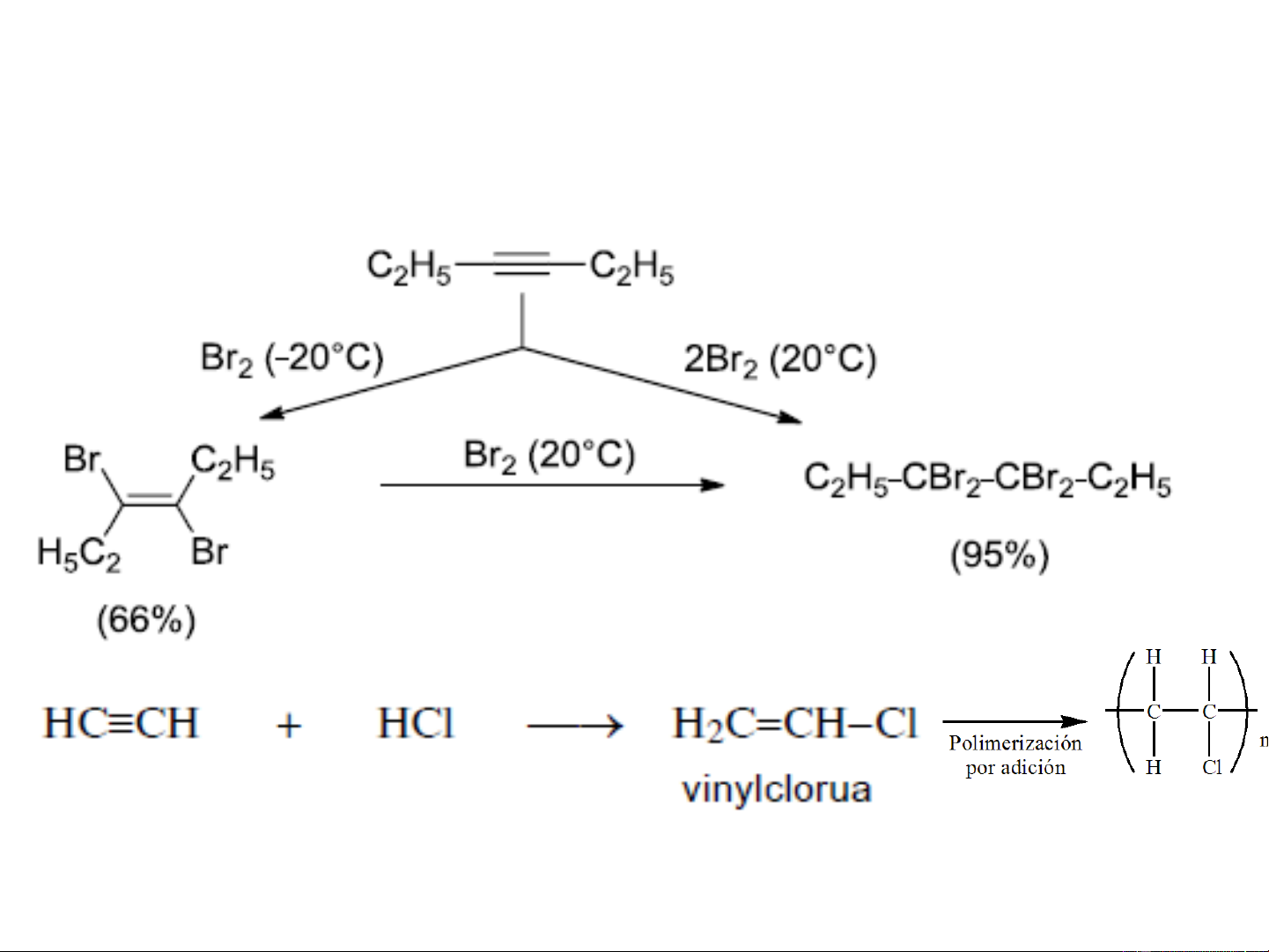
+ Cộng halogen: A theo 2 bậc E
trans- diclo anken
Tetra-clo ankan
5.1.2. Phản ứng cộng electrophil AE
❖ Cộng axit HX (hydro halogenua) khó hơn cộng X2
Cơ chế A cho SP cộng tuân theo Markovnikov tổng quát E HgCl2,to Nhựa PVC
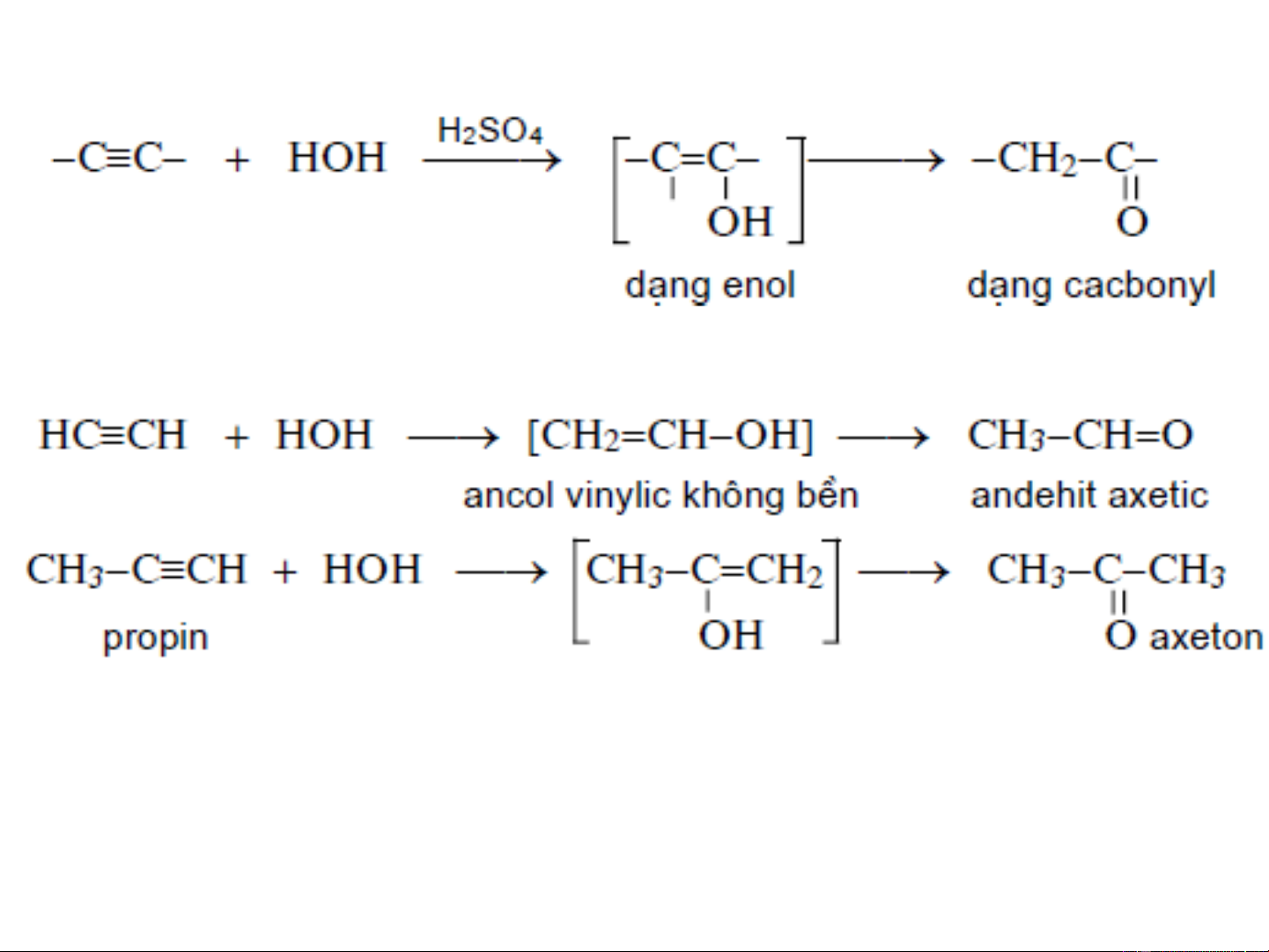
❖Phản ứng cộng H O: 2 + Xúc tác: H SO g 4
5.2. Phản ứng oxy hóa
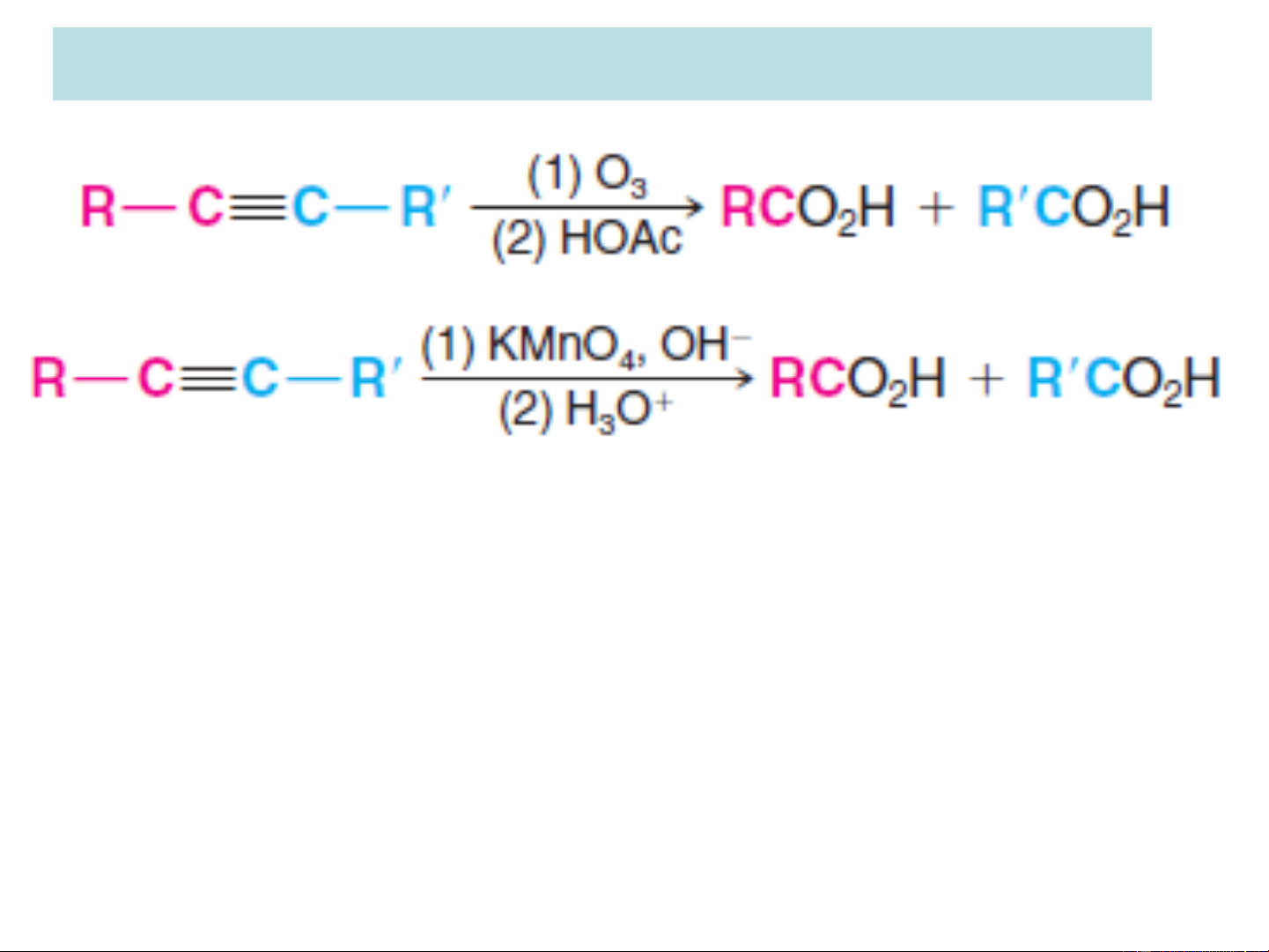
+ Oxi hóa bằng KMnO4, H2O thu được diol:
+ Oxi hóa bằng KMnO hoặc O sẽ cắt mạch ở nối ba cho 4 3 ra hỗn hợp axit
phản ứng này có thể dùng để nhận biết vị trí nối 3 trong mạch C.
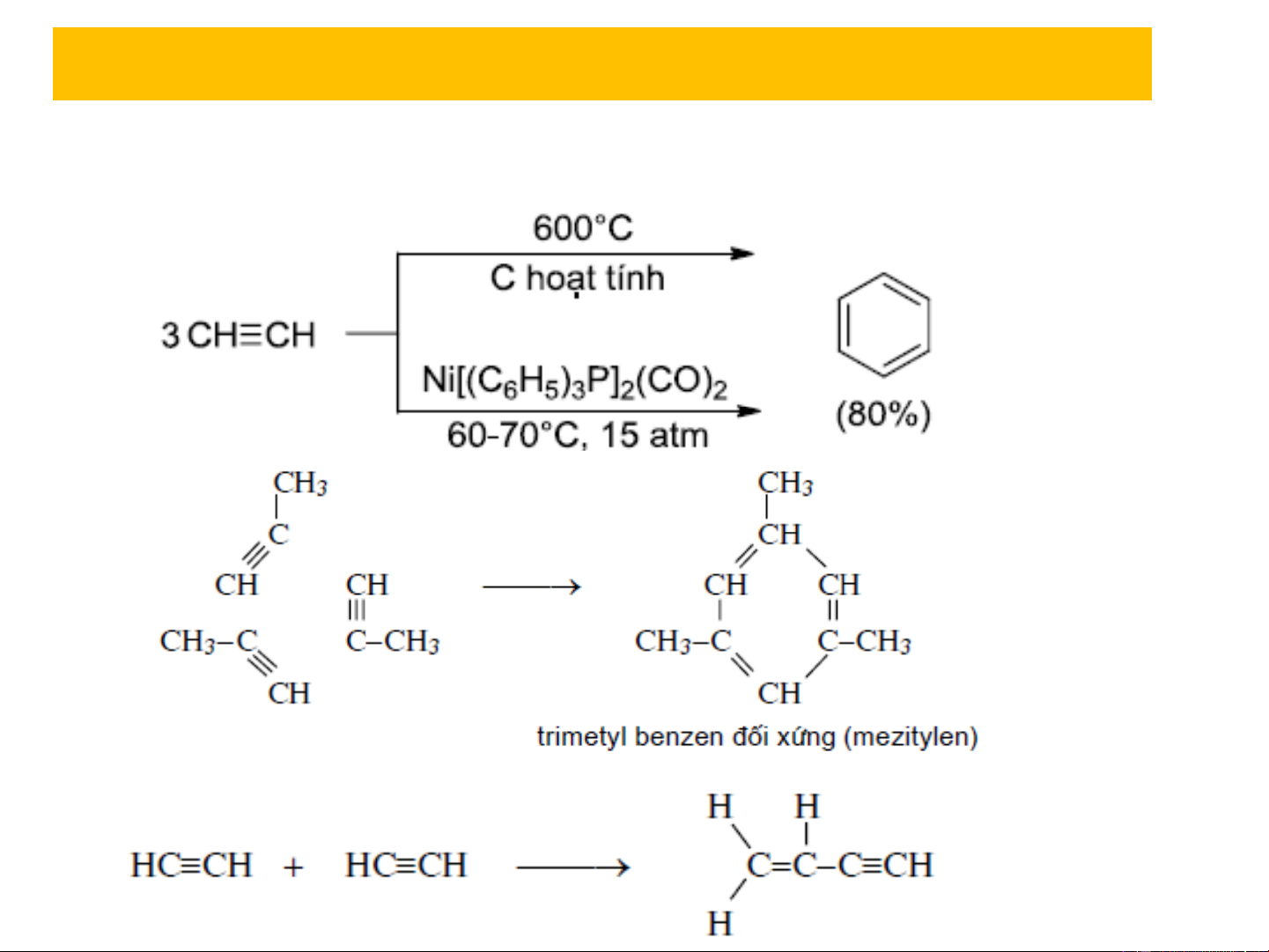
5.3. Phản ứng trùng hợp
Chỉ có phản ứng trùng hợp oligome hóa. benzen Cu2Cl2/NH4Cl 50-60oC vinylaxetylen
5.4. Tính axit yếu và phản ứng thế
- Đó là vì ở cacbon lai hoá sp, trong orbital lai hoá, tỷ lệ
electron s là electron có mức năng lượng thấp ở gần nhân,
chiếm tới 50%, lớn hơn hẳn tỷ lệ electron s trong orbital lai
hoá sp2 và sp3. Do độ âm điện của cacbon lai hoá sp lớn, nên
liên kết C−H của cacbon mang liên kết ba phân cực mạnh,
tăng cường khả năng proton hoá của nguyên tử hydro, cũng
như khả năng thế với kim loại:
R−C ≡ Cδ− ← Hδ+
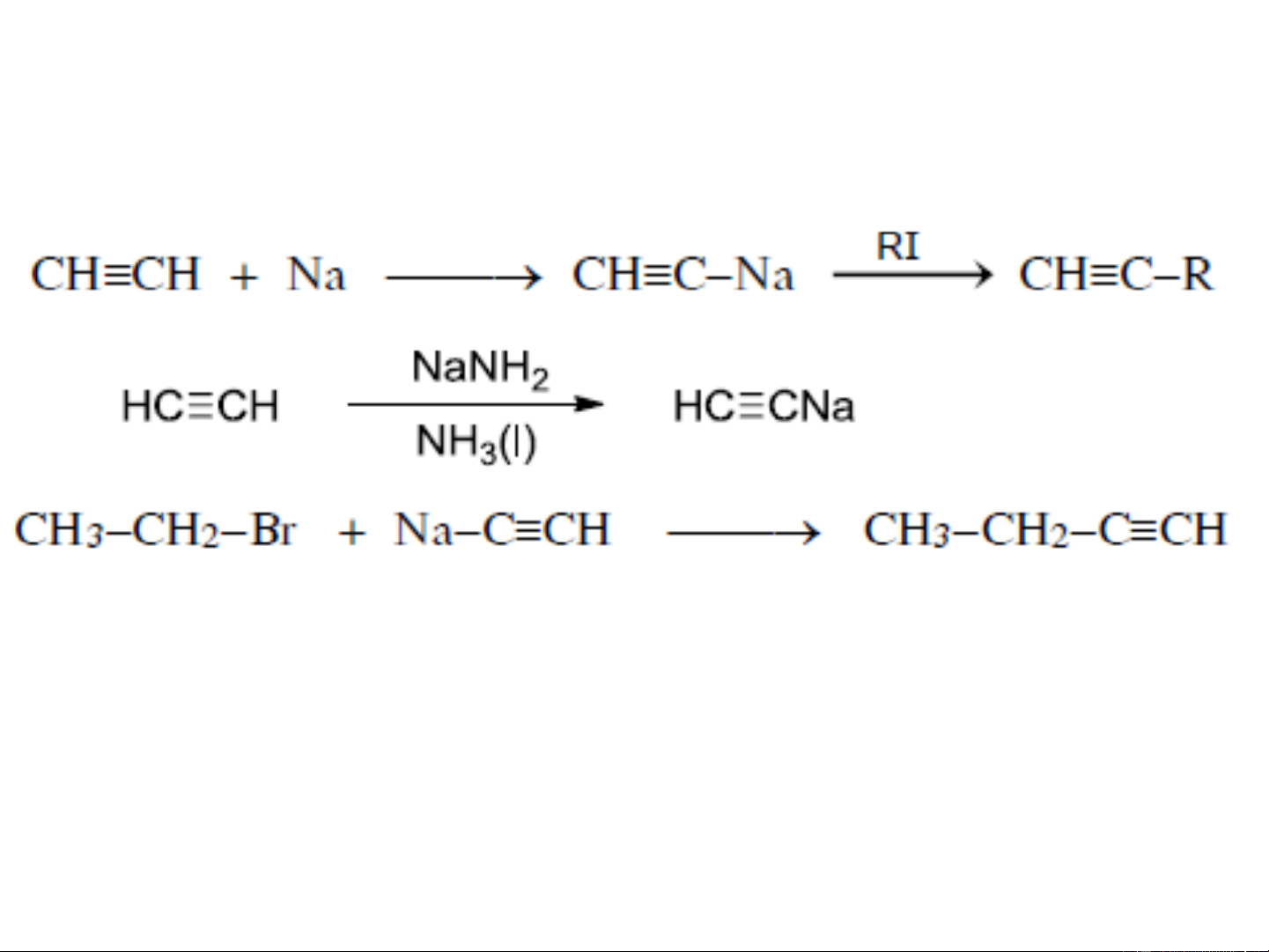
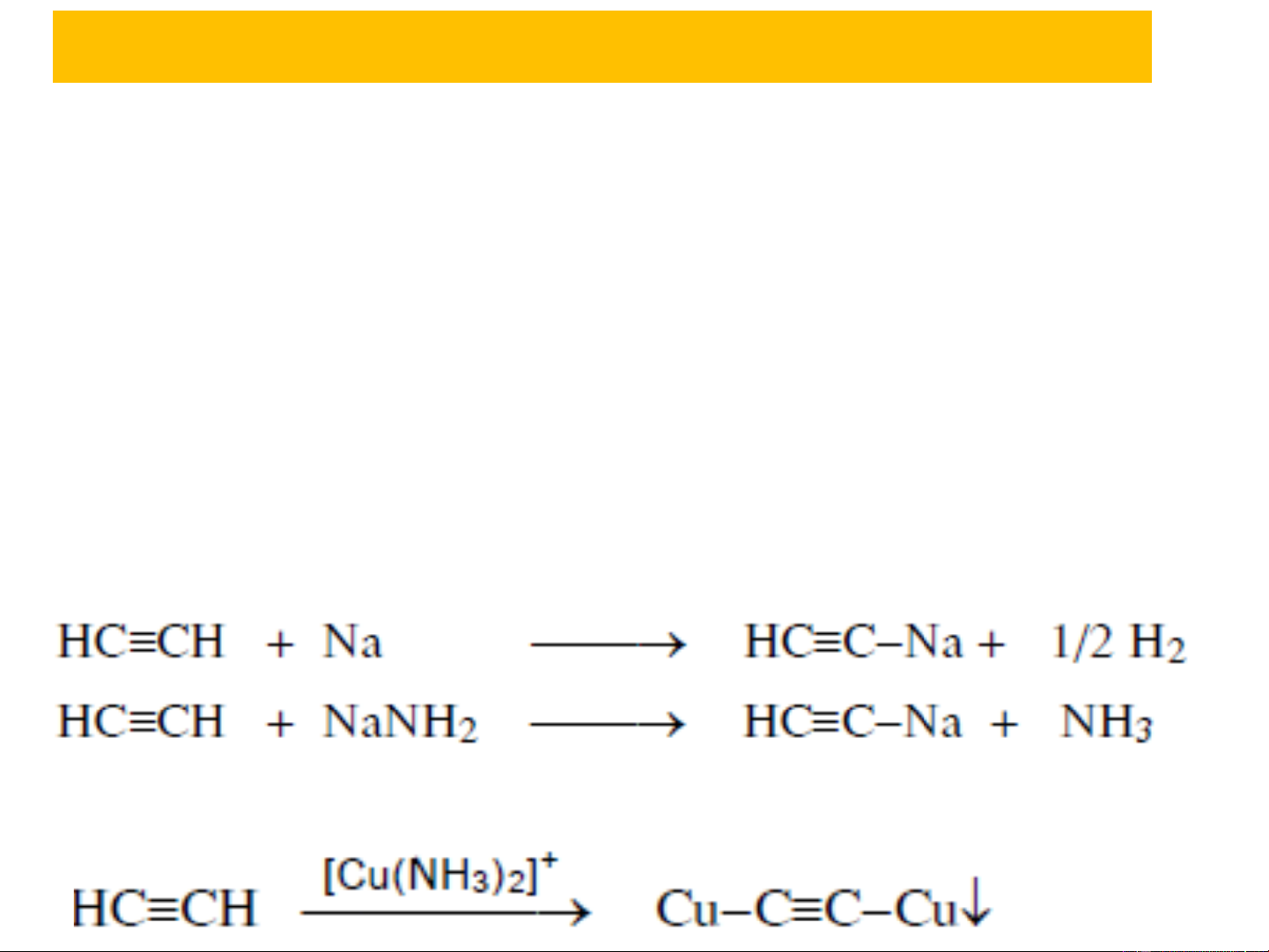
- Tính axit yếu nên chỉ phản ứng với bazơ mạnh: 150oC
R−C ≡CH + [ Ag(NH ) ]OH ⎯⎯→ R−C ≡CAg ↓ + NH + H O 3 2 3 2
2.5. Một số phản ứng khác + Đồng phân hóa
Khi đun nóng với rượu kiềm , alkin có thể bị đồng phân hóa
R − CH − C ≡CH ⎯⎯→ tº R −C ≡C −CH 2 3 rượu kiềm
Khi đun nóng với Na , áp suất thích hợp
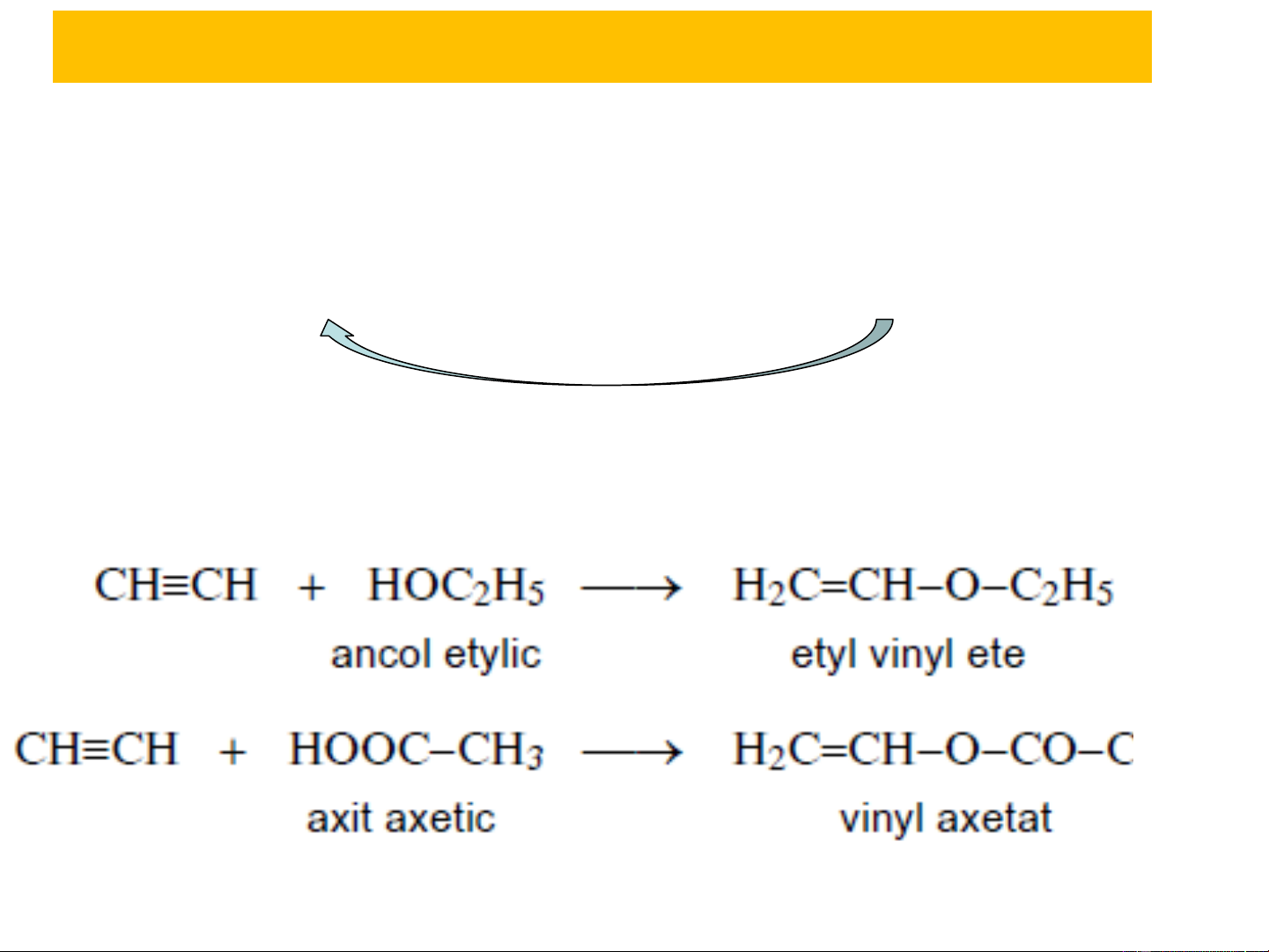
+ Phản ứng của axetylen: H3
Các ete vinylic, cũng như este vinylic, đều có thể dùng làm
nguyên liệu tổng hợp polyme có nhiều ứng dụng trong kỹ thuật




