




Preview text:
Liên kết hoá học trong Hóa Hữu cơ
1. Thuyết hóa trị định hướng
2. Sự lai hóa của các obitan
3. Các loại liên kết trong các hợp chất hữu cơ 1
1. Thuyết hóa trị định hướng VB
Sự tạo thành liên kết cộng hoá trị là do sự ghép chung
các electron; trong đó các electron góp chung phải có
spin đối song. Liên kết được hình thành do sự rằng buộc
giữa 2 nhân nguyên tử bởi lực hút tĩnh điện giữa nhân và các electron góp chung. Phân tử Công thức
Hai nguyên tử giống nhau (H ) 2 H .xH H H : :
Hai nguyên tử khác nhau H .xC : l : H :Cl : Hydro clorua (HCl)
Liên kết hoá học được hình thành theo hướng mà ở đó xảy ra
sự xen phủ cực đại giữa các orbital nguyên tử (AO) trong
khoảng cách cân bằng nhất định và như vậy liên kết bền nhất
khi sự xen phủ giữa các orbital là lớn nhất
1. Thuyết hóa trị định hướng VB
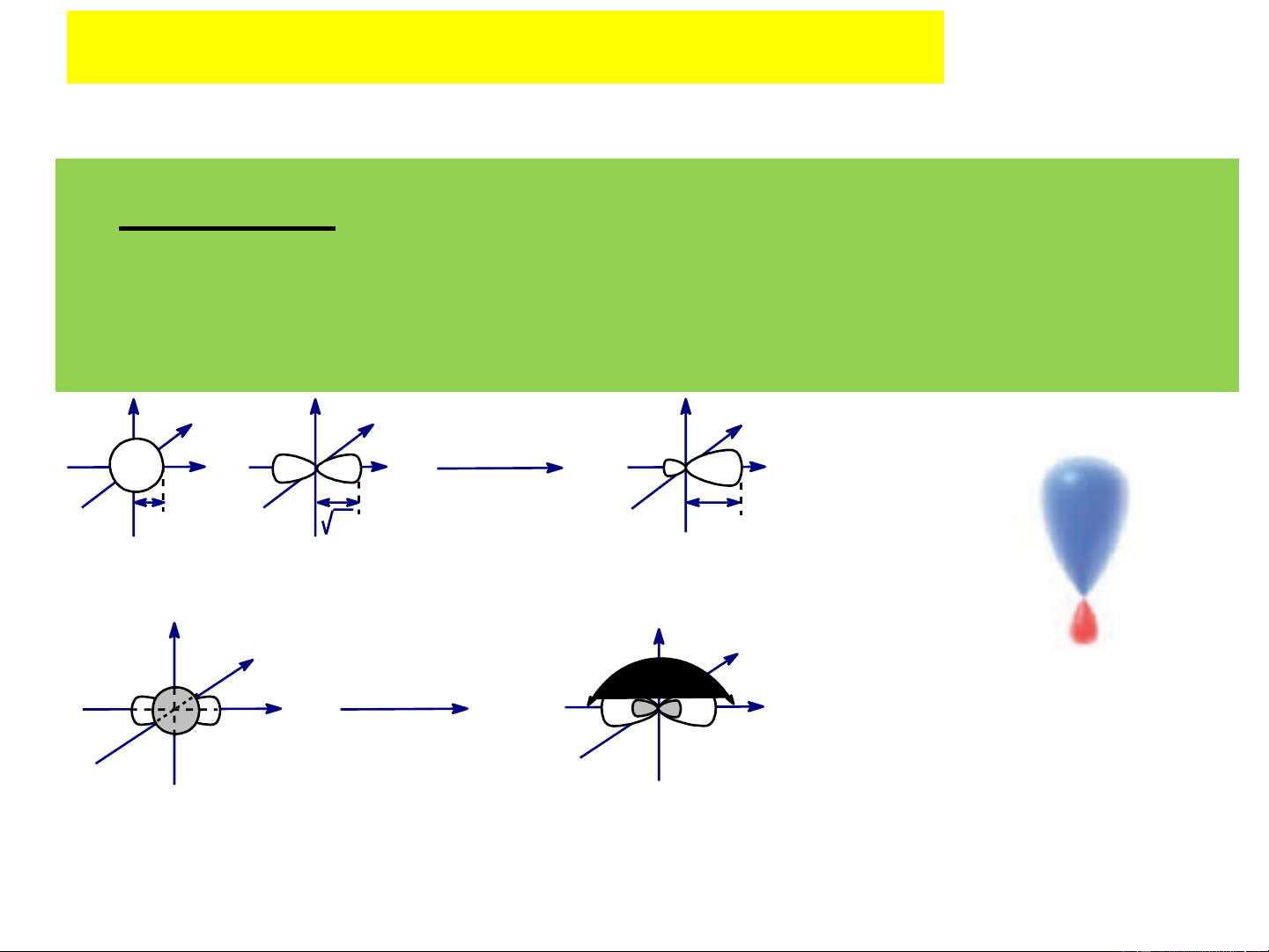
- Kết quả tính toán: nếu qui ước khả năng xen phủ của
orbital s là 1 thì của các orbital p , p , p đều bằng 3 x y z
- Thuyết hóa trị định hướng cho phép tiên đoán về liên kết và
góc hóa trị trong phân tử các chất tuy nhiên còn chưa chính
xác. Như dự đoán góc hoá trị của các phân tử dạng H–X–H
là 900.. Tuy nhiên trong thực tế các góc hoá trị : → HOH là 10405’ → H – S – H là 920
→ H – N – H là 10705’ ( trong NH ) 3
Giải thích: có sự sai lệch là do các nguyên tử X có độ âm điện
lớn hơn H, tạo độ phân cực cho các liên kết X – H, H tích điện
δ+ và đẩy nhau làm tăng góc hóa trị.
2. Sự lai hóa của các obitan
Thuyết lai hoá được đưa ra trong khuôn khổ thuyết
VB để giải thích sự hình thành liên kết trong phân tử
CH , BeF … và các hợp chất tương tự. 4 2
Xét nguyên tử C có cấu hình e- : ↑↓ ↑↓ ↑ ↑ ↑↓ ↑ ↑ ↑ ↑ 1s2 2s2 2p2 1s2 2s1 2p3 trạng thái cơ bản
trạng thái kích thích
2. Sự lai hóa của các obitan
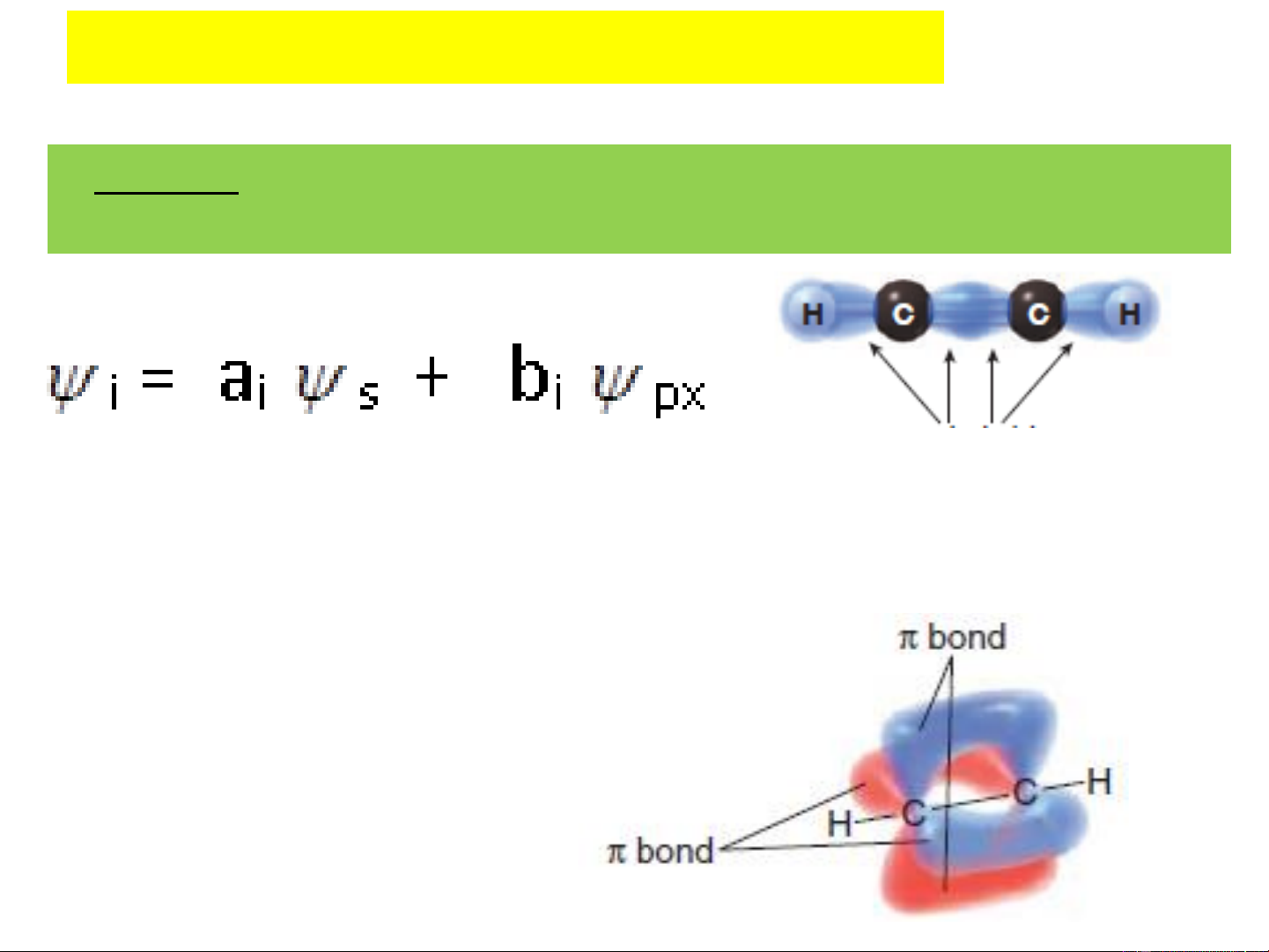
Khi tham gia liên kết ( VD: xét ↑↓ ↑ ↑ ↑ ↑
phân tử đơn giản nhất là CH ) 4
sẽ tạo thành 4 liên kết: 1s2 2s1 2p3
trạng thái kích thích
1 liên kết tạo thành do sự xen phủ giữa orbital s của C và orbital s của Hydro
3 liên kết tạo thành do sự xen phủ của 3 orbital, 2p , x
2p , 2p của C và 3 orbital s của 3 hydro còn lại y z
Trong 4 liên kết này thì 3 liên kết p - s vuông góc nhau, liên kết
còn lại s – s tạo góc 1250 với các liên kết còn lại, mức độ xen
phủ của liên kết này ít hơn nên độ bền kém hơn 3 liên kết p – s
Thực tế: 4 liên kết C – H hoàn toàn đồng đều và CH có 4
cấu hình tứ diện đều.
2. Sự lai hóa của các obitan
Pauling và Slater đã đưa ra khái niệm về sự lai hóa của
các obitan: Lai hóa là sự tổ hợp của các orbital (AO) có
kiểu khác nhau để tạo thành orbital lai hóa giống nhau về
năng lượng, hình dạng và định hướng rõ rệt trong không
gian; có khả năng tạo liên kết bền vững hơn so với từng orbital riêng biệt
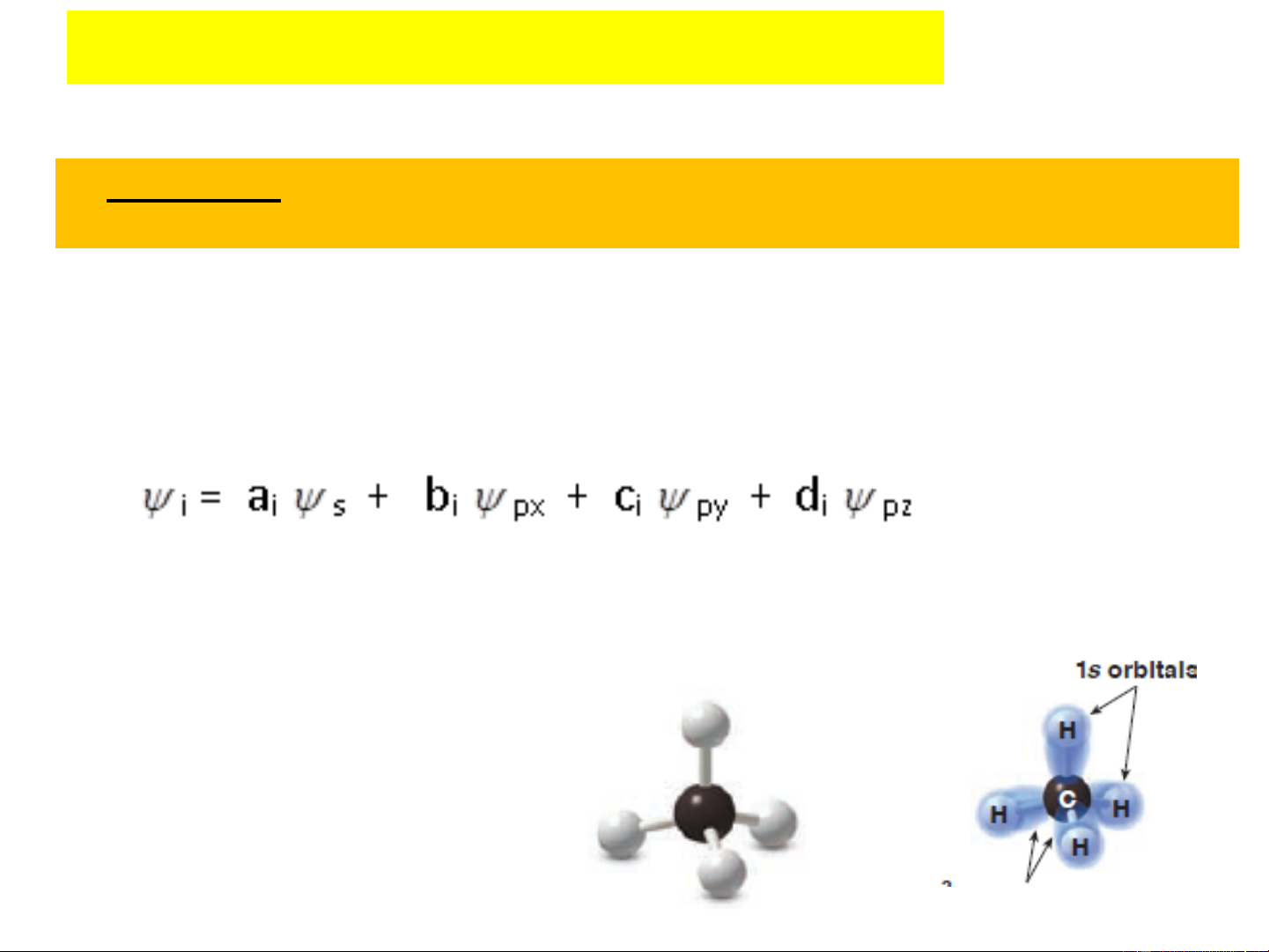
Với phân tử CH , nguyên tử cacbon có 4 4
orbital nguyên tử đã lai hóa (hòa trộn) tạo
thành 4 AO mới giống hệt nhau, không
còn là AO-s hay AO-p thuần tuý và 4 AO
mới này sẽ tham gia tạo thành liên kết.
Về mặt hóa hữu cơ lượng tử, có thể giả thiết rằng hàm sóng
thật của 4 liên kết của cacbon sẽ là tổ hợp của các hàm
sóng AO-s và AO-p tham gia tạo thành liên kết
2. Sự lai hóa của các obitan
Điều kiện để các AO lai hoá bền là:
- Năng lượng của các AO tham gia lai hoá phải xấp xỉ nhau
- Năng lượng của các AO tham gia lai hoá thấp
- Độ xen phủ các AO lai hoá với các AO của các nguyên tử
khác tham gia liên kết phải lớn.
Nếu không đủ các điều kiện trên thì khả năng lai hoá
giảm dần hoặc không có sự lai hoá, kết quả dẫn đến độ bền liên kết giảm dần.
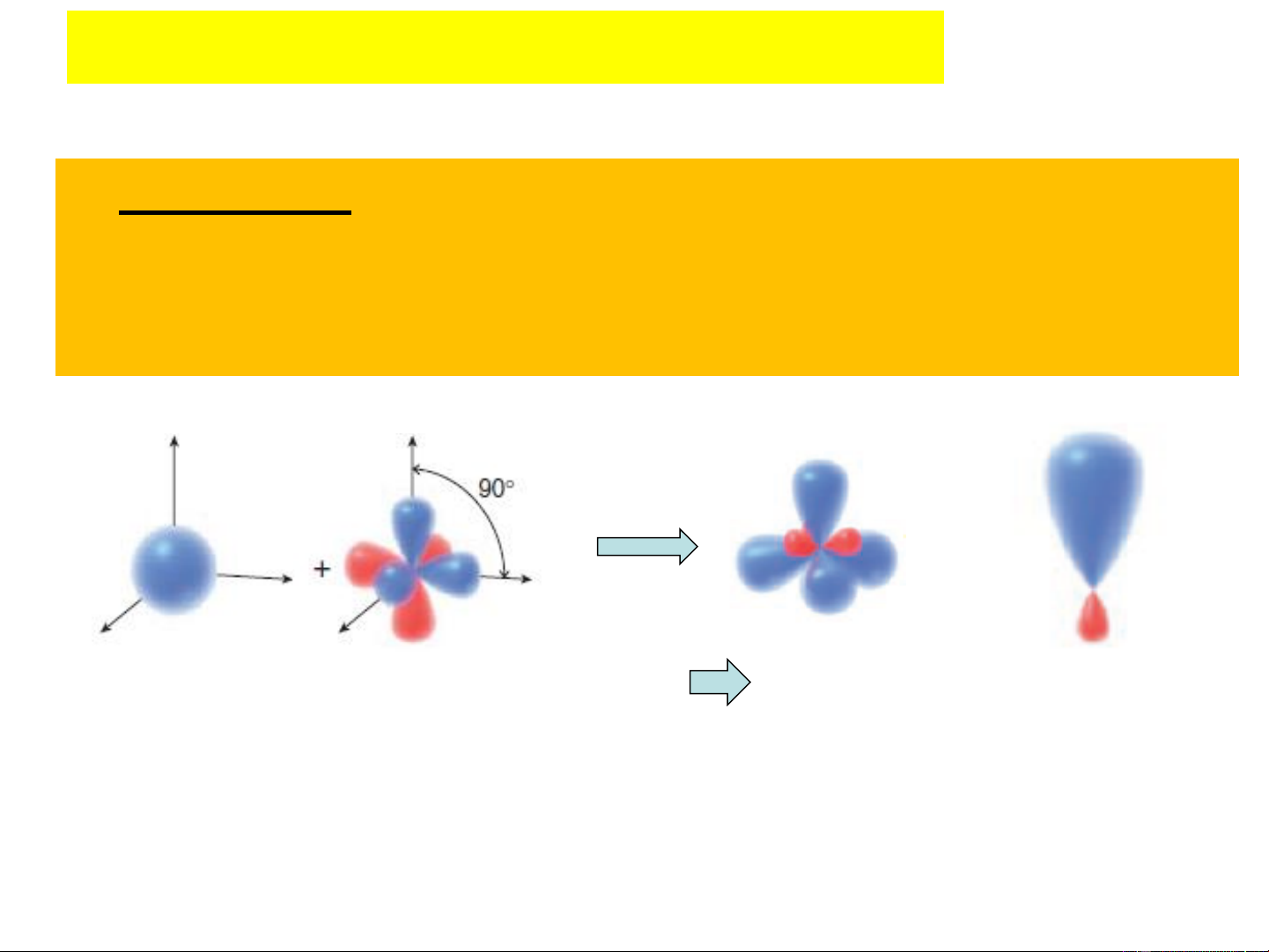
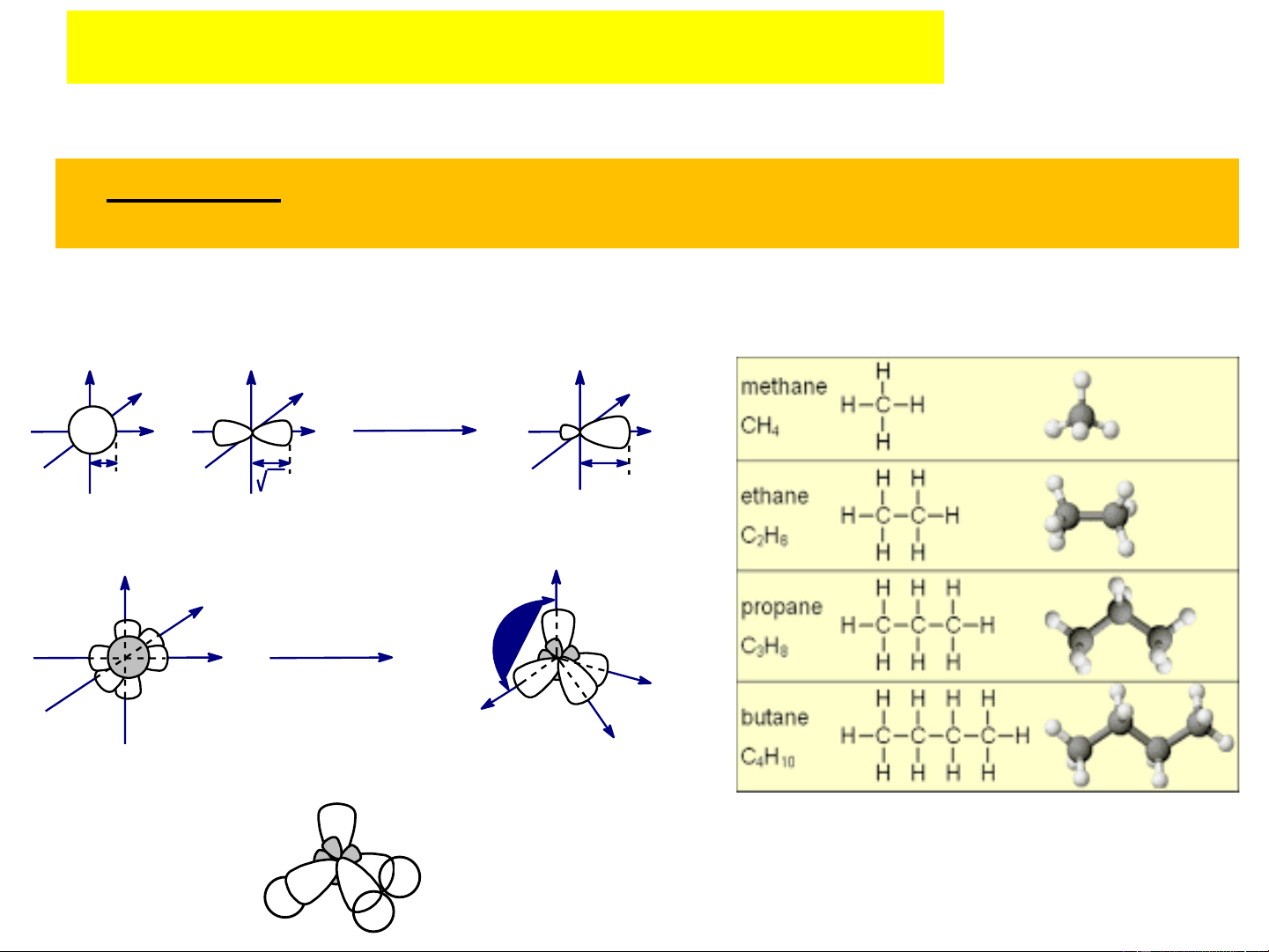
2. Sự lai hóa của các obitan Các kiểu lai hóa:
+) Lai hoá sp3 : 1 orbital s và 3 orbital p tổ hợp để tạo
thành 4 orbital lai hoá sp3, 4orbital lai hoá giống nhau về
hình dạng, kích thước, năng lượng vàvhướng từ tâm đến
đỉnh của 1 tứ diện đều (Lai hóa tứ diện)
1 AO 2s + 3 AO 2p (p , p , p ) 4 AO sp3 1 AO sp3 x y z
- Góc lai hóa (góc giữa các trục đối xứng của các orbital ): 109028’
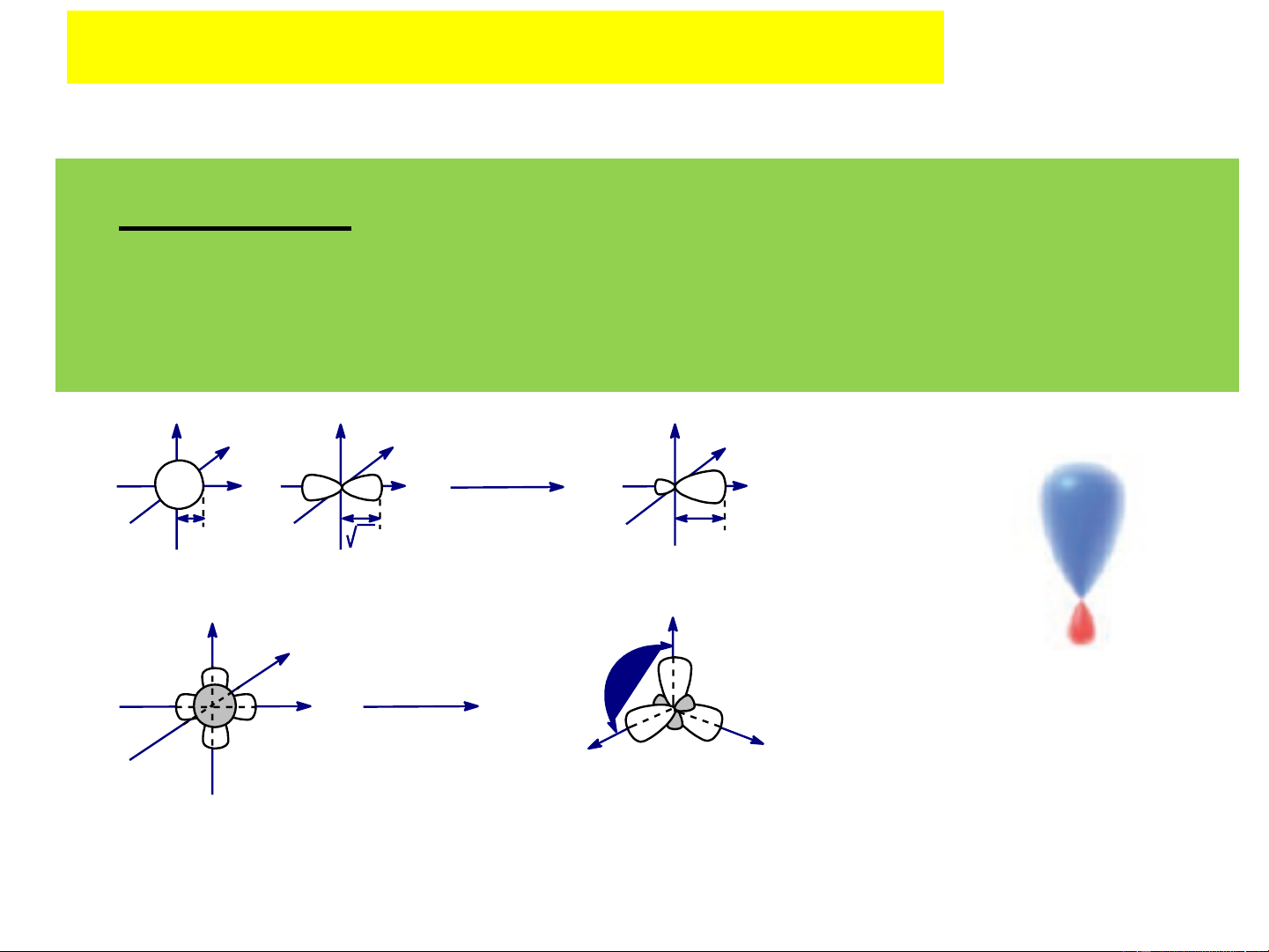
2. Sự lai hóa của các obitan Các kiểu lai hóa:
+) Lai hoá sp3 : 1 orbital s và 3 orbital p tổ hợp để tạo thành 4 orbital lai hoá
sp3, 4orbital lai hoá hướng từ tâm đến đỉnh của 1 tứ diện
- Nếu hàm sóng của các orbital lần lượt là Ψ , Ψ , Ψ , Ψ 3 px py pz
thì hàm sóng của các orbital lai hoá là tổ hợp tuyến tính của các hàm riêng, cụ thể:
- Bằng các phương pháp tính toán cơ học lượng tử, xác định
được khả năng xen phủ cực đại của các orbital lai hoá đều bằng nhau và bằng 2. - Ví dụ: Đây là kiểu lai hóa thường gặp ở các hợp chất no. Orbital lai hóa sp3
2. Sự lai hóa của các obitan Các kiểu lai hóa:
+) Lai hoá sp3 : 1 orbital s và 3 orbital p tổ hợp để tạo thành 4 orbital lai hoá
sp3, 4orbital lai hoá hướng từ tâm đến đỉnh của 1 tứ diện
Ví dụ: Đây là kiểu lai hóa thường gặp ở các hợp chất no alkan. Lai hãa 1 3 2 Orbital s Orbital p Orbital lai hãa sp3 109o28' H Lai hãa C H H H Orbital lai hãa tø diÖn sp3 1 orbital s + 3 orbital p .. Phân tử amoniac (NH ) có N 3 H H
nguyên tử nitơ ở trạng thái lai hóa sp3 H
2. Sự lai hóa của các obitan Các kiểu lai hóa:
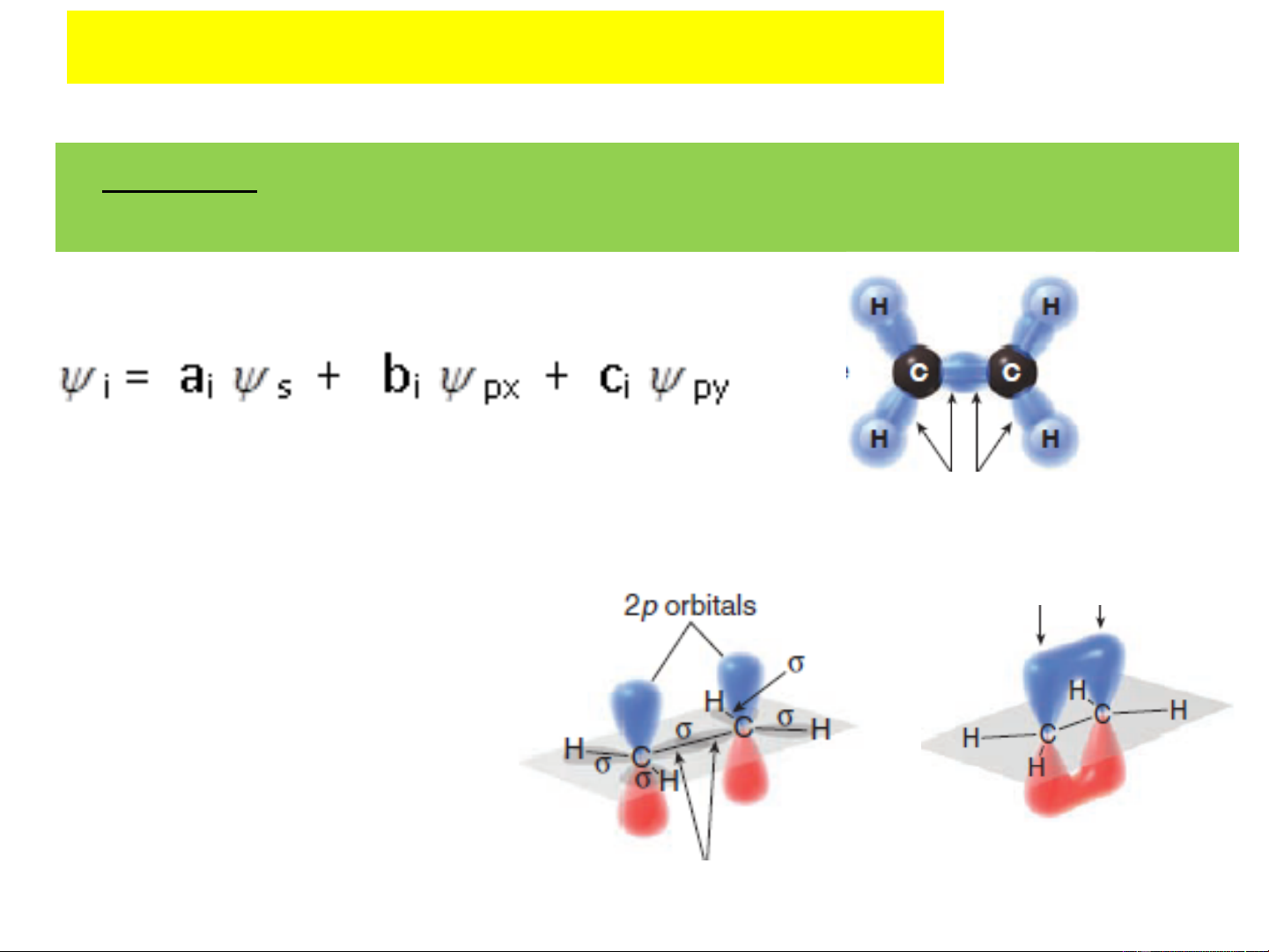
+) Lai hoá sp2 : 1 orbital s và 2 orbital p tổ hợp để tạo
thành 3 orbital lai hoá sp2 giống nhau, hướng từ tâm đến
3 đỉnh của 1 tam giác đều (lai hóa tam giác) Lai hãa 1 3 1,99 Orbital s Orbital p Orbital lai hãa sp2 120o 1 AO sp2 Lai hãa Orbital lai hãa tam gi¸c sp2 1 orbital s + 2 orbital p - Góc lai hóa: 1200
2. Sự lai hóa của các obitan Các kiểu lai hóa:
+) Lai hoá sp2 : 1 orbital s và 2 orbital p tổ hợp để tạo thành 3 orbital lai hoá sp2 giống
nhau, hướng từ tâm đến 3 đỉnh của 1 tam giác đều (lai hóa tam giác)
- Hàm sóng của các orbital lai hoá:
- Khả năng xen phủ cực đại của các Orbital lai hóa sp2
orbital lai hoá sp2 đều bằng nhau và
AO p xen phủ bên tạo liên kết π bằng 1,991. z - Ví dụ: Đây là kiểu lai hóa thường gặp ở các hợp chất không no có liên kết đôi như anken: C H
2 Orbital lai hóa sp2 của 2 nguyên tử C tạo liên kết σ 2 4
2. Sự lai hóa của các obitan Các kiểu lai hóa:
+) Lai hoá sp : 1 orbital s và 1 orbital p tổ hợp để tạo
thành 2 orbital lai hoá sp giống nhau, hướng ra 2 phía
của đường thẳng (lai hóa đường thẳng ) Lai hãa 1 3 1,93 Orbital s Orbital p Orbital lai hãa sp 180o 1 AO sp Lai hãa 1 orbital s + 1 orbital p
Orbital lai hãa ®-êng th¼ng sp - Góc lai hóa: 1800
2. Sự lai hóa của các obitan Các kiểu lai hóa:
+) Lai hoá sp : 1 orbital s và orbital p tổ hợp để tạo thành 2 orbital lai hoá sp giống
nhau, hướng ra 2 phía của đường thẳng (lai hóa đường thẳng )
- Hàm sóng của các orbital lai hoá: Orbital lai hóa sp
- Khả năng xen phủ cực đại của các
orbital lai hoá sp đều bằng nhau và bằng 1,91.
Xen phủ bên tạo 2 liên kết π - Ví dụ: Đây là kiểu lai hóa thường gặp ở các hợp chất không no có liên kết ba như ankin. C H 2 2 Chú ý:
-Tổng số orbital lai hóa bằng tổng số orbital tham gia hòa trộn.
-Hình dạng orbital lai hóa phụ thuộc vào các orbital
nguyên tử (atomic orbital, AO) tham gia lai hóa.
-Từ giá trị khả năng xen phủ cực đại ta nhận thấy:
-Độ âm điện của các orbital lai hoá sắp xếp theo thứ tự 2 3 sp sp sp
3. Các loại liên kết trong hoá hữu cơ
✓ Theo thuyết hoá trị định hướng thì liên kết tạo thành do sự
xen phủ của các orbital theo hướng tạo ra độ xen phủ cực đại.
✓ Tuỳ thuộc vào đặc điểm xen phủ của các orbital mà có các loại liên kết khác nhau:
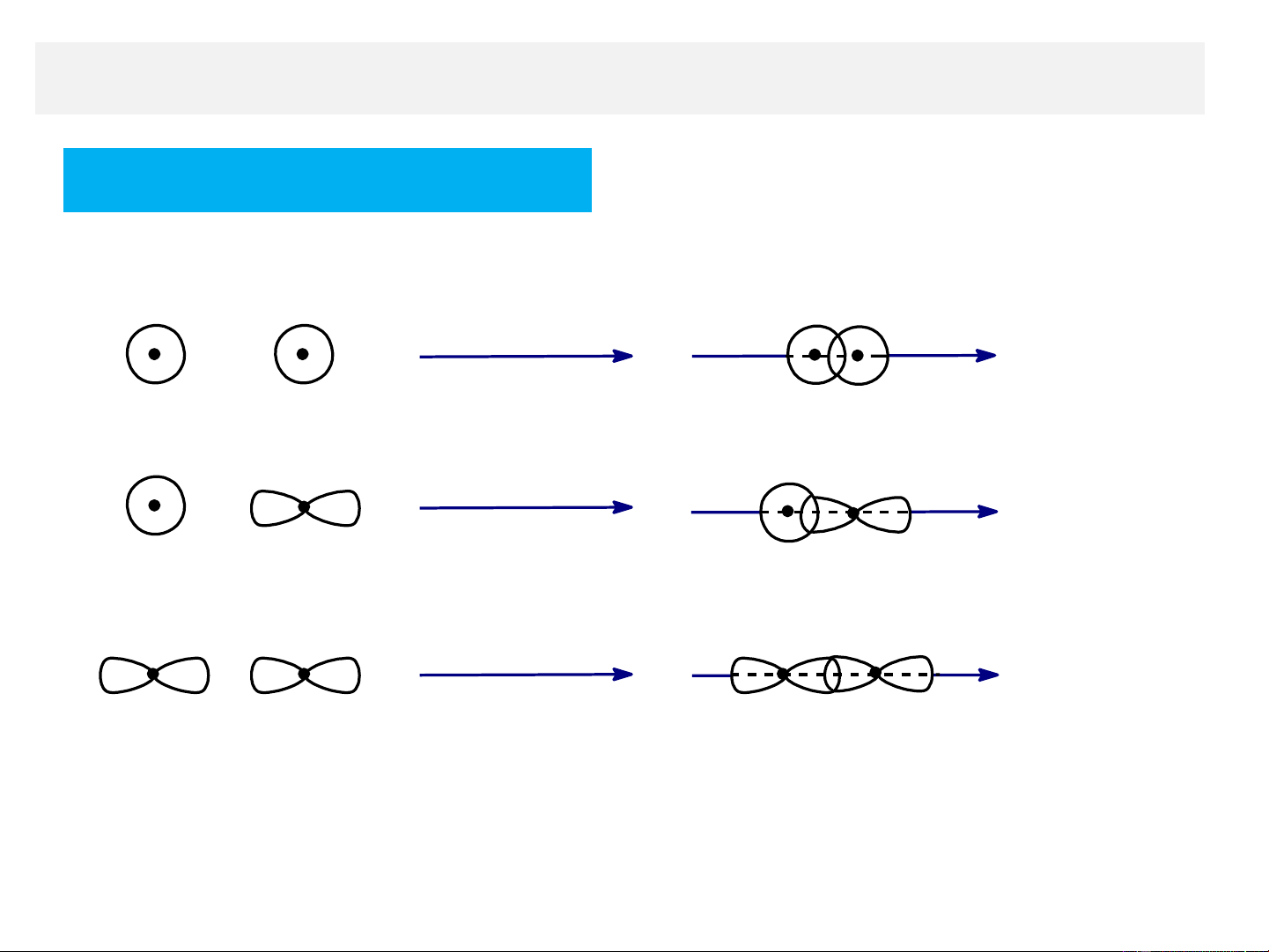
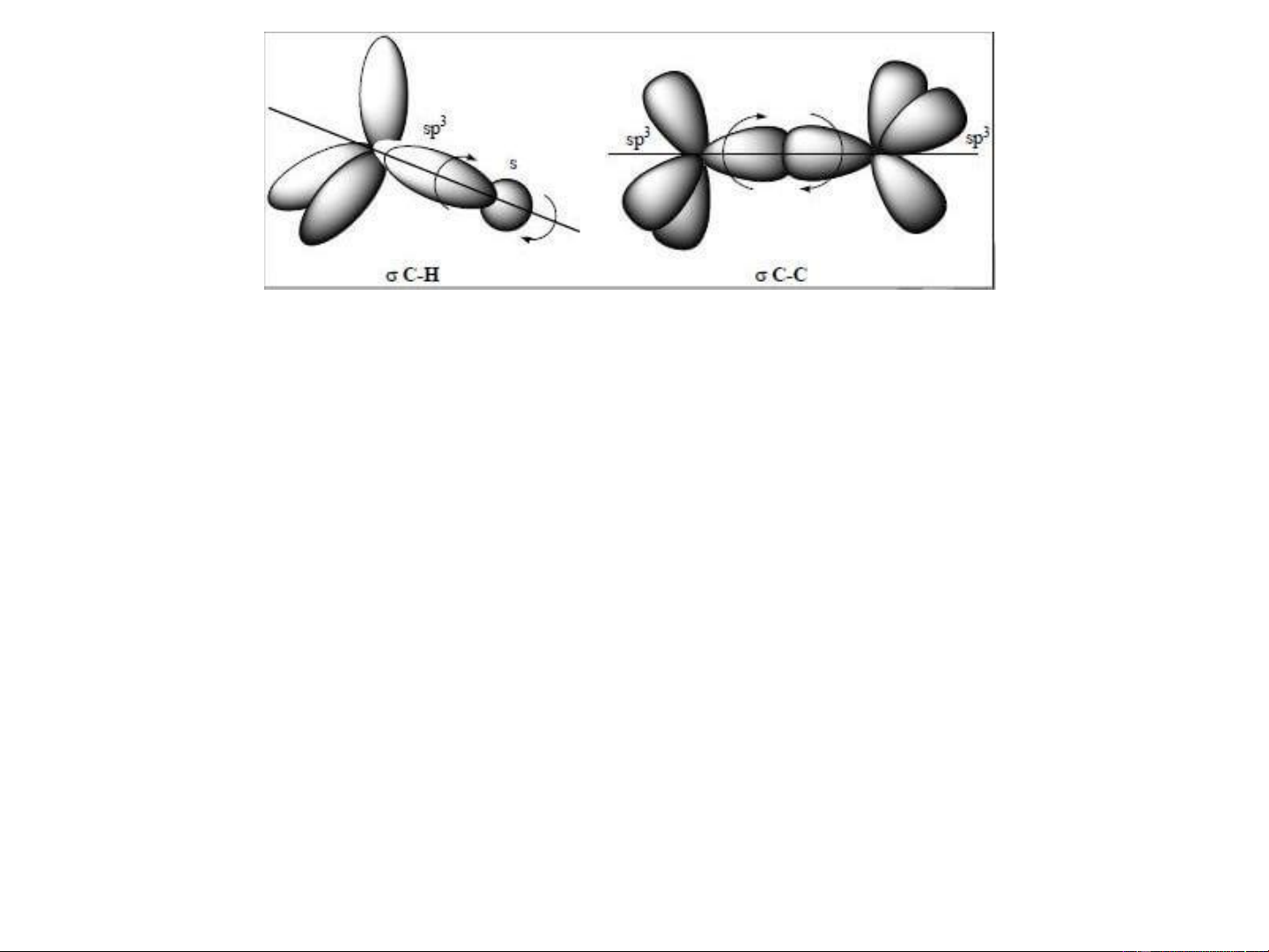
A. Liên kết σ (sigma)
- Được hình thành khi các obital nguyên tử (AO ) hoặc
orbital lai hoá tham gia liên kết xen phủ dọc theo trục liên
kết (theo trục nối giữa hai hạt nhân nguyên tử) Sự xen phủ trục
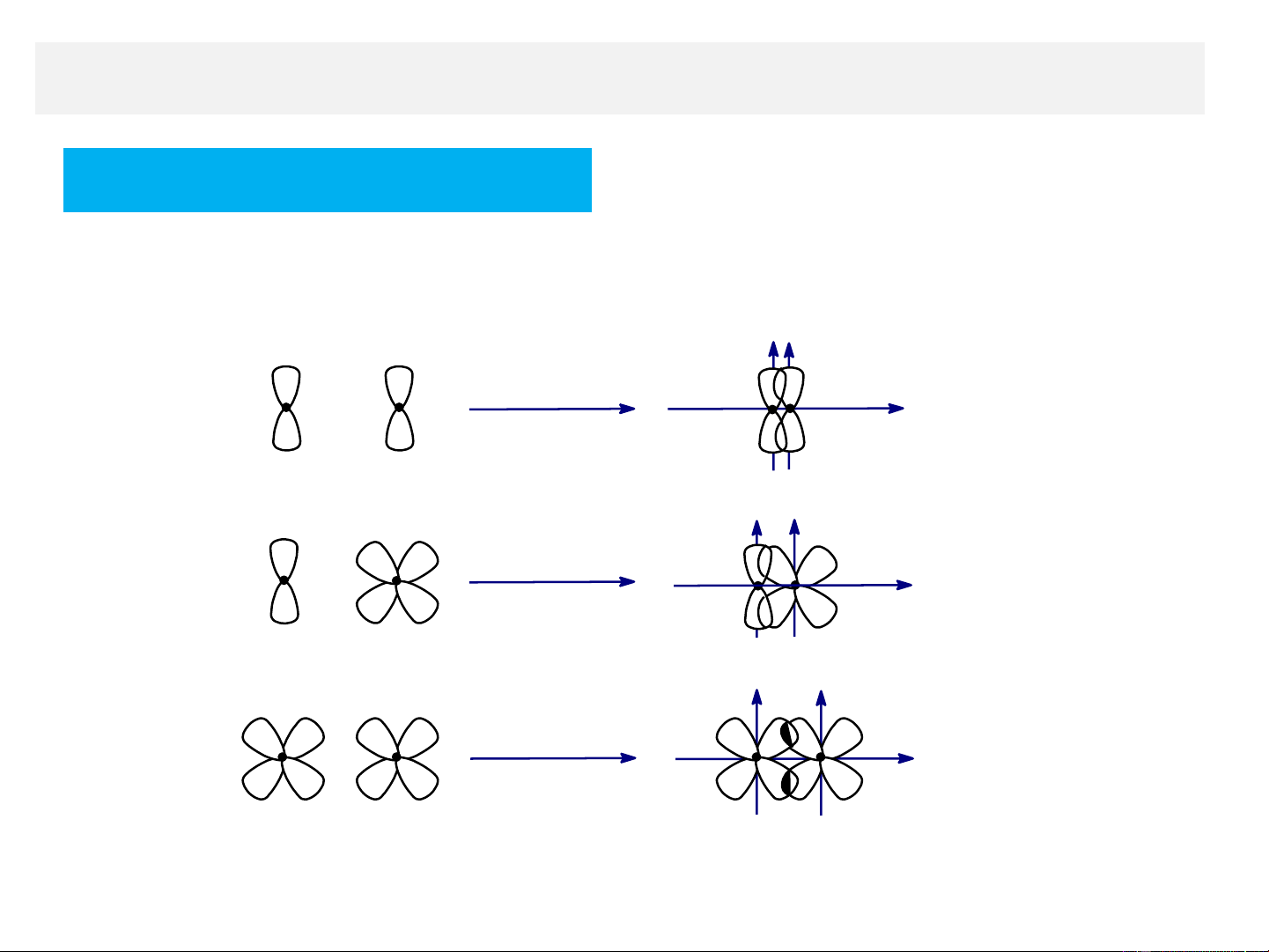
3. Các loại liên kết trong hoá hữu cơ
A. Liên kết sigma (σ)
- Được hình thành do sự xen phủ trục của các AO xen phñ trôc trôc liªn kÕt AO-s AO-s s-s xen phñ trôc trôc liªn kÕt AO-s AO-p s-p xen phñ trôc trôc liªn kÕt AO-p AO-p p-p
Về mặt lượng tử, hình chiếu của momen động lượng của liên
kết trên trục liên kết bằng 0
❖ Đặc điểm của liên kết :
- Liên kết được tạo thành do sự xen phủ trục nên rất bền vững.
- Trục của liên kết cũng là trục đối xứng.
- Các nguyên tử hoặc nhóm nguyên tử liên kết với nhau
bằng liên kết có thể quay tự do quanh trục liên kết,
không bị phá vỡ liên kết. Sự quay tự do này dẫn tới hình
thành các cấu dạng khác nhau của hợp chất hữu cơ.
3. Các loại liên kết trong hoá hữu cơ
B. Liên kết p (pi)
- Được tạo thành khi hai AO-p hoặc AO-d có trục
song song, xen phủ bên ngoài và vuông góc với trục liên kết Sự xen phủ bên.
- Về mặt lượng tử, các electron của liên kết p có hình
chiếu mô men động lượng trên trục liên kết là 1
3. Các loại liên kết trong hoá hữu cơ
A. Liên kết pi (p)
- Được hình thành do sự xen phủ bên của các AO xen phñ bªn trôc liªn kÕt AO-p AO-p pp-p trôc orbital xen phñ bªn trôc liªn kÕt AO-p AO-d pp-d trôc orbital xen phñ bªn trôc liªn kÕt AO-d AO-d d-d




