









Preview text:
HYDROCACBON THƠM (3)
(AROMATIC HYDROCARBONES)
Quy luật Thế electrophil SE ở vòng thơm
1. Các loại nhóm thế ❖ Đặt vấn đề:
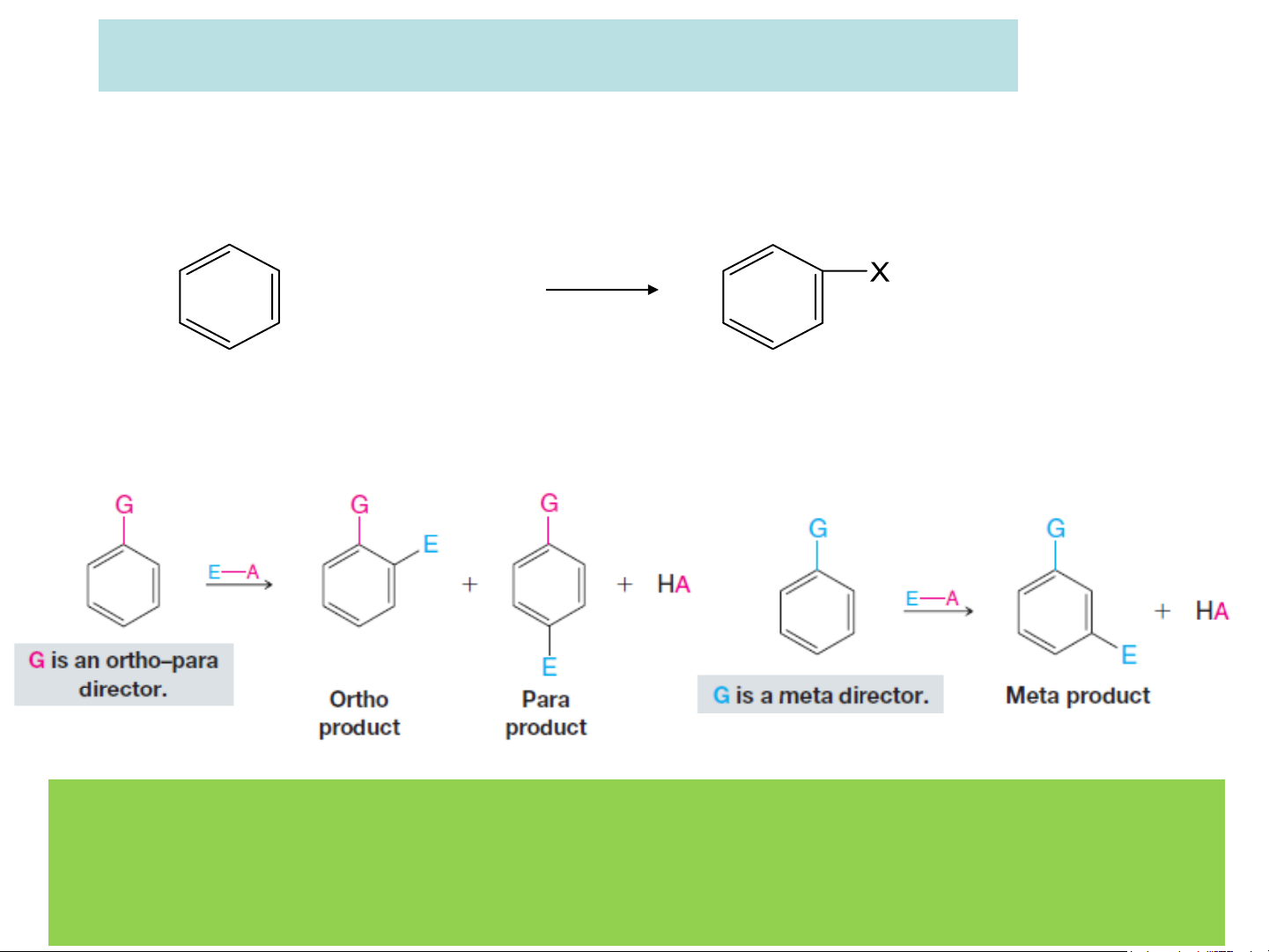
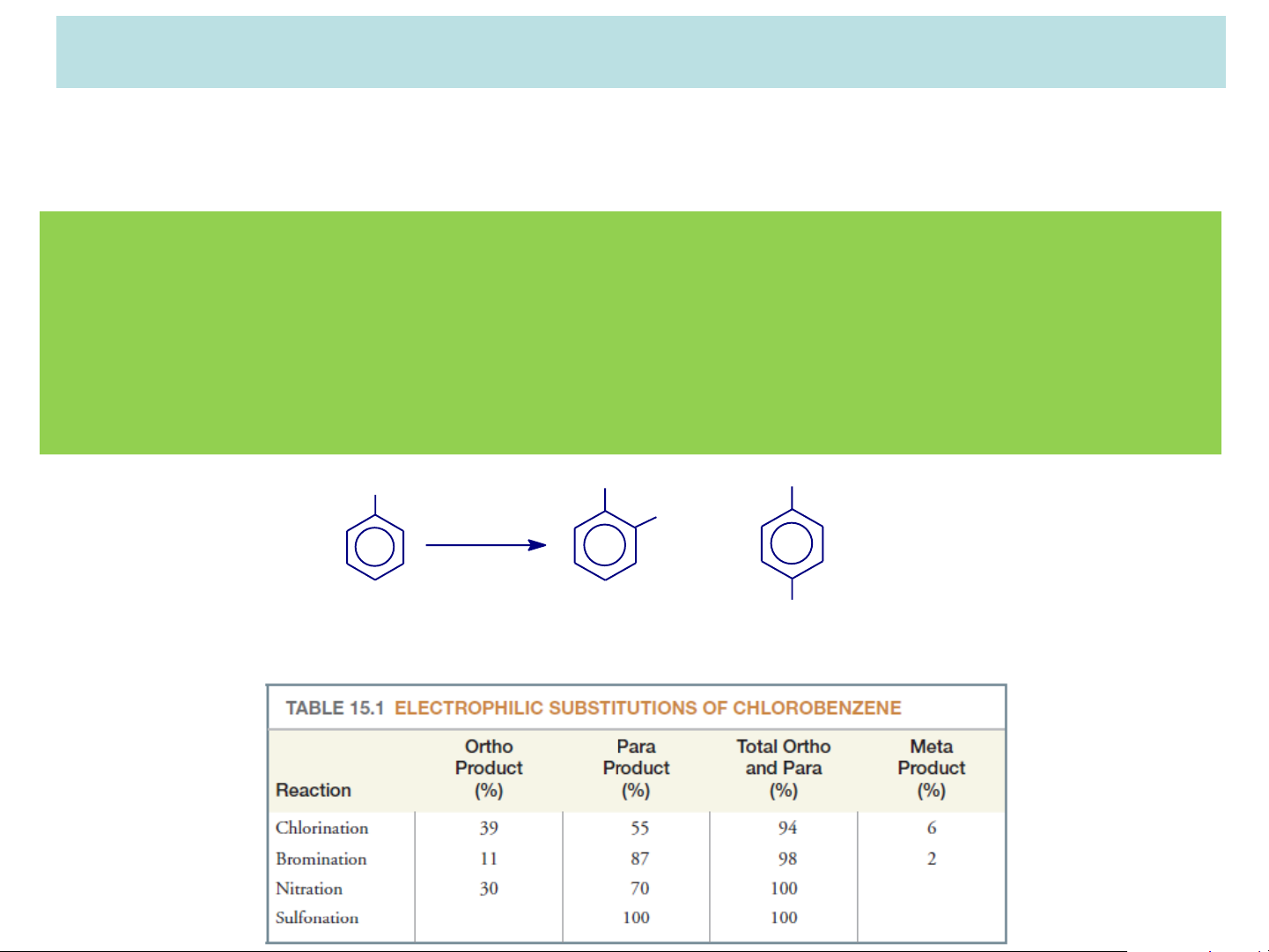
Phản ứng đặc trưng của vòng benzen là thế SE: + X+ Y- + HY
Khi trong vòng đã có 1 nhóm thế thì nhóm thế tiếp theo sẽ tấn
công vào vị trí xác định:
Phản ứng thế SE của nhóm thế thứ 2 sẽ chịu sự động của nhóm
thế thứ 1 cả về vị trí và khả năng phản ứng. Nhóm thế có sẵn
này gọi là nhóm định hướng
❖ Các loại nhóm thế:
+ Nhóm thế loại I: thường là các nhóm đẩy điện tử vào
vòng thơm, gây ra bởi các hiệu ứng dương (+I, +C, H)
hoặc có cả hiệu ứng cảm ứng âm (-I) và hiệu ứng liên hợp
dương (+C) nhưng │+C │ > │ -I │
Loại nhóm thế này có đặc trưng:
- Hoạt hóa nhân thơm (làm cho phản ứng thế xảy ra nhanh
hơn, dễ dàng hơn), trừ halogen (là nhóm thế đặc biệt).
- Định hướng tác nhân electrophil thế vào các vị trí o- và p-
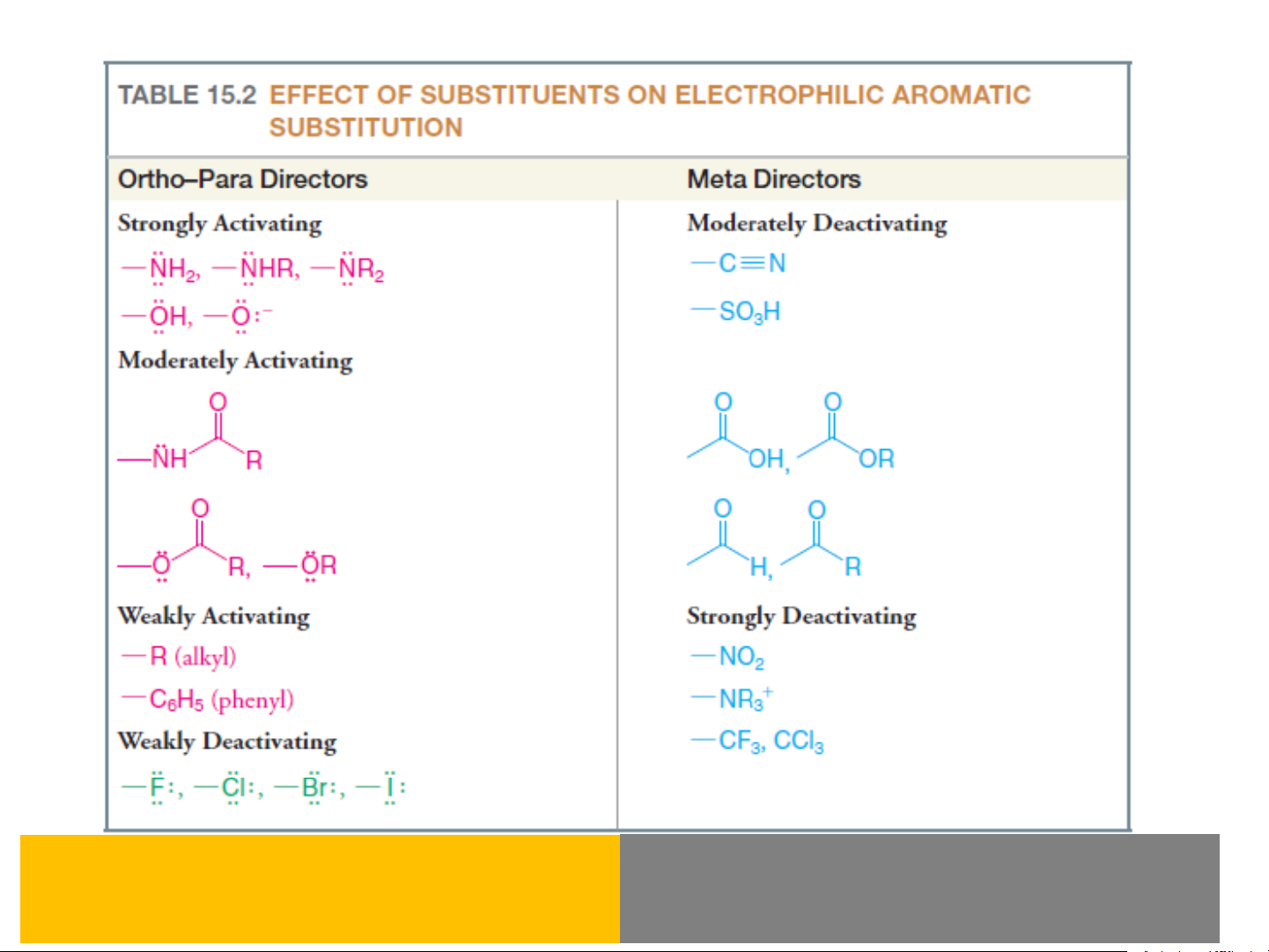
Bằng thực nghiệm người ta sắp xếp các nhóm thế loại I định hướng
vào các vị trí ortho và para như sau
O− > −NR2 > −NHR > −NH2 > −OH > −OR > −NHCOR >
> halogen (−F > −Cl > −Br > −I) > −OCOR > −R > ankenyl
❖ Các loại nhóm thế:
+ Nhóm thế loại II: thường là các nhóm hút điện tử ra
khỏi vòng thơm, gây ra bởi các hiệu ứng âm: hiệu ứng
cảm ứng âm (-I), liên hợp âm (-C) hoặc cả hai.
Loại nhóm thế này có đặc trưng:
- Phản hoạt hóa nhân thơm (làm cho phản ứng thế xảy ra khó hơn)
- Định hướng tác nhân electrophil thế vào các vị trí meta.
Bằng thực nghiệm người ta sắp xếp các nhóm thế loại II định hướng
vào các vị trí meta như sau
−NO2 > −N+R3 > −CN > −COOH > −COOR > −SO3H >
−CHO> −COR
❖ Các loại nhóm thế: + Nhóm thế loại I:
+ Nhóm thế loại II:
hoạt hóa nhân thơm, định hướng o-, p-
phản hoạt hóa, định hướng m-
2. Quy luật thế electrophil ở nhân thơm benzen ❖ Thế lần 1:
Khi trong vòng benzen chưa có nhóm thế (tức
phân tử benzen) thì khi thế SE lần 1 nhóm thế sẽ
thay thế nguyên tử H ở vị trí bất kỳ NO2 H + HNO 2SO4 ®Æc 3 + H2O 50-60oC Benzen Nitrobenzen
2. Quy luật thế electrophil ở nhân thơm benzen
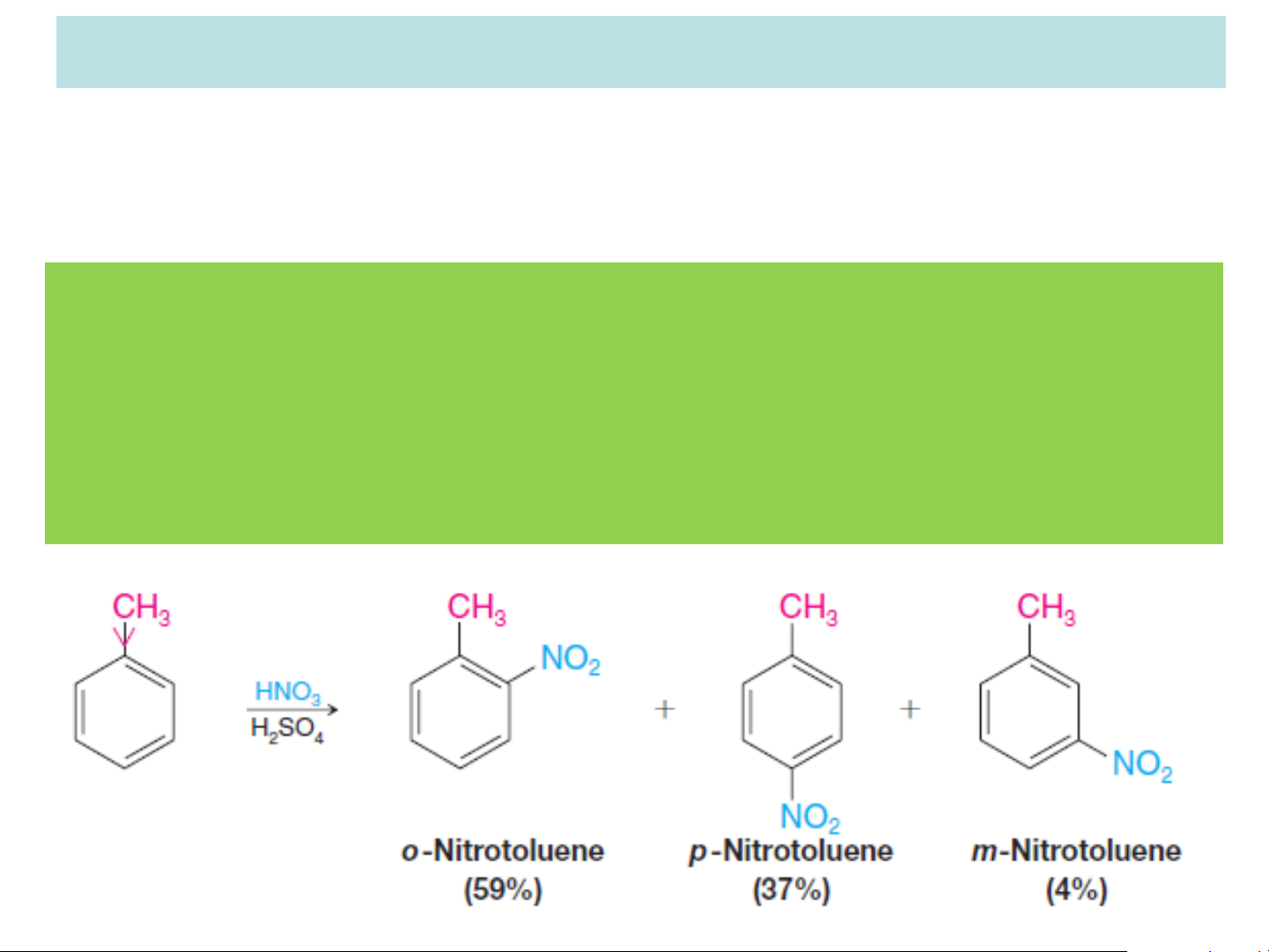
❖ Thế lần 2 (Khi trong vòng benzen có sẵn một nhóm thế):
Nếu trong vòng benzen đã có sẵn 1 nhóm thế
loại I thì nhóm thế thứ 2 ưu tiên thế vào vị trí o-
và p- so với nhóm thế đính sẵn và phản ứng thế
xảy ra dễ dàng hơn benzen. Đun nóng (t<50oC)
2. Quy luật thế electrophil ở nhân thơm benzen
❖ Thế lần 2 (Khi trong vòng benzen có sẵn một nhóm thế):
Nếu trong vòng benzen đã có sẵn 1 nhóm thế
loại II thì nhóm thế thứ 2 ưu tiên thế vào vị trí m-
so với nhóm thế đính sẵn và phản ứng thế xảy
ra chậm, khó khăn hơn benzen. 80-90oC (SPP ) (SPP) (SPC)
2. Quy luật thế electrophil ở nhân thơm benzen
❖ Thế lần 2 (Khi trong vòng benzen có sẵn một nhóm thế):
Trường hợp đặc biệt: Nếu trong vòng benzen đã có sẵn 1
nhóm thế halogen thì phản ứng thế xảy ra chậm, khó
khăn hơn benzene và nhóm thế thứ 2 ưu tiên thế vào vị
trí o- và p- so với nhóm thế đính sẵn Cl Cl Cl NO2 HNO3 + + H2O H2SO4 ®Æc NO2 Clobenzen
2-Nitroclobenzen 4-Nitroclobenzen Cl Cl Cl SO SO 3H 3 + H2SO4 SO3H Clobenzen 2-Closunfonic 4-Closunfonic
2. Quy luật thế electrophil ở nhân thơm benzen
❖ Thế lần 3 trở lên (Khi trong vòng benzen có
sẵn hai nhóm thế trở lên):
Khi trong vòng benzen đã có sẵn nhiều nhóm thế thì vị
trí của nhóm thế vào sau sẽ được quyết định bởi nhóm
thế có tác dụng định hướng mạnh hơn
Trường hợp 1: Các nhóm thế có sẵn cùng loại thì trật tự định
hướng các nhóm thế đính sẵn theo thực nghiệm (nhóm nào định
hướng mạnh hơn sẽ quyết định vị trí thế của nhóm thế vào sau)
2. Quy luật thế electrophil ở nhân thơm benzen
❖ Thế lần 3 trở lên (Khi trong vòng benzen có
sẵn hai nhóm thế trở lên):
Khi trong vòng benzen đã có sẵn nhiều nhóm thế thì vị
trí của nhóm thế vào sau sẽ được quyết định bởi nhóm
thế có tác dụng định hướng mạnh hơn
Trường hợp 2: Các nhóm thế có sẵn khác loại thì nhóm thế loại I
sẽ định hướng nhóm thế vào sau
3. Giải thích Quy luật thế electrophil
Quy luật thế electrophil vào vòng benzen được giải thích dựa trên hai yếu tố:
- Yếu tố tĩnh: lúc phân tử các chất chưa phản ứng (ở trạng thái cơ bản).
- Yếu tố động: lúc phân tử các chất phản ứng (ở trạng thái chuyển tiếp).
❖ với phản ứng thế electrophil của benzen: do benzen
cấu tạo đối xứng, 6 vị trí C như nhau nên phản ứng
thế lần 1 vào vị trí C bất kỳ.
3. Giải thích Quy luật thế electrophil
Tập trung giải thích Quy luật thế electrophil vào vòng benzen khi vòng có sẵn 1 nhóm thế.
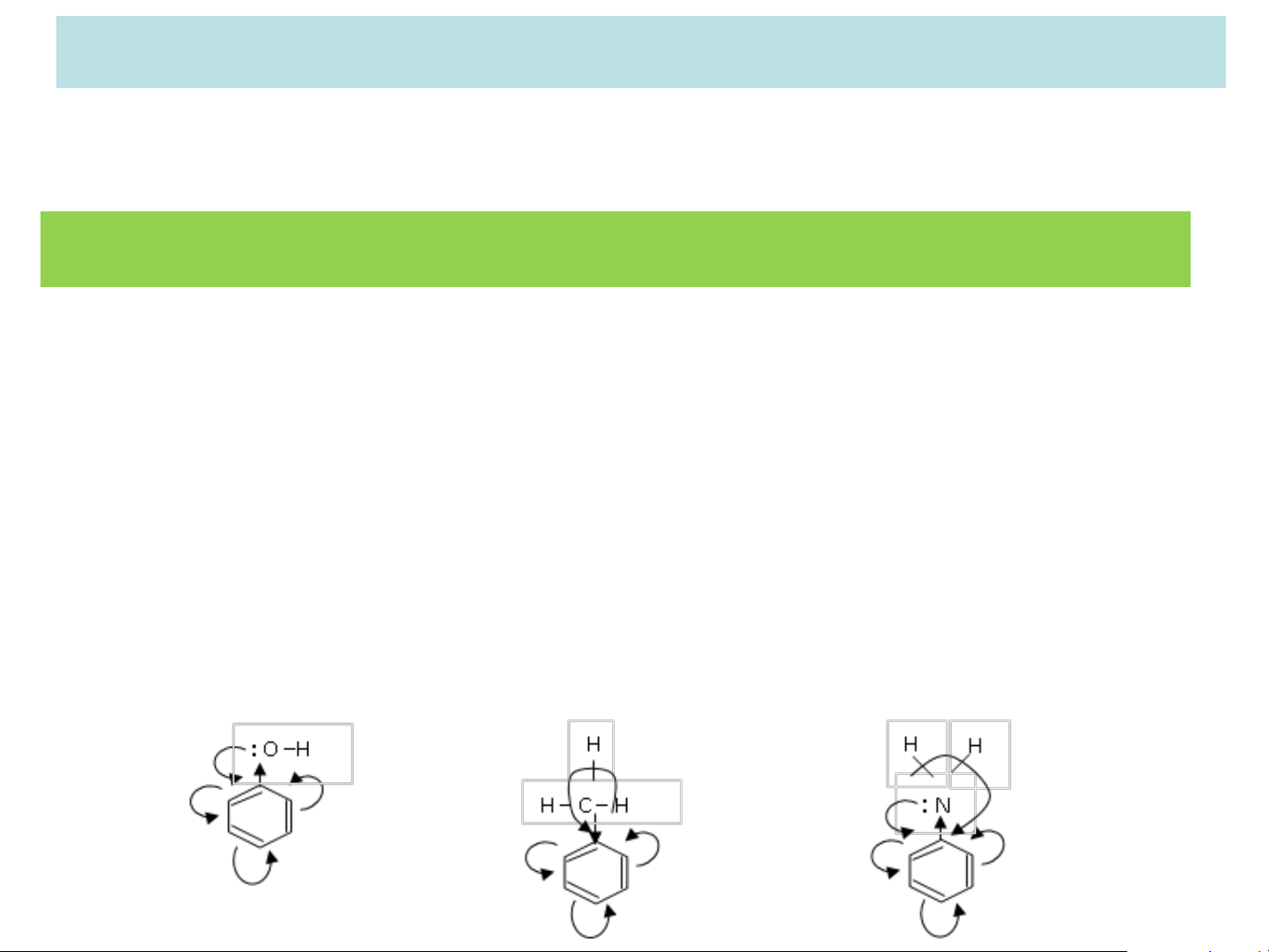
❖ Theo Yếu tố tĩnh (Xét trạng thái tĩnh):
Đối với các nhóm thế có sẵn loại I đẩy e vào vòng thơm
→ làm mật độ e trong toàn vòng tăng lên và do sự liên
hợp của hệ thống ep trong vòng benzen nên các vị trí o-,
p- có mật độ e lớn hơn vị trí m-. + C > – I + I, H H, + C > – I
3. Giải thích Quy luật thế electrophil
❖ Theo Yếu tố tĩnh (Xét trạng thái tĩnh):
Đối với các nhóm thế có sẵn loại II: Do các nhóm thế có
hiệu ứng –C, –I sẽ hút e- ra khỏi nhân thơm làm giảm mật
độ e- trong vòng benzen vị trí m– giảm ít nhất. Phản ứng thế
electrophil giảm và khi thế tác nhân thế định hướng vào vị trí meta.
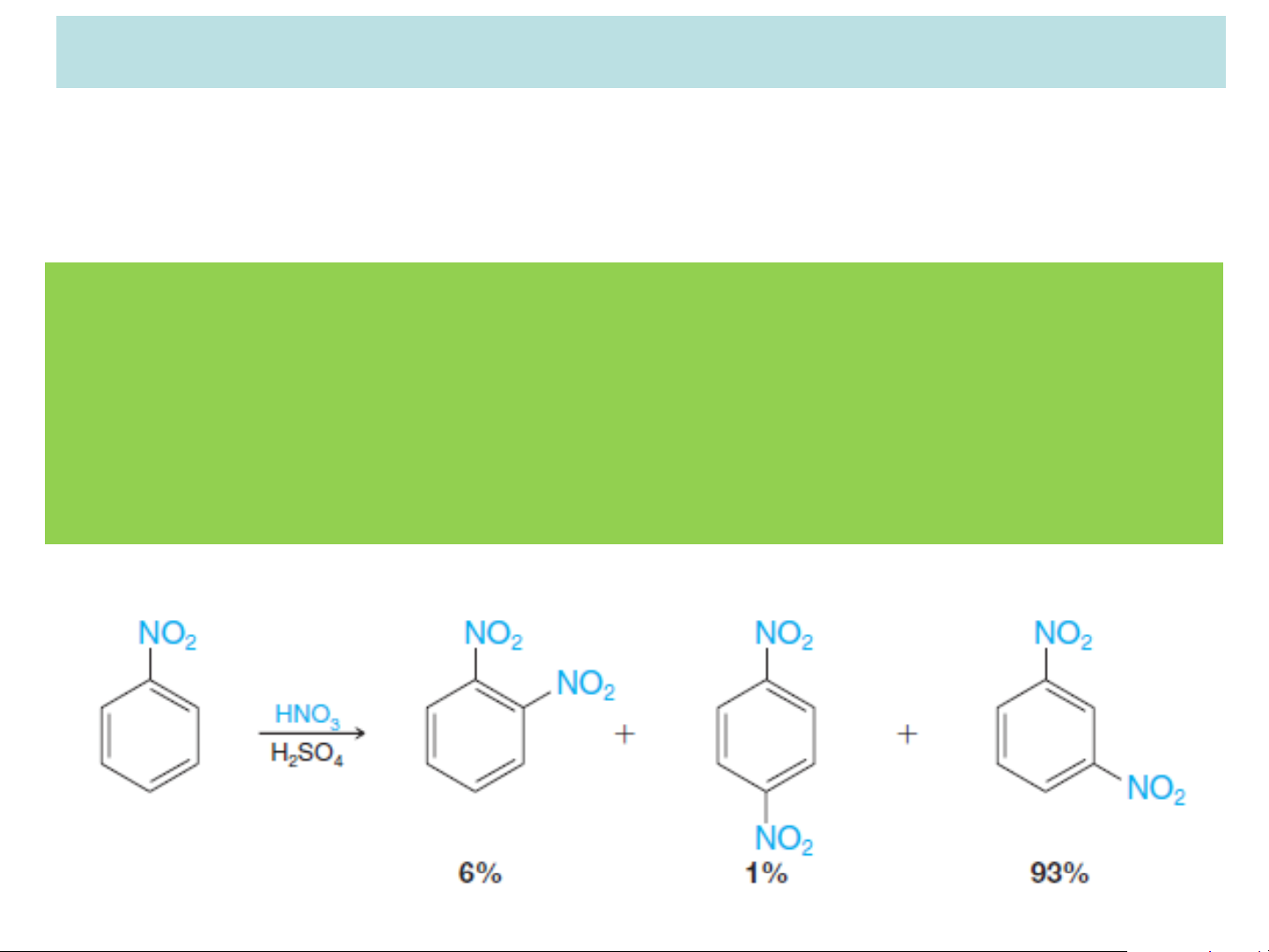
Ví dụ: nhóm NO2 có hiệu ứng – C, – I hút e ra khỏi nhân
benzene nên phản ứng của nitrobenzen khó hơn và
địnhhướng thế vào vị trí m-
3. Giải thích Quy luật thế electrophil
❖ Theo Yếu tố động (Xét trạng thái động):
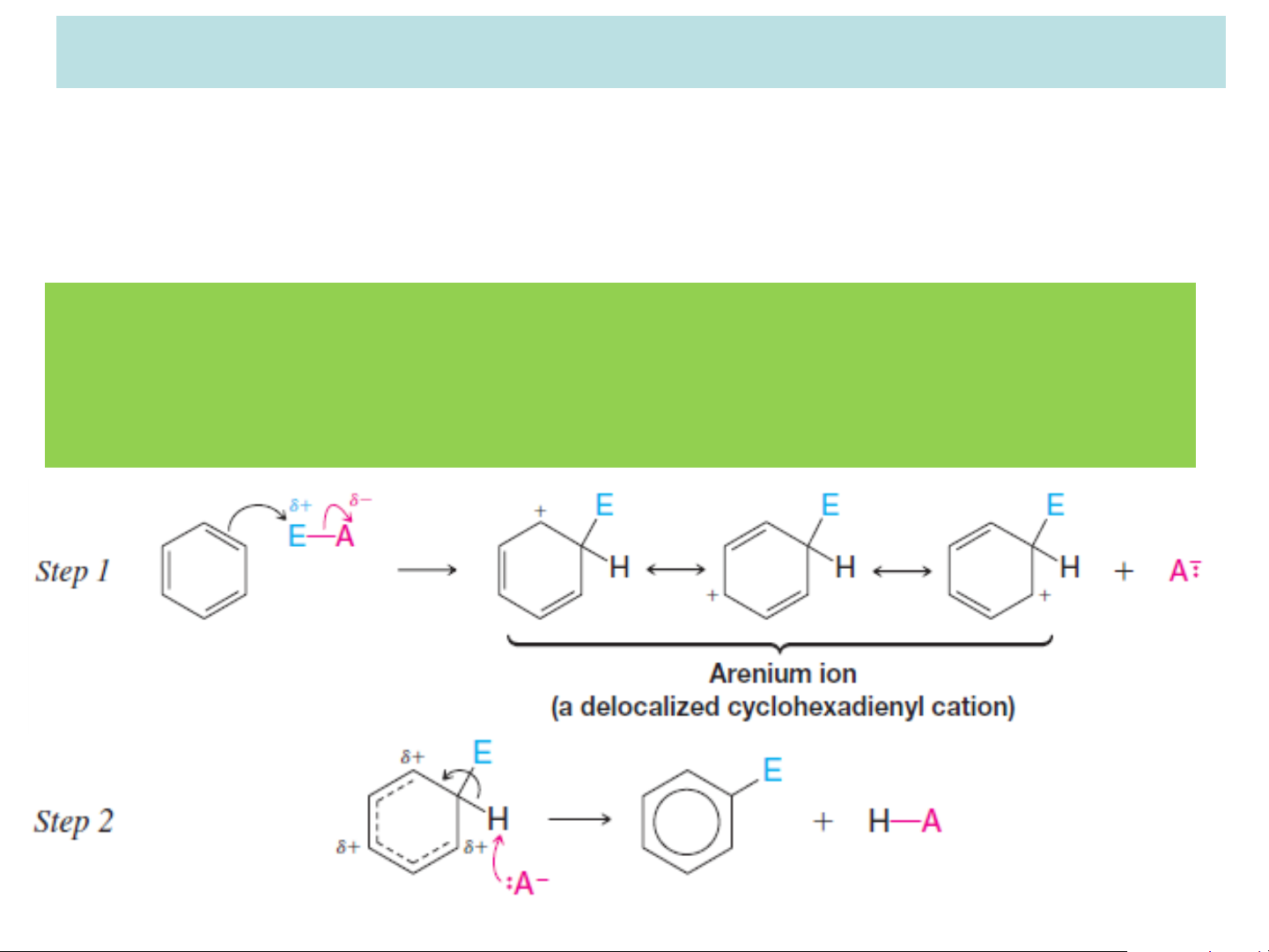
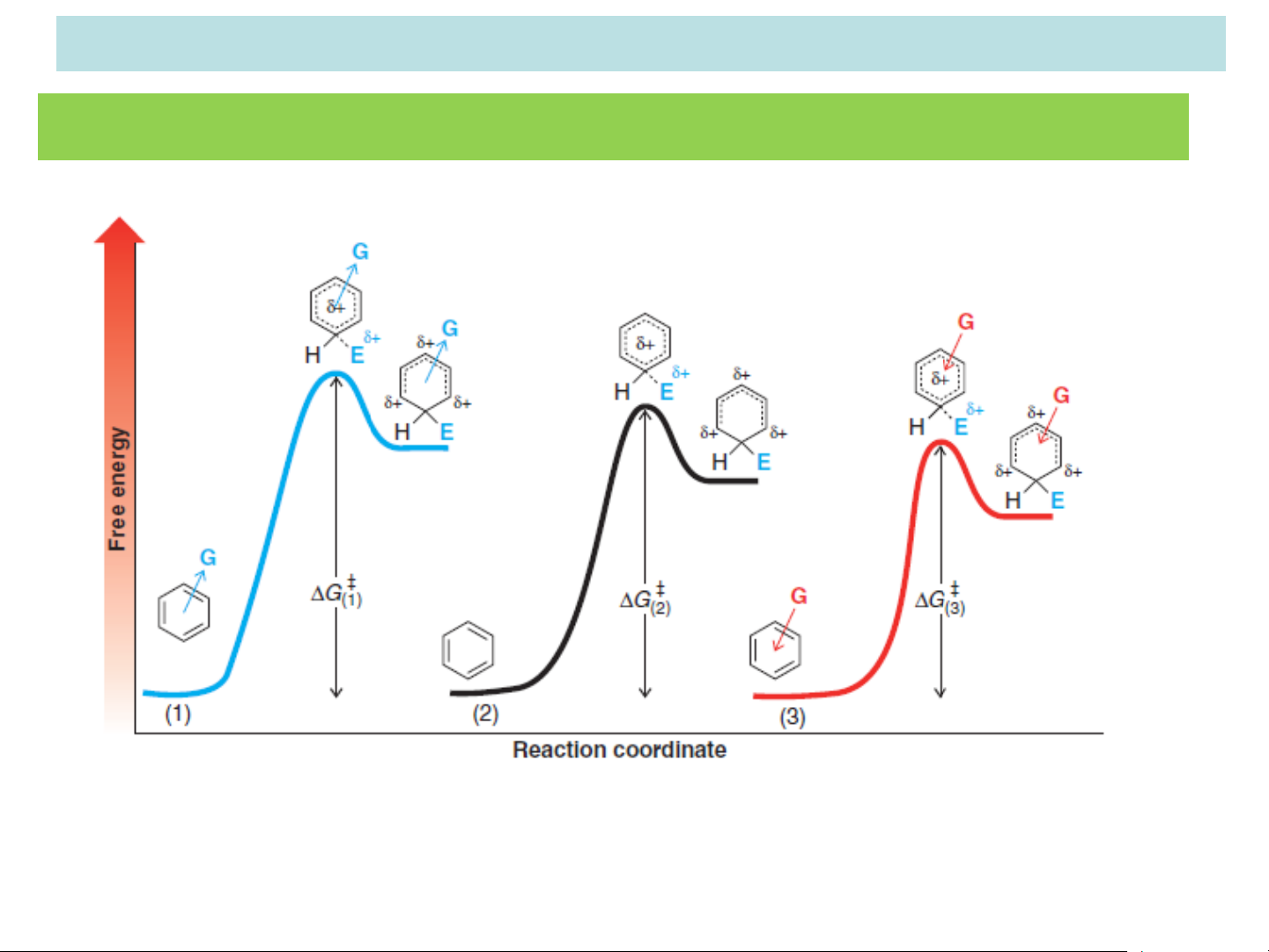
Khi phản ứng SEAr xảy ra thì tác nhân electrophil tấn công
vào vòng benzen tạo thành phức s. Phản ứng thế electrophil sẽ
ưu tiên tạo thành phức s có năng lượng thấp hơn. Do phức s
là một tiểu phân giàu năng lượng nên mức năng lượng của nó
càng thấp nếu điện tích dương được giải toả càng nhiều. Nhóm
thế có sẵn Z có vai trò gì trong việc giải toả điện tích dương trên phức s. Z H Z
Năng lượng phức sigma: ortho E E Eo Z Z Z meta + E H Em E E Z Z para Ep H E E
3. Giải thích Quy luật thế electrophil
❖ Theo Yếu tố động (Xét trạng thái động):
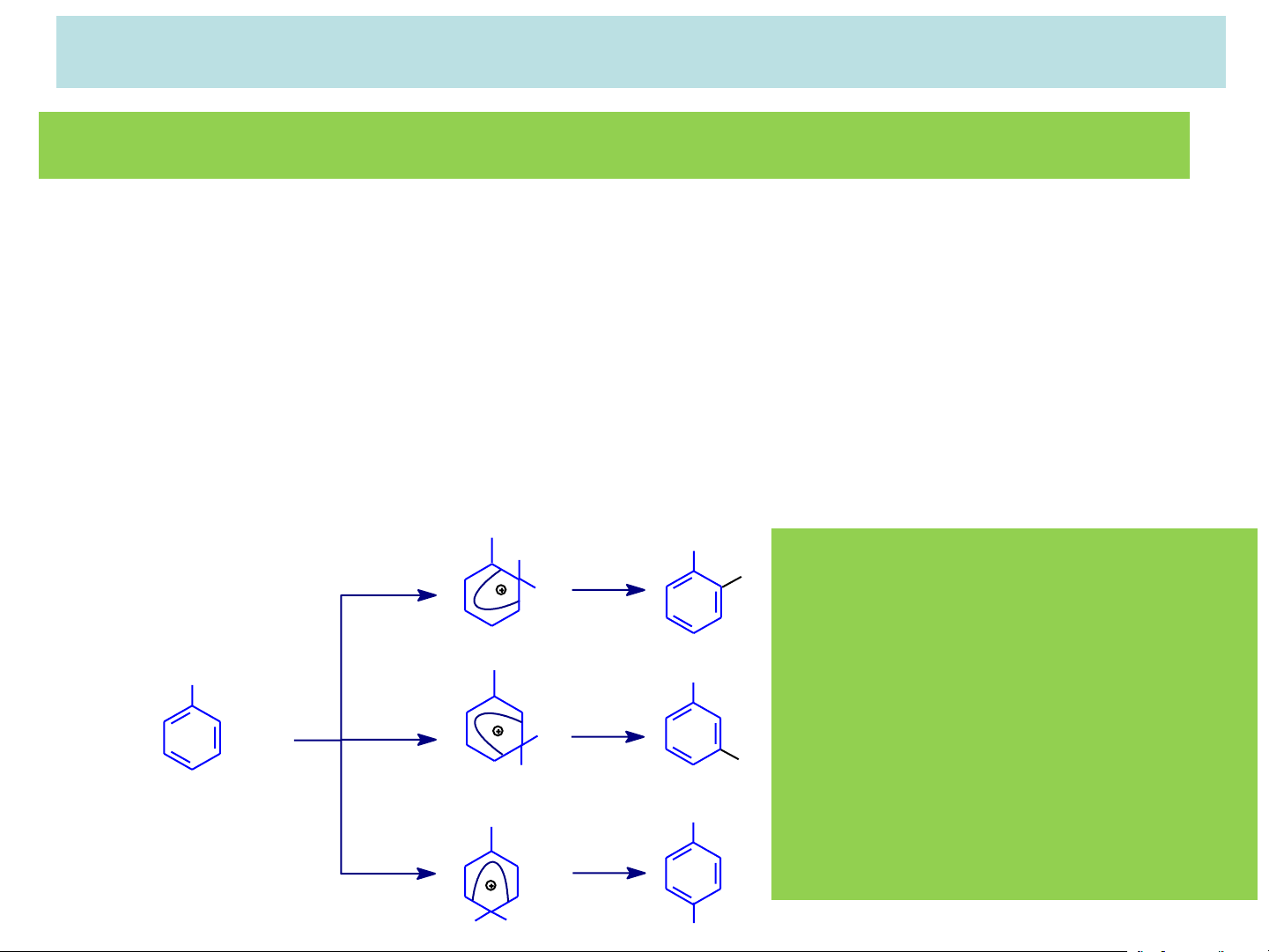
Đối với các nhóm thế có sẵn loại I, gây ra các hiệu ứng dương (+I, +C) đẩy
electron vào trong vòng benzen. Khi phản ứng SEAr xảy ra, tác nhân
electrophil E+ gắn vào vòng sẽ làm dương hóa chân nhóm thế loại I, làm giảm
điện tích dương ở phức s, đặc biệt giảm ở các phức so và sp. Do đó năng
lượng hoạt hóa của các phức so và sp thấp hơn phức sm. Z Z Z Z H + + + + E H + + + + H E + E
Nhóm thế E vào sau dễ tấn (R: nhãm thÕ lo¹i I) s s s ortho para meta
công hơn và ưu tiên đi vào = < o p m < Ebenzen
các vị trí ortho và para.
3. Giải thích Quy luật thế electrophil
❖ Theo Yếu tố động (Xét trạng thái động):
Đối với các nhóm thế có sẵn loại I, gây ra các hiệu ứng dương (+I, +C) đẩy electron
vào trong vòng benzen. Khi phản ứng SEAr xảy ra, tác nhân electrophil E+ gắn vào
vòng sẽ làm dương hóa chân nhóm thế loại I, làm giảm điện tích dương ở phức s, đặc
biệt giảm ở các phức so và sp. Do đó năng lượng hoạt hóa của các phức so và sp thấp hơn phức s Z Z m. Z Z H + + + + E H + + + + H E + E (R: nhãm thÕ lo¹i I) s s s ortho para meta = < o p m < Ebenzen
Nhóm thế E vào sau dễ tấn công hơn và ưu
tiên đi vào các vị trí
ortho và para.
3. Giải thích Quy luật thế electrophil
❖ Theo Yếu tố động (Xét trạng thái động):
Đối với các nhóm thế có sẵn loại II, gây ra các hiệu ứng âm (-I, -C) hút
electron ra khỏi vòng benzen làm giảm mật độ electron trong vòng. Khi phản
ứng SEAr xảy ra, tác nhân electrophil E+ gắn vào vòng ở vị trí ortho và para sẽ
làm làm tăng điện tích dương ở các phức so và sp. Nhóm thế loại II là các nhóm
thế tích điện dương nên ở phức so và sp sẽ có 2 trung tâm tích điện dương cạnh
nhau sẽ kém bền. Do đó năng lượng hoạt hóa của các phức so và sp cao hơn so
với phức sm. Nhóm thế E vào sau khó tấn công hơn và ưu tiên đi vào Z Z Z Z
các vị trí meta H + + + + E H + + + + H E + E
(R: nhãm thÕ lo¹i II) s s s ortho para meta = > o p m > Ebenzen
3. Giải thích Quy luật thế electrophil
❖ Theo Yếu tố động (Xét trạng thái động):
3. Giải thích Quy luật thế electrophil
❖ Theo Yếu tố động (Xét trạng thái động):
Trường hợp đặc biệt nhóm thế có sẵn là nhóm halogen: :
+ Ở trạng thái tĩnh, do hiệu ứng │-Is│>│+Cs│nên halogen là X
nhóm hút electron mạnh làm mật độ electron giảm. Do đó làm
xuất hiện điện tích dương ở tất cả các vị trí nhưng điện tích + +
dương lớn nhất là ở các vị trí ortho và para. Khi phản ứng S +
EAr xảy ra tác nhân E+ sẽ ưu tiên vào vị trí meta là vị trí điện
tích dương ít hơn. Sự thế xảy ra khó khăn hơn và halogen là (X: halogen)
nhóm thế phản hoạt hoá nhân thơm.
+ Yếu tố động: Ở trạng thái động, halogen có hiệu ứng │+Cd│>│−
Id│nên đẩy electron vào trong vòng benzen (như các nhóm thế loại I khác)
làm giảm điện tích dương ở phức s, đặc biệt là phức so và phức sp. Do
nguyên tử halogen còn các cặp e đã ghép đôi có thể nhường vào nhân thơm
(liên hợp) khi thế ở vị trí o-, p- nên mật độ điện tích dương giải tỏa rộng
hơn và năng lượng hoạt hóa của các phức so và sp nhỏ hơn sm. Khi phản
ứng SEAr xảy ra tác nhân E+ sẽ ưu tiên vào vị trí ortho và para và xảy ra khó hơn benzen.




