












Preview text:
Tính axit - bazơ
của hợp chất hữu cơ
1. Thuyết axit - bazơ của Bronsted
2. Thuyết axit - bazơ của Lewis 1
1. Thuyết axit - bazơ của Bronsted
Theo thuyết điện ly cổ điển của Ahrenius thì axit là
những chất cho proton H+, còn bazơ là những chất cho ion hydroxyl OH-.
- Khái niệm về axit-bazơ bị hạn chế vì chỉ giải thích
được các phản ứng tiến hành trong môi trường nước.
- Có nhiều axit, bazơ khác nhau không cho các ion H+ và OH-
Vì vậy, người ta đã mở rộng để có khái niệm tổng quát hơn về axit - bazơ.
Thuyết axit - bazơ của Bronsted và Lowry:
- Axit là các chất có khả năng cho proton H+
- Bazơ là các chất có khả năng nhận proton H+
Thuyết axit - bazơ của Bronsted và Lowry:
- Axit là các chất có khả năng cho proton H+
- Bazơ là các chất có khả năng nhận proton H+ HA H+ + A- 1 B + H+ BH+ 2 axit bazơ Bazơ axit
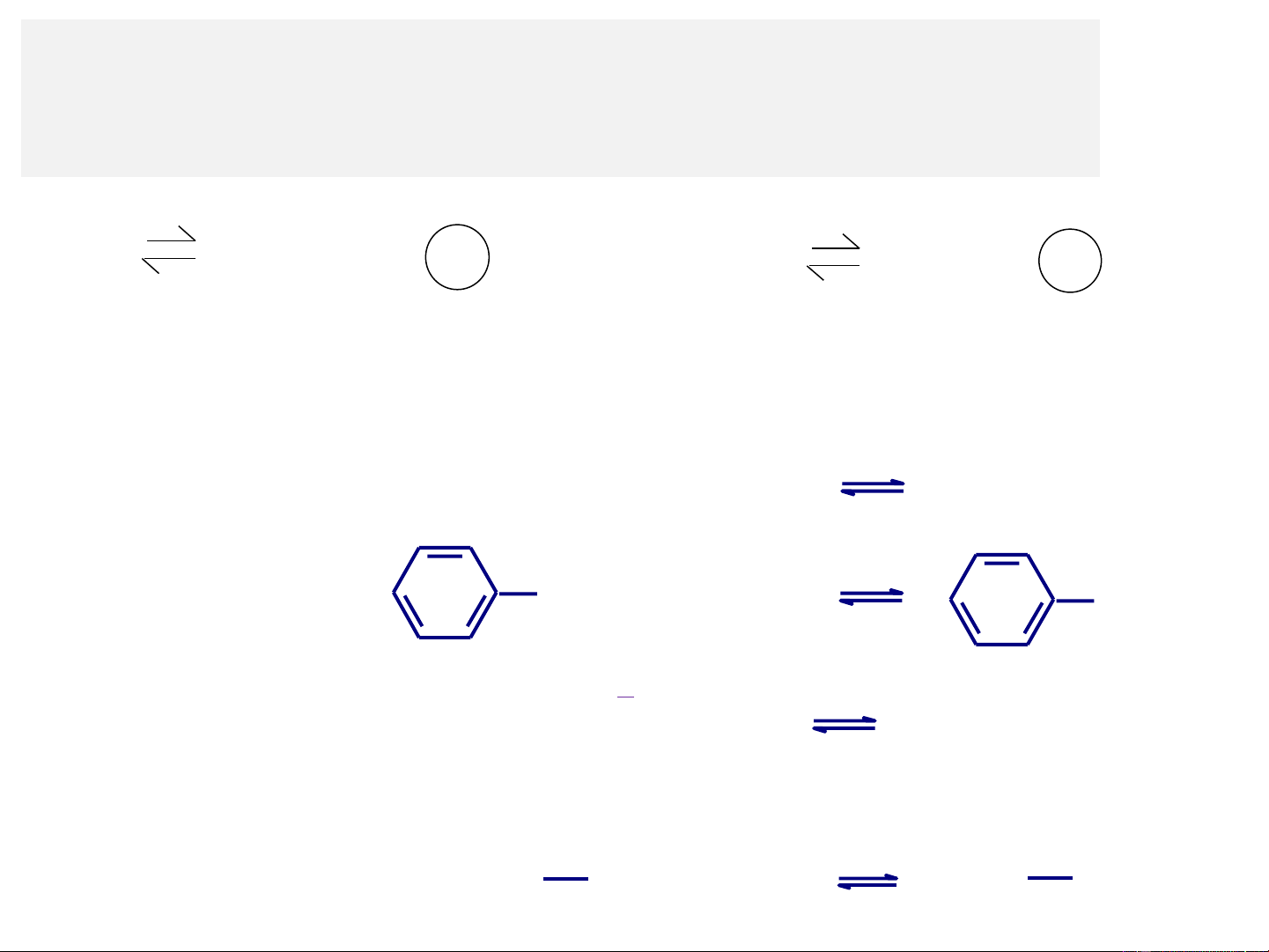
Theo Brönsted, axit gồm 3 loại: - Phân tử trung hòa: H − 2SO4 H+ + HSO4 CH3COOH H+ + CH3COO− - Anion: HCO − 2− 3 H+ + CO3 HCO − 2− HOOC- 3 COO H+ + CO3 OOC-COO CH3 CH3 + CH3 NH H+ + N CH3 - Cation: CH3 CH3
Thuyết axit - bazơ của Bronsted và Lowry:
- Axit là các chất có khả năng cho proton H+
- Bazơ là các chất có khả năng nhận proton H+ HA H+ + A- 1 B + H+ BH+ 2 axit bazơ Bazơ axit
Theo Brönsted, bazơ cũng gồm 3 loại: + - Phân tử trung hòa: NH3 H+ + NH4 + NH2 H+ + NH3 + - Anion: HOOC- NH3 COO H+ + NH4 HOOC-COOH + + + - Cation: NH2 NH3 H+ + NH3 NH3
Phản ứng giữa axit và bazơ thực chất là một quá
trình thuận nghịch nên axit sau khi cho proton sẽ trở
thành một bazơ gọi là bazơ liên hợp. Ngược lại, mỗi
một bazơ sau khi kết hợp với proton sẽ trở thành axit liên hợp. Axit I + Baz¬ II Baz¬ I + Axit II RCOOH RCOO- + H+ H+ + R N R NH+ 3 3 axit bazơ liên hợp bazơ axit liên hợp
Một chất có tính axit càng mạnh bao nhiêu thì
bazơ liên hợp của nó càng yếu bấy nhiêu và ngược lại. C H O- +H+ C H OH 2 5 2 5 ion etylat
axit liên hợp rất yếu (bazơ rất mạnh)
K = 10-8 (yếu hơn H O) a 2
+) Một chất có thể là axit hay bazơ còn tuỳ theo chất đứng cạnh nó.
VD: CH COOH là 1 axit trong môi trường nước 3
CH COOH + H O CH COO- + H O+ 3 2 3 3
và là 1 bazơ trong H SO đặc 2 4 + CH + H CH − + 3COOH 2SO4 3 C OH HSO4 OH Baz¬ Axit Axit liªn hîp Baz¬ liªn hîp
❖ Hằng số cân bằng axit k và bazơ k và sự liên quan a b giữa chúng
- Cân bằng axit-bazơ luôn chuyển dịch về phía tạo thành axit
yếu hơn và bazơ yếu hơn.
- Đặc trưng cho độ mạnh của axit là hằng số cân bằng axit
k và của bazơ là hằng số cân bằng bazơ k . a b
❖ Hằng số cân bằng axit k và bazơ k và sự liên quan giữa chúng a b
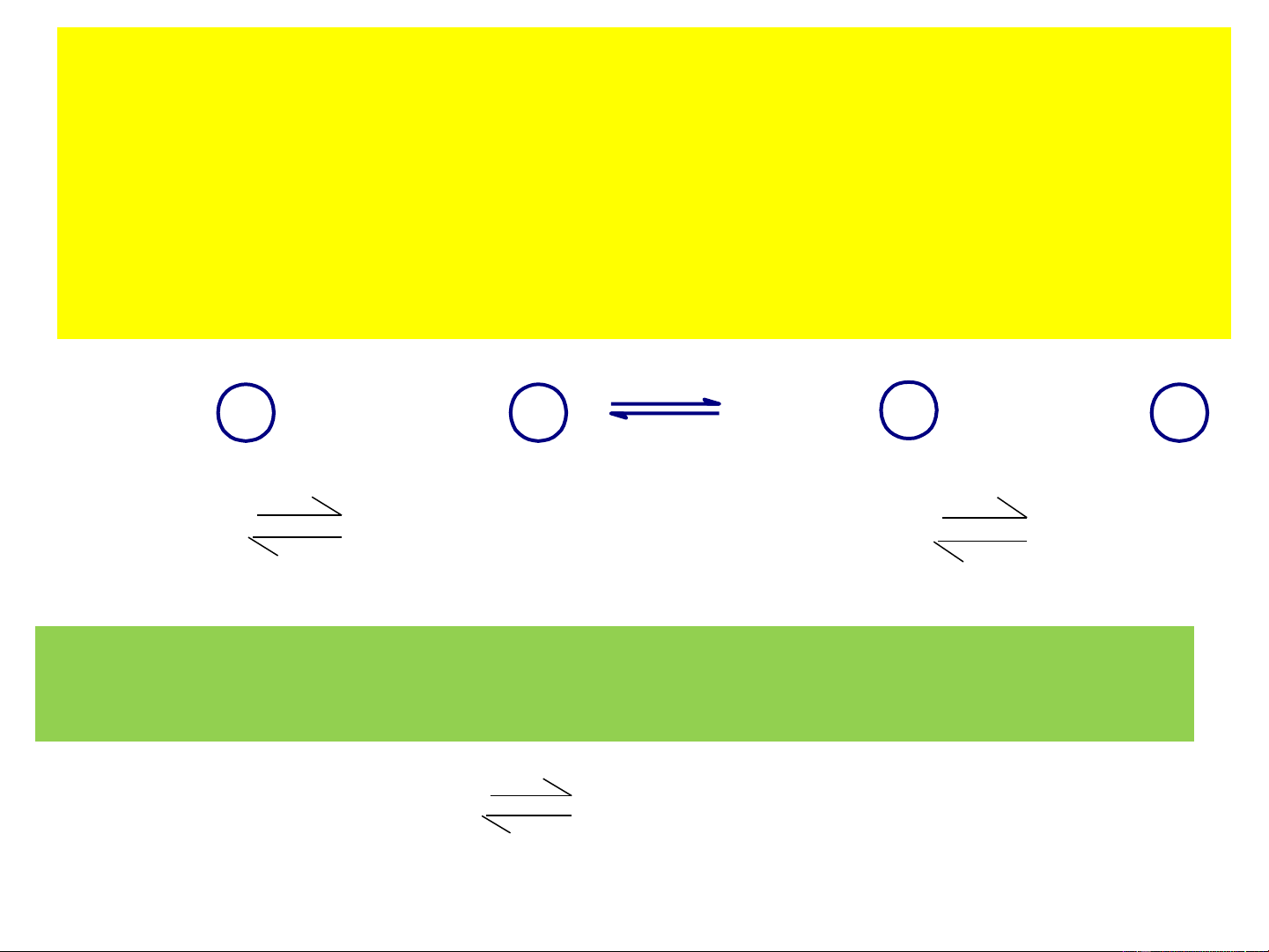
H O là 1 chất lưỡng tính, vừa đóng vai trò axit vừa 2 đóng vai trò bazơ. H2O + H2O H3O+ + OH− (1) Baz¬ Axit Axit liªn hîp Baz¬ liªn hîp + − [H O ][OH ]
Ở 25oC, nồng độ của nước 2 K = cb 2 = 1,8.10-16 [H O] [H O] = 55,5 mol/l. 2 2
Kw = [H O+] [OH-] = 1,8.10-16 x 55,5 = 10-14 3
Xét một cặp axit-bazơ liên hợp: axit HA/bazơ liên hợp A- [H O+ ].[A− ] HA + H 3 = 2O H k 3O+ + A− a [ ] HA Với dung dịch loãng [ − OH ].[ ] HA thì [H O] = const 2 A− + H k = 2O HA + OH− b [ − A ] Đặt pk = - lgk a a pk = - lgk b b
❖ Hằng số cân bằng axit k và bazơ k và sự liên quan giữa chúng a b
Sự liên quan giữa k , k và pK , pK a b a b
k .k = [H O+] [OH-] = Kw = 10-14 a b 3 pk pk = 14 = const a + b
Tóm lại:
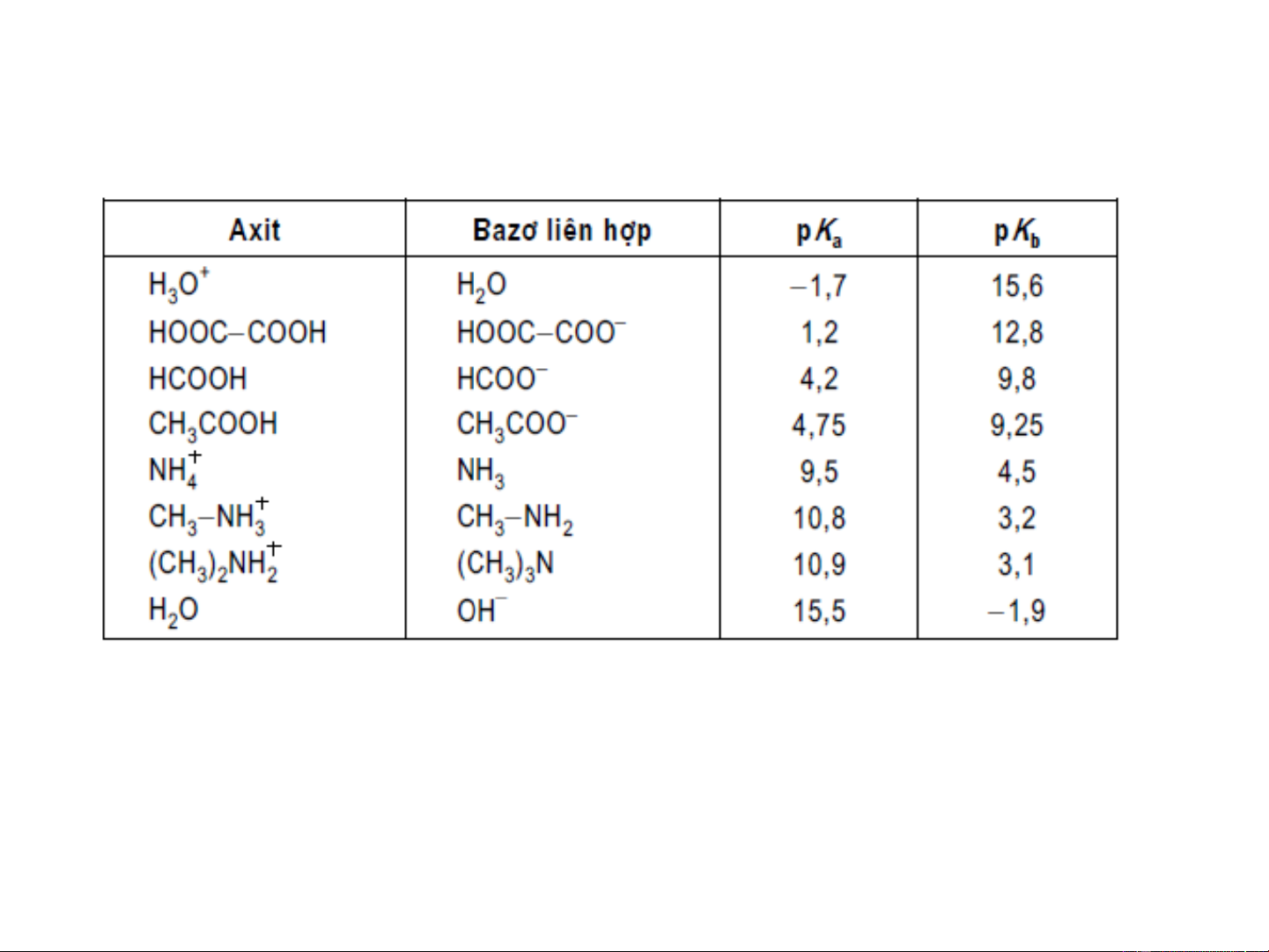
-Nếu pk của một chất càng nhỏ thì tính axit của nó càng a
mạnh và ngược lại
-Nếu pk của một chất càng nhỏ thì tính bazơ của nó càng b
mạnh và ngược lại
-Tích hằng số k .k của một cặp axit-bazơ liên hợp luôn a b
bằng 10-14. Do đó, axit càng mạnh thì bazơ liên hợp của nó
càng yếu và ngược lại.
Giá trị pK , pK của một số axit-bazo liên hợp (ở 20oC) a b 9
❖ Vai trò của dung môi trong các phản ứng hữu cơ
+) Ngoài cấu tạo của axit và bazơ, nhiệt độ thì các giá trị
K , K còn phụ thuộc vào bản chất dung môi. Đa số các phản a b
ứng hữu cơ được thực hiện trong một dung môi nào đó nên
dung môi đóng vai trò quan trọng đối với phản ứng hữu cơ
- Vai trò vật lý kép: Tạo môi trường đồng thể cho các tác
nhân phản ứng tiếp xúc mật thiết với nhau. Tạo điều kiện để
đo vận tốc phản ứng căn cứ vào nồng độ của chất tan.
- Vai trò hóa học: rất rõ rệt, hiếm khi dung môi trơ phản ứng
mà thường tham gia vào quá trình phản ứng.
+) Người ta phân biệt các loại dung môi trong hóa hữu cơ như sau:
- Dung môi không phân cực (dung môi trơ - dung môi
aproton) là những dung môi trơ về mặt hóa học, không có khả
năng cho hoặc nhận proton cũng như khả năng ion hóa: C H , 6 6 cyclohexan,…
- Dung môi lưỡng tính (dung môi amphiproton) là các dung
môi có thể đóng vai trò của 1 axit hoặc của 1 bazơ: H O, etylic 2 …
- Dung môi bazơ (dung môi protophyl) là những dung môi có
khả năng nhận proton mạnh: NH , amin, Pyridin … 3
- Dung môi axit (dung môi protogen) là những dung môi có
khả năng dễ nhường proton: HCOOH khan, H SO đặc,... 2 4
Giá trị các hằng số cân bằng axit k và bazơ k không a b
những phụ thuộc vào cấu tạo của axit, bazơ, nhiệt độ mà
còn phụ thuộc rất nhiều vào bản chất của dung môi, hằng
số điện môi của dung môi . Chẳng hạn như cùng một chất
nhưng trong các dung môi khác nhau sẽ đóng vai trò
khác nhau và sự phụ thuộc này là do ái lực của dung môi với proton khác nhau.
Ví dụ: Nếu ký hiệu dung môi là chữ S, ta có phương trình
phản ứng của 1 axit với 1 dung môi S: HA + S HS+ + A-
Nếu dung môi có tính bazơ càng mạnh → cân bằng chuyển sang phải càng mạnh.
Vậy các axit hữu cơ đều là axit yếu trong H O nhưng trong 2
NH lỏng (dung môi bazơ) thì sẽ trở thành các axit mạnh và ion 3 hóa gần như hoàn toàn
2. Thuyết axit - bazơ của Lewis
Lewis đã đưa ra khái niệm tổng quát hơn về axit và bazơ
dựa vào cấu tạo electron của chúng.
-Axit là những chất có khả năng nhận cặp e- chưa chia
(tự do) của bazơ để tạo nên liên kết cộng hóa trị.
-Bazơ là những chất có cặp e- chưa chia.
Theo khái niệm của này, các axit -bazơ Lewis có thể là:
các phân tử trung hòa, anion, cation như Bronsted.
Ngoài ra, nó còn mở rộng hơn chủ yếu là axit.
2. Thuyết axit - bazơ của Lewis
Theo Lewis, Axit còn có thể là:
+ Những chất trong phân tử có nguyên tử có lớp electron
ngoài cùng chưa đầy đủ (số electron < 8), còn chứa các orbital trống.
Trường hợp này tính axit tăng khi:
- điện tích của hạt nhân nguyên tử trung tâm tăng (áp dụng cho các nguyên tố cùng nhóm).
- độ âm điện của các nguyên tử liên kết với nguyên tử trung tâm tăng.
- bán kính nguyên tử trung tâm giảm.
- số lớp electron xung quanh nguyên tử trung tâm giảm.
2. Thuyết axit - bazơ của Lewis
Theo Lewis, Axit còn có thể là:
+ Cation: Li+, H+, Al3+, Na+, Fe2+, NO +…. 2
Tính axit của các cation tăng CH3 + CH3 khi: Li+ + :O Li O
- Điện tích dương của cation H H tăng: Fe2+ < Fe3+ Ion liti Metanol
- Điện tích hạt nhân của cation Axit Baz¬ tăng: Li+ < Be2+ < B3+
- Bán kính ion giảm: K+ < Na+ H+ + NH + 3 NH4 < Li+ Proton Amoniac
- Số lớp electron của cation Axit Baz¬ giảm.
+ Các nguyên tử trung hoà có 6 electron ở lớp ngoài cùng: O , S,… 2 1 R O 3N + 2 R 2 3N O Baz¬ Axit
2. Thuyết axit - bazơ của Lewis
Theo Lewis, Axit còn có thể là:
+ Các chất trong phân tử có chứa nguyên tử trung tâm
có lớp vỏ ngoài cùng bão hoà electron, nhưng khi tác
dụng với bazơ có thể mở rộng lớp electron do có orbital
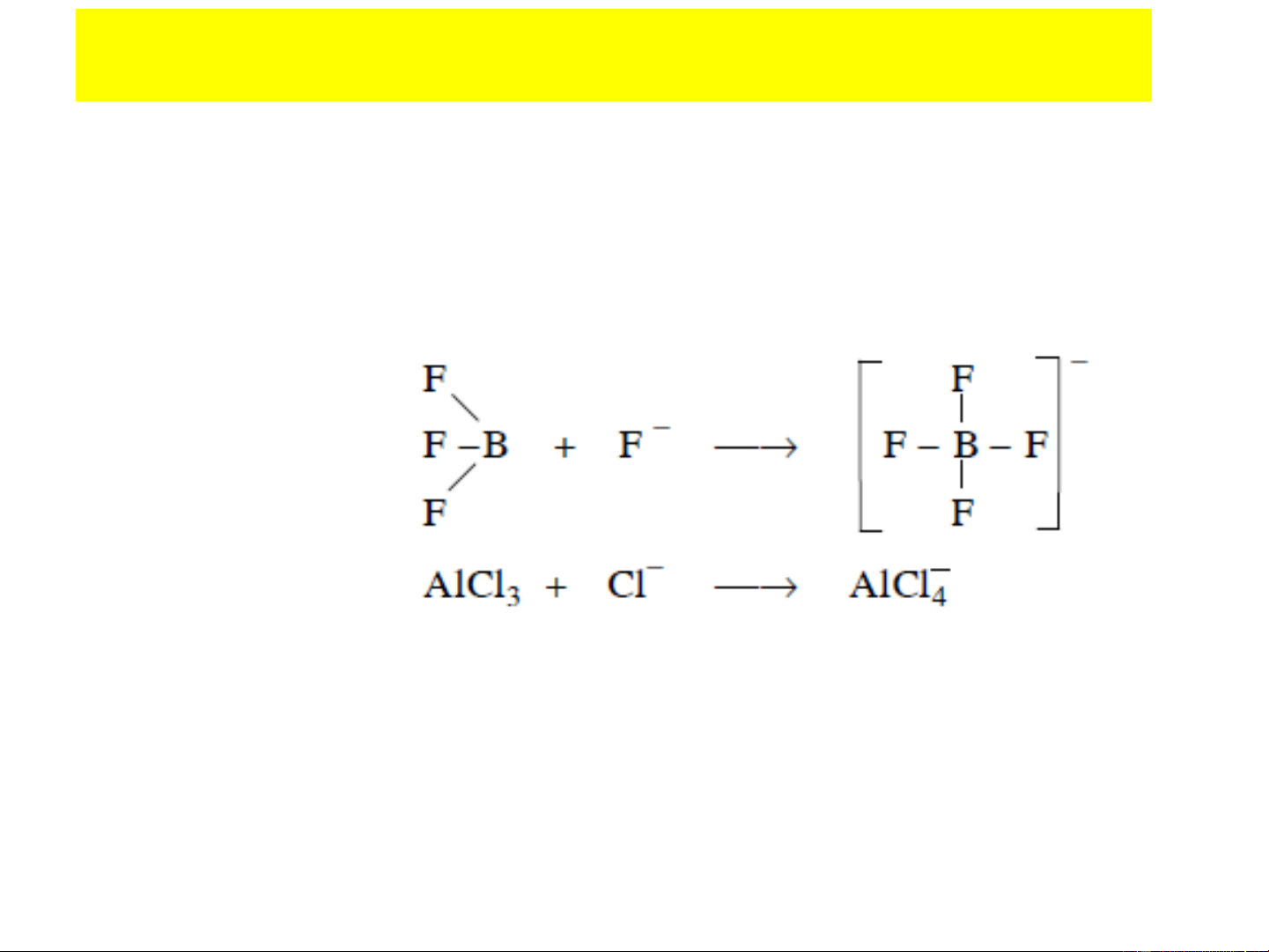
d còn trống: SiF , SnCl ,… 4 4 F F 2− + 2 F − SiF 2− 4 SiF F Si F 6 Axit Baz¬ F F Cl Cl N C 6H5 : SnCl 4 + 2 N C Sn 6H5 : Cl Axit Baz¬ N C6H5 Cl
2. Thuyết axit - bazơ của Lewis
Theo Lewis, Axit còn có thể là:
+ Các hợp chất trong phân tử chứa liên kết đôi, liên kết
ba bị phân cực: >C=O, -C≡N, -N=C… O O− R C + CN− R CH H CN Axit Baz¬ − + OH− R C N R C N Axit Baz¬ OH
2. Thuyết axit - bazơ của Lewis
Theo định nghĩa của Lewis thì bazơ Lewis có thể là:
các anion, phân tử như olefin, các hydrocacbon thơm
có khả năng cho cặp electron tự do của mình CH2 CH2 + Br2 CH2 CH2 Baz¬ Axit Br Br
2. Thuyết axit - bazơ của Lewis
❖ Mối tương quan giữa tính axit, tính bazơ với các tác nhân hữu cơ:
Theo định nghĩa của Lewis về axit và bazơ thì mọi phản
ứng tạo liên kết cho-nhận đều là phản ứng axit-bazơ.
- Axit đi vào chỗ có nhiều electron của bazơ nên mang bản
chất tác nhân electrophil. Nói cách khác, bản chất tác nhân
electrophil là axit Lewis.
- Bazơ đi vào chỗ trống electron của axit nên mang bản chất
tác nhân nucleophil. Nói cách khác, bản chất tác nhân
nucleophil là bazơ Lewis.
Mối tương quan trên chỉ là định tính chứ không định lượng
2. Thuyết axit - bazơ của Lewis
❖ Axit-bazơ và tác dụng xúc tác trong hoá học hữu cơ
Trong Hóa học Hữu cơ có nhiều phản ứng được xúc tác bằng axit hoặc bằng bazơ.
+ Phản ứng xúc tác bằng axit thì chất phản ứng đóng
vai trò của một bazơ, nó chiếm lấy proton do chất xúc
tác nhường cho để trở thành axit liên hợp
Xúc tác bằng axit được chia làm 2 loại:
- axit proton như: HF, H2SO4, H3PO4 ...
- axit phi proton như: BF3, AlCl3, SnCl4 ...
Trong các phản ứng hữu cơ như phản ứng loại nước của ancol; phản ứng axyl hoá;
phản ứng cracking, trùng hợp hoá... thì vai trò xúc tác của proton và phi proton ở giai
đoạn đầu có tác dụng tách anion tạo ra ion cacbonium hoặc tạo ra phức mang đặc
trưng của ion cacbonium, sau đó chuyển biến tiếp để tạo ra sản phẩm phản ứng.